Introducción
El género Capsicum comprende al menos 38 especies diferentes, de las cuales se cultivan seis: C. annuum, C. frutescens, C. pubescence, C. chinense, C. baccatum y C. assamicum. En relación a la especie C. annuum, diversas pruebas arqueológicas, genéticas y distribución de plantas contemporáneas indican que su origen y domesti- cación se encuentra en México, país donde el chile piquín (Capsicum annuum var. glabriusculum) es altamente preferido, presentando demanda en los mercados nacionales e internacionales, debido a su sabor particular y pungencia, contribuyendo con su alto valor económico al desarrollo de los sectores rurales (Rodríguez-del Bosque 2005, Maiti et al. 2015, Nirala y Chittaranjan 2019). En México, esta especie está registrada en todos los estados del país y se encuentra ampliamente distribuida en la zona costera desde Sonora hasta Chiapas sobre el Pacífico y desde Tamaulipas hasta Yucatán y Quintana Roo por el Golfo de México (Pickersgill 1988). Esta distribución posiblemente está relacionada con la diversidad genética como resultado de la evolución, sobrevivencia y adaptación (Ulukan 2011). La especie se caracteriza por su alta plasticidad fenotípica derivada de la variación morfologica de las hojas (González-Jara et al. 2011). Además, se considera como el pimiento con mayor variación en tamaño, forma y color de frutos (Hernández-Verdugo et al. 2001). Esta diversidad genética ofrece la posibilidad de identificar genotipos necesarios para su aprovechamiento y conservación, la cual se puede medir a partir de descriptores morfológicos, bioquímicos, citogenéticos y moleculares (Mondini et al. 2009, López-Báez et al. 2018). Si bien los estudios de diversidad genética son importantes, existe muy poca investigación en poblaciones de chile piquín (González-Jara et al. 2011). Además, a pesar de la importancia que tiene el fruto de chile piquín, no se dispone de información sobre su variabilidad morfológica. Con base en ello se realizó la siguiente investigación, cuyo objetivo fue determinar la variabilidad morfológica de genotipos de chile piquín del Noreste y Centro de México a través de caracteres en fruto y definir los descriptores que permitan discriminar los genotipos de chile piquín.
Materiales y métodos
Localización del sitio experimental
La investigación inicio con la generación de plántulas de chile piquín en el invernadero No. 7 del Departamento de Fitomejoramiento. Posteriormente se estableció el trasplante en el Departamento de Forestal de la Universidad Autónoma Agraria Antonio Narro sede Buenavista, Saltillo, Coahuila, México localizado geográficamente a los 25° 21’ 12.05” LN y 101° 01’ 38.43” LO, a una altitud de 1 781 msnm. Presentando un clima templado semiseco clasificado como Cfb por el sistema Köppen-Geiger, con temperatura media anual de 17 °C y precipitación anual de 481 mm.
Material vegetal
Se utilizaron 10 genotipos de chile piquín colectados de diferentes orígenes geográficos del Noreste y Centro de México (Figura 1, Tabla 1). Siendo siete silvestres y tres semidomesticados, los cuales se encontraron entre 20°46’ 56” a 26°45’ 59” LN y 98°00’ 54” a 101°29’ 44” LO. Los genotipos silvestres fueron recolectados en sus zonas de origen natural, dentro de vegetación nativa, desde zonas de pradera y monte bajo, hasta áreas de bosque o entre cactáceas en ambientes semidesérticos; estos son accesiones originales que no tienen ningún tipo de selección. Por otra parte, los genotipos semidomesticados son aquellos que se establecen en ambientes de traspatio y milpas, solos o en asociación con otros cultivos como maíz, plantaciones de cítricos, mango o aguacates, entre otros cultivos. Estos son materiales que han tenido algún tipo de selección empírica por los propios productores.
Tabla 1 Identificación y sitios de colecta de los genotipos de chile piquín.
| ID | Número de colección | Nivel de domesticación | Municipio | Estado | Coordenadas | Altitud (msnm) |
|---|---|---|---|---|---|---|
| G1 | BGH-242 | Silvestre | Villaldama | N. L. | 26°23’ 51” N, 100°23’ 42” O | 486 |
| G2 | BGH-243 | Silvestre | Aramberri | N. L. | 24°02’ 20” N, 99°55’ 15” O | 1496 |
| G3 | BGH-259 | Silvestre | Burgos | Tam. | 24°56’ 56” N, 98°47’ 59” O | 160 |
| G4 | BGH-260 | Silvestre | San Carlos | Tam. | 24°24’ 01” N, 99°06’ 50” O | 370 |
| G5 | BGH-314 | Silvestre | Castaños | Coah. | 26°46’ 02” N, 101°30’ 01” O | 809 |
| G6 | BGH-442 | Semidomesticado | IXMA | Ver. | 20°49’ 04” N, 98°05’ 45” O | 404 |
| G7 | BGH-445 | Semidomesticado | IXMA | Ver. | 20°41’ 06” N, 98°00’ 44” O | 110 |
| G8 | BGH-460 | Semidomesticado | IXMA | Ver. | 20°49’ 04” N, 98°05’ 45” O | 277 |
| G9 | BGH-277 | Silvestre | Linares | N. L. | 24°53’ 40” N, 99°28’ 13” O | 302 |
| G10 | BGH-304 | Silvestre | Rioverde | S. L. P. | 21°51’ 37” N, 99°54’ 40” O | 980 |
BGH: Banco de Germoplasma Huastecas, N.L.: Nuevo León, Tam.: Tamaulipas, Coah.: Coahuila, Ver. Veracruz, S.L.P.: San Luis Potosí; IXMA: Ixhuatlán de Madero.
Siembra
Debido a que las semillas de chile piquín presentan latencia fisiológica, los genotipos fueron sometidos a un tratamiento pregerminativo, el cual constó en sumergir la semilla de cada genotipo en ácido giberélico a 5 000 ppm durante 24 horas a temperatura ambiente (Alcalá-Rico et al. 2019). Posteriormente para la siembra se utilizaron charolas germinadoras de poliestireno de 200 cavidades y como sustrato se empleó peat moss. Se colocaron dos semillas por cavidad, sembrándose 60 cavidades por genotipo. Después se asperjó un fungicida orgánico llamado BIORGAN SF® a concentración de 2.5 mL L-1 de agua. En seguida se procedió a realizar el sellado, que consistió en colocar una charola sobre otra, dejándolas empalmadas y siendo cubiertas por una película de plástico negro, con la finalidad de mantener una óptima temperatura y humedad para acelerar el proceso de germinación.
Trasplante
Este proceso se realizó bajo una estructura cubierta con malla sombra al 30%. Las plántulas a los dos meses después de la siembra fueron trasplantadas en bolsas de polietileno negras de 30 x 30 cm, cuyo sustrato fue tierra de lombricomposta. Las bolsas se colocaron sobre estructuras metálicas de 1 m de altura para mejorar el manejo del cultivo y evitar las posibles plagas presentes en el suelo.
Diseño experimental
Los genotipos de chile piquín se establecieron bajo un diseño de bloques completamente al azar con tres repeticiones. La unidad experimental constó de seis plantas por repetición. La distancia entre plantas fue de 0.5 m, entre hileras de 0.9 m y entre calles de 1 m.
Parámetros evaluados
Se utilizaron dos guías técnicas para la descripción varietal de chile (Capsicum annuum L.), la primera propuesta por el Servicio Nacional de Inspección y Certificación de semillas (SNICS) y la segunda propuesta por el Instituto Internacional de Recursos Fitogenéticos (IPGRI).
Se evaluaron todos los caracteres relacionados con el fruto de chile piquín. Los cuales fueron siete cuantitativos, tres cualitativos y 14 pseudocualitativos. En lo que respecta a los caracteres cuantitativos se tomó: longitud de fruto (mm), diámetro de fruto (mm), relación longitud/diámetro de fruto (mm), número predominante de lóculos, grosor del pericarpio (mm), longitud del pedúnculo (cm) y grosor del Pedúnculo (mm). Así mismo los caracteres cualitativos fueron: posición del fruto (1 = erecta, 2 = horizontal, 3 = pendiente), cavidad peduncular (1 = ausente, 9 = presente) y con- tenido de capsaicina en la placenta (1 = ausente, 9 = presente). Mientras que en relación a los caracteres pseudocualitativos se evaluó: color antes de la madurez (1 = blanco verdoso, 2 = amarillento, 3 = verde, 4 = purpura), forma del fruto (1 = aplanada, 2 = redonda, 3 = de corazón, 4 = cuadrada, 5 = rectangular, 6 = trapezoidal, 7 = triangular, 8 = trian- gular estrecha, 9 = de cuerno), forma de la sección transversal (1= elíptica, 2 = angular, 3 = circular), on- dulación transversal (1 = débil, 2 = media, 3 = fuerte), color en madurez (1 = amarillo, 2 = naranja, 3 = rojo, 4 = café), intensidad de color antes de madurez (3 = Claro, 5 = Medio, 7 = Oscuro), intensidad de color en madurez (3 = claro, 5 = medio, 7 = oscuro), forma del ápice (1 = agudo, 2 = redondeado, 3 = hundido, 4 = hundido y agudo), textura (1 = liso, 2 = corchoso, 3 = rugoso), profundidad de depresiones interloculares (1 = ausentes, 2 = poco profundas, 3 = medias, 4 = profundas, 5 = muy profundas), sabor (1 = dulce, 2 = pungente), posición de la placenta (3 = compacta, 5 = semidistribuida, 7 = distribuida), aspecto del cáliz (1 = no desarrollado, 2 = desarrollado) y margen del cáliz (1 = entero, 2 = intermedio, 3 = dentado). Para los caracteres cuantitativos se utilizaron 15 frutos por planta, en lo que respecta a los caracteres cualitativos y pseudocualitativos se evaluaron a través de evaluaciones visuales mediante una sola observación de cada unidad experimental.
Análisis
Se realizó un análisis de varianza para caracteres cuantitativos. Así mismo, se efectuaron análisis de componentes principales y análisis de conglomerados jerárquicos utilizando el Método de Grupo de Pares no Ponderados con Media Aritmética (UPGMA) y con la distancia euclidiana como media de disimilitud para caracteres cuantitativos y pseudocualitativos. En lo que respecta a los caracteres cualitativos, se analizaron a través de un gráfico radial. Cada proceso se realizó utilizando el software Excel 2021 y R versión 4.1.
Resultados y discusión
Análisis de varianza de caracteres cuantitativos
Se encontraron diferencias significativas (P ≤ 0.01) para la mayoría de los caracteres en la fuente de variación de genotipos, excepto para número predominante de lóculos, debido a que la mayoría de los genotipos presentaron dos lóculos (Tabla 2). Las divergencias que se presentaron pudieran deberse a la constitución genética especifica en cada genotipo, como consecuencia de la evolución que han presentado para adaptarse y sobrevivir a las diferentes condiciones geográficas. Estos resultados coinciden con Ornelas-Ramírez et al. (2021), quienes reportaron diferencias significativas en todos los caracteres evaluados de tres especies de Capsicum. Lo anterior, es un indicativo de la variabilidad que presenta cada genotipo en los rasgos morfológicos, lo cual es de vital importancia en un programa de mejoramiento genético para la creación de nuevas variedades sostenibles y competitivas, ya que a partir de esta variabilidad es posible identificar plantas sobresalientes y conservar los recursos fitogenéticos (Rodríguez et al. 2007, Díaz et al. 2010, Onamu et al. 2012).
Tabla 2 Cuadrados medios del análisis de varianza para caracteres cuantitativos de fruto de chile piquín.
| Descriptores | Fuente de Variación | Media | CV | R2 | DMS | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| Rep | Gen | Pta | ||||||||
| FL | 0.71 | 142.26 | ** | 19.69 | ** | 8.65 | 6.38 | 0.97 | 0.59 | |
| FD | 0.39 | * | 10.12 | ** | 18.91 | ** | 5.86 | 6 | 0.9 | 0.38 |
| FL/FD | 0.01 | 8.33 | ** | 0.12 | ** | 1.54 | 7.65 | 0.97 | 0.13 | |
| FNPL | 0.29 | 0.33 | 0.24 | 2.21 | 19.16 | 0.14 | 0.45 | |||
| FGPR | 0.03 | 0.11 | ** | 0.01 | 0.67 | 22.17 | 0.24 | 0.16 | ||
| FLP | 0.25 | 0.89 | ** | 0.23 | * | 2.19 | 12.37 | 0.45 | 0.29 | |
| FGPE | 0.05 | 0.09 | ** | 0.02 | 0.99 | 16 | 0.19 | 0.17 | ||
*, ** Significativos a los niveles de probabilidad 0.05 y 0.01, Gen = Genotipos, Rep = Repeticiones, Pta = Plantas, CV = Coeficiente de Variación, R2 = Coeficiente de determinación, DMS: Diferencia mínima significativa, FL: Longitud, FD: Diámetro, FL/FD: Relación Longitud/Diámetro, FNPL: Numero Predominante de Lóculos, FGPR: Grosor del pericarpio, FLP: Longitud del Pedúnculo y FGPE: Grosor del Pedúnculo.
Análisis de conglomerados para caracteres cuantitativos
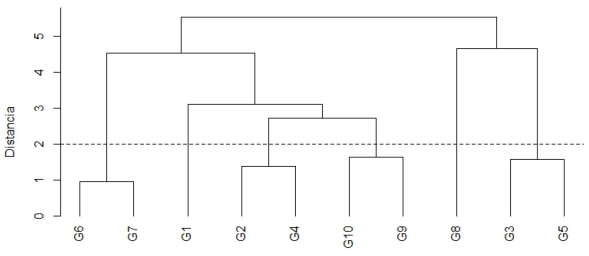
Con respecto al análisis de agrupamiento, de acuerdo a los caracteres cuantitativos los genotipos pudieron conglomerarse en seis grupos a dos unidades (Figura 2). El primer grupo estuvo con- formado por los genotipos G6 y G7 originarios de Veracruz, caracterizándose por tener en promedio los mayores valores en longitud de fruto (13.62 mm) y relación longitud/diámetro de fruto (2.81 mm). Por otro lado, estos genotipos también destacaron por presentar valores superiores a la media en número predominante de lóculos (2.28 lóculos), sin embargo, mostraron los valores más bajos en diámetro de fruto (4.89 mm). El segundo grupo fue representado por el genotipo G1 de Villaldama, Nuevo León, mostrando valores mínimos en relación longitud/diámetro de fruto (1.09 mm), grosor del pericarpio (0.57 mm) y grosor del pedúnculo (0.89 mm), aunque tuvo los mayores valores en número predominante de lóculos (2.39 lóculos) y longitud de pedúnculo (2.49 cm). En el tercer grupo se integraron los genotipos G2 de Aramberri, Nuevo León y G4 de San Carlos, Tamaulipas, los cuales se asociaron con valores bajos en grosor de pedúnculo (0.96 mm en promedio). En el cuarto grupo estuvieron incluidos los genotipos G9 de Linares, Nuevo León y G10 de Rioverde, San Luis Potosí, con la particularidad de haber presentado en promedio valores por debajo de la media en longitud de fruto (7.2 mm) e intermedios en longitud de pedúnculo (2.1 cm) y grosor de pedúnculo (1 mm). El quinto grupo lo representó el genotipo G8 de Ixhuatlán de Madero, Veracruz al caracterizarse por tener los mayores valores en diámetro de fruto (7.52 mm), grosor de pedúnculo (1.16 mm) y longitud de pedúnculo (2.42 cm), además de pre- sentar valores intermedios de numero predominante de lóculos (2.22 lóculos). El último grupo se integró por los genotipos G3 de Burgos, Tamaulipas y G5 de Castaños, Coahuila teniendo en conjunto valores intermedios en la variable diámetro de fruto (6.04 mm), valores inferiores a la media en relación longitud/diámetro de fruto (1.21 mm) y los valores más altos en grosor del pericarpio (0.79 mm) y grosor del pedúnculo (1.01 mm). Además, este grupo mostró los mínimos valores en longitud del pedúnculo (1.87 cm) (Figura 2, Figura 3A-G). La agrupación de los genotipos de chile piquín representa cierto parentesco entre cada uno de ellos según los caracteres evaluados, indicando variabilidad entre los genotipos estudiados (González et al. 2011). En particular, Mohammadi y Prasanna (2003) mencionan que los niveles y patrones de variabilidad genética pueden facilitar la clasificación de accesiones. Al respecto, Adetula (2006) estimó la relación entre accesiones de Capsicum, las cuales serían usadas en el mejoramiento de la productividad y la estabilidad en el rendimiento de los cultivos.
Componentes principales para caracteres cuantitativos
En lo que respecta el análisis de componentes principales (PC), los dos primeros componentes explicaron el 47.18% de la variabilidad total de los caracteres evaluados. PC1 fue el más importante, obteniendo el mayor porcentaje de participación (29.94%), estando asociado con los descriptores longitud de fruto y relación longitud/diámetro de fruto. Asimismo, PC2 explicó el 17.24% de la variación y se relacionó con diámetro de fruto, numero predominante de lóculos, grosor del pericarpio, longitud del pedúnculo y grosor del pedúnculo. La diversidad del fruto es un punto clave en la morfología del chile piquín, ya que se ha observado que los descriptores de fruto han sido los de mayor contribución en la explicación de los primeros componentes principales de chiles (Villota-Cerón et al. 2012). En este aspecto Zhigila et al. (2014) mencionan que el género Capsicum se caracteriza por presentar una gran diversidad en el tipo de fruto, color, forma, sabor y contenido fitoquímico. Por otro lado, se observó correlación positiva entre el grosor del pericarpio, grosor del pedúnculo y diámetro de fruto. De la misma forma existió asociación positiva entre número predomínate de lóculos, longitud de fruto, relación longitud/diámetro de fruto y longitud del pedúnculo. Aunque, el carácter diámetro de fruto se correlacionó negativamente con longitud del pedúnculo, relación longitud/diámetro de fruto y longitud de fruto; mostrando la misma condición el grosor del pericarpio con longitud del pedúnculo y relación longitud/diámetro de fruto, así mismo el grosor del pedúnculo con longitud del pedúnculo. Por otra parte, los descriptores con vectores más largos discriminan más los genotipos, mientras que un vector muy corto proporciona poca o ninguna información sobre las diferencias del genotipo (Yan et al. 2007). De acuerdo a las longitudes de los vectores de los siete caracteres, solo tres fueron los más discriminatorios (longitud, diámetro y relación longitud/diámetro de fruto), los cuales pueden clasificar distintos individuos en grupos o poblaciones conforme a sus diferencias entre colectas de chile piquín. En relación a los genotipos, se distribuyeron en cuatro cuadrantes de la gráfica biplot, lo que indicó que la variabilidad en los caracteres está enfocada en los primeros dos componentes principales (De la Cruz-Lázaro et al. 2017). Los genotipos con valores más altos son clasificados con puntajes de PC1 mayor que cero (lado derecho), mientras que aquellos con PC1 menor que cero (lado izquierdo) se identifican como genotipos con valores menores a la media (Yan y Thinker 2006). Los genotipos G1, G2, G3, G5, G8, G9 y G10 se ubicaron al lado izquierdo del PC1; mientras que G6 y G7 se situaron a la derecha del mismo componente, indicando que en general estos dos últimos genotipos sobresalieron con los mayores valores en los caracteres evaluados. Por otro lado, el genotipo G4 se distribuyó muy cerca de la línea vertical del PC1, mostrando valores cercanos al promedio general (Figura 4). Hay que mencionar, que cada carácter en cada genotipo representó un valor especifico, lo cual puede deberse a la variabilidad genética que presentan. En relación con esto Allard y Bradshaw (1964) mencionan que la variabilidad ocurre cuando diferentes genotipos responden diferente a la expresión de distintos caracteres. Por lo tanto, es de gran importancia utilizar análisis multivariantes para determinar diferencias entre individuos (Sassone et al. 2013).

Figura 4 Análisis de componentes principales de genotipos de chile piquín a través de caracteres cuantitativos asociados con el fruto. FL: Longitud, FD: Diámetro, FL/FD: Relación Longitud/Diámetro, FNPL: Numero Predominante de Lóculos, FGPR: Grosor del pericarpio, FLP: Longitud del Pedúnculo y FGPE: Grosor del Pedúnculo.
Análisis radial en caracteres cualitativos
En la evaluación de caracteres cualitativos se observó una uniformidad, indicando que no hubo variación entre genotipos, en todos los casos la posición del fruto fue erecta, la cavidad peduncular ausente y presentaron contenido de capsaicina en la placenta (Figura 5). Lo ocurrido de cierta manera es debido al tipo de herencia, la cual generalmente en este tipo de caracteres depende de un par de genes. Por lo anterior, estos caracteres pudieran considerarse para detectar morfológicamente el fruto de chile piquín, pero no para discriminar entre accesiones de la misma especie, ya que son caracteres morfológicos propios del chile piquín. Esto es un indicativo de que las características son representativas del chile silvestre, lo cual revela que pertenece a una determinada especie (Mongkolporn y Taylor 2011, Narez-Jiménez et al. 2014).
Análisis de conglomerados en caracteres pseudocualitativos
De acuerdo a los caracteres pseudocualitativos se formaron cuatro grupos a dos unidades. El primer grupo estuvo conformado por los genotipos G3, G1 y G2 originarios de Burgos, Villaldama y Aramberri respectivamente. El primer genotipo pertenece al estado de Tamaulipas y el resto al estado de Nuevo León, estos genotipos se caracterizaron principalmente por tener la forma del fruto redonda. El segundo grupo estuvo conformado por los genotipos G4 de San Carlos, Tamaulipas, G5 de Castaños, Coahuila, G9 de Linares, Nuevo León y G10 de Rioverde, San Luis Potosí teniendo en común la forma de fruto de corazón. El tercer grupo estuvo integrado por el genotipo G8 de Colatlán, Ixhuatlán de Madero, Veracruz caracterizándose por tener un color de fruto blanco verdoso e intensidad de fruto antes de madurez claro. Así mismo, el cuarto grupo se integró por el resto de genotipos de Veracruz teniendo la forma del fruto rectangular e intensidad de color antes de madurez oscuro (Figura 6). Se formaron menos grupos en comparación con los caracteres cuantitativos, a pesar de que se evaluó un número mayor de caracteres, indicando que existe mayor similitud en este tipo de caracteres. Estas agrupaciones pudieron haber sido resultado de la adaptación de cada genotipo a las condiciones específicas de cada región. Estos hallazgos coinciden con Aguilar-Melendez et al. (2009), quienes en un estudio de diversidad genética realizado en poblaciones de C. annuum L. var. glabriusculum y C. annuum var. annuum del centro y sureste de México, demostraron que la diferenciación genética estaba correlacionada con la ubicación geográfica.
Componentes principales en caracteres pseudocualitativos
Se analizó seis de 14 caracteres, debido a que se eliminaron aquellos que no mostraron significancia a la explicación de la variación, mejorando el análisis y reduciendo el trabajo de procesamiento de datos (Castañón-Nájera et al. 2008). Los dos primeros componentes explican el 78.16% de la variación total. El valor propio del PC1 explicó el 47.47% de la variación. Los caracteres asociados con este componente fueron forma del fruto, forma el ápice, textura y margen del cáliz. En cuanto a PC2, su valor propio representó el 30.69% de la variación y estuvo relacionado con el color antes de la madurez e intensidad de color antes de la madurez. Por otro lado, el ángulo entre los vectores de dos caracteres mostro la relación entre ellos (Vaezi et al. 2017), encontrándose una correlación positiva entre margen del cáliz y color antes de la madurez, así como entre los caracteres intensidad de color antes de la madurez, forma del fruto, textura del fruto y forma del ápice. Por otra parte, textura del fruto y forma del ápice tuvieron relación negativa con margen del cáliz y color antes de la madurez. Cabe destacar que los caracteres pseudocualitativos más discriminantes fueron intensidad de color antes de la madurez, color antes de la madurez, forma del fruto y forma del ápice (Figura 7).

Figura 7 Análisis de componentes principales de 10 genotipos a través de sus caracteres pseudocualitativos. FMC: Margen del Cáliz, FCAM: Color antes de la madurez, FICAM: Intensidad de Color antes de Madurez, FF: Forma, FT: Textura, FFA: Forma del Ápice.
En promedio, los dos primeros componentes principales de caracteres cuantitativos y pseudocualitativos explicaron más de 60% de la variabilidad morfológica de fruto de chile piquín en genotipos del Noreste y Centro de México, lo que indicó que por medio de un biplot se pueden interpretar los datos de manera segura como una representación gráfica (Yang et al. 2009, Rakshit et al. 2012). Es importante que en futuros trabajos se incluya marcadores moleculares para incrementar la eficiencia al estudiar la diversidad genética de los recursos vegetales (Zhong et al. 2021).
En conclusión, se encontró variabilidad morfológica de frutos de chile piquín en genotipos del Noreste y Centro de México, lo que representa un reservorio de genes que pueden tener un uso potencial para la domesticación y mejoramiento genético. Los caracteres diámetro de fruto, longitud de fruto, relación longitud/diámetro de fruto, intensidad de color antes de madurez, color antes de la madurez, forma de fruto y forma del ápice contribuyen en la máxima variabilidad y son adecuados para discriminar y caracterizar genotipos de chile piquín a través de la variabilidad morfológica del fruto.











 nueva página del texto (beta)
nueva página del texto (beta)