Introducción
A nivel mundial, el frijol común (Phaseolus vulgaris L.) es considerado uno de los cultivos más importantes para el consumo humano directo (Refaay et al. 2021). En México, se establecen extensas superficies de siembra tanto en condiciones de riego como de temporal, en 2021, en promedio de estas condiciones, se sembraron 1 690 246.99 ha, con rendimiento de 0.77 t ha-1, siendo los principales estados productores Zacatecas, Durango, San Luis Potosí, Chiapas, Chihuahua y Sinaloa, destacando este último por su mayor rendimiento (SIAP 2022). Los bajos rendimientos de este cultivo a nivel mundial obedecen a los diferentes tipos de estrés abiótico que afectan de forma negativa su producción, al disminuir la velocidad de crecimiento de los órganos aéreos de la planta, y, por ende, la cantidad de energía solar capturada por el área foliar durante la fotosíntesis. El estrés provocado por factores ambientales como la sequía, temperaturas extremas y salinidad, afectan de manera negativa la diferenciación y expansión de órganos, la captación de asimilados y su translocación al resto de la planta, traduciéndose en una deficiente acumulación de biomasa aérea (Ojuederie et al. 2019).
Los bioestimulantes son una opción prometedora; ya que este grupo de sustancias o microorganismos benéficos, inducen respuestas fisiológicas y morfológicas en las plantas, especialmente bajo condiciones desfavorables, lo que conduce a mejorar su adaptación, crecimiento y productividad (Szpunar 2022, Valero et al. 2023), impactando de forma favorable en el rendimiento (Kocira et al. 2020). Estos productos son una alternativa para el manejo sustentable en la nutrición de cultivos, lo que permite el desarrollo de una agricultura rentable y ecológica (Tamayo-Aguilar et al. 2020). Los bioestimulantes pueden ser derivados de algas marinas, hidrolizados de proteínas (aminoácidos), microorganismos promotores de crecimiento, ácidos húmicos y fúlvicos (Drobek et al. 2019), quitosanos y otros biopolímeros, compuestos inorgánicos (Du-Jardin 2015). Existe evidencia de que su uso estimula el crecimiento del área foliar y acumulación de materia seca, así como el rendimiento y sus componentes; al respecto, Tamayo-Aguilar et al. (2020) al utilizar hongos micorrícicos arbusculares y Spiruvinas y la combinación de estos, reportaron un mayor crecimiento y rendimiento de grano en frijol var. Delicia 364. Mientras que Petropoulos et al. (2020) al evaluar el efecto de la micorriza Glomus spp, microorganismos benéficos, aminoácidos y una mezcla (hongos micorrícicos arbusculares, bacterias simbióticas de la rizosfera y hongos saprofitos) en frijol común, señalan que los tratamientos que contenían la micorriza Glomus spp y la mezcla, promovieron mayor rendimiento de semilla y número de vainas en plantas que estuvieron tanto en condiciones de riego como en sequía, con respecto al resto de tratamientos. Por otra parte, Lara-Acosta et al. (2019) señalan que el Pectimorf® (oligogalacturónidos) aplicado por aspersión foliar a concentración de 100 mg L-1 incrementa el número de hojas, la materia seca de la parte aérea y radicular en frijol variedad Cuba Cueto-25-9-N.
Actualmente, se han descrito una gran diversidad de compuestos estimulantes como alternativa de mejora para la producción de distintos cultivos, sobre todo, para disminuir el uso excesivo de fertilizantes y plaguicidas independientemente del ambiente, sin embargo, en el estado de Sinaloa, principal productor de frijol, aún existe escaza evidencia en la literatura sobre el uso de bioestimulantes para su producción, razón por la cual, el objetivo de este trabajo fue evaluar el efecto de la micorriza (M) Glomus intraradices, aminoácidos libres (AA) y la combinación de M + AA sobre el crecimiento de la parte aérea de la planta y el rendimiento y sus componentes en frijol común var. Azufrado Higuera en condiciones de campo, en el norte de Sinaloa.
Materiales y métodos
Esta investigación se llevó a cabo en el ciclo otoño-invierno 2021-2022, en el Campo Experimental Valle del Fuerte (CEVAF), del Instituto Nacional de Investigaciones Forestales Agrícolas y Pecuarias (INIFAP), ubicado en Juan José Ríos, Guasave, Sinaloa, (25°45’ 47” LN y 108°49’ 46” LO), con una altitud de 14 msnm.
Material vegetal
Se sembró semillas de la variedad de frijol Azufrado Higuera, originado de la cruza entre Canario DIVEX 8130 y Royal Red realizada en 1981 en el Centro Internacional de Agricultura Tropical, se caracteriza por su adaptación en las áreas de riego y por alcanzar niveles de producción aceptables bajo condiciones de humedad residual, con alto rendimiento en el norte de Sinaloa. Las plantas miden hasta 40 cm de altura, son de hábito de crecimiento determinado y el grano es de color amarillo (Salinas-Pérez et al. 1995).
Diseño experimental y tratamientos
El experimento se estableció bajo un diseño en bloques completos al azar con cuatro tratamientos y tres repeticiones. La unidad experimental consistió de un surco de 100 m de longitud con separación de 80 cm entre surcos y la parcela útil estuvo representada por un área de 3.2 m2. Los tratamientos fueron los siguientes: T1) Bioestimulante Aminocel 500 (Cosmocel®), aminoácidos (AA); 1.5 g L-1 agua, aplicados vía foliar en horas de la mañana, utilizando una mochila aspersora con capacidad de 8 L. Las aplicaciones se realizaron cada 15 días a partir de 36 días después de la siembra (dds). La composición porcentual del producto es de 50% AA libres [Ácido aspártico (3.50), serina (6.02), ácido glutámico (6.30), glicina (5.17), histidina (0.09), arginina (1.04), treonina (4.34), alanina (2.60), prolina (5.30), cisteína (0.59), tirosina (0.71), valina (4.11), metionina (0.24), lisina (0.89), isoleucina (2.84), leucina (3.91) y fenilalanina (3.10)] y 10% N, 8% de P2O5, 10% de K20, 0.100% de Fe, 0.030% de Zn, 0.020% de Mn, 0.005% de Mo y 0.010% de B; T2) Micorriza Glomus intraradices (Myco Evolution®) se aplicó recubriendo a la semilla previo a la siembra [400 g (300 propágulos g-1) en 80 kg-1 de semilla], su contenido es 70% de tierra de diatomeas y 30% de Glomus intraradices; T3) la combinación de Glomus intraradices + AA, y T4) control.
Manejo agronómico
La siembra se realizó el 01 de noviembre de 2021, a una profundidad de 6 cm en suelo parcialmente húmedo, en surcos de 80 cm de separación, con una densidad de 16 semillas por metro lineal. Previo a la siembra, se fertilizó con 200 kg ha-1 de urea [CO (NH2)2] como fuente de N y 100 kg ha-1 de fosfato diamónico [(NH4)2 HPO4] como fuente de N y P. Se aplicaron dos riegos de auxilio, antes de inicio de floración (35 días después de la siembra; dds) y durante el llenado de grano (60 dds). El manejo fitosanitario y la aplicación de fertilizante se hizo de acuerdo con las recomendaciones de la guía técnica del CEVAF (2003). Se registró la temperatura máxima y mínima y la precipitación pluvial durante el ciclo del cultivo (INIFAP 2022).
Variables evaluadas y determinadas
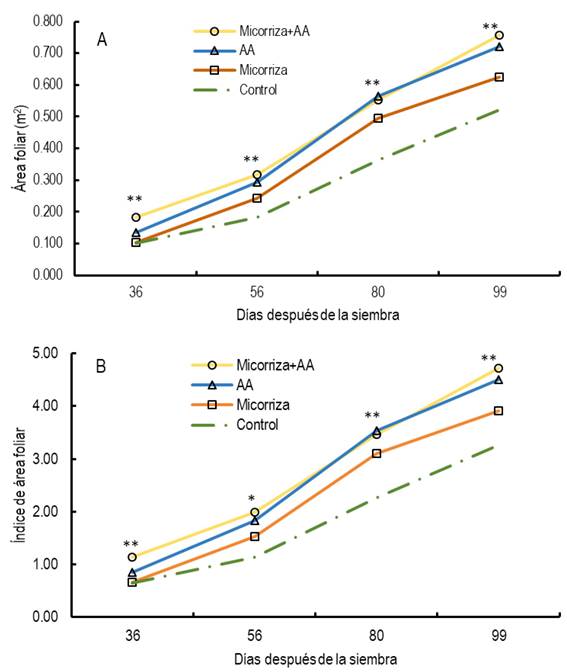
Área foliar (AF, m2): se determinó al digitalizar las imágenes de todas las hojas de las plantas que ocupaban un área de 0.16 m2 en cada muestreo destructivo, a los 36, 56, 80 y 99 dds, con la ayuda de un escáner marca Epson®, posteriormente las imágenes fueron medidas con el programa imageTool®.
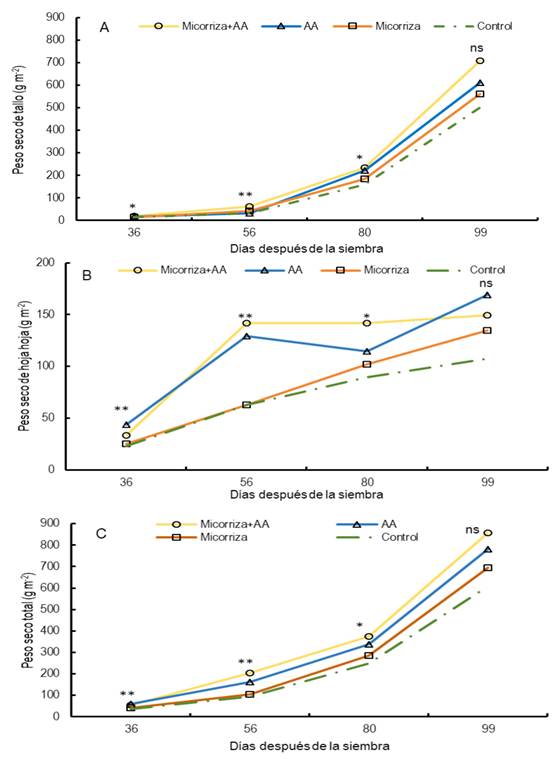
Índice de área foliar (IAF): se calculó como el cociente entre AF de las plantas y el área de suelo ocupada por las mismas (0.16, m2) (IAF = AF/0.16). Peso seco de tallo (PST) y peso seco de hoja (PSH) (g m-2): se resolvió al realizar muestreos destructivos de plantas a los 36, 56, 80 y 99 dds en un área de 0.16 m2, las muestras se colocaron en una incubadora (Felisa®) a 70 °C durante 72 horas para obtener el peso seco constante. Peso seco total (PSTotal, g m-2): se obtuvo de la suma del PST y PSH. Rendimiento de semilla (RS, g m-2): se determinó al pesar la semilla con una balanza digital (Sartorius® CP224S). Biomasa aérea final (BMA, g m-2): se obtuvo en madurez fisiológica del cultivo, al cosechar y determinar el peso seco de las plantas de cada unidad experimental, tomadas de un área de 0.24 m2. Índice de cosecha (IC, %): se determinó como el cociente entre el rendimiento de semilla (RS) entre la biomasa aérea final (BMA)*100 [(IC = RS/ BMAF)*100]. Número de vainas normales por m2 (VN): se calculó al contar el número total de vainas de todas las plantas presentes en una muestra de plantas tomadas de un área de 2.4 m2 y dividir el total de vainas entre esa área cosechada. Se consideró como vaina normal aquella que tenía al menos una semilla normal. Número de semillas por vaina normal (SV): se contó el número promedio de semillas por vaina en 30 vainas normales, elegidas al azar de la muestra utilizada para determinar el rendimiento de la semilla. Número de semillas normales por m2 (SN): se determinó al dividir el número de SV entre 2.4 m2 que corresponde al área ocupada por las plantas cosechadas para obtener el RS, y Peso de 100 semillas (P100S, g): se obtuvo al pesar 100 semillas con una balanza analítica (Sartorius® CP224S).
Análisis estadístico
Los datos obtenidos de cada una de las variables cumplieron con el supuesto de normalidad (Shapiro y Wilk 1985). Estos se sometieron a un análisis de varianza (ANOVA) de una vía, y la comparación de medias con Tukey al 5% de significancia, utilizando el programa Statistical Analysis Software (SAS®) versión 9.1.
Resultados y discusión
Datos meteorológicos
La temperatura máxima varió entre 34 y 24 °C y la mínima entre 16 y 7 °C durante el ciclo de crecimiento del cultivo. Mientras que, la precipitación fue muy escaza, registrándose en total 68 mm, la cual se presentó entre los 56 dds (11 días después de la floración) y 77 dds, lo cual indica que el cultivo sólo contó con la humedad proveniente de la lluvia y de aquella proveniente del segundo riego de auxilio efectuado a los 60 dds. Después de los 77 dds la humedad proveniente de la lluvia fue escaza durante el periodo de formación y llenado de vaina, hasta madurez fisiológica (125 dds).
Crecimiento del cultivo
Área foliar
El crecimiento del área foliar fue afectado significativamente (P ≤ 0.05) por los bioestimulantes; el tratamiento combinado de Glomus intraradices + AA y AA, fueron los que mostraron altos valores medios en el área foliar (Figura 1A) e índice de área foliar (Figura 1B) desde los 36 a 99 dds, con respecto al control y la micorriza. Así mismo, el producto comercial utilizado como fuente de AA, también contiene elevado porcentaje de N y otros elementos minerales que pudieron intervenir en el incremento del área foliar, ya que son precursores de hormonas y parámetros de crecimiento de la planta, como es el caso del área foliar, además, tienen estrecha relación con la fotosíntesis, síntesis de clorofila y con la absorción de nutrientes (Shahrajabian et al. 2022). En otros trabajos, se ha reportado aumento significativo en el crecimiento del área foliar al aplicar bioestimulantes que contienen aminoácidos (Cristofano et al. 2021), los cuales juegan un papel importante en las plantas al aumentar su contenido y la actividad de los reguladores endógenos del crecimiento (Ismail y Fayed 2020). Por otro lado, también se ha registrado incremento en el área foliar con el uso de micorrizas (Hidalgo-Rodríguez y Ramos-Otiniano 2019, Sánchez-Roque et al. 2022), que también inducen el crecimiento del sistema radicular de la planta y la absorción de nutrientes (Ikan et al. 2023).
Peso seco acumulado
El tratamiento combinado con Glomus intraradices + AA mostró mayor peso seco acumulado en el tallo desde los 36 hasta los 80 dds, seguido del tratamiento a base de AA a los 36 dds (Figura 2A); el peso seco de hoja tuvo el valor medio más alto con el tratamiento AA a los 36 dds, con la combinación de Glomus intraradices + AA y AA a los 56 dds y Glomus intraradices + AA a los 80 dds (Figura 2B); y mayor peso seco total con los tratamientos Glomus intraradices + AA y AA a los 36 dds y AA a los 56 y 80 dds (Figura 2C). Los AAs esenciales son absorbidos rápidamente por los cultivos y actúan como una fuente estable de precursores de moléculas para integrarse en el metabolismo de las plantas, como es el caso del ácido glutámico, que forma parte del producto utilizado como fuente de AA, que desempeña un papel importante en el metabolismo del nitrógeno, estimula el metabolismo primario y secundario, y la actividad fotosintética (Franzoni et al. 2021). Aunado a esto, la micorriza mejora la absorción de nutrientes, incrementa los caracteres morfológicos como el área foliar y fisiológicos como la conductancia estomática, al inducir mayor captura de CO2, lo cual se refleja en mayor peso seco acumulado en los órganos aéreos y radicular de la planta (Anli et al. 2020, Ikan et al. 2023). Es importante mencionar que la materia seca o peso seco es una característica importante que está relacionada con el rendimiento de los cultivos, como es el caso del frijol común (Romero-Félix et al. 2021).
Rendimiento y sus componentes
Para el rendimiento y sus componentes se observa que todas las variables de rendimiento y sus componentes evaluadas fueron estadísticamente diferentes (P ≤ 0.05), excepto el P100S, el número de SV y el IC que fueron iguales (Tabla 1). El rendimiento de semilla (47, 22 y 20%), biomasa aérea final (46, 21 y 19%), número de vainas normales por m2 (42, 16 y 12%) y semillas normales por m2 (44, 17 y 15%) fueron mayores por efecto de la aplicación combinada de Glomus intraradices + AA, AA y Glomus intraradices, respectivamente. Mientras que el número de vainas normales por m2 fue 42 y 16% mayor con el tratamiento Glomus intraradices + AA y AA. Lo anterior probablemente se debió a que los AA y la micorriza optimizaron la absorción de nutrientes, y por tanto, mejoraron las reacciones bioquímicas de la fotosíntesis, la biosíntesis de proteínas y de clorofila, lo cual es clave para incrementar el rendimiento y sus componentes (Hristozkova y Orfanoudakis 2023), ya que el rendimiento está correlacionado con un aumento en la actividad fotosintética y el metabolismo del nitrógeno (Giordano et al. 2022). Así como con la acumulación de metabolitos responsables de estimular la formación del rendimiento agronómico (Rouphael y Colla 2020). Estudios previos, indican aumentos significativos, con respecto al control, en el rendimiento de semilla (Petropoulos et al. 2020, Ashwin et al. 2023), biomasa aérea y número de vainas y semillas (Ashwin et al. 2023), al utilizar como tratamientos hongos micorrizicos arbusculares, y también, mayor rendimiento de semilla, número de vainas y número de semillas normales en frijol (Kocira et al. 2020) al emplear aminoácidos. Al igual, Peña et al. (2017) no encontraron diferencias entre tratamientos con el uso de diferentes dosis de aminoácidos, en promedio de cuatro variedades de frijol en condiciones de campo. Por el contrario, en el caso del índice de cosecha, Ashwin et al. (2023) observaron diferencias significativas en soya Glycine max L., al utilizar la micorriza Ambispora leptoticha, en condiciones de riego y sequía en campo.
Tabla 1 Valores medios para el rendimiento de semilla y sus componentes de la variedad de frijol Azufrado Higuera. Campo Experimental Valle del Fuerte, Juan José Ríos, Guasave, Sinaloa.
| Tratamiento | RS | BMA | VN | SN | P100S | SV | IC |
|---|---|---|---|---|---|---|---|
| M+AA | 442a | 828a | 339a | 1244a | 45.13 | 3.67 | 53.67 |
| Aminoácidos (AA) | 300ab | 567ab | 235ab | 839ab | 43.53 | 3.67 | 53.00 |
| Micorriza (M) | 295ab | 550ab | 224b | 822ab | 44.53 | 4.0 | 53.67 |
| Control | 236b | 448b | 197b | 699b | 44.17 | 3.6 | 52.67 |
| Media general | 318 | 550 | 249 | 901 | 44.34 | 3.75 | 53.25 |
| Tukey (P ≤ 0.05) | 160.40 | 550 | 111 | 457 | 6.38 | 1.63 | 3.56 |
| F = 7.17 | F = 6.81 | F = 7.50 | F = 6.47 | F = 0.26 | F = 0.25 | F = 0.47 | |
| 0.021* | 0.023* | 0.019* | 0.026* | 0.85 ns | 0.86 ns | 0.71 ns |
RS = Rendimiento de semilla (g m-2); BMA = Biomasa aérea final (g m-2); VN = Número de vainas normales por m2; SN = Número de semillas normales por m2; P100S = Peso de 100 semillas (g); SV = Número de semillas por vaina normal; IC = Índice de cosecha (%). Medias con letras iguales en cada columna no difieren significativamente. *(P ≤ 0.05), ns = no significativo.
Los bioestimulantes tuvieron efecto positivo sobre el crecimiento de la parte aérea de la planta y el rendimiento y sus componentes en la variedad de frijol Azufrado Higuera. El tratamiento sobresaliente fue el de la combinación de la micorriza Glomus intraradices más los aminoácidos, por promover mayor crecimiento del área foliar y acumulación de peso seco y altos valores en el rendimiento, biomasa aérea final y número de vainas y semillas normales por m2.











 nueva página del texto (beta)
nueva página del texto (beta)