Introducción
El chile (Capsicum ssp.) es uno de los cultivos hortícolas más importantes a nivel mundial por el volumen de producción de 41 125 955 t en el 2021 (FAOSTAT 2023) y consumo; sus frutos se utilizan en fresco y seco para proporcionar sabor, aroma y color a diversos platillos (Molina-Suarez et al. 2021). También, son usados como condimento, verdura, ornamental, medicinal y colorante alimenticio (Xiao-min et al. 2016, Massot y Barbieri 2016, Haralayya y Asha 2017, Konishi et al. 2019).
En México, se han identificado más de 60 morfotipos de chiles en estudios in situ y por información de productores, la mayoría corresponden a C. annuum L., y exhiben gran diversidad de forma, tamaño, color, rango de maduración (precocidad) y pungencia (Gálvez et al. 2021); los tipos que destacan son el Jalapeño, Ancho, Guajillo, Pasilla, Serrano, Chile de árbol y Piquín, todos ellos distribuidos en todo el territorio mexicano y de importancia cultural, social y económica (Castellón-Martínez et al. 2012). En el 2021, la producción de chile verde fue de 3 238 244.81 t, con rendimiento promedio de 21.65 t ha-1 y consumo per cápita de 18.4 kg. Los principales Estados productores fueron Sinaloa (757 769 t/53.5 t ha-1), Chihuahua (682 084 t/24.53 t ha-1), Zacatecas (450 098 t/12.70 t ha-1), San Luis Potosí (323 141 t/13.33 t ha-1) y Sonora (192 3651/42.89 t ha-1); mientras que, el Estado de Guerrero sólo produjo 8 970 t, con rendimiento de 6.70 t ha-1 (SIAP 2021).
A pesar del bajo rendimiento por superficie, el Estado de Guerrero cuenta con gran diversidad de chiles con alto potencial para su aprovechamiento y de impacto en la economía regional y local, así como, en la gastronomía (Vera-Sánchez et al. 2016). Tal es el caso de los chiles apaxtlecos (fenotipos locales conocidos como: Ancho Liso, Ancho Chino, Delgado Liso y Carricillo), considerados como material nativo y de presencia en la cultura y económica de los habitantes de Apaxtla de Castejón, Guerrero, México (Aguilar-Rincón et al. 2010, Vázquez-Casarrubias et al. 2011); usados para mole y guisos típicos de la región Norte del Estado. Pero la variabilidad genética y fenotípica de estos chiles ha disminuido por efecto de algunos factores como polinización de la planta y método de mejoramiento (selección) que realizan los productores, afectando negativamente las características cuantitativas (tamaño, grosor) y cualitativas (forma, color, olor, sabor) de los frutos (López 2003). Por otro lado, las investigaciones referentes a la caracterización genotípica y agronómica de estos tipos de chiles es escaza. Solo se reportan resultados obtenidos por Vázquez-Casarrubias et al. (2011), quienes evaluaron el efecto de la edad de la plántula al trasplante en los parámetros de crecimiento y rendimiento de las plantas de morfotipos de chile apaxtleco.
Una alternativa para incrementar la variabilidad genética de las poblaciones y seleccionar individuos sobresalientes en corto tiempo es la mutagénesis mediante radiación ionizante (Aklilu 2021, Madriz-Martínez et al. 2022). Los rayos gamma originan nuevas combinaciones genéticas de genes parentales ya existentes (Majeed et al. 2018); además, tienen alta penetración, reproducibilidad y frecuencia de mutaciones (Abaza et al. 2020).
La irradiación de semillas u otros órganos (yemas, esquejes, polen) de la planta con 60Co ha producido cambios favorables en parámetros morfológicos (porte alto o bajo; formación de tallos, ramas, hojas), reproductivos (forma y color de flores, semillas) y del rendimiento (Oladosu et al. 2016) de especies, como frijol (Phaseolus vulgaris L.) (Martirena et al. 2019), pasto africano (Eragrostis lehmanniana Ness) (Álvarez-Holguín et al. 2018); cacahuate (Arachis hypogaea L.) (Brito y Ángeles 2016); ajo (Arachis hypogaea L.) (Pardo-Roldan 2015); soya (Glycine max L.), trigo (Triticum spp.) y girasol (Helianthus annuus L.) (Foroughbakhch-Pournavab et al. 2015); papa (Solanum tuberosum L.) (Salomón et al. 2017); vainilla (Vanilla planifolia L.) (Reyes-López et al. 2018) y ornamentales (Patil et al. 2015, Deshmukh y Malode 2018, Billore et al. 2019). Otro efecto de la irradiación es que estimula la capacidad de las plantas para resistir periodos de sequía, plagas y enfermedades (Oladosu et al. 2016). Por ejemplo, Gaswanto et al. (2016) emplearon los rayos gamma para inducir la resistencia del chile a Begomovirus sp. y mejorar las características agronómicas. No obstante, los efectos estimulantes de la radiación gamma van a depender de la dosis (Ramchander et al. 2015) y el material vegetal; pues se ha reportado que dosis mayores de 300 Gy disminuyen el crecimiento de las plantas de C. annuum (Thisawech et al. 2020).
Considerando que los trabajos de mejoramiento genético del chile apaxtleco son escasos y que la planta es autógama; se considera de interés un programa de mejoramiento por mutagénesis radioinducida como complemento al mejoramiento convencional (Villalta-Villalobos y Gatica-Arias 2019). Por lo tanto, la presente investigación tuvo el objetivo de evaluar los efectos de diferentes dosis (0 a 300 Gy) de radiación gamma a la semilla en el comportamiento morfológico y productivo (rendimiento y calidad del fruto) de las plantas M1 de tres morfotipos de chile apaxtleco; bajo la hipótesis de que al menos una dosis de rayos gamma induce cambios biológicos que amplían la variabilidad morfologica, rendimiento y calidad del fruto, que pueden ser aprovechados por selección para obtener nuevas variedades.
Materiales y métodos
Germoplasma
Se usaron semillas de tres fenotipos (Ancho liso, Ancho chino 1 y 2) de chile apaxtleco (Capsicum annuum L.) de un año; provenientes de Apaxtla de Castrejón, Guerrero, México. Los frutos del Ancho chino se caracterizan por la epidermis rugosa (al deshidratarse), forma trapezoidal y color es rojo intenso a negro. Mientras que, el chile Ancho liso se diferencia solamente en la epidermis del fruto que es lisa (Aguilar-Rincón et al. 2010). En este sentido, los frutos colectados de Ancho chino 1 tuvieron un peso seco promedio de 6.82 g (peso sin semilla de 5.19 g), con 11.26 cm de longitud, y diámetro medio de 38.82 mm (basal de 45.8 mm y apical de 16.86 mm). El Ancho chino 2 presentó 6.82 g de peso seco (peso sin semillas de 5.19 g), longitud de 11.26 cm y diámetro medio de 38.82 mm (basal de 45.8 mm y apical de 16.86 mm). Por último, los frutos de Ancho liso registraron 3.59 g de peso seco (peso sin semillas de 2.45 g), longitud de 9.14 cm y diámetro medio de 24.67 mm, (basal de 28.9.mm y apical de 10.29 mm). La irradiación del germoplasma se realizó en el Instituto Nacional de Investigaciones Nucleares (ININ), en el Estado de México, en un irradiador LGI-01 Transelektro, en junio de 2018.
Diseño de tratamientos
Los factores de estudio fueron (i) dosis de irradiación (0, 50, 100, 200, 250 y 300 Gy de rayos gamma 60Co (en 5 g de semilla) y (ii) fenotipo de chile (Ancho chino 1 y 2, y Ancho liso). Los tratamientos resultaron de la combinación de estos dos factores, y se distribuyeron en un diseño completamente al azar, con seis repeticiones (cada repetición la constituyó seis plantas M1, seleccionando una planta que presentó diferencias fenotípicas con respecto al testigo) de cada dosis en cada fenotipo, trasplantadas en bolsa negra de polietileno de 9 L de volumen con piedra pómez como sustrato.
Establecimiento de semilleros y trasplante
Las semillas se sembraron en octubre de 2018, en charolas de poliestireno con turba como sustrato y se regaron con agua de llave, con pH 7.6 y conductividad de 0.5 dS m-1. En cuanto, a la sensibilidad de la semilla; las dosis de 100 y 300 Gy fueron las que estimularon el proceso de germinación.
Las plántulas se regaron manualmente dos veces al día con agua de llave y solución nutritiva Steiner (1984) al 25% de su concentración desde la emergencia hasta su trasplante. El trasplante se realizó en noviembre de 2018 en invernadero tipo cenital cubierto con plástico de 720 μm en el techo y malla antiáfidos en las paredes, ubicado en la Facultad de Ciencias Agropecuarias y Ambientales, unidad Tuxpan, de la Universidad Autónoma de Guerrero (18° 20’ 51” LN, 99° 30’ 32” LO, 758 msnm). Para esta actividad, se seleccionaron seis plántulas M1 (las más vigorosas) por cada dosis en cada fenotipo de chile. El sustrato fue piedra pómez con granulometría de 2 a 9 mm, densidad aparente de 0.4 a 0.9 g cm-3, 24% de porosidad total, 16% de porosidad de aireación, 2.49% de agua fácilmente disponible (Luna et al. 2021).
Manejo del cultivo
Las plantas se mantuvieron en posición vertical mediante tutoreo con rafia que se colocó a lo largo de las hileras y se sujetó a postes de madera en los extremos de las mismas. Para el fertirriego se empleó la solución nutritiva Steiner (1984) al 50% de su fuerza iónica original, con pH ajustado a 5.5. Durante el desarrollo del experimento en invernadero se presentó temperatura máxima de 42 °C y mínima de 24 °C, y humedad relativa de 58%.
Variables de crecimiento y rendimiento
A los 120 días después del trasplante (ddt) se registraron las variables morfológicas: (i) altura (cm) de planta con un flexómetro Truper®, desde la base del tallo en contacto con el sustrato hasta el punto de crecimiento apical de la rama más larga; (ii) diámetro del tallo (mm) mediante un vernier digital Truper® modelo CAL-6MP, a 2 cm de la base del tallo, y (iii) el número de ramas por planta. El rendimiento, se evaluó con base en el número de frutos acumulados de cuatro cosechas (el número de cosechas se limitó por las temperaturas mayores de 40 °C, en los meses de febrero a mayo) y su peso (g) (fresco y seco), con una báscula digital Torrey® serie L-PCR. Para la obtención del peso seco, los frutos recolectados en cada cosecha se almacenaron en bolsas de papel con perforaciones y se colocaron en una estufa de secado con aire reforzado (Riossa®) modelo HCF-62D, a 75 °C hasta que las muestras se mantuvieron a peso constante. Los parámetros de calidad del fruto se determinaron en 30 frutos cosechados (y se obtuvo un promedio por repetición), a los cuales se midió el diámetro polar (cm) y ecuatorial (mm); el primero de la base del pedúnculo al ápice, con un flexómetro Truper®, y el segundo, con un vernierdigital Truper® modelo CAL-6MP; el peso (g) (fresco y seco) individual de los frutos, con y sin semilla, se registraron con una báscula digital ISOLAB®; también, se contabilizó el número de semillas por fruto. Con el valor de los 30 frutos se obtuvo un promedio por repetición.
Se realizó un análisis de varianza combinado para cada variable cuyas fuentes de variación fueron Dosis (D), Fenotipo (F) y la interacción Dosis x Fenotipo. Las medias se compararon con la prueba de Tukey (a < 0.05). Los análisis se efectuaron con el programa estadístico SAS, versión 9.1 (SAS 2002).
Resultados
Los análisis de varianza combinados detectaron significancia (α ≤ 0.05) de las dosis de radiación (D) en el número de frutos por planta y los parámetros de calidad del fruto; mientras que, el fenotipo (F) mostró significancia (α ≤ 0.05) en los rasgos de crecimiento (excepto número de ramas), rendimiento y los parámetros de calidad del fruto. La interacción D x F solo fue significativa en altura y diámetro de tallo de las plantas Mi, y calidad del fruto (Tabla 1 a 3).
Tabla 1 Grados de libertad y cuadrados medios de las fuentes de variación para características morfológicas, rendimiento y calidad del fruto de plantas M1 de tres fenotipos de chiles apaxtleco.
| FV | GL | AL | DT | NR | NFA | PFF | DPF | DEF | PFF | PSF | NSF | PSSF | PSFS |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Dosis (D) | 6 | 760.39ns | 53.31ns | 1.65ns | 1486.56* | 45990.96ns | 5.81* | 77.44* | 20.36* | 3.84* | 1843.80* | 0.08* | 2.69* |
| Fenotipo (F) | 2 | 7190.30* | 194.84* | 2.38ns | 4427.72* | 469226.54* | 2.55* | 1108.91* | 362.69* | 31.80* | 3447.14* | 0.74* | 25.03* |
| D x F | 12 | 1072.98* | 72.46* | 1.76ns | 910.51ns | 35961.00ns | 3.70* | 33.55* | 37.76* | 2.40* | 884.15* | 0.05* | 1.92* |
| C.V. (%) | 18 | 32 | 33 | 54 | 52 | 7 | 6 | 9 | 10 | 20 | 22 | 13 |
FV = Fuente de variación. GL = Grados de libertad. AL = Altura de la planta. DT = Diámetro de tallo. NR = Número de ramas. NFA = Número de frutos acumulados. PFF = Peso fresco del fruto. DPF = Diámetro polar del fruto. DEF = Diámetro ecuatorial del fruto. PFF = Peso fresco del fruto. PSF = Peso seco del fruto. NSF = Número de semillas por fruto. PSSF = Peso de semillas por fruto. PSFS = Peso seco del fruto sin semilla. * = Significativo, α ≤ 0.05. ns = No significativo, α ≥ 0.05.
Tabla 2 Medias de dosis de radicación para las características morfológicas y rendimiento de plantas M1 de tres fenotipos de chile apaxtleco.
| Dosis (Gy) | AL (cm) | DT (mm) | NR | NFA | PFF (g) | DPF (mm) | DEF (mm) | PFF (g) | PSF (g) | NSF | PSSF (g) | PSFS (g) |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 0 | 108.33a | 20.46a | 3.56a | 57.11ab | 422.84a | 7.02b | 25.40d | 9.77ab | 2.81b | 64.09a | 0.53ab | 2.28b |
| 50 | 109.37a | 16.55a | 3.61a | 47.56ab | 340.99a | 7.03b | 26.98c | 10.47a | 3.22a | 64.32a | 0.54a | 2.68a |
| 100 | 116.02a | 19.07a | 4.00a | 65.78a | 416.56a | 7.52b | 26.74cd | 9.81ab | 3.16a | 63.91a | 0.52ab | 2.64a |
| 150 | 110.3a | 17.75a | 3.78a | 52.78ab | 393.44a | 7.21ab | 29.06ab | 10.14ab | 3.32a | 52.27bc | 0.46ab | 2.86a |
| 200 | 117.92a | 16.03a | 3.44a | 49.94a | 369.42a | 6.23c | 29.42a | 10.53a | 3.29a | 60.31ab | 0.49ab | 2.88a |
| 250 | 120.17a | 17.33a | 3.72a | 36.00b | 275.33a | 5.89c | 27.75bc | 7.97c | 2.41c | 43.67cd | 0.35c | 2.06bc |
| 300 | 125.99a | 20.08a | 4.33a | 52.11ab | 374.28a | 6.82b | 23.46e | 9.31b | 2.26c | 40.71 d | 0.43bc | 1.92c |
| C.V. (%) | 18 | 32 | 33 | 54 | 52 | 7 | 6 | 9 | 10 | 20 | 22 | 13 |
| DMS | 10.98 | 5.91 | 1.25 | 28.05 | 193.58 | 0.45 | 1.51 | 0.92 | 0.30 | 11.35 | 0.10 | 0.32 |
AL = Altura de la planta. DT = Diámetro de tallo. NR = Número de ramas. NFA = Número de frutos acumulados. PFF = Peso fresco del fruto. DPF = Diámetro polar del fruto. DEF = Diámetro ecuatorial del fruto. PFF = Peso fresco del fruto. PSF = Peso seco del fruto. NSF = Número de semillas por fruto. PSSF = Peso de semillas por fruto. PSFS = Peso seco del fruto sin semilla. Medias con la misma letra en cada variable son estadísticamente iguales, Tukey, 0.05.
Tabla 3 Medias del fenotipo para las características morfológicas y rendimiento de plantas M1 de tres chiles apaxtleco.
| Fenotipo | AL (cm) | DT (mm) | NR | NFA | PFF (g) | DPF (mm) | DEF (mm) | PFF (g) | PSF (g) | NSF | PSSF (g) | PSFS (g) |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ancho chino 1 | 113.12b | 16.80b | 3.55a | 57.19a | 410.23a | 6.82b | 27.90b | 9.70b | 3.05b | 57.09b | 0.62a | 3.14a |
| Ancho chino 2 | 103.69b | 17.08b | 4.02a | 39.76b | 450.42a | 7.06a | 31.58a | 13.86a | 3.72a | 63.84a | 0.43b | 2.65b |
| Ancho liso | 129.54a | 20.70a | 3.76a | 57.88a | 250.59b | 6.57c | 21.43c | 5.58c | 2.00c | 45.91c | 0.37c | 1.63c |
| C.V. (%) | 18 | 32 | 33a | 54 | 52 | 7 | 6 | 9 | 10 | 20 | 22 | 13 |
| DMS | 10.98 | 3.06 | 0.64 | 14.52 | 100.22 | 0.23 | 0.78 | 0.47 | 0.15 | 5.87 | 0.05 | 0.16 |
AL = Altura de la planta. DT = Diámetro de tallo. NR = Número de ramas. NFA = Número de frutos acumulados. PFF = Peso fresco del fruto. DPF = Diámetro polar del fruto. DEF = Diámetro ecuatorial del fruto. PFF = Peso fresco del fruto. PSF = Peso seco del fruto. NSF = Número de semillas por fruto. PSSF = Peso de semillas por fruto. PSFS = Peso seco del fruto sin semilla. Medias con la misma letra en cada variable son estadísticamente iguales, Tukey, 0.05.
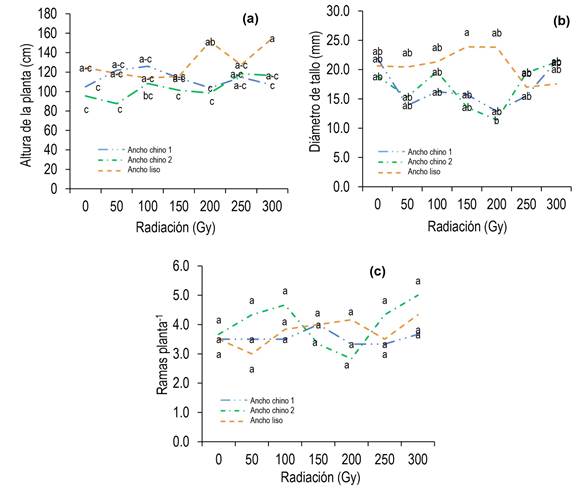
Efecto de radiación x fenotipo en aspectos morfológicos de plantas M1
Las variables morfológicas (altura, diámetro del tallo y número de ramas) de las plantas M1 de los tres fenotipos de chiles apaxtlecos evaluados presentaron respuesta similar con las dosis de radiación (0 a 300 Gy) (Figura 1). En Ancho chino 1, la altura de planta osciló entre 104.88 y 126.02 cm, el grosor del tallo de 12.89 a 21.87 mm y de 3.33 a 4.00 ramas. En plantas de Ancho chino 2, la altura varió de 87.53 a 118.30 cm, el diámetro de tallo de 11.40 a 21.27 mm y de 2.83 a 5.00 ramas. Únicamente, el Ancho liso mostró respuesta favorable en altura de planta (154.87 cm) con 300 Gy, y grosor del tallo (23.81 y 23.88 mm) de la planta M1, cuando las semillas se irradiaron con 150 a 200 Gy, respetivamente (Figura 1 a-b), el número de ramas fue de 3.00 a 4.33 (Tablas 2 y 3). La respuesta observada en los dos primeros parámetros se puede relacionar con el tamaño del fruto, ya que Ancho liso produce frutos de menor tamaño que los del Ancho chino (Tabla 3), situación que puede alterar el crecimiento de las plantas.
Efecto de radiación x fenotipo en parámetros del rendimiento y calidad del fruto de plantas M1
La radiación gamma y el fenotipo de chile afectaron estadísticamente (α ≤ 0.05) la producción de frutos de chile apaxtleco (Tabla 1 a 3). La irradiación de las semillas con 100 Gy en los fenotipos Ancho chino 1 (88 frutos planta-1) y Ancho liso (74 frutos planta-1), originó las plantas M1 con mayor número de frutos (Figura 2a), en comparación con las plantas de Ancho chino 2 (29 a 42 frutos planta-1). Por otro lado, el peso fresco por planta no varió significativamente por las dosis de radiación (0 a 300 Gy; pero, si por efecto del fenotipo; los mayores pesos se presentaron en los frutos provenientes de chiles Ancho chino 1 (224.00 a 528.10 g) y 2 (289.50 a 550.30 g), en comparación con los frutos de Ancho liso (183.70 a 323.60 g) (Figura 2b). En este sentido, el comportamiento del rendimiento de los tres chiles dependió directamente de los parámetros de calidad del fruto (tamaño y peso), los cuales fueron alterados significativamente por la radiación (Tablas 2 y 3, Figura 3).
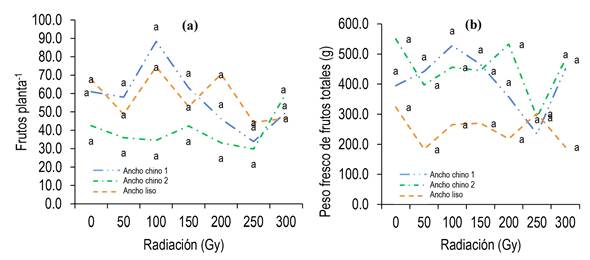
Figura 2 Efecto de dosis de radiación en el rendimiento de tres fenotipos de chiles apaxtleco. Letras iguales en cada parámetro son estadísticamente iguales (p ≥ 0.05). DMSa = 59.21. DMSb = 408.55.

Figura 3 Efecto de dosis de radiación en parámetros de calidad del fruto de tres fenotipos de chiles apaxtleco. Letras iguales en cada parámetro son estadísticamente iguales (p ≥ 0.05). DMSa = 0.95. DMSb = 3.19. DMSc = 1.95. DMSd = 0.65. DMSe = 23.96. DMSf = 0.68.
El tamaño (diámetro ecuatorial y polar) y peso (fresco y seco) del fruto fueron favorecidos con dosis de irradiación de 100 a 200 Gy; principalmente en los fenotipos Ancho chino 1 y 2; mientras que, dosis mayores de 200 Gy provocaron una respuesta negativa en los parámetros, especialmente en los frutos del Acho liso, de tal modo que, en frutos de Ancho chino 1; el mayor diámetro ecuatorial (29.52 mm) se presentó con 200 Gy; mientras que, el diámetro polar (8.21 cm) y peso seco (3.80 g) fue con 150 Gy, y con 300 Gy fue el mayor peso fresco (11.47 g). En cuanto al Ancho chino 2; el mayor diámetro ecuatorial (35.89 mm) se obtuvo con 200 Gy, y con 150 Gy se presentó mayor diámetro polar (7.42 cm), peso fresco (16.81 g) y seco del fruto (4.93 g). Por otro lado, la formación de semilla mostró ser un parámetro sensible a la radiación gamma específicamente en los fenotipos de mayor tamaño (Ancho chino 1 y 2), y que conforme aumentó la dosis de irradiación (> 200 Gy) se tuvo menor cantidad de semillas en los frutos. Respuesta contraria, se observó en los frutos de plantas M1 del Ancho liso, provenientes de cualquier dosis de irradiación (100 a 300 Gy), que presentaron la mayor cantidad de semillas (42 a 51 semillas por fruto), en comparación con los frutos de plantas testigo (semillas sin irradiar), con 36 semillas por fruto.
Discusión
La respuesta observada en aspectos morfológicos de los chiles apaxtlecos se puede relacionar con características ligadas a la planta (especie, cultivar, etapa de desarrollo, arquitectura de los tejidos y organización del genoma) (Chen et al. 2020; Muhammad et al. 2021) y con el grado de sensibilidad a la radiación ionizante (dosis, duración, tipo de mutágeno) (Hasan et al. 2020, Sani Haliru et al. 2020). En este sentido, diversas investigaciones señalan que las semillas irradiadas con rayos gamma originaran plantas que manifiestan cambios en el balance hormonal, actividad enzimática y ciclo celular, debido a daños en el DNA (Puerta-Ortiz y Morales-Aramburo 2020, Hong et al. 2022), en algunas situaciones la planta tiene la capacidad para reparar el daño, por lo tanto, los cambios se pueden expresar en mejor vigor, crecimiento, rendimiento o supresión en las progenies (enanismo, clorosis) (Andrew-Peter-Leon et al. 2021, Choi et al. 2021, Hong et al. 2022). Con respecto a los fenotipos de chiles apaxtlecos estudiados, ninguna dosis limitó el crecimiento de las plantas M1 (Figura 1).
El efecto estimulante de la radiación en C. annuum L. fue reportado por Mullainathan y Aruldoss (2015) en plantas M2, provenientes de semillas irradiadas con 300 y 400 Gy; pues obtuvieron plantas de porte alto (75 a 80 cm) e intermedio (31 a 45 cm), con menor ramificación; sin embargo, la dosis de 500 Gy provocó plantas enanas (≤ 20.16 cm), con respecto a las plantas testigo (65 a 72.8 cm). Igualmente, en cereales y leguminosas se han observado resultados sobresalientes, principalmente con dosis bajas (< 100 Gy), que favorecen la acumulación de materia seca, el contenido total de clorofila y rendimiento (Majeed et al. 2018); mientras que, dosis altas (> 100 Gy) provocaron lesiones, irregularidad en la síntesis de proteínas, desequilibrio hormonal (Ulukapi 2021) y en algunos casos la muerte de la planta (Olasupo et al. 2016). No obstante, los resultados anteriores contrastan con lo reportado por Soyam et al. (2019), quienes encontraron que dosis de 200 a 400 Gy aplicados a semillas, redujeron altura (6 a 15%), formación de ramas (4 a 16%) y frutos, y por ende rendimiento (peso en fresco del fruto) de las plantas M1 de C. annuum, con respecto a las plantas testigo (altura: 74 cm; ramas: 8; frutos: 708 y peso: 52 kg por planta); mientras que, el tamaño (diámetro polar y ecuatorial) del fruto fue estadísticamente similar entre las plantas irradiadas y no irradiadas. Estos autores señalaron que al incrementar la dosis de irradiación gamma se generó una respuesta negativa en estos indicadores.
Los resultados obtenidos en productividad de chiles apaxtlecos evaluados en el presente estudio tienen similitud con lo reportado en plantas M2 de C. annuum L. de semillas irradiadas con 400 Gy, que tuvieron mayor producción de flores y frutos (52 a 60), estos últimos con mayor tamaño que los frutos de plantas testigo (≤ 30 frutos) (Mullainathan y Aruldoss 2015). Asimismo, en plantas M1 de Psoralea corylifolia L.; la irradiación estimuló la formación de ramas, flores y frutos; sin embargo, estos disminuyeron considerablemente con dosis altas (> 1000 Gy) de rayos gamma (Jan et al. 2011).
Existen resultados por el efecto de la aplicación de radiación gamma en los componentes del rendimiento de cultivos industriales (algodón, soya, frijol, cacahuate, okra) y cereales (arroz, trigo) (Billore et al. 2019, Martirena et al. 2019, Abaza et al. 2020, Chen et al. 2020). No obstante, se ha observado que la magnitud de los efectos horméticos son ligeros, inconsistentes y representan el 10% del valor obtenido en el control (Hase et al. 2020). En otros casos, la radioestimulación no se expresa en las siguientes generaciones o suele ser diferente entre individuos, principalmente en aquellos que tienen baja producción de biomasa (Choi et al. 2021). Lo anterior se debe a que en la generación Mi; las plantas son genéticamente heterocigotas, ya que un solo alelo es afectado por una mutación durante el tratamiento (Oladosu et al. 2016).
La disparidad de cambios biológicos que expresan las plantas por la irradiación gamma, se debe al grado de daño o modificación que provocan los radicales libres (peróxido de hidrogeno) en los componentes de las células (DNA, mitocondria y cloroplastos), que participan directamente en aspectos de la anatomía, fisiología, bioquímica y morfología de las plantas (Choi et al. 2021, Hong et al. 2022). Es por ello, que algunos investigadores sugieren dosis bajas e intermedias (< 200 Gy) (Majeed et al. 2018, Andrew-Peter-Leon et al. 2021), porque estimulan la respiración, actividades enzimáticas y niveles de fitohormonas de las plantas (Han et al. 2020, Hong et al. 2022).
Conclusiones
Los resultados del estudio demuestran las respuestas morfológicas cuantitativas de las plantas de chile apaxtleco a la irradiación, que ocurren durante el crecimiento vegetativo y la reproducción. La radiación gamma 60Co en dosis de 100 a 300 Gy no alteró los aspectos morfológicos de las plantas M1 de los tres fenotipos de chiles apaxtlecos. Las dosis de 100 a 200 Gy estimularon los parámetros del rendimiento y calidad del fruto; sin embargo, dosis mayores de 200 Gy limitaron la formación de semillas en los frutos. Con relación al fenotipo de chile apaxtleco; el Ancho liso sólo mostró respuesta favorable en los rasgos de altura y número de ramas por planta; mientras que, los fenotipos Ancho chino 1 y 2 sobresalieron en parámetros del rendimiento y calidad del fruto. Estos resultados aportan conocimiento de la sensibilidad de las plantas y permite seleccionar individuos sobresalientes (en variantes de importancia económica) que pueden emplear en futuras investigaciones de mejoramiento genético.











 nueva página del texto (beta)
nueva página del texto (beta)