Introducción
La vegetación ribereña se encuentra conformada por comunidades vegetales que incluyen a árboles, arbustos y hierbas que se desarrollan en las márgenes de ríos, arroyos, lagos, lagunas y zonas de inundación (Naiman et al. 2005). Debido a la cercanía e interacción con los cuerpos de agua constituye una zona de transición entre los sistemas terrestres y acuáticos (Ward et al. 2002). Las principales características de las especies vegetales que conforman la vegetación ribereña son la capacidad de soportar inundaciones temporales y colonizar rápidamente áreas expuestas (Ramos 2019). De acuerdo con su estructura, la vegetación ribereña se clasifica en dos tipos: bosques de galerías o bosques ribereños, en los que predominan árboles de hojas perenes, deciduas o semideciduas cuya altura varía entre 4 y 40 m; generalmente se distribuyen en climas tropicales y subtropicales (Rzedowski 2006); y matorrales ribereños cuyas especies dominantes son arbustos perennifolios, que generalmente miden de 1 a 2 m de alto (Ramos 2019).
La vegetación ribereña desempeña varias funciones ecosistémicas importantes, entre las que destacan: la regulación de inundaciones, retención y estabilización de sedimentos, ciclado de nutrientes, trasformación y degradación de contaminantes, secuestro de carbono en suelo y biomasa, producción de alimento para la fauna silvestre y ganado doméstico (Riss et al. 2020). Además, la vegetación ribereña constituye un área de refugio, descanso y alimentación para una gran diversidad de fauna silvestre y sirven como zonas de migración y conexión entre hábitats, lo que permite el mantenimiento de la diversidad biológica en paisajes fragmentados (Hamilton et al. 2015, Zimbres et al. 2017). Entre la fauna que se beneficia de la vegetación ribereña se encuentran los murciélagos filostómidos, los cuales encuentran condiciones ideales para refugiarse y alimentarse en comparación con áreas colindantes, como cultivos y vegetación primaria (Llaven-Macías 2013, Urquizo et al. 2018). En estos ambientes los murciélagos filostómidos pueden representar entre el 40 y 70% del total de las especies de murciélagos presentes (Galindo-González y Sosa 2003, De la Peña-Cuellar et al. 2015, Urquizo et al. 2018).
En el estado de Tabasco, México, la vegetación ribereña ocupa el 1.37% de la superficie estatal y se distribuye principalmente en las orillas de los ríos Grijalva, Mezcalapa, Samaria, Tonalá, San Pedro y Usumacinta (Barba-Macías et al. 2006, Castillo-Acosta y Zavala-Cruz 2019). En el caso del río Usumacinta este cuenta con poco más del 1% de la cobertura de vegetación ribereña original; principalmente en la subregión de Los Ríos (Roa-Fuentes et al. 2016). A pesar de su importancia ecosistémica gran parte de la vegetación ribereña en esta zona ha sido convertida en áreas de uso agrícola y ganadero, debido a la calidad de suelo en términos de fertilidad y disponibilidad de agua (Roa-Fuentes et al. 2016).
Los murciélagos filostómidos son la familia taxonómica más diversa desde el punto de vista ecológico, y en la actualidad, solo son superados por los murciélagos vespertiliónidos en número total de especies (Cirranelo y Simmons 2020). Debido a su diversidad y amplia variedad de estrategias tróficas realizan una variedad de funciones ecológicas en los ecosistemas que habitan (Patterson et al. 2003). Por ejemplo, las especies frugívoras y nectarívoras desempeñan un valioso papel en los ecosistemas como dispersores de semillas y polinizadores, permitiendo mantener la diversidad de plantas, promoviendo la sucesión secundaria y la regeneración de la vegetación natural (Muscarella y Fleming 2007, Kunz et al. 2011). Las especies insectívoras, carnívoras y piscívoras actúan como reguladores de poblaciones. Las primeras regulan poblaciones de artrópodos causantes de daños a cultivos o de artrópodos vectores de enfermedades zoonóticas, las carnívoras se encargan de regular las poblaciones de pequeños vertebrados (Kunz et al. 2011), mientras que las piscívoras regulan las poblaciones de peces y artrópodos en ecosistemas acuáticos (Fahl et al. 2015). Las especies hematófagas, especialmente el murciélago vampiro (Desmodus rotundus) son trasmisoras de enfermedades zoonóticas al ganado y al ser humano, principalmente la rabia (Stoner-Dunca et al. 2014). A pesar de los daños que puedan causar al sector ganadero y a la salud pública, los estudios han demostrado la importancia medica de las especies hematófagas en el tratamiento de la trombosis (Ligabue-Braun et al. 2012) y el desarrollo de anestésicos (Kakumanu et al. 2019) a partir de los anticoagulantes presentes en su saliva. Por estas características se han usado como un grupo focal en la evaluación de los cambios producidos por las actividades humanas (García-Morales et al. 2013).
El conocimiento sobre los patrones de diversidad de murciélagos filostómidos en vegetación ribereña es limitado. En México los estudios realizados se han enfocado en determinar la importancia de la vegetación ribereña para conservar la comunidad de murciélagos en paisajes dominados por actividades humanas (Galindo-González y Sosa 2003, De la Peña-Cuellar et al. 2015, Zarazúa-Carbajal et al. 2017). En general, se ha demostrado que la vegetación ribereña alberga mayor diversidad de murciélagos filostómidos en comparación con los diferentes elementos que conforman los paisajes antrópicos (Estrada y Coates-Estrada 2001, Galindo-González y Sosa 2003, De la Peña-Cuellar et al. 2015). Pero se cuenta con poca información sobre cómo la estructura y composición de los ensambles de murciélagos filostómidos varía entre diferentes sitios y/o condiciones de vegetación ribereña (De la Peña-Cuellar et al. 2015, Urquizo et al. 2018). Conocer esta información podría proporcionar elementos para el desarrollo de programas de manejo y conservación de sitios altamente degradados en los que se realizan actividades agrícolas y ganaderas (Romero et al. 2014, Roa-Fuentes et al. 2016). Por lo anterior, el objetivo del presente estudio fue comparar la estructura y composición del ensamble de murciélagos filostómidos que habitan en vegetación ribereña del río Usumacinta en Tabasco, México.
Materiales y métodos
Área de estudio
El estudio se realizó en la subregión de Los Ríos, localizada al oriente del estado de Tabasco entre los 30 y 250 msnm, está conformada por los municipios de Balancán, Emiliano Zapata y Tenosique (Figura 1). La fisiografía corresponde en su mayor parte a la Llanura Costera del Golfo, sólo en Tenosique existen cerros y macizos montañosos de la sierra de Guatemala y Chiapas (INEGI 2010). El clima predominante es cálido húmedo con abundantes lluvias en verano y temperatura media anual que ronda entre los 26 y 28 °C (Aceves-Navarro y Rivera-Hernández 2019). La precipitación anual varía de 1 600 a 2 000 mm. La mayor parte de la vegetación original ha sido reemplazada por pastizales inducidos y áreas de cultivo, en los que se puede encontrar parches de vegetación secundaria en diferentes grados de regeneración (Castillo-Acosta y Zavala-Cruz 2019). Sin embargo, la zona serrana de Tenosique aún conserva vegetación de selva alta perennifolia en la que predominan especies como botoncillo (Rinorea guatemalensis), mamba (Pseudolmedia oxyphyllaria), caimitillo (Chrysophyllum mexicanum), bejuco blanco (Guarea glabra) y zapote (Manilkara zapota; Vázquez-Negrín et al. 2011).
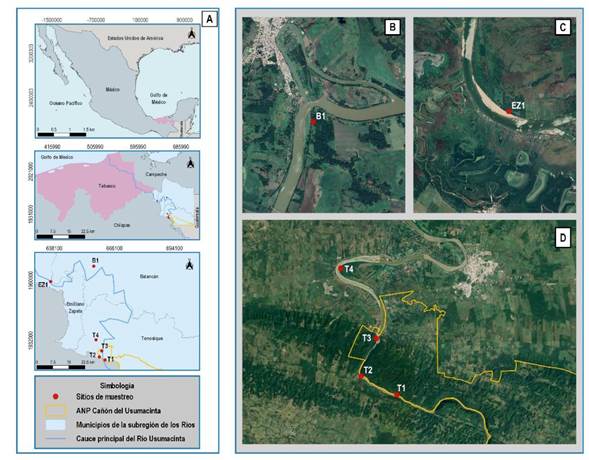
Figura 1 Mapa del área de estudio. A) Localización a nivel nacional, estatal y regional, B) Ubicación del sitio B1 en Balancán, C) Ubicación espacial del sitio EZ1 en Emiliano Zapata y D) Ubicación espacial de los sitos T1, T2, T3 y T4 en el municipio de Tenosique.
La vegetación ribereña ocupa aproximadamente el 2% de la superficie de la subregión de Los Ríos (Barba-Macías et al. 2006). En general estos ambientes presentan un dosel de entre 10 y 20 metros de altura y se observa entre dos y tres estratos (Castillo-Acosta y Zavala-Cruz 2019). La vegetación está compuesta por especies como el pucté (Bucida buceras), jinicuil (Inga vera), tinto (Haematoxylum campechianum), tucuy (Pithecellobium lanceolatum), sauce (Salix humboldtiana), amate (Ficus sp.) y capulín (Muntigia calabura; Ochoa-Gaona et al. 2018, Castillo-Acosta y Zavala-Cruz 2019).
Ubicación de sitios de muestreo y captura de murciélagos
Se seleccionaron seis sitios de muestreo con vegetación ribereña ubicados en las márgenes del río Usumacinta, cada uno con una separación mínima de 3 km, para considerarlos como unidades de muestreo espacialmente independientes (Gorresen y Willig 2004, Klingbeil y Willig 2009). Los sitios se ubicaron considerando el uso de suelo adyacente, de esta forma, los sitios B1, EZ1 y T4 ubicados en el municipio de Balancán, Emiliano Zapata y Tenosique respectivamente, corresponden a ambientes ribereños colindantes con áreas de cultivo y pastizales destinados a la actividad ganadera. Mientras que los sitios T1, T2 y T3 se situaron en ambientes ribereños con vegetación continua en buen estado de conservación dentro del Área Natural Protegida Cañón del Usumacinta, municipio de Tenosique.
Para la captura de murciélagos se colocaron cuatro redes de niebla de 6 x 2.5 m durante una noche al mes en cada sitio. Los muestreos se llevaron a cabo durante los meses de mayo, junio, julio, agosto y noviembre del año 2015. Pero por las condiciones climáticas y logísticas el número de noches de muestreo varió por sitio, siendo cinco el mayor número de noches y tres el menor, con un total de 26 noches de muestreo. Se estimó el esfuerzo de captura (Tabla 1) para cada sitio y para todo el estudio mediante el método de metros/red/hora (Briones-Salas et al. 2005, Calderón-Patrón et al. 2013). Se utilizó como método de captura de murciélagos redes de niebla, por ser la técnica más efectiva para el registro de especies de la familia Phyllostomidae (Pech-Canché et al. 2010, Bracamonte 2018). Cada noche de muestreo las redes se mantuvieron abiertas a partir de las 18:00 hasta las 00:00 h, y se revisaron cada 30 minutos aproximadamente. Los murciélagos capturados se identificaron por sus características morfométricas, con ayuda de la clave de campo de Medellín et al. (2008) y se elaboró un listado de la nomenclatura taxonómica de las especies basado en la propuesta de Ramírez-Pulido et al. (2014). Las especies capturadas fueron agrupadas en cinco gremios tróficos: frugívoro sedentario, frugívoro nómada, omnívoro, hematófago y nectarívoro; de acuerdo con la propuesta de Soriano (2000) y Aguirre et al. (2002).
Análisis de datos
Se estimó la completitud de inventario (CI) por sitio mediante el estimador no paramétrico Chao1 (Chao 1984), que supone homogeneidad en las muestras y relaciona el número de especies representadas por un individuo (Singlentons) y el número de especies representadas por dos individuos (Doblentons) en las muestras, lo que es adecuado para comunidades con especies de baja abundancia o muestras pequeñas (Colwell y Coddington 1994, Magurran 2004). La CI de cada sitio se estimó como el porcentaje representado por la riqueza de especies observadas en campo, en relación con la máxima riqueza esperada acorde al estimador Chao1. Se utilizó el programa PAST 4.05 (Hammer et al. 2001) para obtener el valor del estimador.
Para estimar la riqueza y diversidad de especies por sitio se utilizó el número efectivo de especies de orden 0 (0D) que tiene un valor equivalente a la riqueza de especies (S) y de orden 1 (1D), donde todas las especies incluidas tienen un peso exactamente proporcional a su abundancia en la comunidad y es determinado mediante el exponencial del índice de Shannon (Jost 2006, Moreno et al. 2011). Debido a la variación en el número de noches de muestreo entre los seis sitios (cinco noches para T1, T2 y T3; cuatro noches para B1 y EZ1; y tres noches para T4) los valores de 0D y 1D se compararon mediante la técnica de rarefacción basada en individuos (Gotelli y Colwell 2011). Los análisis se realizaron con el software PAST 4.05 (Hammer et al. 2001).
Se compararon los patrones de abundancia de especies entre sitios utilizando curvas de rango-abundancia o curvas de Whittaker (Feinsinger 2001). Estas curvas permiten identificar visualmente si la distribución de la abundancia de las especies varía entre los diferentes sitios de muestreo. Para ello se graficó la abundancia relativa (ni/N) de cada especie en una escala logarítmica (Log 10) y se ordenaron los datos desde la especie más abundante a la menos abundante (Feinsinger 2001).
Para medir la complementariedad en la composición de especies entre los seis sitios de muestreo se calculó el índice de Colwell y Coddington (1994) el cual se expresa en porcentaje, y varía desde cero cuando ambos sitios son idénticos (baja complementariedad) hasta 100 cuando ambos sitios son completamente distintos (alta complementariedad). Los cálculos se realizaron en una hoja de cálculo en el programa Excel usando la siguiente formula:
Donde: Sj y Sk son el número de especies registradas en los sitios j y k respectivamente y V jk es el número de especies compartidas entre ambos sitios.
Resultados
Se capturaron 541 ejemplares de murciélagos filostómidos de 15 especies, cinco subfamilias y 10 géneros (Tabla 2). De las 15 especies registradas, 10 (67%) pertenecen a la subfamilia Stenodermatinae, dos (13%) a Carolliinae y las subfamilias Desmodontinae, Glossophaginae y Phyllostominae estuvieron representadas por una especie, cada una (Tabla 2). La especie más abundante fue Artibeus jamaicensis con 181 individuos, seguida de Sturnira parvidens con 75 individuos, y en conjunto representan el 47% del total de los individuos capturados. Las especies Dermanura tolteca y Platyrrhinus helleri fueron las menos abundantes, con dos individuos cada una, lo que representa menos del 1% del total de los individuos capturados.
Tabla 2 Listado de especies de murciélagos filostómidos registrados en vegetación ribereña en Tabasco, México. FN = Frugívoro nómada, FS = Frugívoro sedentario, H = Hematófago, N = Nectarívoro, O = Omnívoro
| Subfamilia | Especie | Gremio trófico | B1 | EZ1 | T1 | T2 | T3 | T4 |
|---|---|---|---|---|---|---|---|---|
| Carolliinae | Carollia perspicillata | FS | 0 | 0 | 1 | 1 | 6 | 1 |
| Carollia sowelli | FS | 0 | 1 | 13 | 8 | 16 | 2 | |
| Desmodontinae | Desmodus rotundus | H | 2 | 8 | 4 | 4 | 2 | 2 |
| Glossophaginae | Glossophaga soricina | N | 13 | 8 | 3 | 5 | 6 | 4 |
| Phyllostominae | Phyllostomus discolor | O | 29 | 5 | 0 | 0 | 0 | 1 |
| Stenodermatinae | Artibeus jamaicensis | FN | 31 | 29 | 31 | 31 | 33 | 26 |
| Artibeus lituratus | FN | 0 | 1 | 3 | 7 | 5 | 2 | |
| Centurio senex | FN | 1 | 0 | 3 | 1 | 1 | 1 | |
| Dermanura phaeotis | FN | 5 | 4 | 7 | 3 | 8 | 0 | |
| Dermanura tolteca | FN | 1 | 0 | 0 | 0 | 1 | 0 | |
| Dermanura watsoni | FN | 0 | 0 | 2 | 3 | 2 | 3 | |
| Platyrrhinus helleri | FN | 0 | 0 | 0 | 1 | 1 | 0 | |
| Sturnira hondurensis | FS | 11 | 12 | 0 | 1 | 0 | 22 | |
| Sturnira parvidens | FS | 4 | 29 | 0 | 0 | 1 | 31 | |
| Uroderma bilobatum | FN | 7 | 5 | 0 | 0 | 2 | 14 |
De acuerdo con el gremio trófico, el ensamble de murciélagos se agrupó en cuatro clases: frugívoros (12 spp; 80%), hematófagos (1 sp; 7%), nectarívoro (1 sp; 7%) y omnívoros (1 sp; 7%). Por su parte, los frugívoros se agruparon en nómadas (8 spp) y sedentarios (4 spp; Tabla 1). Al analizar el gremio trófico por sitios, cuatro gremios estuvieron presentes en el 50% de los sitios, siendo los frugívoros los mejor representados, mientras que los omnívoros estuvieron ausentes en los sitios T1, T2 y T3 (Figura 2).
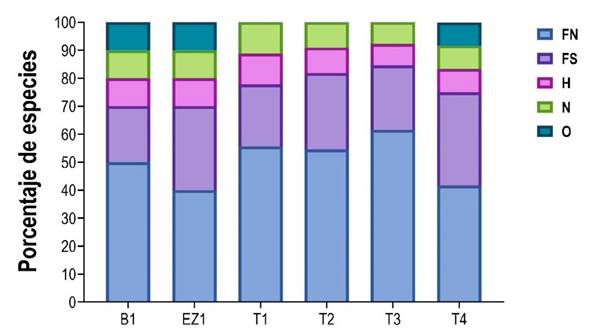
Figura 2 Gremios tróficos de los murciélagos filostómidos registrados en los sitios de muestreo. FN = Frugívoro nómada, FS = Frugívoro sedentario, H = Hematófago, N = Nectarívoro, O = Omnívoro.
En casi todos los sitios se obtuvo una completitud de inventarios superiores al 90%, el inventario más completo correspondió al sitio T1, mientras que en el sitio T2 se obtuvo el valor más bajo (Tabla 3). En términos generales los muestreos fueron suficientes para registrar la totalidad de las especies presentes en cada uno de los sitios.
Tabla 3 Valores de abundancia (N), riqueza (Sobs), diversidad verdadera (0D y 1D), riqueza estimada (Chao1) y completitud del inventario (%CI) para el ensamble de murciélagos filostómidos en cada sitio de muestreo.
| Sitio de muestreo | N | Sobs | 0 D | 1 D | Chao 1 | %CI |
|---|---|---|---|---|---|---|
| B1 | 114 | 10 | 8.94 | 6.42 | 10.5 | 95 |
| EZ1 | 102 | 10 | 9.24 | 6.35 | 11 | 91 |
| T1 | 67 | 9 | 8.96 | 5.26 | 9 | 100 |
| T2 | 65 | 11 | 11 | 5.81 | 17 | 65 |
| T3 | 84 | 13 | 11.94 | 6.69 | 14.5 | 90 |
| T4 | 109 | 12 | 10.21 | 6.11 | 12.75 | 94 |
En términos de riqueza de especies (0D), las curvas de rarefacción mostraron diferencias entre los sitios de muestreo (Figura 3A). Se observó que los sitios T3, T2 y T4 presentaron una mayor riqueza de especies que los sitios B1, EZ1 y T1 (Tabla 3). En el caso de la diversidad de especies (1D) las curvas de rarefacción no mostraron diferencias entre los sitios (Figura 3B), ya que cuatro de los seis sitios tiene valores de diversidad muy similares (rango: 6.11 a 6.69 especies efectivas). La mayor diferencia (1.43 especies efectivas) se presentó entre el sitio T3 y el T1 (Tabla 3).
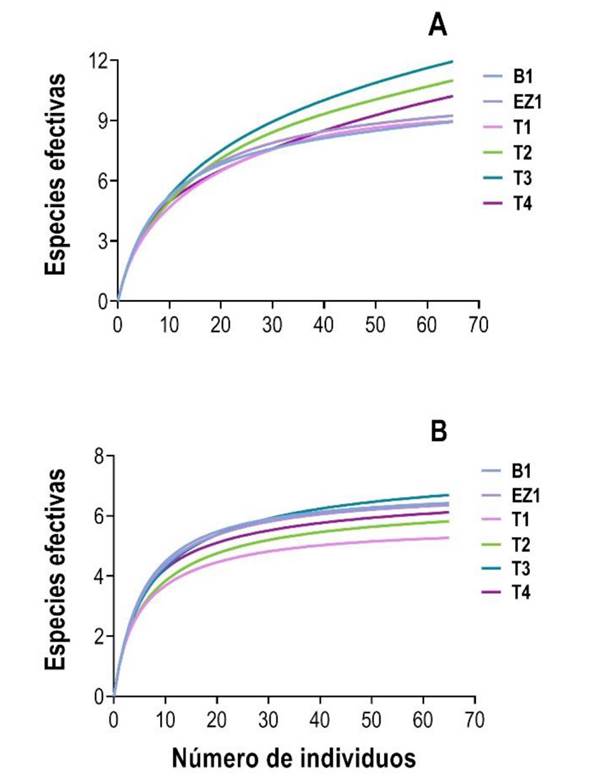
Figura 3 Curvas de rarefacción basadas en individuos para el ensamble de murciélagos filostómidos en vegetación ribereña. (A) riqueza y (B) diversidad de murciélagos filostómidos en los sitios de muestreo.
Las curvas de rango abundancia mostraron que tres especies en el ensamblaje de murciélagos filostómidos fueron dominantes en términos de abundancia: A. jamaicensis fue la especie más abundante en la mayoría de los sitios, seguida de S. parvidens y Carollia sowelli (Figura 4). Las especies raras estuvieron representadas por Centurio senex y Carollia perspicillata, el mayor número de especies raras se registró en los sitios T2, T3 y T4.
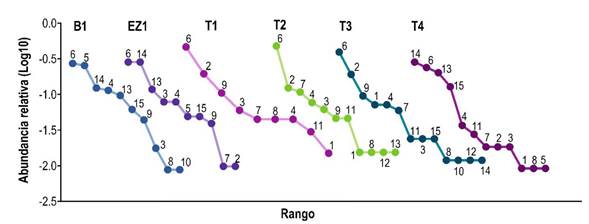
Figura 4 Curvas rango-abundancia de las especies de murciélagos filostómidos capturadas. 1 = C. perspicillata, 2 = C. sowelli, 3 = Desmodus rotundus, 4 = Glossophaga soricina, 5 = Phyllostomus discolor, 6 = A. jamaicensis, 7 = A. lituratus, 8 = C. senex, 9 = Dermanura phaeotis, 10 = D. tolteca, 11 = D. watsoni, 12 = P. helleri, 13 = S. hondurensis, 14 = S. parvidens y 15 = Uroderma bilobatum.
El índice de complementariedad mostró valores distintos entre los sitios de muestreo, el valor promedio fue de 41%. El mayor valor corresponde a los sitios B1 y T1 con un 64%, mientras que los sitios con menor complementariedad son T1 y T2 con 18% (Tabla 3).
Discusión
El esfuerzo de muestreo en la mayoría de los sitios de estudio superó el 90% de la completitud del registro de especies de murciélagos, lo que indica que dada la técnica y el esfuerzo de muestreo en campo, el ensamble de murciélagos filostómidos observado en los sitios de vegetación ribereña es representativo de la comunidad biótica. La falta de CI en el sitio T2 se debió a que cuatro de las 11 especies estuvieron representadas por un solo individuo (C. perspicillata, C. senex, P. helleri y Sturnira hondurensis). La poca representación de estas especies en el sitio puede deberse a factores metodológicos y ambientales, en el caso de C. senex el horario de captura no coincidió con los periodos de mayor actividad reportados para la especie, los cuales ocurren pasada la media noche y a las 03:00 am (Santos Moreno et al. 2010). Para P. helleri su baja abundancia podría responder a la ausencia de frutos de Ficus spp. y Cecropia spp., las cuales son su principal fuente de alimentación (Giannini 2004, Da Silva et al. 2008), C. perspicillata y S. hondurensis prefieren forrajear en sitios donde el sotobosque este dominando por arbustos y hierbas de los géneros Solanum spp. y Piper spp. (Olea-Wagner et al. 2007). En el caso del sitio T2 aún faltan seis especies por ser registradas de acuerdo con el estimador Chao 1, es posible que aumentando el esfuerzo de muestreo se logren registrar especies que potencialmente se encuentran en estos ambientes, como es el caso de Chiroderma salvini, Choeroniscus godmani, Lampronycteris brachyotis, Lonchorhina aurita, Trachops cirrhosus, Vampyressa thyone y Vampyrodes caraccioli las cuales han sido registradas en áreas de vegetación ribereña en la región (de la Peña-Cuellar et al. 2015).
El ensamble de especies de murciélagos fue consistente con el patrón de abundancia y composición observado en otros estudios realizados en comunidades ribereñas, donde una o dos especies con alta abundancia dominan la comunidad de murciélagos, particularmente las especies de la subfamilia Stenodermatinae son las dominantes en las franjas de vegetación ribereña (Lourenço et al. 2014, Zarazúa-Carbajal et al. 2017). La subfamilia Stenodermatinae es la más diversa entre los murciélagos filostómidos, ya que su diversificación está relacionada con la diversidad funcional y ecosistémica de las selvas neotropicales, las cuales ofrecieron nuevos hábitats y recursos que fueron aprovechados por las especies de esta familia (Baker et al. 2012, Saldaña-Vázquez y Fleming 2020). Actualmente está conformada por 20 géneros y 101 especies, lo que representa el 44% del total de especies de la familia Phyllostomidae (Simmons y Cirranello 2020). Las 10 especies registradas representan el 67% del total de los murciélagos stenodermatinos presentes en el estado de Tabasco (Hidalgo-Mihart et al. 2016) y el 56% de las especies en México (Ramírez-Pulido et al. 2014). De las 10 especies solo Dermanura watsoni se encuentra listada en alguna categoría de riesgo a nivel nacional (SEMARNAT 2010). A pesar de que la mayoría de estas especies no se encuentran en peligro, la pérdida de la vegetación ribereña podría significar la reducción de sus poblaciones y a largo plazo afectar procesos ecológicos como la dispersión de semillas (Saldaña-Vázquez y Fleming 2020).
Los murciélagos frugívoros (subfamilia Stenodermatinae y Carolliinae) fueron el gremio trófico mejor representado. La mayoría de las especies de murciélagos frugívoros son consideradas como adaptables a la modificación de su hábitat, capaces de permanecer en paisajes transformados por actividades humanas, en donde utilizan los diferentes elementos, como cercas vivas, corredores ribereños, fragmentos de vegetación natural y agroecosistemas para moverse y alimentarse (Galindo-González 2004, Cerón et al. 2022). Los murciélagos nómadas se caracterizan por tener amplios rangos hogareños, capacidad de movimiento a grandes distancias, se alimentan casi siempre de especies de sucesión tardía (Ficus spp., Inga spp.), mientras que los murciélagos sedentarios son de ámbito hogareño pequeño, con refugios permanentes, y dispersan semillas de sucesión temprana (Piper spp., Solanum spp. y Cecreopia spp.) (Soriano 2000, Giannini y Kalko 2004, Kalko 2008). La presencia de murciélagos frugívoros en los ecosistemas ribereños permite el mantenimiento de los procesos ecológicos, como la dispersión de semillas, la cual favorece a la regeneración de la vegetación que ha sido perturbada por sucesos naturales o de origen antrópico (Castro-Luna y Galindo-González 2012, García-Morales et al. 2012).
Si bien se ha visto que los ambientes ribereños presentan mayor riqueza y diversidad de murciélagos filostómidos en comparación con áreas agrícolas y ganaderas (Galindo-González y Sosa 2003, De la Peña-Cuellar et al. 2015). No se observaron diferencias entre los sitios de muestreo a pesar de que algunos se encontraban adyacentes a vegetación natural continua y otros a zonas agropecuarias. La ausencia de estas diferencias puede deberse a la cantidad de hábitat disponible en los sitios ubicados en áreas agropecuarias (B1, EZ1 y T4). Se ha demostrado que en paisajes fragmentados los parches de vegetación más grandes y mejor conectados favorecen el aumento de la riqueza y diversidad de murciélagos filostómidos (Arroyo-Rodríguez et al. 2016).
La composición de especies entre sitios varió debido a la presencia de poblaciones abundantes de las especies de murciélagos como A. jamaicensis, S. parvidens y C. sowelli. Estas especies son consideradas adaptables debido a su tolerancia a la transformación del ambiente (Galindo-González 2004, Cerón et al. 2022) y casi siempre se asocian a áreas perturbadas (Harvey y González-Villalobos 2007). A. jamaicensis es un frugívoro común con una amplia distribución y suele ser abundante localmente. Su alta abundancia está relacionada con el tipo de dieta generalista, que puede incluir diversas especies de las familias Cecropiaceae, Moraceae, Piperaceae y Solanaceae (Castro-Luna y Galindo-González 2012, García-Morales et al. 2012). S. parvidens y C. sowelli, son especies frugívoras de tamaño pequeño que basan su alimentación en frutos de especies de plantas que aparecen en sucesión temprana de las familias Piperaceae y Solanaceae (Vleut et al. 2015b, Hernández-Canchola et al. 2020). Ambas especies son consideradas generalistas de hábitat, además de ser abundantes en parches de vegetación secundaria en paisajes con actividad agrícola (Vleut et al. 2012, Vleut et al. 2015a). Otro frugívoro nómada con importante presencia en los sitios B1, EZ1 y T4 fue Uroderma bilobatum, la cual es una especie resistente a la trasformación del ambiente (Galindo-González 2004, Cerón et al. 2022) y que con anterioridad se ha visto que su abundancia está relacionada positivamente con el grado de modificación del hábitat (Willig et al. 2007). Esto coincide con los resultados encontrados, debido a que mostró las abundancias más altas en los sitios que presentan alrededores con mayor perturbación.
La presencia del vampiro común (Desmodus rotundus) en la mayoría de los sitios de muestreo podría indicar cierto grado de perturbación asociado a la actividad ganadera (Romero-Barrera et al. 2021). En general los sitios de vegetación ribereña están inmersos en menor o mayor medida en paisajes ganaderos. Esto se hace evidente al observar que la mayor abundancia de la especie se registró en el sitio EZ1 el cual está rodeado por una amplia área destinada a la cría de ganado, lo que podría favorecer la presencia de esta especie al tener disponibilidad de alimento (Lanzagorta-Valencia et al. 2020).
El 18% de las especies podrían clasificarse como raras o poco abundantes. Las especies con poblaciones pequeñas podrían ser más susceptibles a las extinciones locales (Foley 1997), en el caso de la vegetación ribereña en el río Usumacinta, algunas especies como C. senex, tiene una baja tasa de natalidad (Santos-Moreno et al. 2010), P. helleri prefiere forrajear en el dosel de la vegetación (Kalko et al. 2008) y D. tolteca presenta tamaños poblacionales pequeños, estimados en menos de 300 individuos (García-García et al. 2010). Por lo que estas especies podrían ser vulnerables a la perturbaciones ocasionadas por las actividades humanas. Aun cuando no se consideró a C. perspicillata como especie rara en la vegetación ribereña su rareza en los sitios T1 y T2 podría estar relacionado con una competencia por los recursos alimenticios con C. sowelli, ya que tienen una dieta similar, sin embargo, la de C. sowelli es ligeramente más diversa (Kraker-Castañeda et al. 2016). Otro punto importante es que durante las noches de muestreo en T2 se observó la ausencia de plantas del género Solanum spp. y Pipper spp. lo que podría tener relación con el bajo número de individuos registrados de C. perspicillata y S. hondurensis en dicho sitio. Esto coincide con estudios previos en la selva Lacandona en donde se observó que C. perspicillata se alimentó la mayor parte del tiempo de frutos de arbustos pioneros, mientras S. hondurensis prefirió lo frutos de hierbas pioneras (Olea-Wagner et al. 2007).
Aunque la riqueza y diversidad de murciélagos filostómidos no varió entre los sitios de muestreo, se observaron diferencias en la composición de especie entre los sitios. Los menores valores de complementariedad se registraron entre los sitios de vegetación ribereña continua, esto es intuitivo si consideramos que los sitios comparten el mismo tipo de vegetación y por ende, la composición de murciélagos es similar, caso contrario, la mayor complementariedad se registra entre los sitios inmersos en los paisajes agropecuarios con los de vegetación ribereña continua probablemente por el contraste entre las condiciones de la vegetación a nivel local (composición y estructura) y a las características de la heterogeneidad del paisaje que los rodea. Esto coincide con un estudio realizado en un paisaje antropizado en el sur de Veracruz, en donde se encontró que la riqueza y diversidad de murciélagos no fue diferente entre los diferentes tipos de vegetación muestreados (fragmento de selva mediana subperennifolia, cultivo de café bajo sombra y pastizal con vegetación secundaria), pero si se observa alta complementariedad de especies de murciélagos entre los tipos de vegetación con mayor contraste en su estructura y composición florística (Alavéz-Martínez et al. 2020).
Conclusiones
En la vegetación ribereña de la subregión de Los Ríos del estado de Tabasco habita una comunidad de murciélagos estable en términos de riqueza y abundancia de especies, pese a la transformación constante a la que se encuentra sometida, por lo que algunas especies son raras en el ensamblaje. Es evidente que algunas de las especies de la comunidad de murciélagos han sabido explotar los recursos generados a partir de la transformación de estos sitios; por lo que la riqueza y diversidad de filostómidos registrados no mostraron notables diferencias entre los ambientes. Lo que destaca la importancia de la vegetación ribereña para ambos ambientes, al aportar parte de los requerimientos que permiten hacer uso del espacio y de los recursos en estos fragmentos de vegetación. El uso de murciélagos como bioindicadores de los bosques ribereños presentan potencial como herramienta para la planificación e implementación de programas de conservación que permitan el mantenimiento y conectividad de la vegetación ribereña en paisajes agrícolas.











 nueva página del texto (beta)
nueva página del texto (beta)



