Introducción
La variación morfológica entre poblaciones de una sola especie y entre especies que presenta el grupo de lagartijas, se debe a factores como la herencia filogenética, mecanismos estructurales de desarrollo, o como consecuencia de la morfología funcional (Ramírez-Bautista et al. 2006, Elizalde-Rocha et al. 2008, Cruz-Elizalde et al. 2020). Es decir, las estructuras morfológicas de lagartijas pueden variar debido a efectos cómo la distribución de sus poblaciones en diferentes ambientes o plasticidad fenotípica (Roff 1992); puede deberse a un efecto filogenético debido a la variación genética entre las poblaciones de una especie (Charnov 1992, Haenel y John-Alder 2002). A nivel poblacional la variación morfológica puede estar dada por competencia por el acceso a las hembras (selección sexual), fecundación(selección por fecundación), divergencia de nicho y dimorfismo sexual (Cox et al. 2007, Cruz-Elizalde et al. 2020). Estos factores se pueden evaluar para describir los patrones de variación de la forma y tamaño de caracteres morfológicos en poblaciones de una especie (Rohlf 2003).
De acuerdo con la teoría de la ecomorfología, la morfología de las estructuras corporales que ejercen una función en los individuos está sustentada por las presas que consume y su interacción con el medio abiótico, es decir, la evolución en la divergencia de nicho entre machos y hembras se desarrolló a partir de la repartición de recursos como el alimento, espacio y nicho de microhábitat (Galindo et al. 2015). Para poner a prueba estas hipótesis, es necesario comparar la morfología funcional (relación de la forma y función de las estructuras corporales de un conjunto de organismos con el ambiente) en diferentes poblaciones que habitan distintos tipos de ambientes (Stayton 2006, Cruz-Elizalde et al. 2020, Cruz-Elizalde et al. 2022), ya que estudiar la variación en diferentes estructuras morfológicas funcionales permite entender la acción que ejerce la selección natural para generar adaptaciones; lo anterior, en conjunto con la herencia ancestral, brinda una idea de la evolución en los rasgos funcionales mediante el estudio de su variación morfológica (Zamora et al. 2003).
Los estudios recientes sobre la variación morfológica entre poblaciones de la misma especie, se han convertido en una herramienta poderosa en el estudio del tamaño y la forma de la variación en características morfológicas y estructuras funcionales de las especies (Rohlf 2003, Parés-Casanova 2014, Parés-Casanova 2019). Esta forma de analizar la morfología funcional es ventajosa para detectar variación en la forma y tamaño de los individuos, debido a que las coordenadas (landmarks y semilandmarks) capturan información en los puntos de variabilidad, en comparación y en contraste a la morfología tradicional que se mide en un plano lineal; sin embargo, esta última también es importante para detectar variación a otra escala (Rohlf 2003). En el caso particular de Sceloporus variabilis se han realizado estudios de interés ecológico-evolutivo como la evolución de la locomoción, evolución de los rasgos relacionados con su historia de vida, su adaptación fenotípica a lo largo de gradientes de elevación, su morfología funcional y cambios en la tasa de diversificación, ciclos reproductivos y dimorfismo sexual (Cruz-Elizalde y Ramírez-Bautista 2016, Solís et al. 2019, Cruz-Elizalde et al. 2020, Cruz-Elizalde et al. 2022).
Debido a que la morfología de los individuos es el resultado de la interacción del genotipo con el ambiente (plasticidad fenotípica), y considerando que Sceloporus variabilis (Sauria, Phrynosomatidae) es una especie generalista en el uso de hábitat de origen tropical, con presencia en ecosistemas con diferentes tipos de vegetación, abarcando un amplio rango de distribución como bosques tropicales, matorrales xerófilo, bosques de encino, bosque mesófilo de montaña, ambientes perturbados, entre otros (Canseco-Manriquez y Gutiérrez-Mayén 2010). Ésta resulta ser una especie ideal para poner a prueba hipótesis ecológicas y evolutivas (Solís et al. 2019), particularmente en tres ecosistemas de Veracruz, México. En este contexto, los objetivos del presente estudio fueron: a) evaluar la morfología en individuos de S. variabilis de tres ecosistemas del centro de Veracruz, México, mediante la aplicación de la morfometría geométrica y lineal para saber si hay diferencias morfológicas entre las tres poblaciones, y b) relacionar las características morfológicas de las tres oblaciones con las características ambientales de los ecosistemas donde habita, donde se asume el supuesto de que la forma y tamaño, es el resultado de patrones específicos y genéricos de la especie.
Materiales y métodos
Área de estudio
El estudio se realizó en nueve localidades de ocho municipios de la región fisiográfica conocida como Las Montañas, ubicada en la zona centro del estado de Veracruz, México en los municipios de Atoyac, Tezonapa, Omealca, Amatlán, Córdoba, Atzacan, Huatusco, Orizaba (Figura 1). Los municipios de Atoyac, Tezonapa y Omealca presentan vegetación Selva Alta Perennifolia (SAP), definida por árboles con más de 20-25 m de altura como el sombrerete o súchil amarillo (Terminalia amazonia), ramón, ojite u ojoche (Brosimum alicastrum), la caoba (Swietenia macrophylla), chicozapote (Manilkara zapota), hualhua (Talauma mexicana), corpus (Vochysia guatemalensis), macayo (Andira galeottiana), palo mulato o chaca (Bursera simaruba), frijolillo (Pithecellobium arboreum), zapote mamey (Pouteria sapota), alzaprima u hojancho (Carpodiptera ameliae) y la pimienta (Pimenta dioica). Su precipitación anual es de 1 500 a 3 000 mm, y de 20 a 26°C de temperatura media anual, su rango altitudinal va de los 0 a 900 msnm (Semarnat 2016). Los municipios de Amatlán de Los Reyes y Córdoba, presentan Selva Mediana Subperennifolia (SMSP) con árboles de 15 a 25 m como guanacaste (Enterolobium cyclocarpum), tepeguaje (Lysiloma acapulcensis), palo de rosa (Tabebuia rosea), el palo mulato o chaca (Bursera simaruba), higueras (Ficus spp. y Chlorophora tinctoria). Presenta una temperatura media anual superior a 20 °C y entre 1 000 a 1 600 mm de precipitación media anual; su atitud máxima es de 1 300 msnm. Los municipios de Atzacan, Huatusco y Orizaba presentan Bosque Mesófilo de Montaña (BMM) compuesto por plantas epífitas, líquenes, musgos, helechos, orquídeas, piperáceas y bromelias y árboles como liquidámbar (Liquidambar styraciflua) y magnolia (Magnolia dealbata), y otras especies de los géneros Inga, Quercus, Juglans, Ficus, Fagus, Cornus, Clethra, Carpinus y Ulmus. Este se desarrolla desde los 1 200 hasta los 2 000 msnm, la precipitación oscila entre los 1 000 y 2 000 mm y la temperatura media anual varía de 12 a 23°C (Tabla 1).

Figura 1. Ubicación de los municipios de muestreo de S. variabilis en la región Las Montañas, Veracruz, México.
Tabla 1. Tipo de vegetación, clima, temperatura, precipitación e individuos de S. variabilis e información del área de muestreo.
| Sitio en Fig. 1 | Tipo de vegetación | Clima | Temperatura media anual | Precipitación media anual | N° de In- dividuos | Localidad | Latitud | Longitud | Altitud |
|---|---|---|---|---|---|---|---|---|---|
| A | Selva alta perennifolia | Cálido-seco-regular | 19.5 | 1705 | 5 | San Fermín | 18.901256 | -96.80595 | 263 |
| B | Selva alta perennifolia | Templado-húmedo-regular | 18.7 | 2757 | 4 | Motzorongo | 18.639337 | -96.72384 | 558 |
| C | Selva alta perennifolia | Cálido-húmedo-regular | 18.4 | 2719 | 10 | Cruz tetela | 18.665313 | -96.70793 | 348 |
| D | Selva mediana subperennifolia | Templado-regular | 20.1 | 1701 | 7 | Peñuela | 18.857569 | -96.90023 | 720 |
| E | Selva mediana subperennifolia | Templado-húmedo-regular | 20.0 | 1588 | 8 | Los Mangos | 18.901434 | -96.9325 | 860 |
| F (1) | Selva mediana subperennifolia | Templado-húmedo-regular | 20.3 | 1493 | 10 | Dos Ríos | 18.947112 | -97.03633 | 1213 |
| F (2) | Bosque mesófilo de montaña | Templado-húmedo-regular | 19.9 | 1607 | 7 | Atzacan | 18.975861 | -97.03868 | 1302 |
| G | Bosque mesófilo de montaña | Cálido-húmedo | 18.2 | 1737 | 17 | Pastoría | 19.168784 | -97.00466 | 1347 |
| H | Bosque mesófilo de montaña | Templado-húmedo-regular | 20.6 | 1327 | 1 | Cerro del Borrego | 18.847354 | -97.11569 | 1438 |
Colecta de ejemplares de S. variabilis
La colecta de ejemplares de S. variabilis se llevó en localidades donde la especie se distribuye en SAP, SMSP y BMM. Para la colecta de ejemplares, se tuvo la licencia de Colecta Científica con Propósitos de Enseñanza no. SGPA/DGVS/001894/18 por la Subsecretaría de Gestión para la Protección Ambiental, Dirección General de Vida Silvestre, Secretaría de Medio Ambiente y Recursos Naturales. Durante el periodo de febrero a septiembre 2019, se llevó a cabo la colecta en cada ecosistema mediante caminatas en transectos para la búsqueda de la especie y una vez detectada se inmovilizaron con bandas de hule (Gallina 2015). Los ejemplares fueron etiquetados con datos del ecosistema (SMSP, BMM o SAP), coordenadas y altitud, y posteriormente se trasladaron al Laboratorio de Microscopia de la Facultad de Ciencias Biológicas y Agropecuarias de la Universidad Veracruzana, donde se realizó la captura de imágenes y su posterior análisis.
Trabajo en laboratorio
Se colectaron 69 ejemplares (41 machos y 28 hembras) por los tres tipos de ecosistemas donde fueron colectados: n = 19 en SAP, n = 16 en SMS y n = 35 en BMM, todos fueron adultos de acuerdo con Ramírez-Bautista et al. (2006), ya que presentaron una longitud hocico-cloaca mayor de 42.5 mm. A los ejemplares, se les asignó una clave de identificación para asociarlo a la captura de sus datos, se clasificaron por número de individuo y localidad de colecta, sexo y zona de colecta.
Posteriormente, el animal se colocó en papel milimétrico sobre el equipo para la toma de fotografías, las cuales se tomaron con una cámara Canon modelo T100 sobre un soporte metálico y una base de madera ajustable a diferentes niveles. Se utilizó luz artificial externa a la cámara, la altura del obturador y la del cráneo fue la misma para todos los individuos fotografiados.
Se utilizaron 26 puntos para evaluar la morfometría geométrica de S. variabilis, 16 landmarks y 10 semilandmarks a nivel del cráneo de las lagartijas, ya que permiten identificar señales evolutivas para obtener información de la diferenciación morfológica. Estos puntos fueron definidos a priori para delimitar y definir la forma, ya que son homólogos en la anatomía del organismo (Moreno-Barajas et al. 2014, Aguirre y Jiménez 2018), se colocaron en la parte craneal superior de los individuos (separados por hembras y machos de cada ecosistema) y se analizaron en los softwares de la serie TpsDig versión 2.26 y TpsUtil v.1.58 (Rohlf 2016) y la serie IMP (Integrated Morfhometric Package) como CoordGen 8 (Sheets 2016a), MakeFan8Win (Sheets, 2016b) y PCAGen 8 (Sheets, 2016c). Estos landmarks y semilandmarks fueron utilizados en este estudio, ya que se han implementado en S. variabilis para análisis filogenéticos por ser evolutivamente explicativos (Solís-Zurita et al. 2019).
Análisis de los datos morfométricos
La morfometría geométrica, previo al análisis de corrección Procrustes, se desarrolló en el programa MakeFan8Win (Sheets 2016b), con el cual se trazó un abanico en cada fotografía que sirvió como referencia para la colocación de los landmarks y semilandmarks en el programa TpsDig (Rohlf 2016). Los 26 puntos estratégicos (entre landmarks y semilandmarks) para los análisis, los puntos en rojo señalan los landmarks colocados en el interior del cráneo, y en azul, las semilandmarks (Figura 2), estas últimas cubrieron el contorno del cráneo. Una vez terminado se unieron los archivos (uno de hembras y otro de machos de cada ecosistema) en el programa TPSUtil obteniendo un solo archivo que fue alineado en el programa CoordGen8 (Sheets 2016a). Así, se alinearon los semilandmarks mediante la herramienta Semiland instalada en el software CoordGen8 (Sheets 2016a); este proceso ayuda a que los semilandmarks definidos se puedan tratar como landmarks en los análisis siguientes. Para obtener las gradillas de deformación y realizar el análisis de componentes principales (PCA por sus siglas en inglés), se utilizó el software PCAGen (Sheets 2016c) y para realizar el análisis de variables canónicas (CVA por sus siglas en inglés) se empleó el algoritmo CVAGen, ambos análisis están programados dentro de la serie IMP.

Figura 2. Gradilla de deformación. En rojo y azul los landmarks y semilandmarks que presentaron variación, (rojo landmarks-azul semilandmarks) y en verde el desplazamiento de la gradilla.
Asimismo, se utilizó la morfometría lineal para determinar si existen diferencias entre los individuos de los ecosistemas, para ello se evaluaron ocho variables: longitud hocico-cloaca (LHC, medida desde la punta del hocico hasta el final de la cloaca), longitud de cabeza (LC, medida de la base del cuello a la punta del hocico), ancho de cabeza (AC, medida tomada del costado izquierdo de la cabeza al costado derecho), alto de la cabeza (ALC, medida de la base inferior a la base superior de la cabeza), longitud del hocico (LH, medida de la punta del hocico hasta el final), distancia entre fosas nasales (DFN, medida desde una narina a otra), ancho del cuerpo (AnCu, medida tomada de costado izquierdo al costado derecho del cuerpo), y largo del cuerpo (LaCu; medida tomada de la base del cuello a la cloaca), ya que se han implementado en estudios morfológicos de la especie y se consideran explicativas para estudios de morfometría en diferentes ambientes (Ramírez-Bautista et al. 2013, Galindo et al. 2015). Se aplicaron análisis de varianza (ANOVA) para comparar las características morfológicas de las lagartijas entre ecosistema; la variable categórica fue el tipo de vegetación y las explicativas fueron las variables LHC, LC, AC, ALC, LH, DFN, AnCu, LaCu de las lagartijas.
Se aplicó un análisis de regresión por mínimos cuadrados parciales (PLS) para correlacionar los valores de las variables morfológicas con los valores de las variables ambientales de temperatura, humedad y precipitación promedio de los tres ecosistemas. Para obtener los valores ambientales de los tres ecosistemas, se extrajeron las variables de WorldClim (Fick y Hijmans 2017) y con el complemento Point Sampling Tools del programa Qgis versión 3.10, se obtuvieron los valores de la temperatura media anual (Bio1) y precipitación media anual (Bio12) ya que determinan aspectos fisiológicos de los reptiles (Serna-Lagunes et al. 2020). El objetivo del análisis PLS fue evaluar si los juegos de variables están correlacionados, cuantificar la magnitud y describir el patrón de la correlación. Esto se consigue explorando los ejes que mejor definen la covarianza entre los juegos de variables al reducir la dimensionalidad de los datos, ya que se encuentran ejes en pares y los ordena desde el par que expone la máxima covarianza entre los juegos, hasta el par que explica la menor cantidad de covarianza (Aguirre y Jiménez 2018).
Por último, se realizó un análisis de conglomerados para evaluar la similitud/disimilitud entre las variables morfológicas y ambientales, mismo que fue elaborado mediante el método de ligamiento promedio. El análisis de varianza (ANOVA), el análisis de regresión por mínimos cuadrados parciales (PLS), y el análisis de conglomerados desarrollados en este estudio, fueron implementados en el software Infostat versión 2020 (Di Rienzo et al. 2020).
Resultados
Los resultados de la morfometría geométrica explican una variación mínima en la forma y tamaño en las lagartijas de S. variabilis de tres ecosistemas, aunque no fue suficiente esta variación para diferenciarlos entre ecosistemas. Las gradillas de deformación del PCA utilizados para evaluar la diferenciación morfológica de la forma en términos de sus dimensiones reales y su relación espacial entre los segmentos, indican similitud entre las landmarks y semilandmarks evaluadas en las lagartijas de S. variabilis. Las coordenadas de la superposición de Procustes indican que para alcanzar el 83.9% de la varianza acumulada, fueron necesarios 10 componentes principales, siendo el primer componente (23.5%) el que más aporta a la discriminación entre las formas, y prácticamente con seis componentes principales se explica más del 70% de la variación entre las formas analizadas de las lagartijas. En el grafico del PCA no se pudieron discriminar patrones que diferenciaran a las poblaciones, la mayoría de las variaciones están alojadas en solo seis caracteres evolutivos, excepto en algunas lagartijas del BMM (Figura 3).

Figura 3. Biplot del ACP con 69 observaciones. Círculos negros representan a las lagartijas de S. variabilis de la selva alta perennifolia, la X (azul) a las lagartijas del bosque mesófilo de montaña y la Estrella (roja) a lagartijas de selva mediana subperennifolia.
Por otro lado, la gradilla de deformación muestra la variación en 5 de los 16 landmarks evaluados, esto representa el 31.25% de la variación en el total de los individuos; mientras que en 4 de 10 semilandmarks se encontró variación, esto es equivalente al 40% de variación total de la población (Figura 2). Esta diferenciación se debe principalmente a la talla y conformación corporal de los ejemplares de las diferentes poblaciones, y no a la forma de su cráneo, pues las variaciones de landmarks más significativos sobresalen en la parte inferior del cuello, cuyas variaciones se orientan hacia las regiones laterales. Así, la gradilla de deformación resultante, muestra escasa variación entre los grupos estudiados, es decir, existe una gran similitud en la forma del cráneo.
El análisis de variables canónicas (CVA), clasificó a los individuos de S. variabilis con base en el tipo de ecosistema donde fue colectado (Figura 4), esto como resultado de que los individuos que habitan un mismo tipo de ecosistema presentaron similitud en sus características morfológicas.
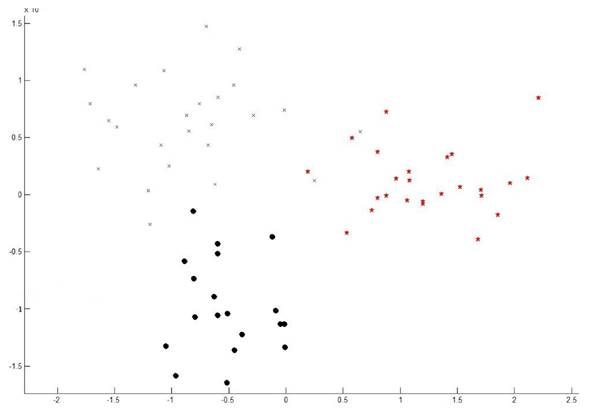
Figura 4. Biplot del CVA. Círculos negros representan a los ejemplares de la SAP, la X (azul) los del BMM y la Estrella (roja) a lagartijas de la SMSP.
En el ANOVA realizado con las medidas por morfometría lineal no mostró diferencias significativas entre las poblaciones de S. variabilis en las variables morfométricas evaluadas (Tabla 2), ya que la variación intrapoblacional se mantuvo alrededor del 20 al 30% de variación entre individuos que pertenecen a una misma población (Tabla 2).
Tabla 2. Resultados del ANOVA para las variables morfométricas lineales de tres poblaciones de S. variabilis habitantes de tres ecosistemas en la zona centro de Veracruz, México.
| Variable | n | R | CV | F. V. | gl | CM | Significancia |
|---|---|---|---|---|---|---|---|
| Longitud Hocico-Cloaca (LHC) | 69 | 0.01 | 22.61 | Vegetación | 2 | 0.43 | NS |
| Error | 66 | 1.35 | |||||
| Total | 68 | ||||||
| Longitud de cabeza (LC) | 69 | 0.02 | 23.86 | Vegetación | 2 | 0.08 | NS |
| Error | 66 | 0.12 | |||||
| Total | 68 | 0.02 | |||||
| Ancho de cabeza (AC) | 69 | 0.01 | 22.19 | Vegetación | 2 | 0.05 | NS |
| Error | 66 | ||||||
| Total | 68 | ||||||
| Alto de la cabeza (ALC) | 69 | 0.01 | 28 | Vegetación | 2 | 0.01 | NS |
| Error | 66 | 0.04 | |||||
| Total | 68 | ||||||
| Longitud del hocico (LH) | 69 | 0.03 | 24.55 | Vegetación | 2 | 0.06 | NS |
| Error | 66 | 0.05 | |||||
| Total | 68 | ||||||
| Distancia entre fosas nasales (DFN) | 69 | 0.05 | 23.79 | Vegetación | 2 | 4.40E-03 | NS |
| Error | 66 | 2.60E-03 | |||||
| Total | 68 | ||||||
| Ancho del cuerpo (AnCu) | 69 | 0.02 | 31.81 | Vegetación | 2 | 0.09 | NS |
| Error | 66 | 0.13 | |||||
| Total | 68 | ||||||
| Largo del cuerpo (LaCu) | 69 | 0.02 | 25.42 | Vegetación | 2 | 0.33 | NS |
| Error | 66 | 0.46 | |||||
| Total | 68 |
n = Número de observaciones, R = Coeficiente de Correlación; CV = Coeficiente de Variación; F.V.= Fuente de Variación; SC = Suma de Cuadrados; gl = grados de libertad; CM = Cuadrado Medio, NS = No siginificativo.
El análisis de regresión por mínimos cuadrados parciales (PLS, Tabla 3), indicó que la humedad en el BMM estuvo relacionada con el AIC-M y el AC-M, mientras que la precipitación en la SMSP determinó la forma de seis caracteres morfométricos. La temperatura en la SAP tiene bajos o pocos efectos con las variables morfométricas, ya que se encuentran en el plano negativo junto con las variables morfológicas (Figura 5).
Tabla 3. Valores promedio de las variables climáticas y de las variables morfométricas. La letra al final de cada variable indica H para hembras y M para referirse a los machos.
| Variables climáticas de World Clim | SAP | SMSP | BMM |
|---|---|---|---|
| Temperatura | 30 | 28 | 23 |
| Precipitación | 1500 | 1000 | 1250 |
| Humedad | 80 | 80 | 100 |
| Variables morfométricas (promedio) | |||
| LHC-H | 5.4 | 4.74 | 4.8 |
| LHC-M | 4.6 | 5.43 | 5.19 |
| LC-H | 1.52 | 1.26 | 1.29 |
| LC-M | 1.4 | 1.48 | 1.53 |
| AC-H | 0.95 | 0.86 | 0.89 |
| AC-M | 0.92 | 1 | 0.96 |
| AlC-H | 0.71 | 0.61 | 0.65 |
| AlC-M | 0.65 | 0.77 | 0.7 |
| LH-H | 0.93 | 0.86 | 0.93 |
| LH-M | 0.78 | 0.96 | 1.05 |
| DFN-H | 0.2 | 0.18 | 0.2 |
| DFN-M | 0.17 | 0.23 | 0.22 |
| AnCu-H | 1.21 | 1.08 | 1.08 |
| AnCu-M | 0.9 | 1.24 | 1.07 |
| LaCu-H | 2.81 | 2.63 | 2.36 |
| LaCu-M | 2.31 | 2.84 | 2.55 |
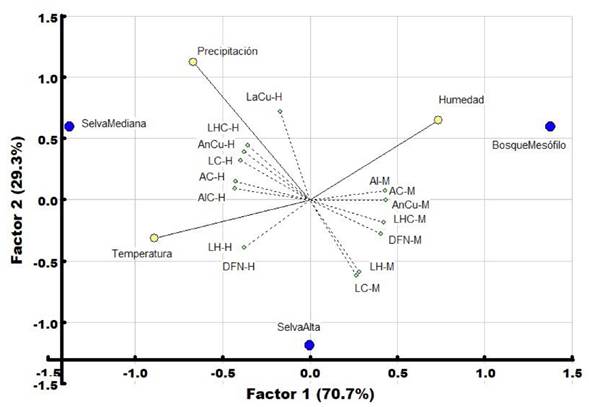
Figura 5. Biplot PLS. Variables ambientales en amarillo; precipitación (Pp), humedad (H) y temperatura (Temp), ecosistemas de estudio; SMSP, SAP y BMM en azul y en verde las variables morfométricas, en el plano superior derecho se muestra la correlación positiva de las variables; altura de la cabeza (AlC), ancho de la cabeza (AC) y ancho del cuerpo (AnCu) en machos con la H, en el plano superior izquierdo las variables que no dependieron de la Pp, largo del cuerpo (LaCu), longitud hocico cloaca (LHC), ancho del cuerpo (AnCu), largo del cuerpo (LaCu) ancho y altura de la cabeza (AC-AlC) en hembras y en el plano inferior izquierdo las variables que no se ven afectadas por la Temp.
En el análisis de conglomerados se aprecia la formación de dos grandes grupos poblacionales, pero al interior de cada grupo, existen individuos de los tres ecosistemas, que presentaron afinidad en sus caracteres morfológicos. Los individuos similares morfométricamente fueron los de SAP y SMSP, y con algunos individuos de BMM (Figura 6).
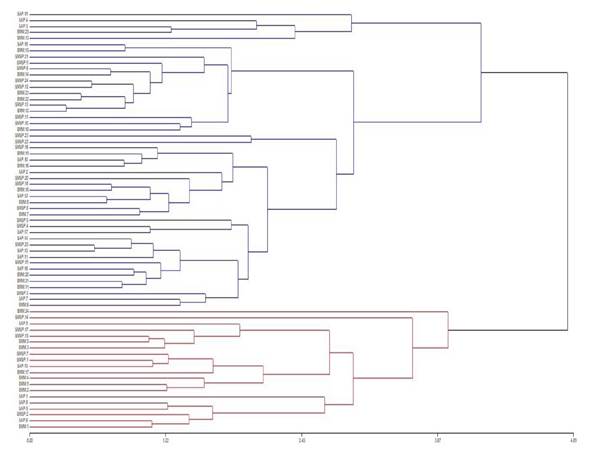
Figura 6. Dendrograma de relaciones morfológicas entre los individuos de S. variabilis de tres ecosistemas en la zona centro de Veracruz. En azul y rojo se observan los dos grupos que se formaron a través de las variables estudiadas, en el lazo izquierdo del dendrograma se aprecian los individuos con su tipo de vegetación correspondiente (ej. SAP 19: individuo 19 de la selva alta perennifolia), así mismo se aprecian subgrupos de comparación entre los mismos, es decir, aquellos que comparten los mismos valores de las variables analizadas.
Discusión
Las poblaciones de S. variabilis evaluadas en este estudio, presentaron caracteres morfológicos similares, aunque solo ciertos individuos expresaron una forma diferente, no fue suficiente para diferenciarlos por su morfología entre ecosistemas, posiblemente por el tamaño de muestra evaluado (Roff 1992, Foster et al. 2015, Soria-Barreto et al. 2011). A pesar de que cada ambiente presenta presiones selectivas para las lagartijas de una población de S. variabilis, este no presenta una influencia considerable en su morfología (Dunham 1982).
La teoría ecológica clasifica a las especies en dos grandes grupos con base en la amplitud de nicho ecológico, el cual se define en función de los factores abióticos y bióticos, especialistas y generalistas. Según esta teoría, las especies especialistas presentarían una reducida amplitud de nicho ecológico, mientras que las generalistas (como el caso de S. variabilis), presentan un nicho ecológico de mayor amplitud, es decir, pueden adaptarse a las condiciones del hábitat donde se encuentran cambiando su tipo de alimentación y por consiguiente la estructura de su cuerpo (Canseco-Márquez y Gutiérrez-Mayén 2010). En el presente estudio a pesar de considerarse a S. variabilis como una especie generalista y con amplia distribución en áreas geográficas con condiciones tropicales y templadas (Mendoza et al. 1998, Solís-Zurita et al. 2019), no se presentan diferencias significativas en la forma del cráneo (Cruz-Elizalde et al. 2017). Esto se ha documentado para los géneros de Anolis, Sceloporus y Aspidoscelis (Mata-Silva et al. 2010, Bonneaud et al. 2016, Ramírez-Bautista et al. 2016), la similitud se debe a factores externos como el microhábitat usado, el tipo y tamaño de alimento consumido (Leyte-Marrique et al. 2017), a factores intrínsecos como las tasas de crecimiento de los individuos, como el mantenimiento de una condición corporal para mantener un tamaño constante para la reproducción (Bonneaud et al. 2016, Ramírez-Bautista et al. 2016). En saurios, el no presentar diferencias morfológicas en individuos de la misma especie en diferentes ambientes, sugiere que las presas potenciales que consume en cada ambiente tiene la misma proporción de tamaño (Mata-Silva et al. 2010). Por otro lado, la morfología de las tres poblaciones de S. variabilis evaluada puede deberse a que los individuos evaluados fueron adultos, ya que la ontogenia es un factor que no permite visualizar diferencias en ejemplares adultos (West 2005).
Las condiciones abióticas de los ecosistemas donde se colectaron las lagartijas de S. variabilis son favorables para la especie, ya que en algunas áreas de interacción poblacional o zonas de hibridación poblacional en los tres ecosistemas evaluados, es posible que se incremente el flujo genético entre los individuos de la especie, lo que podría suponer que los individuos provienen de un linaje evolutivo con características genéticas similares, aunque esta hipótesis debe de abordarse en estudios futuros mediante el enfoque de la filogeografía (Serna-Lagunes et al. 2015).
Conclusiones
Scelporus variabilis es una especie que presenta individuos con similitudes morfológicas a pesar de habitar en tres ecosistemas con diferente tipo de vegetación. Es decir, independientemente del ecosistema donde se distribuye S. variabilis, esta presenta una similitud en los caracteres morfológicos y morfométricos evaluados, lo cual puede estar relacionado a que consumen presas potenciales con un tamaño similar en cada ecosistema, o porque posiblemente los individuos evaluados son genéticamente similares, pero esto se debe estudiar bajo el contexto filogeográfico.











 nueva página del texto (beta)
nueva página del texto (beta)



