Introducción
A nivel mundial, el ganado bovino contribuye con aproximadamente el 62% de las emisiones de gases de efecto invernadero (GEI) del sector ganadero, correspondientes a 5 gigatoneladas de CO2 eq . Estas emisiones tienen diferentes orígenes, siendo la fermentación entérica la que contribuye con un 44%, principalmente en forma de metano (CH4) (FAO 2022). Además de su impacto en el calentamiento global, la producción de CH4 ruminal disminuye la eficiencia productiva de los rumiantes domésticos al invertir entre 2-15% de la energía total consumida para la síntesis de este gas (Bodas et al. 2008). Por ello, de acuerdo con Johnson y Johnson (1995), el desarrollo de estrategias para disminuir las emisiones de CH4 en el ganado bovino no sólo reducirán su impacto sobre el ambiente, sino también se mejorará la eficiencia alimenticia y, por ende, la productividad de los sistemas de producción.
Muchas de las estrategias para disminuir las emisiones de CH4 en los rumiantes domésticos se centran en la modificación del ambiente ruminal a través de la alimentación, entre las cuales se incluye el uso de ionóforos, suplementación energética o proteica en dietas de baja calidad nutricional, leguminosas forrajeras con alto contenido de taninos condensados, compuestos químicos como bromoclorometano y nitrocompuestos, lípidos, metabolitos secundarios como taninos, saponinas y aceites esenciales, probióticos, entre otros (Patra 2012). Pero algunas de estas estrategias son costosas, tóxicas para los animales y con efecto temporal en la reducción de CH4 (Moss et al. 2000, Patra 2012). Ante ello, es indispensable buscar alternativas que disminuyan la metanogénesis ruminal, y que a su vez, no afecten el bienestar de los animales, ni representen riesgo a la salud de los consumidores ante la posibilidad de residuos en la carne o leche. Bajo este contexto, una alternativa es el uso de aditivos de origen vegetal como el jengibre (Zingiber officinale Roscoe), el cual es fuente de diferentes metabolitos secundarios, como compuestos fenólicos y terpenos (Mao et al. 2019), y de micro RNAs (Xing et al. 2022), mismos que han mostrado capacidad de modular las poblaciones de la microbiota intestinal (Teng et al. 2018, Wang et al. 2021).
El jengibre tiene un uso ancestral como planta medicinal, al que se le atribuyen actividades biológicas como anticancerígena, antioxidante, antiinflamatoria, antidiabética, auxiliar para contrarrestar efectos de náuseas derivados de tratamientos de quimioterapia, protectora cardiovascular y antimicrobiana, tanto en humanos como en animales de laboratorio (Mao et al. 2019). A la fecha existen pocos estudios sobre el uso del jengibre en la alimentación de animales destinados para consumo humano. En aves de corral, se ha demostrado su efecto antimicrobiano al disminuir las poblaciones de bacterias patógenas como Escherichia coli, Salmonella, Shigella, Staphylococcus spp. en el contenido ileocecal de gallinas ponedoras, pollos de engorda y codornices (Dieumou et al. 2009, Shanoon et al. 2012, Salmanzadeh 2015). En rumiantes, el jengibre se ha utilizado como modulador de la fermentación ruminal. Al respecto, algunos estudios in vitro han demostrado que el jengibre disminuye la producción ruminal de CH4, empleado como extractos etanólicos, metanólicos y acuosos (Patra et al. 2010), aceite esencial (Altιnçekiç et al. 2021, Temmar et al. 2021) y harina (Soroor y Moeini 2015, Kurniawati et al. 2018, Khejornsart et al. 2021). Además, se han reportado cambios en diversas poblaciones de microorganismos ruminales, tales como un aumento de protozoarios entodiniomorfos y holotricos (Patra et al. 2010) y de poblaciones bacterianas de Fibrobacter succinogenes, Ruminococcus flavefaciens y Ruminococcus albus, así como disminución de la población de ciliados asociados a metanógenos (Kim et al. 2012). Los estudios mencionados ponen en evidencia el potencial antimicrobiano y modulador de la fermentación ruminal del jengibre. Sin embargo, aún son insuficientes los estudios respecto al uso del jengibre y su capacidad para modular las características de la fermentación ruminal. Por lo anterior, los objetivos de este estudio fueron evaluar in vitro el efecto del rizoma seco de jengibre (RSJ) sobre la fermentación ruminal, producción de CH4, y determinar la cantidad óptima de RSJ en la dieta capaz de disminuir la producción de CH4.
Materiales y métodos
Obtención del RSJ
El rizoma fresco de jengibre fue adquirido en un mercado local del municipio de Texcoco, Estado de México, México, en septiembre de 2020 y su procesamiento fue realizado en el Laboratorio de Nutrición Animal del Colegio de Postgraduados Campus Montecillo. Fue lavado con agua hasta eliminar cualquier suciedad visible y cortado en láminas de entre 2 y 3 mm de grosor. Las láminas de jengibre se deshidrataron en estufa de aire forzado a 60 °C durante 4 días y posteriormente se trituraron en un molino eléctrico con malla metálica de acero inoxidable de 1 mm.
Tratamientos
Se evaluaron siete tratamientos que consistieron en dietas adicionadas con 0, 1, 3, 5, 10, 20 y 40% de RSJ en un experimento in vitro. Los niveles de inclusión fueron seleccionados ante la escasa información disponible en rumiantes. Las dietas fueron elaboradas cubriendo los requerimientos nutricionales establecidos por el NRC (2000) para ganado bovino de engorda en etapa de finalización. Los ingredientes y la composición química de cada una de las dietas evaluadas están mostrados en la Tabla 1.
Tabla 1: Ingredientes y composición química de las dietas con rizoma seco de jengibre (RSJ).
| Ingredientes1 | RSJ (%) | ||||||
| 0 | 1 | 3 | 5 | 10 | 20 | 40 | |
| Maíz | 56 | 56 | 55 | 54 | 48 | 37.5 | 18.5 |
| Pasta de soya | 15 | 14 | 14.5 | 16 | 18 | 18.5 | 19 |
| Rastrojo de maíz | 15 | 15 | 15 | 15 | 15 | 15 | 15 |
| Salvado de trigo | 9 | 9 | 7.5 | 5 | 4 | 4 | 2.5 |
| Melaza | 3 | 3 | 3 | 3 | 3 | 3 | 3 |
| Premezcla mineral y vitaminas2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 |
| RSJ | 0 | 1 | 3 | 5 | 10 | 20 | 40 |
| Composición química1 | |||||||
| MS | 90.2 | 90.3 | 90.5 | 90.6 | 90.8 | 91.6 | 92.6 |
| PC | 12.2 | 12.4 | 12.7 | 12.2 | 13.6 | 14.2 | 13.4 |
| FDN | 27.7 | 28.1 | 27.2 | 25.6 | 25.9 | 29.2 | 31.0 |
| FDA | 10.2 | 10.3 | 10.8 | 10.6 | 11.1 | 12.8 | 14.8 |
| EE | 2.7 | 2.6 | 2.5 | 2.5 | 2.9 | 3.2 | 3.2 |
| Cenizas | 6.4 | 6.5 | 6.1 | 5.9 | 6.3 | 7.9 | 9.8 |
1Valores expresados en porcentaje. 2Premezcla mineral MNA MR, Corral Elite 250-F (Finalización) contiene: fósforo 1.9%, calcio 21.0%, sodio10%, magnesio 3.4%, vitaminas A y E, y aditivos. MS: materia seca. PC: proteína cruda. FDN: fibra detergente neutro. FDA: fibra detergente ácido. EE: extracto etéreo.
Análisis químicos
Los análisis químicos de las dietas fueron realizados en el Laboratorio de Nutrición Animal del Colegio de Postgraduados Campus Montecillo, en Texcoco, Estado de México, México. Cada una de las dietas fue analizada para determinar el contenido de fibra detergente neutro (FDN) y fibra detergente ácido (FDA) de acuerdo a lo descrito por Van-Soest et al. (1963), así como el contenido de materia seca (MS), proteína cruda (PC), extracto etéreo (EE) y cenizas por los métodos establecidos por la AOAC (2006).
Fermentación in vitro
Las fermentaciones in vitro se realizaron en el laboratorio de Fisiología Vegetal del Colegio de Postgraduados Campus Campeche, en Champotón, Campeche, México. El líquido ruminal (LR) fue obtenido de dos bovinos machos, no castrados, de cruzas de razas Sardo Negro y Pardo Suizo, con peso aproximado de 450 kg, de 2.5 a 3 años de edad, manejados de acuerdo a la Norma Oficial Mexicana NOM-062-ZOO-1999 (SAGARPA 2001) y con autorización del Comité de Bienestar Animal del Colegio de Postgraduados (COBIAN/001/21). Los animales fueron alojados en corrales individuales de 30 m2, alimentados con paja de pasto y alimento concentrado comercial, y con acceso a agua limpia ad libitum. La extracción de LR fue realizada con una sonda orogástrica y máquina de bombeo manual (Drench-Mate®). El LR fue colocado en termos precalentados a 39 °C e inmediatamente trasladado al laboratorio. Posteriormente el LR fue filtrado a través de cuatro capas de tela tipo manta de cielo. Previo a la colecta del LR, el buffer fue preparado e incubado en baño María a 39 °C con flujo constante de CO2 (Menke et al. 1979). El inóculo fue preparado con el LR mezclado con el buffer a una relación 1:3, homogeneizado inmediatamente y mantenido bajo flujo constante de CO2. Una vez preparado, se depositaron 50 mL del inóculo en viales de vidrio de 120 mL de capacidad, que contenían 0.5 g de cada una de las dietas, los cuales fueron sellados herméticamente con tapón de goma sólida y arillo de aluminio, y colocados en una estufa a 39 °C. Se realizaron tres fermentaciones con tres repeticiones por tratamiento en cada una.
Medición de CH4 y CO2
El CH4 y CO2 fueron medidos utilizando hidróxido de sodio (NaOH) (Fievez et al. 2005) con las siguientes modificaciones: el gas producido en un set de viales incubados como se mencionó previamente, fue colectado utilizando una jeringa de vidrio de 50 mL y transferido a viales de 120 mL que contenían 50 mL de NaOH 1N (sellados herméticamente con tapón de goma y arillo de aluminio). El NaOH y el gas fueron mezclados manualmente y el gas remanente fue colectado con la misma jeringa de vidrio. De acuerdo con Fievez et al. (2005), el CO2 reacciona con la solución acuosa de NaOH para formar carbonato de sodio (Na2CO3), mientras que el gas remanente es considerado como CH4.
Producción de gas
La producción de gas (PG) fue medida con un manómetro usando la técnica de transducción de presión de acuerdo a Theodorou et al. (1994). La PG de cada vial fue registrada a las 3, 6, 9, 12, 18, 24, 32, 48 y 72 h de incubación. Después de cada medición de gas, la presión de cada vial fue igualada a cero. La PG acumulado se obtuvo sumando la PG obtenida de cada una de las horas previas.
Degradabilidad de la materia seca
La degradabilidad de la materia seca (DMS) fue evaluada a las 6, 12, 24, 48 y 72 h de incubación. Al final de cada tiempo, los viales fueron colocados en agua con hielo durante al menos 2 h para detener la actividad microbiana. Posteriormente, el contenido de cada vial fue filtrado. El material filtrado fue colocado en una estufa a 80 °C durante 24 h.
Cálculos
El volumen máximo de gas (Vmax, mL g MS-1), la tasa de producción de gas (S, h-1) y la fase de retardo (L, h) fueron determinados con el procedimiento NLIN del programa estadístico SAS (2002), utilizando el modelo mencionado por France et al. (2000):
Donde: y = Volumen de gas (mL) en el tiempo; b = Volumen de gas (mL) de la fermentación del sustrato (mL) (asíntota); c = Tasa fraccionaria de producción de gas (h); t = Tiempo (h); L = Retardo antes de iniciar la PG.
La energía metabolizable (EM), expresada en MJ, fue calculada de acuerdo a Menke et al. (1979) con la siguiente fórmula:
Donde: PG = Producción de gas a las 24 h de incubación (mL 200 mg MS-1); PC = Proteína cruda (g kg MS-1).
La conversión de la EM en MJ a Mcal se realizó con la siguiente fórmula:
El factor de partición (FP) a las 24 h de incubación se calculó según Blümmel et al. (1997), de la siguiente manera:
Donde: FP24 = Eficiencia de fermentación a las 24 h de incubación; DMS24 = DMS (mg g MS-1) a las 24 h de incubación; PG24 = PG (mL g MS-1) a las 24 h de incubación.
Análisis estadístico
Los resultados se analizaron mediante un diseño experimental de bloques completos al azar con el paquete estadístico SAS (2002) y comparación de medias de Tukey con (P ≤ 0.05). El modelo estadístico utilizado fue el siguiente:
Donde: Yij = Respuesta observada con el tratamiento i en el bloque j; µ = Media general; Ti = Efecto del tratamiento i; i = 1, 2,. . . , t; βj = Efecto de bloque j; j = 1,2,. . . ,r; £ij = Error experimental.
Resultados
Cinética de producción de gas, energía metabolizable y factor de partición
En este estudio la cinética de PG, EM y FP fueron afectados por el RSJ (Tabla 2). El volumen máximo de gas (Vmax) fue disminuido de manera significativa a partir de 10% de RSJ en la dieta, registrándose con 40% de RSJ el valor más bajo (P ≤ 0.05). El Vmax disminuyó desde 8.6 hasta 25.7% con 10 y 40% de RSJ, respectivamente, comparado con el tratamiento testigo. La tasa de PG (S) disminuyó con los tratamientos 3 y 10% de RSJ (P ≤ 0.05), mientras que los tratamientos con 0, 1, 5, 20 y 40% de RSJ no mostraron diferencias estadísticas (P > 0.05) entre sí. La fase de retardo (L) no fue afectada en ninguno de los tratamientos evaluados (P > 0.05). La energía metabolizable (EM) mostró diferencias significativas (P ≤ 0.05) a partir de 10% de RSJ, disminuyendo a mayor cantidad de RSJ en la dieta. El factor de partición (FP) aumentó a mayor inclusión de RSJ en las dietas, aunque los tratamientos con 0, 1, 3, 5 y 10% de RSJ no mostraron diferencias significativas entre sí (P > 0.05); mientras que los tratamientos con 20 y 40% RSJ tuvieron mayor FP, siendo estadísticamente diferentes (P ≤ 0.05) respecto al resto de los tratamientos.
Tabla 2: Efecto del rizoma seco de jengibre en la dieta sobre la cinética de producción de gas, energía metabolizable, factor de partición y producción de metano y dióxido de carbono.
| Variable | RSJ, % | |||||||
| 0 | 1 | 3 | 5 | 10 | 20 | 40 | EEM | |
| Vmax, mL g MS-1 | 186.6 a | 185.8 a | 187.1 a | 182.9 a | 170.6 b | 159.5 b | 138.7 c | 3.200 |
| S, h-1 | 0.057 a | 0.055 a | 0.050 b | 0.053 ab | 0.050 b | 0.053 ab | 0.053 ab | 0.001 |
| L, h | 4.376 a | 4.689 a | 4.125 a | 4.314 a | 4.082 a | 4.112 a | 4.197 a | 0.121 |
| EM, Mcal kg MS-1 | 1.74 a | 1.71 a | 1.69 ab | 1.69 ab | 1.63 bc | 1.59 c | 1.46 d | 0.020 |
| FP | 3.98 c | 4.13 c | 4.09 c | 4.15 c | 4.37 bc | 4.67 ab | 5.12 a | 0.109 |
| CH4, mL g MS-1 | 46.2 a | 50.8 a | 43.7 a | 25.9 b | 23.7 b | 24.2 b | 22.1 b | 3.093 |
| CH4, % | 28.1 a | 31.4 a | 27.7 a | 15.9 b | 16.1 b | 17.0 b | 18.3 b | 1.756 |
| CO2, mL g MS-1 | 115.3 ab | 105.7 bc | 109.8 abc | 128.2 a | 118.8 ab | 111.2 abc | 94.9 c | 2.808 |
| CO2, % | 71.9 b | 68.5 b | 72.2 b | 84.0 a | 83.9 a | 82.9 a | 81.7 a | 1.756 |
RSJ: rizoma seco de jengibre. Medias con distinta literal ( a,b,c ) en cada fila son diferentes (P ≤ 0.05). CH4 y CO2 se calcularon a las 24 horas de incubación. Vmax: volumen máximo de gas; S: tasa de producción de gas; L: fase de retardo; EM: energía metabolizable; FP: factor de partición a las 24 h de incubación, mg MS degradada/mL gas; EEM: Error estándar de la media.
Producción de CH4 y CO2
La producción (mL g MS-1) y concentración (%) de CH4 y CO2 fueron afectadas por la cantidad de RSJ incorporado en la dieta (Tabla 2). Tanto la producción como la concentración de CH4 disminuyeron significativamente (P ≤ 0.05) a partir de 5% de RSJ, sin diferencias con 10, 20 y 40% de RSJ (P > 0.05). La producción de CH4 disminuyó entre 45.9 y 52.1% a partir de 5 y hasta 40% de RSJ, respectivamente, en comparación a la dieta testigo. Respecto a la concentración de CO2, el comportamiento es inverso al de CH4, aumentando significativamente a partir de 5% de RSJ (P ≤ 0.05), sin diferencias con los tratamientos 10, 20 y 40% de RSJ (P > 0.05); sin embargo, la producción de CO2 fue estadísticamente menor (P ≤ 0.05) con 40% de RSJ (< 21.5%).
Producción de gas acumulado
La PG acumulado no se afectó en las primeras 6 horas de incubación con el RSJ en la dieta (P >0.05); sin embargo, disminuyó significativamente con 20 y 40% de RSJ a partir de las 9 h, así como con 10% a partir de las 12 h y hasta las 72 h de incubación, respecto al tratamiento testigo (P ≤ 0.05, Figura 1).
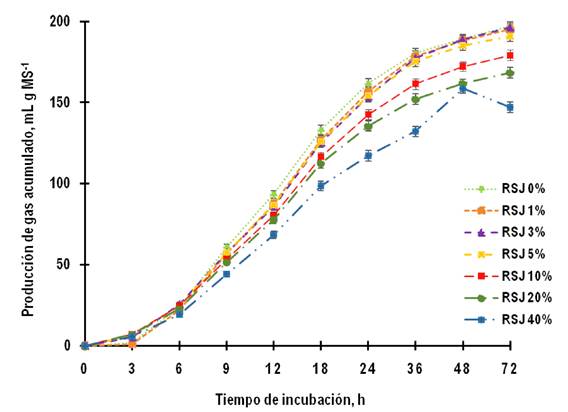
Figura 1. Efecto del rizoma seco de jengibre (RSJ) en la dieta sobre la producción de gas acumulado durante 72 h de incubación (P ≤ 0.05). Error estándar de la media (EEM) indicado por las barras; 0.88, 1.14, 1.79, 2.25, 2.85, 3.15, 3.25, 2.83, 3.31 a las 3, 6, 9, 12, 18, 24, 36, 48 y 72 h respectivamente. Barras no visibles caen dentro de los símbolos de cada serie.
Degradabilidad de la materia seca
No hubo diferencias significativas durante las primeras 12 h de incubación (P > 0.05). Sin embargo, a partir de las 24 y hasta las 72 h de incubación, la DMS disminuyó significativamente (< 10.6%, P ≤ 0.05) con 40% RSJ, en comparación al resto de los tratamientos evaluados (Figura 2).
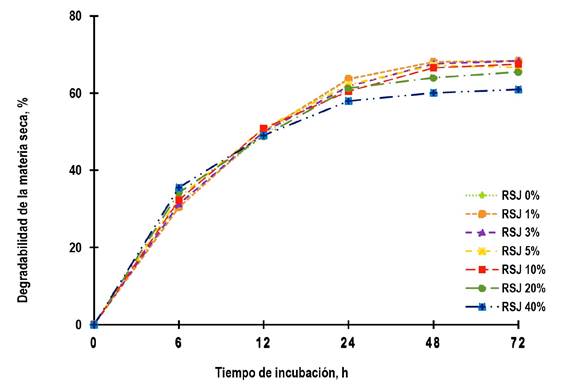
Figura 2. Efecto del rizoma seco de jengibre (RSJ) en la dieta sobre la degradabilidad de la materia seca (DMS) durante 72 h de incubación (P ≤ 0.05). Error estándar de la media (EEM) indicado por barras: 0.48, 0.50, 0.45, 0.38, 0.46 a las 6, 12, 24, 48 y 72 horas respectivamente. Barras no visibles caen dentro de los símbolos de cada serie.
Discusión
Actualmente los estudios sobre el uso de jengibre en alimentación de rumiantes son escasos. Los pocos estudios disponibles muestran el potencial de esta planta como aditivo alimenticio capaz de disminuir la producción de CH4 en el rumen (Kim et al. 2012, Soroor y Moeini 2015, Altιnçekiç et al. 2021). En la presente investigación se obtuvieron resultados que fortalecen la propuesta del uso de la raíz de jengibre con fines antimetanogénicos en bovinos. Adicionalmente, se pudo establecer el contenido mínimo de RSJ necesario para disminuir la producción de CH4, sin afectar las variables de fermentación ruminal bajo condiciones in vitro.
Cinética de producción de gas, energía metabolizable y factor de partición
Pocos estudios in vitro acerca del uso de jengibre en rumiantes reportan datos de volumen máximo de gas (Vmax), tasa de producción de gas (S), fase de retardo (L), energía metabolizable (EM) y factor de partición (FP). Los datos obtenidos en este experimento muestran que el RSJ en la dieta tiene efecto sobre estas variables de fermentación. Al respecto, la disminución en el Vmax coincide con Khejornsart et al. (2021) quienes reportaron disminución de hasta 23.5% al agregar 7.5% de harina de jengibre en una dieta para ovinos alta en carbohidratos no estructurales altamente fermentables. Por el contrario, Soroor y Moeini (2015) reportaron que el Vmax aumentó hasta 5.4% con la inclusión de 30% de jengibre seco en una dieta compuesta por heno de alfalfa y grano de cebada (70:30). En este experimento la disminución del Vmax pudo deberse al efecto antimicrobiano de los metabolitos secundarios presentes en jengibre, los cuales han demostrado disminuir poblaciones microbianas importantes para la fermentación ruminal, como los protozoarios (Kim et al. 2012), que participan en el proceso de degradación de las partículas de alimento de la dieta (Williams et al. 2020). La disminución en la S indica disminución de la cantidad de gas por cada hora de incubación y, por consiguiente, la actividad fermentativa es menos eficiente (Khejornsart et al. 2021); no obstante, los resultados de otras investigaciones no tienen la misma tendencia y difieren entre sí, ya que mientras Khejornsart et al. (2021) no observaron diferencias significativas, Soroor y Moeini (2015) reportaron una disminución significativa de la S de hasta 18.7%. La L no fue afectada en ninguno de los tratamientos evaluados, lo cual contrasta con lo reportado por Khejornsart et al. (2021), en cuyo estudio observaron un aumento significativo en la L respecto al tratamiento testigo. Nuestros resultados podrían indicar que el jengibre no inhibió drásticamente a los microorganismos ruminales durante las primeras horas de incubación, aunado a que en todos los tratamientos hubo presencia de nutrientes disponibles para iniciar el proceso de fermentación. En términos generales, el comportamiento de la cinética de producción de gas (Vmax, L y S) depende de la disponibilidad de nutrientes en la dieta como carbohidratos solubles y proteína, principalmente (Khejornsart et al. 2021). En este sentido, la composición de las dietas pudo influir en la cinética de PG, ya que tanto la dieta utilizada por Khejornsart et al. (2021) como la de este estudio fueron altas en grano (> 70%) con alrededor de 28 y 12% de FDN, respectivamente; mientras que la dieta de Soroor y Moeini (2015) fue alta en forraje (> 70%) con alrededor de 39% de FDN, por ende, con mayor cantidad de carbohidratos estructurales, los cuales no son de fácil fermentación.
La EM disminuyó 6.3, 8.6 y 16.1% en las dietas con 10, 20 y 40% de RSJ, respectivamente, en comparación con la dieta testigo. Estos resultados coinciden con los reportados por Altιnçekiç et al. (2021), quienes demostraron disminución de EM de hasta 10.8% con el uso de aceite esencial de jengibre. Sin embargo, contrastan con los obtenidos por Mekuiko et al. (2018) al aumentar significativamente la EM hasta en 6.38% con la adición de 0.02% de aceite esencial de jengibre. Dado que la EM representa la energía disponible para el mantenimiento básico del animal, de la cual deriva la energía para sintetizar nuevas biomoléculas que se reflejan en la ganancia de peso y producción de leche (Mendoza-Martínez et al. 2008), una dieta con una EM alta podría considerarse como una dieta favorable para la producción animal. Por consiguiente, para los fines de esta investigación, las dietas con más de 10% de RSJ serían poco viables desde esta perspectiva. El FP aumentó a mayor inclusión de RSJ en las dietas, aunque los tratamientos con 0, 1, 3, 5 y 10% de RSJ no mostraron diferencias significativas (P > 0.05) entre sí; mientras que los tratamientos con 20 y 40% RSJ tuvieron mayor FP, siendo estadísticamente diferentes (P ≤ 0.05) respecto al resto de los tratamientos (Tabla 2). El FP es la relación entre el sustrato degradado por cada unidad de gas que se produce en la fermentación, un factor de partición elevado en los sustratos, se relaciona con mayor DMS, mayor eficiencia en la síntesis de la biomasa y proteína microbiana, pero está asociado a menor producción de CH4 (Posada y Noguera 2005). Los resultados presentados en este estudio difieren de aquellos reportados por Soroor y Moeini (2015), quienes no encontraron diferencias significativas al adicionar 15 y 30% de jengibre seco en la dieta, al igual que Mekuiko et al. (2018), quienes no encontraron cambios en el FP al utilizar 100, 200 y 400 mg kg1 de aceite esencial de jengibre en la dieta.
Producción de CH4 y CO2
La producción (mL g MS-1) y concentración (%) de CH4 y CO2 fueron afectadas por la cantidad de RSJ incorporado en la dieta (Tabla 2). Tanto la producción como la concentración de CH4 disminuyeron significativamente (P ≤ 0.05) a partir de 5% de RSJ, sin diferencias con 10, 20 y 40% de RSJ (P > 0.05). La producción de CH4 disminuyó entre 45.9 y 52.1% a partir de 5 y hasta 40% de RSJ, respectivamente, en comparación a la dieta testigo. El jengibre ha sido utilizado para disminuir el CH4 ruminal in vitro, tanto como harina (Soroor y Moeini 2015, Khejornsart et al. 2021), extractos metanólicos obtenido de la parte superior de la planta (Kim et al. 2012) y aceites esenciales del rizoma (Altιnçekiç et al. 2021). Aunque todos los estudios previamente mencionados reportan disminución en la producción de CH4 con la adición de jengibre en alguna de sus formas, en ninguno de ellos fue tan considerable como lo reportado en este experimento, que fue de 52%. Sin embargo, cabe mencionar que también existen estudios en los cuales el uso de jengibre no disminuyó la producción de CH4 (Kurniawati et al. 2018, Patra et al. 2010). La disminución en la producción de CH4 podría estar relacionada con el efecto antimicrobiano de los metabolitos secundarios del jengibre (Dieumou et al. 2009, Shanoon et al. 2012, Kumar et al. 2014, Salmanzadeh 2015, Kurniawati et al. 2018, Mekuiko et al. 2018), disminuyendo bacterias y protozoarios ruminales (Kurniawati et al. 2018, Khejornsart et al. 2021), principalmente protozoarios ciliados, los cuales se encuentran asociados a las arqueas metanogénicas (Patra et al. 2010, Kim et al. 2012). Se estima que entre 9 y 37% del CH4 ruminal es producido por estos microorganismos (Newbold et al. 2015, Eckard et al. 2010, Huws et al. 2018). Adicionalmente, se hipotetizaría que los microRNAs del jengibre podrían afectar a las poblaciones de microorganismos ruminales responsables de la producción de CH4. Estos microRNAs, tanto a una dosis alta como baja (10 y 0.5 mg kg-1 de peso corporal, respectivamente), han mostrado modificar la composición bacteriana del intestino de ratones, incrementando la abundancia relativa de familias Lactoballiaceae y Bacteroidales, y disminuyendo la Clostridiaceae (Teng et al. 2018).
Respecto a la concentración de CO2, se observó un comportamiento inverso al de CH4, aumentando significativamente a partir de 5% de RSJ (P ≤ 0.05), sin diferencias con los tratamientos 10, 20 y 40% de RSJ (P > 0.05); sin embargo, la producción de CO2 fue estadísticamente menor (P ≤ 0.05) con 40% de RSJ (< 21.5%). Estudios previos han reportado disminución de CO2 similares con la utilización de harina (Soroor y Moeini 2015) y aceite esencial de jengibre (Altιnçekiç et al. 2021) cuyos resultados coinciden con los obtenidos en este estudio. El aumento en la producción de CO2 ruminal fue previamente reportado por Kim et al. (2012), quienes observaron un incremento del 20.3% en la producción de CO2 in vitro al adicionar un extracto de la parte superior del jengibre.
Producción de gas acumulado
La PG acumulado no se afectó en las primeras 6 horas de incubación con el RSJ en la dieta (P >0.05), pero disminuyó significativamente con 20 y 40% de RSJ a partir de las 9 h, así como con 10% a partir de las 12 h y hasta las 72 h de incubación, respecto al tratamiento testigo (P ≤ 0.05, Figura 1). Un estudio previo reportó hasta 19.6% disminución de la PG con 7.5% de harina de jengibre (Khejornsart et al. 2021). También se han reportado menor PG con el uso de aceite esencial de jengibre (Kurniawati et al. 2018, Altιnçekiç et al. 2021). En contraste los otros estudios han observado hasta 5.4% de aumento en la PG con 15 y 30% de jengibre seco en la dieta (Soroor y Moeini 2015) y de 8.7% con la adición de 1% de extracto etanólico elaborado con la parte superior de la planta de jengibre (Kim et al. 2012). Asimismo, Mekuiko et al. (2018) reportaron un aumento de hasta 9.9% en la PG al agregar 0.02% de aceite esencial de jengibre en la dieta respecto al tratamiento testigo en líquido ruminal de cabras, mientras que el mismo tratamiento incubado en líquido ruminal de borregos bajo las mismas condiciones no tuvo efectos. Lo anterior, es un indicativo del efecto del origen del líquido ruminal utilizado para la fermentación in vitro. Por otro lado, también hay estudios en los cuales no hay cambios en la PG con la adición de extractos etanólicos, metanólicos y acuosos de raíz de jengibre en la dieta (Patra et al. 2010), lo cual coincide con los tratamientos con 1, 3 y 5% de RSJ del presente experimento, efecto que podría indicar que bajas concentraciones de jengibre no afectan la PG.
Degradabilidad de la materia seca
No hubo diferencias significativas durante las primeras 12 h de incubación (P > 0.05), pero a partir de las 24 hasta las 72 h de incubación, la DMS del tratamiento con 40% RSJ disminuyó significativamente (P ≤ 0.05) en comparación al resto de los tratamientos evaluados (Figura 2). Este resultado es similar a lo reportado con extractos (Patra et al. 2010, Altιnçekiç et al. 2021) o aceite esencial (Mekuiko et al. 2018) de jengibre. No obstante, también hay estudios que reportan el efecto contrario, como Soroor y Moeini (2015) quienes reportaron un incremento de casi 8% en la degradabilidad de la materia orgánica con 30% de jengibre seco en una dieta de 70:30 heno de alfalfa y cebada, respecto a la dieta testigo.
Los resultados observados, respecto a otras investigaciones sobre el efecto de jengibre en la fermentación ruminal, no son concluyentes y no son comparables entre sí, ya que cada uno puede ser afectado por diversos factores, como la composición de las dietas basales, proporción grano: forraje, digestibilidad de la materia orgánica (Soroor y Moeini 2015) y origen del líquido ruminal utilizado (Mekuiko et al. 2018). Asimismo, el jengibre puede influir en la fermentación ruminal dependiente de la cantidad utilizada, la forma en la que se suministra (extracto, aceite esencial o harina), parte vegetativa de la cual proviene el extracto (raíz o parte superior de la planta), y tipo de extracto (metanólico, etanólico o acuoso). Por otro lado, la temperatura de deshidratación, temperatura de extracción (calor o liofilizado) y pH del procesamiento del jengibre (Ok y Jeong 2012, An et al. 2015); estado físico del jengibre, ya sea fresco o seco (Ozola et al. 2019), así como el genotipo o variedad y tiempo de almacenado post cosecha del rizoma (Sanwal et al. 2010, Yeh et al. 2014) cambian la composición y concentración de los metabolitos secundarios, principalmente de compuestos fenólicos como gingeroles y shogaoles, o aceites esenciales del jengibre. Estos compuestos poseen efectos antimicrobianos (Abd et al. 2020) pudiendo afectar la microbiota ruminal (Kim et al. 2012). Incluso, es posible que los microRNAs del jengibre afecten las características de la fermentación ruminal, regulando y modulando a la microbiota del rumen. Estudios en ratones han demostrado que los microRNAs del jengibre son captados selectivamente por las bacterias intestinales regulando su expresión genética y, en consecuencia, modulando la composición y función de la microbiota intestinal (Teng et al. 2018). Por lo anterior, es importante profundizar y enfocar los estudios venideros en determinar los componentes específicos o su interacción en la composición microbiana y fermentación ruminal.
Conclusiones
En las condiciones de este estudio, el 5% de RSJ en la dieta es suficiente para disminuir la producción y concentración de CH4, sin afectar de forma negativa otras variables de la fermentación ruminal. Pero aún es necesario determinar cuáles son los metabolitos secundarios involucrados, así como su efecto en la modulación de la microbiota ruminal. Por otro lado, es indispensable que se lleven a cabo estudios in vivo que permitan determinar el efecto del RSJ y sus metabolitos en las variables productivas de los rumiantes.











 nueva página del texto (beta)
nueva página del texto (beta)



