Introducción
Los árboles asociados a los pastizales brindan múltiples servicios ecosistémicos, esenciales para el desarrollo sostenible de los sistemas de producción; en conjunto estos servicios mejoran, protegen y recuperan la fertilidad de los suelos (Serna 2009). Un beneficio de los árboles es el aporte de hojarasca que al depositarse sobre el suelo contribuye a la formación del mantillo, que previene cambios bruscos de temperatura y humedad (Schalatter et al. 2006, Wang et al. 2008). La hojarasca es una de las principales vías de transferencia de materia orgánica al suelo ya que al descomponerse libera nutrientes esenciales para el crecimiento de las plantas (Vitousek y Sanford 1986, Sayer y Tanner 2010, Chakravarty et al. 2020), los cuales constituyen entre el 70-90% del total de nutrientes requeridos por estas (Sayer et al. 2020).
En las regiones tropicales, uno de los principales sistemas de producción es la ganadería de bovinos que se manejan bajo pastoreo extensivo. Esta forma de manejo ha propiciado la de forestación de grandes extensiones de selvas tropicales, reduciéndolas a parches en paisajes antrópicos (Guevara y Lira-Noriega 2004, Rzedowski 2006), donde el ciclaje de nutrientes ha sido modificado y los suelos se han empobrecido gradualmente. Los árboles pueden integrarse en los sistemas de producción animal para formar sistemas silvopastoriles, los cuales tienen la función de capturar carbono y liberar nutrientes para el sistema (Rossettiet et al. 2015). Lysiloma acapulcense (Kunth) Benth y Vachellia pennatula (Schltdl. y Cham.) Seigler y Ebinger, antes Acacia pennatula (Schltdl. y Cham.) Benth, son especies de selva baja con algunos árboles dispersos remanentes en pastizales inducidos (Bautista-Tolentino et al. 2011, Camacho-Moreno et al. 2017). La primera es una especie de estados sucesionales avanzados de selva baja (Suárez et al. 2012) y la segunda es una especie de sucesión temprana (Salas-Estrada 1993). Ambas especies aportan cantidades similares de hojarasca a los pastizales (Avendaño-Yáñez et al. 2020) y generan islas de fertilidad (Avendaño-Yáñez et al. 2018). Además, estas especies tienen un alto valor cultural para las familias por los usos y la intensidad de uso que les dan (Bautista-Tolentino et al. 2011, Suárez et al. 2012, Camacho et al. 2021). Los árboles de estas especies pierden la mayor parte de sus hojas durante la estación seca, sin embargo, se desconoce la dinámica de descomposición y liberación de nutrientes de la hojarasca. Por lo anterior, el objetivo de este estudio fue estimar la tasa de descomposición y la liberación de nutrientes de la hojarasca producida por L. acapulcense y V. pennatula como componentes de un sistema de pastizal, en un ambiente de clima cálido subhúmedo. Conocer aspectos funcionales asociados al rol ecológico que tienen estas dos especies permitirá generar información ecológica básica para el diseño y rediseño de sistemas silvopastoriles.
Materiales y métodos
Ubicación geográfica y descripción del sitio experimental
El estudio se realizó en el municipio de Paso de Ovejas, Veracruz, en un sitio ubicado en las coordenadas 19° 22’ LN, 96° 35’ LO, a 174 msnm. El clima es cálido subhúmedo Aw0”(w)(i’) g que se considera el más seco de los cálidos subhúmedos, la precipitación media anual es de 909 mm distribuidos entre junio y octubre, la temperatura media anual es de 25.2 °C (García 2004). El sitio es un potrero de 18 has dedicado al pastoreo extensivo de ganado bovino, clasificado como un sistema silvopastoril con árboles dispersos. El estrato herbáceo del sitio está dominado por las gramíneas introducidas Hyparrhenia rufa (Nees) Stapf. y Megathyrsus maximus (Jacq.) B.K. Simon & S.W.L. Jacobs (anteriormente Panicum maximum). La especie arbórea más abundante asociada al pastizal en el periodo de evaluación fue V. pennatula. Los árboles de L. acapulcense tuvieron un diámetro a la altura del pecho promedio de 52.4 cm (± 13.6), mientras que los árboles de V. pennatula tuvieron 26.0 cm (± 2.7). El tipo de suelo que predomina en el sitio es Vertisol (WRB 2007).
Recolección de la hojarasca
Se recolectó la hojarasca de L. acapulcense y V. pennatula de febrero a abril de 2018 bajo el dosel de tres árboles de cada especie. Se utilizaron piezas de nylon de 2 X 2 m como trampas de hojarasca y se colocaron sobre el suelo bajo el dosel de los árboles. La hojarasca acumulada se recolectó cada siete días durante los meses en que ocurrió la senescencia (febrero a abril) y después se separó en sus componentes: folíolos, raquis primarios y secundarios de cada especie. La hojarasca recolectada se secó en una estufa de aire forzado a 65 °C durante 72 h; posteriormente se colocó en bolsas de papel y se resguardó en bolsas plásticas hasta el inicio del experimento en campo, en junio de 2018.
Diseño experimental
Se utilizó un diseño de bloques al azar en el que cada bloque estaba constituido de dos condiciones: sombra de L. acapulcense y de V. pennatula. Cada bloque (n = 3 bloques) se designó en puntos dentro del sitio donde hubiera un árbol de cada especie a una distancia en que sus sombras no se interceptaran, pero si compartieran condiciones similares. En cada condición se probó la descomposición de la hojarasca de ambas especies. Este diseño incluyó cuatro tratamientos: sombra de L. acapulcense / hojarasca de L. acapulcense, sombra de L. acapulcense / hojarasca de V. pennatula, sombra de V. pennatula / hojarasca de L. acapulcense, sombra de V. pennatula / hojarasca de V. pennatula.
En cada árbol seleccionado se colocaron 10 bolsas con hojarasca de L. acapulcense y 10 bolsas con hojarasca de V. pennatula (20 bolsas de descomposición por árbol), distribuidas aleatoriamente en un espacio de 2 x 2 m, aproximadamente. Para conocer y explicar lo que sucede con cada fracción de la hojarasca, en el mismo espacio se colocaron bolsas de descomposición adicionales, tres con folíolos, tres con raquis primarios y tres con raquis secundarios, cuyos resultados no se compararon con ningún otro material en descomposición. También, se colocaron seis bolsas de descomposición en un área abierta a pleno sol cercana a cada bloque; tres bolsas con hojarasca de V. pennatula y tres con hojarasca de L. acapulcense, con el fin de observar que sucedería con la hojarasca a pleno sol.
Descomposición
La descomposición se evaluó por el método de litterbags, para esto se elaboraron bolsas (10 x 10 cm) con una malla de tela tipo tul, con luz de 0.05 mm para evitar pérdida de folíolos antes de que suceda la fragmentación natural de la hojarasca. En cada bolsa se colocaron 10 g de hojarasca (en base seca) que incluyeron: folíolos, raquis primarios y secundarios; la proporción de folíolos, raquis primarios y secundarios de L. acapulcense fue 0.44, 0.35 y 0.21 y de V. pennatula fue 0.38, 0.39 y 0.23, respectivamente. Las bolsas se colocaron de manera que tuvieran contacto con el horizonte orgánico y se fijaron al suelo con un hilo atado a clavos metálicos.
Las bolsas se recolectaron aleatoriamente a los 7, 28, 56, 84, 112, 140, 168, 196, 224 días después de iniciado el estudio (entre junio de 2018 y enero de 2019). En cada fecha se recolectaban dos bolsas con la hojarasca de L. acapulcense y dos bolsas con la hojarasca de V. pennatula por cada bloque. Las bolsas en el área abierta y las bolsas que contenían las diferentes fracciones de la hojarasca se recogieron únicamente al final del estudio (224 días después).
Después de cada recolección, las bolsas se limpiaron cuidadosamente para remover cualquier residuo de suelo adherido, posteriormente se extrajo la hojarasca remanente y se secó en una estufa con circulación de aire forzado a 65 °C, hasta alcanzar peso constante.
Monitoreo de las condiciones bajo el dosel de los árboles
Se monitoreó la temperatura y la humedad del suelo bajo el dosel de los árboles en las mismas fechas en que se realizaron las recolecciones de las bolsas con hojarasca. La temperatura ambiente se registró a 50 cm del suelo dentro de un radio de 1m alrededor del tallo de dos árboles (un árbol de cada especie) con Data Loggers portátiles (marca Elitech, modelo RC-5). La humedad del suelo se determinó bajo el dosel de todos los árboles y en el área abierta, con el fin de comparar la condición fuera y bajo el dosel de los árboles. Se recolectaron muestras compuestas de suelo, cada muestra se formó de submuestras (n = 3 submuestras/árbol) tomadas de forma aleatoria bajo la copa evitando la línea de goteo y la base del tallo, a una profundidad de 10 cm, para obtener el porcentaje de humedad con el método gravimétrico (SEMARNAT 2000). Las muestras se secaron en una estufa (Marca Riossa, modelo H33) a 105 °C, hasta obtener peso constante. El porcentaje de humedad se obtuvo con la fórmula siguiente:
Liberación de nutrientes
Se estimó la liberación de nutrientes de la hojarasca de ambas especies mediante la diferencia entre el contenido inicial de nutrientes de la hojarasca y el contenido final, la diferencia se tomó como la cantidad de nutrientes liberados. También se calculó el porcentaje en que los nutrientes y las fracciones disminuyeron y aumentaron en la hojarasca a los 224 días.
Análisis químico de la hojarasca
Las muestras de hojarasca iniciales y las recolectadas en campo en la última fecha de recolección se trituraron por separado en un molino Willey (Marca Thomas Scientific, modelo 3383-L10) para realizar los análisis químicos. Se determinó el contenido de cenizas de acuerdo a la AOAC (1990), para lo cual se pesó 1 g de cada muestra y se colocó en una mufla (marca Felisa, modelo FE-350) a 550 °C por 6 horas. El contenido de cenizas se determinó con la fórmula siguiente:
Los contenidos de C y N se obtuvieron con el método Dumas, en un analizador de CHN (Marca PERKIN ELMER, modelo 2400). El contenido de P se determinó con el método reactivo fosfovanadatomolibdato (Bremmer 1965). Mientras que los contenidos de celulosa, hemicelulosa y lignina se obtuvieron con el método de Van Soest y Wine (1968)).
Análisis estadístico
La temperatura bajo el dosel de V. pennatula y L. acapulcense solo se utilizó con fines descriptivos. Los datos de humedad del suelo, incluyendo los datos de áreas abiertas, se analizaron con un modelo lineal generalizado con medidas repetidas, con respuesta normal. El modelo incluyó el efecto de la condición (mencionada como tratamiento en el modelo), la semana de evaluación y la interacción entre condición y semana. La variable masa remanente de hojarasca se analizó con un modelo lineal generalizado con medidas repetidas, con respuesta exponencial. Se utilizó el procedimiento GLIMMIX y la matriz de covarianza simetría compuesta (CS) y la prueba LSmeans, a un nivel de significancia α = 0.05.
El modelo estadístico para ambas variables fue:
Donde: Y
ijkl
es la variable respuesta, µ es la media general, rep (bloque)kl es el efecto aleatorio de repetición dentro del bloque asumiendo rep(bloquekl)
Los resultados de liberación de nutrientes (carbono, nitrógeno, fósforo, hemicelulosa, celulosa y lignina), incluyendo lo que sucede en áreas abiertas y las fracciones de la hojarasca, se presentan de manera descriptiva mostrando los valores promedio iniciales y finales. Complementariamente, la biomasa de hojarasca remanente se utilizó para realizar un ajuste de regresión y predecir la descomposición en el tiempo utilizando el modelo de regresión simple (Olson 1963):
Donde: yi j es la fracción de biomasa remanente, αi intercepción, ki es la constante de descomposición y t es el tiempo expresado en días.
Los parámetros de las ecuaciones resultantes no se compararon, pero con las constantes de descomposición obtenidas por medio de los modelos, se calculó el tiempo necesario para una desaparición de la hojarasca del 50% (t0.5 = - 0.69/k) y el tiempo necesario para alcanzar 99% de descomposición (t0.99 = - 4.60/k) (Olson 1963, Arunachalam y Singh 2002), en cada uno de los tratamientos.
Resultados
Condiciones bajo el dosel de los árboles
Las temperaturas máximas bajo los árboles ocurrieron durante los primeros días de junio (28.7°C bajo V. pennatula y 27.8 °C bajo L. acapulcense) y septiembre de 2018 (27.7 °C bajo V. pennatula y 27 °C bajo L. acapulcense), las más bajas se observaron en diciembre 2018 y enero del 2019, en ambas condiciones; en diciembre se registró 22.8 °C bajo L. acapulcense y 22.9 °C bajo V. pennatula, en enero se mantuvo en 22.6 °C bajo L. acapulcense y 23.5 °C bajo V. pennatula (Figura 1).

Figura 1 Temperatura bajo el dosel de Lysiloma acapulcense y Vachellia pennatula de junio de 2018 a enero de 2019, en condiciones de clima cálido subhúmedo.
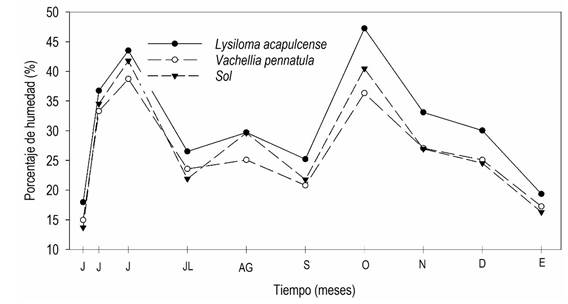
La humedad del suelo no difirió por la condición de sombra (P = 0.098), pero si difirió por efecto del momento de medición (semana) (P < 0.0001, Figura 2). Bajo el dosel de L. acapulcense se conservó mayor humedad en el suelo (30.9%) que en el área abierta (27.1%, P < 0.05) y bajo V. pennatula (26.2%, P < 0.05). Hubo dos puntos máximos de humedad, uno a finales de junio durante la época de lluvias (43.5% en L. acapulcense, 38.7% en V. pennatula y 41.7% en el área abierta) y otro en el periodo de transición a época seca a finales de octubre (47.23% en L. acapulcense, 36.3% en V. pennatula y 40.4% en el área abierta) que coincidieron con los periodos de mayor precipitación en la región. Las tres condiciones tuvieron los niveles más bajos de humedad a principios de junio que es la última parte del estiaje (17.9, 14.9 y 13.7%).
Pérdida de biomasa
La masa remanente de hojarasca a los 224 días de evaluación fue similar en todos tratamientos (P = 0.999, Figura 3). En este tiempo, la hojarasca remanente de L. acapulcense fue 75% en ambas condiciones de sombra (L. acapulcense y V. pennatula) y la hojarasca de V. pennatula fue 73% en ambas condiciones de sombra (sombra de L. acapulcense y V. pennatula). Como referencia, la masa remanente de la hojarasca que permaneció en el área abierta (sin sombra) fue 77% de L. acapulcense y 76% de V. pennatula, aunque estos datos no se incluyeron en el modelo estadístico.

Figura 3 Curvas del peso remanente libre de cenizas de Lysiloma acapulcense y Vachellia pennatula, en un periodo de 32 semanas, en condiciones de clima cálido subhúmedo.
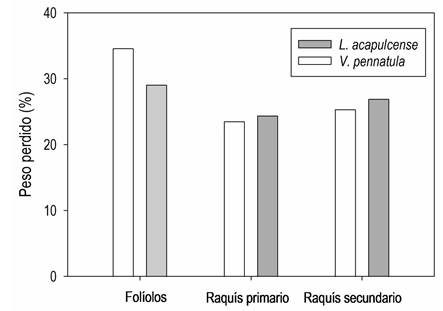
Los datos del peso perdido de las distintas fracciones de la hojarasca (Figura 4), sugieren que la mayor descomposición de biomasa corresponde a los folíolos que probablemente se perdieron por fragmentación, y en menor medida a la pérdida de biomasa de los raquis, que son más fibrosos y de lenta descomposición. Esto también explica que las fracciones de hemicelulosa y lignina aumentaron en la biomasa remanente final (Tabla 1).
Descomposición y liberación de nutrientes
Al inicio del estudio, la hojarasca de L. acapulcense contenía 3.83% más C que la hojarasca de V. pennatula; sin embargo, esta última contenía ligeramente más N. Con esas concentraciones de C y N iniciales, L. acapulcense tuvo una relación C/N numéricamente mayor que V. Pennatula. Al final, la relación disminuyó en todas las condiciones; sin embargo, bajo el dosel de L. acapulcense fue similar a diferencia de la condición bajo V. pennatula, donde su propia hojarasca resultó tener menor relación C/N (Tabla 1). A nivel descriptivo, la hojarasca de V. pennatula parece tener mayor cantidad de fósforo. De igual forma, la hojarasca remanente contenía menos celulosa y más hemicelulosa y lignina (Tabla 1).
Tabla 1 Valores promedio (±DE) de la composición química y fracciones de la pared celular inicial y final (%) de la hojarasca de Vachellia pennatula y Lysiloma acapulcense en un periodo de 32 semanas, en un clima cálido subhúmedo.
| Especie | Valor inicial | Sombra | Área abierta | |
|---|---|---|---|---|
| L. acapulcense | V. pennatula | |||
| Carbono % (final) | ||||
| L. acapulcense | 49.6 | 47.70(± 0.64) | 46.76(± 0.85) | 48.13(± 0.33) |
| V. pennatula | 47.7 | 45.80(± 0.71) | 47.36(± 0.61) | 47.93(± 0.67) |
| Nitrógeno % (final) | ||||
| L. acapulcense | 1.2 | 1.58(± 0.13) | 1.43(± 0.03) | 1.67(± 0.34) |
| V. pennatula | 1.3 | 1.55(± 0.31) | 1.64(± 0.16) | 1.62(± 0.02) |
| Fósforo % (final) | ||||
| L. acapulcense | 0.02 | 0.03(± 0.00) | 0.09(± 0.07) | 0.03(± 0.00) |
| V. pennatula | 0.02 | 0.04(± 0.31) | 0.06(± 0.16) | 0.03(± 0.00) |
| C/N (final) | ||||
| L. acapulcense | 41 | 30(± 2.49) | 32(± 0.47) | 30(± 4.96) |
| V. pennatula | 36 | 30(± 5.43) | 29(± 3.29) | 30(± 0.47) |
| Celulosa % (final) | ||||
| L. acapulcense | 18.2 | 13.97(± 1.26) | 15.44(± 1.68) | 17.16(± 0.35) |
| V. pennatula | 15.3 | 13.35(± 1.28) | 14.12(± 1.08) | 16.98(± 1.23) |
| Hemicelulosa % (final) | ||||
| L. acapulcense | 2.0 | 6.98(± 2.43) | 4.93(± 2.80) | 2.79(± 0.28) |
| V. pennatula | 1.4 | 5.52(± 1.77) | 4.04(± 2.32) | 2.77(± 0.18) |
| Lignina % (final) | ||||
| L. acapulcense | 21.4 | 36.80(± 1.29) | 38.10(± 1.95) | 36.60(± 0.95) |
| V. pennatula | 22.2 | 39.69(± 2.52) | 37.61(± 3.56) | 41.28(± 1.85) |
La relación entre la hojarasca y el tiempo (t) produjo las expresiones matemáticas expuestas en la Tabla 2, que describen la pérdida de peso en el tiempo. La tasa de descomposición osciló entre 0.00090 y -0.00096. La más alta fue de la hojarasca de V. pennatula bajo la sombra de L. acapulcense y la tasa de descomposición más baja fue en hojarasca de L. acapulcense bajo su misma sombra. Analizando el tiempo de residencia de la hojarasca en el suelo, la hojarasca de V. pennatula bajo la sombra de L. acapulcense tendría el menor tiempo (1.97 años) para alcanzar una descomposición del 50% y 13.2 años para una descomposición del 99%, bajo las condiciones imperantes.
2 Ecuaciones de regresión exponencial ajustadas al peso seco libre de cenizas remanente en función del tiempo de la hojarasca de Lysiloma acapulcense y Vachellia pennatula.
| Hojarasca | Ecuación de regresión | K | t 50 % (días) | t 99 % (días) |
|---|---|---|---|---|
| Sombra de L. acapulcense | ||||
| L. acapulcense | γ = 2.1967 e k∗t | -0.00090 | 770 | 5117 |
| V. pennatula | γ = 2.1840 e k∗t | 0.00096 | 722 | 4797 |
| Sombra de V. pennatula | ||||
| L. acapulcense | γ = 2.1923 e k∗t | 0.00093 | 745 | 4952 |
| V. pennatula | γ = 2.1785 e k∗t | 0.00091 | 762 | 5060 |
La descomposición de los diferentes componentes de la hojarasca (folíolos y raquis primarios y secundarios) de L. acapulcense y V. pennatula fue mayor en la biomasa de folíolos (entre 34.6 y 29.0% de pérdida, respectivamente) (Figura 4). Los folíolos tuvieron una mayor descomposición debido a que son el material más fragmentable y lábil, con mayor potencial para una rápida degradación en comparación a los raquis que son componentes más lignificados.
Discusión
Condiciones bajo el dosel de los árboles
Lysiloma acapulcense tuvo temperaturas menores y más humedad en el suelo bajo su dosel que V. pennatula; esto podría estar relacionado con la densidad foliar, ya que L. acapulcense mantiene más follaje por mayor tiempo que V. pennatula (CamachoMoreno et al. 2017). Esta diferencia entre especies influye en la cantidad de radiación incidente bajo el dosel, ya que la cobertura arbórea regula la distribución de la luz, la humedad, la temperatura y el viento, lo cual genera un microclima, haciendo que el micrositio generado por el dosel sea más favorable para la descomposición (Gómez 2004). Vachellia pennatula tiene mayor incidencia de radiación solar por tener menor índice de área foliar, incluso menor que en el área abierta (De Gante Ramírez, datos no publicados), porque en esta última, se conservó una cobertura vegetal de gramíneas que también genera un micrositio que mantiene cierta humedad.
Pérdida de biomasa
La mayor relación C/N inicial de la hojarasca de L. acapulcense sugiere que podría ser más recalcitrante que la hojarasca de V. pennatula como lo sugiere también la relación L/N de ambas (Avendaño Yáñez et al. 2020). Al término del estudio, la relación C/N de la hojarasca remanente seguía siendo alta en todos los tratamientos. La relación C/N puede ser un buen indicador de la descomposición de la hojarasca, valores menores a 25 indicarían una mineralización más rápida (Ahirwal et al. 2021, Lalremsang et al. 2022). Lysiloma acapulcense y V. pennatula tuvieron una relación C/N similar y mayor a 25 lo que sugeriría un proceso de descomposición relativamente lento de la hojarasca de ambas especies. Aunque, es importante señalar que la relación C/N solo es un buen predictor para las estructuras que no llegan a descomponerse relativamente rápido (Bonanomi et al. 2013). Este resultado probablemente se explique porque la hojarasca incluyó no solo los folíolos, sino también los raquis primarios y secundarios de las hojas y a diferencia de los folíolos, los raquis de las hojas compuestas son estructuras más lignificadas y con menor tasa de descomposición (Boniche et al. 2008). Estos resultados difieren a lo encontrado por Castellanos-Barliza y León (2011) quienes reportan relaciones de C/N más bajas en las hojas de Leucaena leucocephala, pero no incluyeron los componentes más recalcitrantes de las hojas. Aunque, se observó un ligero incremento de C en la hojarasca remanente de V. pennatula en el área abierta posiblemente debido a la adhesión y acumulación de microorganismos que la colonizaron (Santonja et al. 2017).
Descomposición y liberación de nutrientes
Al final del estudio, la concentración de P y N aumentaron visiblemente en todos los tratamientos, al igual que en las muestras de áreas abiertas. Esto puede suceder cuando la descomposición es lenta y los microorganismos (bacterias, hongos) se adhieren a la hojarasca (inmovilización temporal) y su biomasa residual contribuye a la cantidad de nutrientes que se contabiliza (Castellanos-Barliza y León 2011). La aparición de algunas especies de hongos puede ayudar a la liberación de N de la materia orgánica recalcitrante durante el proceso de descomposición (Lindahl y Tunlid 2015). La masa remanente de hojarasca en el área abierta fue más alta solo entre 2 y 3 puntos porcentuales que la remanente bajo el dosel de los árboles. Este resultado sugiere que la cobertura arbórea podría modular cambios ambientales bajo su dosel, creando microambientes que favorecen la descomposición (Von-Arx et al. 2012), aunque en este estudio la descomposición fue mínima, y las condiciones generadas por el dosel de ambas especies no fue determinante para propiciar distintas tasas de desaparición de la biomasa.
Ambas especies evaluadas tienen tasas de descomposición relativamente lentas. Las tasas estimadas a través de los modelos de regresión exponencial (Tabla 2) son similares a las reportadas para ambientes áridos (Montaña et al. 1988), y de lenta degradación, comparadas con estudios realizados en la hojarasca de otras leguminosas (Pandey et al. 2006, Castellanos-Barliza y León 2011, Ruz et al. 2015, Akinyele y Donald-Amaeshi 2021) en climas tropicales subhúmedos. Cabe resaltar que factores como la composición química de la hojarasca, la comunidad de microorganismos, las condiciones ambientales (humedad y temperatura) y su interacción, pueden pausar o impulsar el proceso de degradación de la hojarasca en diferentes hábitats (Berg y McClaugherty 2020).
Las tasas de descomposición que se observaron durante el periodo del estudio sugieren una lenta degradación, lo cual podría obedecer a que el ambiente donde se realizó esta investigación tiene un clima cálido, considerado el más seco de los subhúmedos (García 2004). Aquí el régimen de precipitación es estacional concentrado en cuatro meses, y con cambios recientes en el patrón de precipitación que han originado eventos de precipitación cada vez más irregulares, todo esto en su conjunto no favorece las condiciones para un proceso continuo de descomposición.
El tiempo de residencia estimado para la hojarasca de ambas especies implica hasta 13.2 años aproximadamente para integrarse al suelo completamente, lo cual es relativamente largo para ambientes con temperaturas altas. Sin embargo, son razonables cuando se considera que el periodo de descomposición activa se restringe al período de mayor humedad, que en la región se extiende a cuatro o cinco meses. Estos valores encontrados son mayores a los reportados por Ceccon et al. (2015) para otras leguminosas como Eysenhardtia polystachya (t 0.99 = 6.51 años) y Pithecellobium dulce (t 0.99 = 4.51 años) en un bosque tropical seco, aunque el período evaluado en este estudio de referencia fue de 420 días. Es importante mencionar que la composición y concentración de algunos compuestos químicos en la hojarasca (celulosa, taninos, polifenoles, ceras) varía entre especies y puede retardar su descomposición, por ejemplo, la hojarasca de Quercus robur puede tomar hasta 12 años para una degradación total (Horodecki y Jagodzi´nski 2019).
Conclusiones
Los resultados en esta investigación sugieren que la descomposición de la hojarasca de V. pennatula y L. acapulcense es similar en los diferentes microclimas generados por el dosel a través del tiempo de evaluación. Las tendencias del nitrógeno y el fósforo en la etapa final del periodo evaluado sugieren inmovilización porque al no haber liberación de nutrientes se deduce que la pérdida de peso se debió principalmente a la fragmentación de la fracción más lábil. La tasa de degradación encontrada mediante los modelos de descomposición se considera relativamente lenta para ambas especies, en consecuencia, el tiempo de residencia de la hojarasca podría ser mayor a 10 años para una desaparición del 99%. Los resultados son congruentes con la composición química de la hojarasca y con el ambiente donde se realizó la investigación, ambos aspectos podrían limitar significativamente la descomposición y liberación de nutrientes. No obstante, la hojarasca de ambas especies representa un reservorio de carbono, nitrógeno y materia orgánica para los pastizales, ya que al degradarse lentamente favorece una liberación de nutrientes gradual a través del tiempo. Estos hallazgos permiten ampliar la comprensión de la dinámica de nutrientes y carbono edáfico en sistemas silvopastoriles, donde coexisten estos árboles. Un primer paso para rediseñarlos sería estimar la densidad de árboles adecuada que compense la extracción de nutrientes a través de la cosecha de forraje.











 nueva página del texto (beta)
nueva página del texto (beta)