Introducción
Estudiar los factores que afectan la distribución de las especies es importante para entender cómo se estructura la diversidad de especies de una región (Pilowsky et al. 2022). En regiones tropicales, los cambios en la precipitación pluvial pueden influir en la estructura de la vegetación y, por lo tanto, en la disponibilidad de recursos de alimentación y reproducción para diversas especies de vertebrados e invertebrados (Hazard et al. 2022, Stephenson et al. 2022). Cuando los recursos del hábitat cambian, los animales, para satisfacer sus requerimientos de forrajeo y maximizar su oportunidad de sobrevivencia y reproducción, pueden desplazarse a otras coberturas de suelo para obtener sus recursos (Shute et al.2021). En este sentido, se ha reportado que algunas especies de aves residentes en regiones templadas son flexibles en sus áreas de forrajeo aprovechando diferentes coberturas del suelo que proporcionan recursos alimenticios en el verano e invierno (Tarjuelo et al. 2020). Sin embargo, la mayoría de los estudios se enfocan en una sola estación o temporada, descuidando la variación en la vegetación asociada al cambio de estación (Kawamura et al. 2019). En los trópicos, esta información es escasa y se requieren estudios que vinculen directamente la estacionalidad de las aves residentes con su distribución.
Comparado con los ambientes templados, los trópicos tienen una mayor diversidad de especies de aves y sus rangos de distribución generalmente son más pequeños (Lees et al. 2022). Además, durante el invierno, la región neotropical recibe una gran cantidad de especies migratorias lo que implica un aumento en la competencia e influir su comportamiento de forrajeo (Munoz y Colorado 2021). Por lo anterior, las aves pueden responder de manera diferente a la estacionalidad para cubrir sus requerimientos, dependiendo de la región.
La península de Yucatán es una región neotropical que, a través del año, presenta una mezcla de hábitats estacionales regidos por la variación en la precipitación, con periodos de sequía preestival e intraestival (De la Barreda et al. 2020). También presenta una considerable riqueza de especies de aves migratorias, especialmente en los hábitats de la costa (Echeverría-Caro et al. 2022), por lo que estos hábitats son un buen sistema para estudiar la influencia de la estacionalidad en la distribución de las especies. En este contexto, el tordo sargento (Agelaius phoeniceus) evolucionó en los humedales tropicales (Barker et al. 2008) y todavía usa sitios con vegetación inundable durante su época reproductiva (Yasukawa y Searcy, 2020). En la zona templada, la especie ha colonizado hábitats antropogénicos y puede ser considerada plaga de cultivos agrícolas, especialmente durante el invierno cuando cambia su dieta de insectívora a principalmente granívora (Werrell et al. 2021). Esto indica que la especie puede utilizar diferentes hábitats en función de la época del año. Sin embargo, en la península de Yucatán, no hay grandes extensiones agrícolas como en las regiones templadas, lo que podría limitar la distribución de la especie a humedales y, por lo tanto, presentar menos flexibilidad en su uso de hábitat a través del año, comparado a lo que se ha registrado en las regiones templadas (Bélanger et al. 2021, Ingold 2022).
El objetivo de este estudio fue analizar la asociación entre tipo de hábitat y la distribución regional del tordo sargento en la península de Yucatán y cómo esta asociación varía entre temporadas reproductiva y no reproductiva. Asumimos que la ocurrencia de esta especie es mayor en las zonas de humedales, y que sus movimientos hacia otros hábitats dependen de la estación. Para el propósito de este estudio, se tomó la cobertura del suelo como indicador del tipo de hábitat, y la probabilidad de detectarla en avistamientos como indicador de la ocurrencia de la especie. El tordo sargento es una especie común y abundante, es fácil de identificar y presenta una distribución amplia. Estas características permiten tener datos de ocurrencia de buena calidad para generar modelos de distribución (Van et al. 2021).
Materiales y métodos
Área de estudio
Se consideró como área de estudio la península de Yucatán, conocida como Provincia Biótica Península de Yucatán (PBPY) de acuerdo con Miranda (1958). El área abarca los estados de Yucatán, Quintana Roo, Campeche, y cinco municipios de Tabasco (Balancán, Centla, Emiliano Zapata, Jonuta y Tenosique), tres de Chiapas (Catazajá, La Libertad y Ocosingo), tres Departamentos del norte de Belice (Belice, Corozal y Orange Walk), así como el Departamento del Petén de Guatemala. La temperatura media anual en la región es de 18 a 27 °C (Santillán-Fernández et al. 2021). La temporada de lluvias es de junio a octubre, con una sequía intra-estival en junio-agosto (conocido como la canícula) y la temporada seca es de noviembre a abril, con una temporada de frentes fríos de octubre a febrero, denominada Nortes si acarrean humedad y lluvias (De la Barreda et al. 2020). La PBPY presenta un gradiente espacial continuo de precipitación que crea el siguiente patrón de distribución de las comunidades vegetales de acuerdo con Barber et al. (2001): zona noroeste, la cual se caracteriza por vegetación espinosa o suculentas adaptadas a las temperaturas altas de la zona (26-27 °C), es considerada una zona subárida (450-550mm anual), con sequías severas de al menos seis meses al año; zona del centro de la península caracterizada por fanerófitas caducifolias, especialmente leguminosas, con temperaturas menores (25-26°C) y mayor lluvia (1 000-1 300 mm precipitación anual); y zona sursuroeste con vegetación de selva húmeda con especies perennifolias, asociada a valores mayores de lluvia (1 500-2 000 mm precipitación anual).
Especie de estudio
El tordo sargento se distribuye desde el sur de Alaska y Canadá central hasta Costa Rica (Yasukawa y Searcy 2020). La especie tiene poblaciones migratorias en Canadá y el norte de Estados Unidos que pasan el invierno en el sur de Estados Unidos y México, mientras que algunas de sus poblaciones del sur de Estados Unidos y las poblaciones de México son residentes todo el año (Stonefish et al. 2021). De acuerdo con MacKinnon (2013), el periodo reproductivo de esta ave es de abril a julio, pero en la región del presente estudio se observó y consideró como temporada reproductiva de mayo a julio, que es cuando es más probable que sus territorios de anidación estén bien establecidos (Yasukawa y Searcy, 2020). Para reducir el sesgo del periodo migratorio previo y posterior a la reproducción, se consideró la temporada no reproductiva de diciembre a enero (Fink et al. 2021).
El tordo sargento es un ave gregaria y durante su temporada reproductiva es muy territorial (Yasukawa y Searcy 2020). Este comportamiento territorial se detecta fácilmente ya que los machos vocalizan enérgicamente mientras expanden las alas, a manera de defensa y despliegue para mantener sus territorios al inicio de la etapa de reproducción (Louder et al. 2020, Wisenden et al. 2020). Los tordos sargento adultos son principalmente granívoros, forrajean en cultivos agrícolas como arroz (Oryza sativa), girasol (Helianthus annuus), maíz (Zea mays) y trigo (Triticum spp.) (Werrell et al. 2021) en las zonas templadas. También incluyen insectos en su dieta durante la temporada reproductiva y sus crías son básicamente insectívoras (Yasukawa y Searcy 2020). Esta especie generalmente ocupa humedales como hábitat reproductivo, aunque también puede anidar en pastizales y praderas (Yasukawa et al.2020, Buckley et al. 2022).
Datos de detección/no detección
Para analizar la ocurrencia del tordo sargento, se utilizaron las listas de observación registradas en la base de datos de ciencia ciudadana eBird (eBird 2021) del 2009 al 2020 para la península de Yucatán. Cada lista de observación incluyó información sobre la identidad de la especie, ubicación geográfica (latitud, longitud) del sitio de observación, protocolo usado en la observación, fecha, distancia recorrida y tiempo que duró la observación (eBird 2021). Se utilizaron solo las listas de observación completas (es decir, los observadores indicaron que registraron todas las aves detectadas e identificadas), lo que permitió considerar la ausencia del tordo sargento en una lista como una no detección (Johnston et al. 2021). Se filtraron las listas de observación completas con servando aquellas que presentaban el tipo de protocolo Stationary (punto fijo) y Traveling (recorrido), con duración de observación menor o igual a 5 h, distancia recorrida menor o igual a 5 km (cero para protocolo Stationary) y con 10 o menos observadores (Strimas-Mackey et al. 2020). La base de datos obtenida se categorizó por temporada reproductiva y no reproductiva.
Para reducir el sesgo espacial y el desbalance entre las listas con detección o no detección de la especie, se realizó un submuestreo (Johnston et al. 2021) con el paquete dggridR (Barnes y Sahr 2017) en R v 4.1.2 (R Core Team 2021). Para lo cual se delimitó una matriz espacial de hexágonos para la región de estudio, con una distancia de 5 km entre los centros de cada hexágono. En cada hexágono se seleccionó aleatoriamente un par de listas para cada semana de cada año, una con detección y una con no detección (Strimas-Mackey et al. 2020). Con el submuestreo el número total de listas para la temporada reproductiva se redujo de 16 495 a 7 138 y de 19 129 a 7 769 para la temporada no reproductiva.
Variables explicativas
Se añadió la variable de cobertura del suelo derivada del satélite MODIS, producto MCD12Q1 v006 (Friedl y Sulla-Menashe 2019) como indicador del tipo de hábitat. La cobertura del suelo se clasificó según Hansen et al. (2010), determinando 13 clases de cobertura en la región de estudio (Figura 1). Debido a que el producto de MODIS puede clasificar de manera errónea las áreas urbanas, en especial en ciudades de pequeñas a medianas en tamaños (Wan et al. 2015), se usaron los datos de intensidad lumínica derivados de la base de datos DMSP-OLS Nighttime Lights Time Series versión 4. La intensidad lumínica de las ciudades permite la detección de las áreas urbanas. La base de datos de luces incluye archivos anuales multitemporales (1992-2013) que promedian los datos anuales de la intensidad lumínica de ciudades, pueblos y otros sitios con iluminación constante, en pixeles de 1 km x 1 km (Zhao et al. 2019).
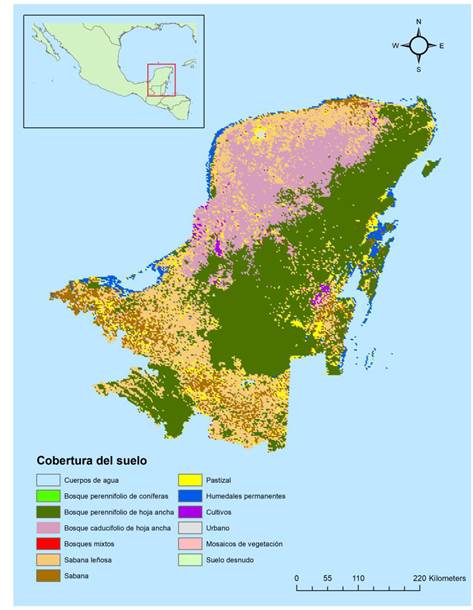
Figura 1 Distribución de los tipos de cobertura del suelo de acuerdo a la clasificación de MODIS en la Provincia Biótica Península de Yucatán en el año 2019.
Considerando que la ubicación de cada lista puede no ser exactamente el punto donde se detectó a la especie, se resumieron los datos de la cobertura del suelo en una zona buffer de 2.5 x 2.5 km con la latitud y longitud de la lista como centro (Strimas-Mackey et al. 2020). Con el paquete exactextractr (Baston D 2022) en R v 4.1.2 (R Core Team 2021), se extrajeron los valores de las capas de cobertura del suelo y se calculó la proporción de la zona buffer dentro de cada clase de cobertura de suelo. También, se calculó la media de los valores de intensidad lumínica luces de ciudad y su desviación estándar con los pixeles de luz dentro de la zona buffer (Johnston et al. 2021). Finalmente, los valores obtenidos de cada variable para cada lista se adjuntaron a la base de datos de detección/no detección.
Modelado de probabilidad de ocurrencia
Para estimar la probabilidad de que la especie esté presente, las listas de observación se dividieron aleatoriamente en 80% de entrenamiento para generar y 20% de prueba para evaluar el modelo. Los datos de entrenamiento se utilizaron para ajustar un modelo de random forest balanceado por temporada con el paquete ranger (Wright y Ziegler 2017) implementado en R v 4.1.2 (R Core Team 2021), usando como variable de respuesta la detección/no detección del tordo sargento y las variables de cobertura del suelo y luces de la ciudad como predictores. También, se añadieron cuatro variables de esfuerzo de muestreo de las listas (hora de inicio de la observación, duración en minutos, distancia recorrida en kilómetros y número de observadores) como covariables para considerar la variabilidad en la detección de la especie dependiendo del esfuerzo de muestreo. Después de aplicar el random forest balanceado, su calibración se realizó con un modelo aditivo generalizado, usando el paquete scam (Pya y Wood 2014) en R v 4.1.2 (R Core Team 2021). Para ello, se consideró la ocurrencia de detecciones como variable de respuesta y la probabilidad de ocurrencia como la variable predictora.
Para evaluar el desempeño de los modelos de random forest balanceado y el modelo calibrado, se usaron las listas de prueba para evaluar la precisión de las predicciones, calculando el error cuadrático medio (MSE), y para evaluar la habilidad discriminativa de los modelos, se consideró el área bajo la curva (AUC). El modelo calibrado presentó un menor MSE, por lo que éste se utilizó para modelar la ocurrencia de la especie por temporada.
Para analizar la diferencia en las asociaciones entre la detección del tordo sargento y las variables y covariables explicativas por temporada, se calculó y graficó de acuerdo con el índice de Gini la importancia de los predictores (Amdouni et al. 2022) en el modelo de probabilidad de ocurrencia. Los valores mayores indican un mayor poder predictivo de la variable en el modelo. También se calculó la dirección del efecto de los predictores y se obtuvieron gráficas de dependencia parcial que muestran el efecto marginal de un predictor dado en la probabilidad de ocurrencia promediada entre los otros predictores (Strimas-Mackey et al. 2020).
Distribución del tordo sargento por temporada
Para generar los mapas de probabilidad de ocurrencia por temporada, primero se construyó la superficie de predicción para la península de Yucatán. La superficie de predicción se determinó con las capas de cobertura del suelo e intensidad lumínica, construyendo una matriz de celdas (ráster) de 2.5 x2.5 km, se asignó el valor de 1 a las celdas dentro del polígono de la península de Yucatán y se dejaron vacías las que quedaron fuera del polígono. Asimismo, se calculó la proporción de cada clase de cobertura de suelo, y la media y desviación estándar de las luces de la ciudad dentro de cada celda.
Al ráster se añadieron las variables de esfuerzo de una lista estándar de eBird de 1 h de observación, 1 km de distancia, y la hora óptima para detectar a la especie (calculado con las listas 05:00 temporada reproductiva y 05:02 no reproductiva) (Strimas-Mackey et al. 2020) en cada celda. Se usó el modelo calibrado de random forest balanceado para estimar la probabilidad de ocurrencia (proporción esperada de listas estándar que detecten a la especie) en cada celda, se convirtieron los datos a un formato espacial y se generó una imagen ráster. Se dividió en “deciles” los datos resultantes de la estimación de valor de ocurrencia por celda, se tomaron las celdas con valores dentro del noveno decil para obtener la superficie en kilómetros cuadrados correspondiente al 10% de los valores superiores de ocurrencia por temporada, y se extrajeron los municipios que se sobreponen con estos valores en la región. Para la temporada reproductiva, se tomaron los valores mayores a 0.152 y para la no reproductiva los valores mayores a 0.184.
Resultados
Modelado de probabilidad de ocurrencia
Las variables con mayor poder predictivo fueron seis clases de cobertura de suelo (sabana, bosque perenne de hoja ancha, sabana leñosa, pastizales, agua y humedales), las luces de la ciudad (media y desviación estándar) y el esfuerzo de muestreo de las listas de observación de eBird (hora de inicio, minutos de duración, distancia recorrida y número de observadores). Las clases de cobertura de suelo con menor poder predictivo fueron el matorral cerrado, bosque perenne de coníferas y mosaico de vegetación.
Respecto a las clases de cobertura del suelo con mayor poder predictivo, el índice de Gini mostró que, en ambas temporadas, la sabana fue la clase que más explicó la ocurrencia del tordo sargento (Figura 2). En general, las variables fueron más importantes en la temporada reproductiva que la no reproductiva, con menos diferencia entre temporadas en la importancia de cobertura de suelo de sabana leñosa y humedales (Figura 2).
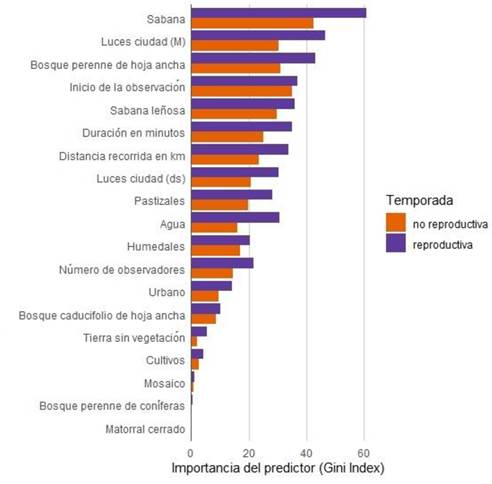
Figura 2 Importancia de las variables predictivas para explicar la detección del tordo sargento (Agelaius phoeniceus) por temporada. El MSE y el AUC de los modelos de la temporada reproductiva fueron 0.0747 y0.833 y no reproductiva 0.043 y 0.847, respectivamente. Luces ciudad (M) = media de la intensidad y Luces ciudad (ds) = desviación estándar de la intensidad.
En ambas temporadas, la probabilidad de ocurrencia se relacionó de forma positiva con la proporción de cobertura de sabana, pastizales y humedales (Figura 3A, 3I, 3J), y de forma negativa con la proporción de cobertura de bosque perenne de hoja ancha y la media de las luces de la ciudad (Figura 3C y 3D). En la sabana leñosa, la probabilidad de ocurrencia del tordo sargento se incrementó conforme aumentó este tipo de sabana hasta un 50% de cobertura, pero en valores mayores de cobertura la ocurrencia disminuyó (Figura 3E).
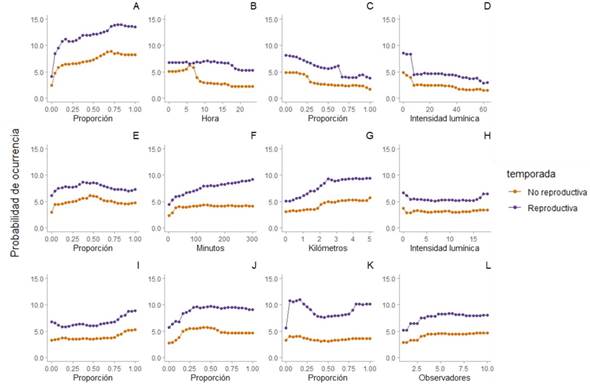
Figura 3 Relación de las variables más explicativas dentro de los modelos con la probabilidad de ocurrencia del tordo sargento (Agelaius phoeniceus) por temporada: A) sabana, B) inicio de la observación, C) bosque perenne de hoja ancha, D) luces ciudad (media), E) sabana leñosa, F) duración de la observación, G) distancia recorrida, H) luces ciudad (desviación estándar), I) pastizales, J) humedales, K) agua y L) número de observadores.
En cuanto a las variables de esfuerzo de muestreo, en ambas temporadas, reproductiva y no reproductiva, la probabilidad de detectar al tordo sargento aumentó con la distancia recorrida durante la observación, a mayor duración de la observación, y con mayor número de observadores (Figura 3F, 3G, 3L), pero disminuyó a medida que la observación se inició más tarde durante el día (Figura 3B).
Distribución del tordo sargento por temporada
En los mapas generados de probabilidad de ocurrencia de la especie, se pueden apreciar diferencias en la distribución por temporada reproductiva y no reproductiva. De acuerdo con la superficie correspondiente al 10% de los valores superiores de probabilidad de ocurrencia, la especie amplía su distribución geográfica dentro de la región durante la temporada no reproductiva (Tabla 1), principalmente en el sur de Campeche cerca de los límites con Quintana Roo, y en la parte noreste de Yucatán y Quintana Roo (Figura 4).
Tabla 1 Superficie y municipios con mayor probabilidad de ocurrencia por temporada del tordo sargento en la Provincia Biótica Península de Yucatán.
| Temporada | Superficie (km2) | Municipios y distritos (BLZ) |
|---|---|---|
| Reproductiva | 22 591.59 | CHP: Ocosingo, La Libertad, Catazajá. TAB: Balancán, Tenosique, E. Zapata, Jonuta, Centla. CAM: Calkiní, Champotón, Escárcega, Carmen, Candelaria, Palizada, Hopelchén, Campeche, Hecelchakán. YUC: Tekax,Tizimín, Río Lagartos, Panabá, San Felipe, Buctzotz, Dzilam de Bravo, Dzilam Gonzáles, Dzidzantún, Yobaín, Sinanché, Telchac Puerto, Dzemul, Ixil, Progreso, Hunucmá, Celestún, Halachó. QRO: Othón P. Blanco, Ba- calar, F. Carrillo Puerto, Tulum, Lázaro Cárdenas, Benito Juárez, Isla Mujeres. GTM: San Andrés, La Libertad, San José, Flores, Santa Ana, San Benito, Melchor de Mencos, San Francisco, Dolores, Sayaxché, San Luis, Poptún. BLZ: Orange Walk, Corozal, Belice. |
| No reproductiva | 26 189.49 | CHP: Ocosingo, La Libertad, Catazajá. TAB: Balancán. Tenosique, E. Zapata, Jonuta, Centla. CAM: Calkiní, Champotón, Carmen, Candelaria, Palizada, Tenabo, Calakmul, Escárcega, Hopelchén, Hecelchakán. YUC: Tizimín, Río Lagartos, Panabá, San Felipe, Buctzotz, Dzilam de Bravo, Dzilam Gonzáles, Dzidzantún, Sucilá, Yobaín, Sinanché, Telchac Puerto, Dzemul, Ixil, Progreso, Hunucmá, Celestún, Halachó. QRO: Othón P. Blanco, Bacalar, F. Carrillo Puerto, Tulum, Benito Juárez, Isla Mujeres, Lázaro Cárdenas, José María Morelos, Puerto Morelos. GTM: San Andrés, La Libertad, San José, Flores, Santa Ana, San Benito, Melchor de Mencos, San Francisco, Dolores, Sayaxché, San Luis, Poptún. BLZ: Orange Walk, Corozal, Belice. |
*CHP = Chiapas, TAB = Tabasco, CAM = Campeche, YUC = Yucatán, QRO = Quintara Roo, GTM = Guatemala, BLZ = Belice.
Discusión
Los hábitats asociados con la ocurrencia del tordo sargento
A diferencia de la zona templada donde el tordo sargento, además de los humedales, se asocia con hábitats suburbanos como cultivos, mosaicos de vegetación y granjas (Bélanger et al. 2021, Ingold 2022, Robinson y McChesney 2022), en la península de Yucatán encontramos que su ocurrencia fue restringida a los hábitats con vegetación natural inundable permanente o temporalmente. Esta ocurrencia fue similar tanto en la temporada reproductiva como no reproductiva.
Aunque se ha reportado a los humedales como el hábitat que más usa esta ave (Yasukawa y Searcy 2020), nuestros resultados indican que la cobertura de sabana y sabana leñosa tienen una mayor contribución a su ocurrencia. En la península de Yucatán, la sabana se mezcla con los humedales costeros y pastizales, los cuales generalmente se encuentran en suelos con drenaje deficiente que suelen inundarse durante la época de lluvias (Morales Ojeda et al. 2021). Además, la sabana presenta una vegetación herbácea, a veces con Typha sp. (Várguez-Vázquez et al. 2012), la cual es conocida como un recurso importante para la anidación de la especie (Robinson y McChesney 2022). En ese sentido, la sabana es más similar a los humedales templados que a los humedales de la península de Yucatán, que están compuestos principalmente por manglar (Morales-Ojeda et al. 2021). Por lo tanto, la cobertura de sabana y sabana leñosa representan hábitats adecuados para la especie.
Durante la temporada reproductiva, la probabilidad de ocurrencia del tordo sargento aumenta en la cobertura de agua, reafirmando la importancia de cuerpos de agua con diferentes niveles de cobertura vegetal para la especie. La distribución de la especie a través del gradiente de agua no tuvo picos tan marcados en la temporada no reproductiva, quizás indicando una asociación menor a zonas de agua con gran cobertura vegetal durante esta temporada. Los diferentes tipos de hábitats con suelos inundables en la península de Yucatán son de gran importancia para la especie, debido a que la colonización de los humedales es un factor al que se le ha atribuido la diversificación adaptativa de los tordos (Barker et al. 2008) y la evolución de diferentes caracteres de comportamiento, como la poliginia (Searcy et al. 1999).
En ambas temporadas, reproductiva y no reproductiva, la ocurrencia del tordo sargento disminuyó drásticamente con la presencia de las luces de la ciudad, aun cuando éstas fueran de baja intensidad. Por lo tanto, es muy poco probable que el tordo ocurra dentro de las zonas urbanas, pero puede ocurrir en áreas aledañas o en el borde entre otros tipos de cobertura y zonas urbanas. La especie principalmente establece sus territorios de anidación en áreas con vegetación natural (Yasukawa y Searcy 2020), aunque, en las zonas templadas, se le ha registrado anidando en hábitats antropogénicos como estanques de retención de agua pluvial, zanjas al borde de carreteras, campos de heno y patios que rodean edificios (Robinson y McChesney 2022). En la península de Yucatán, la poca vegetación inundada o estanques dentro de las zonas urbanas puede contribuir a la ausencia de la especie en las ciudades, en especial si están alejadas de la costa.
La diferencia en la distribución del tordo sargento entre temporadas
En las aves residentes de zonas templadas, se ha registrado que estas expanden sus rangos durante la temporada no reproductiva y ocupan diferentes tipos de hábitats (Morganti et al. 2017, Schlägel y Mädlow 2022). En el caso del tordo sargento en la península de Yucatán, una zona neotropical, se encontró que se distribuye en las mismas clases de cobertura de suelo en ambas temporadas. Se esperaba que el tordo sargento usara más clases de cobertura de suelo durante la temporada no reproductiva, para disminuir la competencia por recursos debido al aumento de riqueza de especies por el establecimiento de aves migratorias en los hábitats de la costa de la península (Echeverría-Caro et al. 2022). Durante esta temporada también hay otros factores que les permitiría aprovechar recursos disponibles en diferentes clases de cobertura de suelo como el final de la temporada de lluvias que favorece el desarrollo de la vegetación, y el comportamiento gregario y exploratorio de la especie durante esta etapa (Pierce y Byrd 2022). Durante la temporada no reproductiva esta ave forma parvadas y generalmente percha en árboles y arbustos con coberturas densas, los cuales abandonan cuando la vegetación tira sus hojas y buscan otra que les proporcione refugio (Pierce y Byrd 2022). Los hábitats en los que el tordo sargento ocurre en la península de Yucatán están compuestos por vegetación principalmente perenne, lo que les provee refugio disponible todo el año.
Por otro lado, la importancia de casi todas las clases de cobertura de suelo fue menor en la temporada no reproductiva, indicando una distribución más igual entre las clases. Asimismo, es notable que la diferencia en ocurrencia fue más marcada cuando había una proporción de cobertura de suelo de sabana alta, presencia de agua, y una mínima intensidad de las luces de la ciudad. Estos resultados subrayan la importancia de hábitats inundables y conservados para la anidación del tordo sargento en la península de Yucatán. Lo anterior es relevante, porque en lugares como Estados Unidos, donde la especie es muy abundante se han registrado disminuciones anuales de las poblaciones de tordo sargento, principalmente debido a la pérdida de la calidad del hábitat reproductivo (Robinson y McChesney 2022).
Aunque la probabilidad de ocurrencia del tordo es más alta en la temporada reproductiva, la especie tiende a usar una menor superficie en la península. En la temporada no reproductiva, se observó una expansión de la distribución geográfica, en el sur de la provincia biótica. Durante la temporada reproductiva, los machos tienen una defensa de territorio activa y las hembras alimentan a las crías, por lo que forrajean principalmente dentro de los mismos humedales donde anidan o en sitios adyacentes (Robinson y McChesney 2022). En cambio, durante la temporada no reproductiva, la especie no defiende territorios y tiene un comportamiento gregario y exploratorio donde forma parvadas mixtas (Werrell et al. 2021) que le permite aprovechar recursos fuera de sus sitios de anidación.
Los datos de ciencia ciudadana son una fuente importante de información y una herramienta útil para llenar espacios de información necesarios para modelar la distribución de las especies (Feldman et al. 2021). A pesar de que se realizaron filtros de los datos para reducir el sesgo espacio temporal, hay que considerar otros factores que pueden sesgar los datos, por ejemplo, falsos positivos (registrar la especie cuando no está presente), la falta de muestreos estructurados y la diversidad en la experiencia de los observadores.
Una ventaja del tordo sargento es que es una especie común y que los machos tienen una morfología y vocalizaciones muy particulares, las cuales ayudan a la correcta identificación de la especie. Sin embargo, esos caracteres son menos notables en la temporada no reproductiva; se observó una disminución de la detección de la especie cerca de las 08:00h, en la temporada no reproductiva. El tordo sargento es más detectable durante su reproducción porque vocalizan más y tienen comportamientos de mayor exhibición, como el despliegue de alas para el cortejo y la defensa del territorio activa durante todo el día. Además, tienen territorios bien definidos que ocupan a lo largo de la temporada (Yasukawa y Searcy 2020), por lo que se les puede encontrar en los mismos sitios. Es posible que la diferencia en las probabilidades de ocurrencia entre temporadas en general y en hábitats específicos, sea influenciada por la capacidad de registrar la especie y no por una diferencia en su selección de hábitat.
Estudios recientes muestran que la combinación de datos de múltiples fuentes mejora la habilidad predictiva de los modelos de distribución (Miller et al. 2019, Robinson et al. 2020), por lo que, para estudios futuros en la región se recomienda la integración de datos de muestreos estructurados. Además, de la incorporación de otras variables que puedan estar asociadas con la distribución de la especie en la región, como las interacciones bióticas. Las interacciones bióticas son un factor importante que limita la distribución de las especies al afectar la eficacia biológica y la estructura de las comunidades, especialmente en latitudes bajas como los trópicos (Paquette y Hargreaves 2021). Sin embargo, debido a la dificultad para cuantificar estas interacciones, únicamente pocos modelos de distribución de especies las incluyen.
Conclusiones
En la temporada reproductiva y no reproductiva el tordo sargento en la península de Yucatán ocurre en hábitats cercanos a la costa o en zonas con vegetación inundable y evita las zonas urbanas y cobertura de bosque perenne. El uso de vegetación inundable, principalmente en la temporada reproductiva coincide con lo reportado para la especie en otras zonas de su distribución. Durante la temporada no reproductiva la especie amplía su rango de distribución en la región. Los humedales, sabanas y pastizales inundables tienen distinto grado de asociación con la ocurrencia, pero son importantes para la especie en ambas temporadas. Este estudio es un primer análisis de la asociación entre la cobertura del suelo y la ocurrencia del tordo sargento en la península de Yucatán. Por lo que proporciona datos importantes para entender la distribución en una región de la especie. Además, se resalta la importancia del hábitat de zonas costeras para la distribución y sostenibilidad de una especie común. Esto es relevante porque a pesar de que el tordo sargento no es una especie incluida en el listado de la Unión Internacional para la Conservación de la Naturaleza (UICN) como amenazada, los ambientes en los que se encuentra están siendo continuamente afectados por las presiones antropogénicas, lo que representa una amenaza para esta ave. Se sugieren estudios adicionales para entender mejor cómo la especie utiliza estos hábitats y qué otros factores influyen en su distribución en la región.











 nueva página del texto (beta)
nueva página del texto (beta)




