Introducción
La especie Peronospora belbahrii es un oomiceto biotrófico, agente causal de la enfermedad llamada mildiu velloso en albahaca (Ocimum basilicum L.) (Zhang et al. 2019). Hasta la fecha no se han reportado variedades resistentes a este patógeno y la mayoría de los fungicidas no tienen registro para su aplicación (Cohen et al. 2013). La diseminación rápida del agente se atribuye a semillas contaminadas (Falach-Block et al. 2019) y el daño principal lo provoca en las hojas al producir amarillamiento y necrosis, disminuyendo la calidad comercial del follaje (Garibaldi et al. 2004).
El Estado de Baja California Sur, México, es uno de los principales productores de albahaca para consumo en fresco; el mildiu velloso se identificó por primera vez en 2015 en dicha entidad donde se estima que disminuye hasta el 70% del rendimiento de biomasa (Romero et al. 2015). Para controlar el efecto negativo del mildiu velloso se utiliza el pre-acondicionamiento de semillas con temperaturas que han mostrado una incidencia menor de la enfermedad y un aumento en el vigor de la planta (Elad et al. 2016). El aumento del vigor de la planta y su relación con la disminución en la incidencia de enfermedades se ha observado en especies como maíz (Rehman et al. 2015), donde los procesos físicos y químicos relacionados con el desarrollo vegetal y procesos fisiológicos como la fotosíntesis (Castillo et al. 1987, Omayio y Ndombi 2022). En albahaca, de acuerdo con Romero et al. (2016) se reporta efecto positivo de los tratamientos de calor sobre las características de vigor durante la germinación, donde a 50 °C se presentó el mayor porcentaje de germinación (85%), mientras que a 70 °C la germinación se redujo (46%), lo que lleva a considerar que esta respuesta se relaciona con una disminución en la incidencia de la enfermedad del mildiu; bajo condiciones controladas donde la temperatura y la humedad permiten identificar el efecto de tratamientos de pre-acodicionamiento de la semilla. Mientras que en condiciones de campo, se reporta una relación entre la aparición de los síntomas del mildiu con la temperatura y la humedad ambiental (Gilardi et al. 2015, Chen et al. 2021). Por lo anterior, es importante detectar los umbrales de temperatura y humedad relativa que provocan la aparición de los síntomas de la enfermedad en los sitios de siembra, sobre todo si el efecto de tratamientos de pre-acodicionamiento de la semilla sobre la incidencia de la enfermedad en la planta mantiene la respuesta ante estos umbrales. Por lo anterior, el objetivo de estudio fue establecer la relación de la temperatura y la humedad relativa a la que se presentan los síntomas del mildiu y cómo el pre-acondicionamiento con calor interviene en la manifestación de los síntomas a través de la incidencia y sobrevivencia de la enfermedad.
Materiales y métodos
Los tratamientos de las semillas a la exposición de calor y obtención de plántulas se realizaron en el campo agrícola experimental y en el laboratorio de fisiotecnia vegetal del Centro de Investigaciones Biológicas del Noroeste, S.C. (CIBNOR) (24° 08’ LN 110° 24’ LO a 27 msnm) en La Paz, Baja California Sur, México. Las plántulas se trasladaron para ser expuestas a la enfermedad del mildiu a una casa de malla sombra localizada en las instalaciones de la empresa Productores Orgánicos Del Cabo, en San José del Cabo, Baja California Sur, México a los (23° 05’ 36.39” LN, 109° 42’ 18.83” LO a 28 msnm) (CONAGUA 2014). San José del Cabo que se caracteriza por tener clima muy seco (Marco Geoestadístico Nacional 2020), temperatura media anual de 18 a 22°C y precipitación media anual de 200 mm (INEGI 2022).
Material vegetal
Para el experimento se utilizaron semillas de albahaca variedad Nufar (Vis Seed® Company Inc., Arcadia, CA, USA) susceptibles a P. belbahrii.
Diseño experimental y tratamientos
El experimento se realizó mediante un diseño completamente al azar con arreglo factorial con tres repeticiones por tratamiento. El primer factor consistió en tratamientos de temperatura a las semillas con cuatro niveles (40, 50 y 60°C) y el segundo factor fueron los tiempos de exposición de las semillas 30, 60 y 90 min. El grupo control estuvo representado por semillas sin tratamiento térmico a las que se les designó como semillas no tratadas, al mantenerlas a temperatura ambiente de 25 °C en el laboratorio de Fisiotecnia vegetal (ISTA 1996). Cada repetición estuvo representada por 10 semillas para un total de 30 semillas por tratamiento. Las semillas se sometieron a acondicionamiento térmico mediante la exposición a calor seco en un horno de secado de flujo laminar (Shel-Lab®, modelo FX-5, serie 1000203, USA).
Siembra de semillas, transplante e infección de plantas
Posterior a los tratamientos de calor, las semillas tratadas y no tratadas, se colocaron en charolas de poliestireno de 200 cavidades con sustrato comercial inerte (Sunshine® mix 3) y se regaron todos los días. Las charolas se colocaron en una casa de malla (modelo 1610 PME CR, con 40% de sombreo). Cuando las plántulas presentaron las primeras hojas verdaderas, se trasplantaron en bolsas negras de plástico para vivero con capacidad de 500 g, con sustrato comercial inerte (Sunshine®). Se aplicaron dos riegos por semana para mantener el sustrato a capacidad de campo, así como una fertilización por mes con Triple 17® (17-17-17 de nitrógeno, fósforo y potasio, respectivamente), utilizando 1 g de Triple 17® L−1 de agua y aplicando 1 mL planta−1. Quince días después del trasplante (ddt), las plantas se trasladaron a las instalaciones de los productores orgánicos en San José del Cabo, Baja California Sur y se colocaron en una casa de malla donde había presencia de Peronospora belbahrii en plántulas de albahaca de la variedad Nufar, asegurando con ello la infección natural en las plantas. Lo anterior, debido a que se realizaron pruebas previas de infección inducida con el patógeno sin la expresión de los síntomas de este. Durante la etapa de experimentación, la temperatura ambiental y la humedad relativa dentro de la casa de malla se registraron con un HOBO modelo UX100-003 (Onset Computer ® Corp., USA).
Evaluación de la enfermedad
La evaluación de la enfermedad se llevó a cabo mediante la determinación de la incidencia del mildiu velloso. Todos los días se realizaron inspecciones visuales de las plantas y una vez que presentaron síntomas de la enfermedad se obtuvo el número de plantas enfermas para cada tratamiento en relación con el total de plantas evaluadas. Las plantas se consideraron enfermas, cuando presentaban en sus hojas esporangióforos típicos del hongo, combinados con manchas cloróticas. Sesenta días después de la siembra (dds) se determinó la sobrevivencia del patógeno, mediante el conteo del número de hojas con esporulación en relación con el total de hojas por planta. Los resultados se expresaron como porcentaje de hojas infectadas. Con estos datos, se calculó el área bajo la curva del progreso de la enfermedad (ABCPE) de acuerdo con el método de Sharner y Finney (1977).
Análisis morfométrico y fisiológico en plantas de albahaca infectadas por P. belbahrii
Sesenta días después de la siembra (dds), se extrajeron cinco plantas por tratamiento para medir la longitud de la parte aérea y raíz (cm), peso fresco y seco (g) de raíces y parte aérea utilizando una báscula analítica (Mettler Toledo AG204) y un horno de flujo laminar a 70 °C (Shel-Lab®, FX-5, series 1000203) hasta alcanzar peso constante. Las variables fisiológicas se registraron a los 50 y 60 dds, cuando la planta se encontraba en su etapa vegetativa, mediante un analizador portátil de gas infrarrojo (IRGA) y un sistema de fotosíntesis portátil LCpro-SD con una cámara de amplificación de la hoja (ADC®, Hoddesdon, Herts, UK). Las variables registradas fueron la tasa fotosintética (A, µmol m−2 s−1), la transpiración (E, mmol m−2 s−1), la temperatura de la hoja (Th,°C), la conductividad estomática (g, mol m−2 s−1) y el contenido sub-estomático de carbono (Ci, µmol mol−1). Las variables se midieron a las 11:00 horas en la tercera hoja inferior del meristemo apical de cada planta, tratamiento y repetición, respectivamente. Posteriormente cada hoja se cosechó para cuantificar la clorofila a, b y total mediante la metodología de Bruinsma (1963) utilizando un espectrofotómetro (Beckman® Coulter, modelo 800).
Análisis estadísticos
Se realizaron análisis de varianza considerando un diseño completamente al azar con arreglo bifactorial y comparaciones múltiples de medias cuando se presentaron diferencias significativas (Tukey HSD, p = 0.05). Los valores de incidencia y sobrevivencia expresados en porcentaje, se transformaron mediante arcoseno (Little y Hills 1989, Steel y Torrie 1995). Con el fin de conocer la relación entre la temperatura ambiental y humedad relativa con la incidencia y sobrevivencia de la enfermedad, se analizaron los datos a través de un modelo de regresión lineal simple. Los análisis estadísticos se realizaron con el programa Statistica v. 10.0 para Windows (StatSoft® 2011).
Resultados
Las condiciones microclimáticas donde se establecieron las plántulas de albahaca presentaron una temperatura promedio durante el experimento de 29.93 ± 12.57 °C (Max = 52.95 °C/min 3.31 °C), con una humedad relativa de 38.46 ± 17.67% (Máx. 91.6%/mín. 23.4%). La temperatura promedio diurna disminuyó a 13 ± 3.89 °C (Máx = 22.09 °C/mín. 3.31 °C) y la humedad relativa fue de 68.92 ± 12.88% (Máx. = 89.3%/mín 34.5%). El mildiu velloso se detectó a los 12 días después del traslado a campo para su infección natural, es decir al día 23 después de la siembra (dds), como se muestra en la Figura 1. La temperatura incrementó progresivamente hasta 23.61°C, correspondiendo a la aparición de síntomas de la enfermedad. La mayor fluctuación de temperaturas se presentó entre el día 26 y 27 descendiendo de 23.4°C a 18.4°C. La humedad relativa se mantuvo estable con diferencia de dos unidades del valor más alto al más bajo registrado en los días de observación.
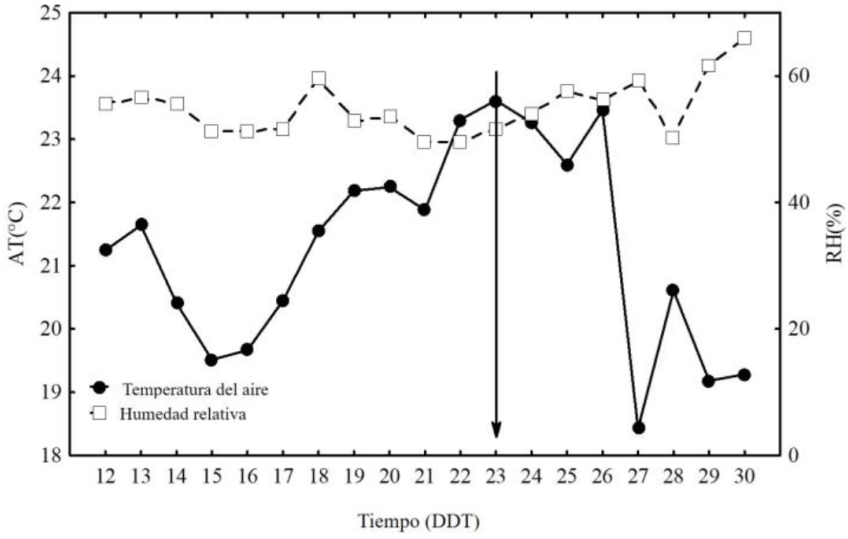
Figura 1 Temperatura ambiental (AT) y humedad relativa (HR)/día del microambiente con plantas de albahaca para la infección natural de mildiú. Las flechas indican el tiempo de aparición de síntomas.
La incidencia presentó diferencias significativas entre temperaturas (p ≤ 0.03), pero no entre tiempos (p ≥ 0.20) ni en la interacción de temperaturas x tiempos (p ≥ 0.50). Las plantas procedentes de semillas tratadas con 60 °C mostraron el porcentaje de incidencia menor respecto a las plantas cuyas semillas se trataron con 40, 50 °C y el grupo de semillas no tratadas (Tabla 1). La sobrevivencia del patógeno mostró diferencias significativas entre temperaturas (p ≤ 0.000014), pero no entre tiempos (p ≥ 0.78), ni en la interacción temperatura x tiempos (p ≥ 0.17). Las plantas cuyas semillas se sometieron a 60 °C mostraron un porcentaje menor de hojas infectadas; sin embargo, las plantas de semillas tratadas con 40 °C mostraron el porcentaje mayor de hojas infectadas, seguido por las plantas de semillas no tratadas (Tabla 1).
Tabla 1 Termoacondicionamiento sobre la incidencia y sobrevivencia P. belbahrii en albahaca.
| Temperaturas (°C) | Incidencia (%) | Sobrevivencia (%) |
|---|---|---|
| Semillas no tratadas | 90 a | 27.6 ab |
| 40 | 79.7 ab | 32.1 a |
| 50 | 82.6 ab | 26.1 bc |
| 60 | 70.8 b | 21.4 c |
*Medias dentro de columna con letras diferentes son diferentes según la prueba de Tukey (P < 0.05).
Quince días después de que las plantas se expusieron a la infección de P. belbahrii, las plantas procedentes de semillas no tratadas presentaron los primeros síntomas de amarillamiento y esporulación, al mostrar un 5% de incidencia, en las hojas superiores cercanas al meristemo apical de la planta. El progreso de la infección continuó principalmente en plantas de semillas no tratadas y en las plantas con semilla tratada con 40 °C. Las plantas procedentes de semillas tratadas con 60 °C en los tiempos de 30, 60 y 90 min de exposición mostraron el porcentaje de incidencia menor en cada evaluación realizada. Las plantas de semillas tratadas con 40 °C durante 90 min y 50 °C por 60 min redujeron el porcentaje de incidencia, pero fue mayor respecto a plantas de semillas tratadas con 60 °C expuestas a 30, 60 y 90 min (Figura 2).
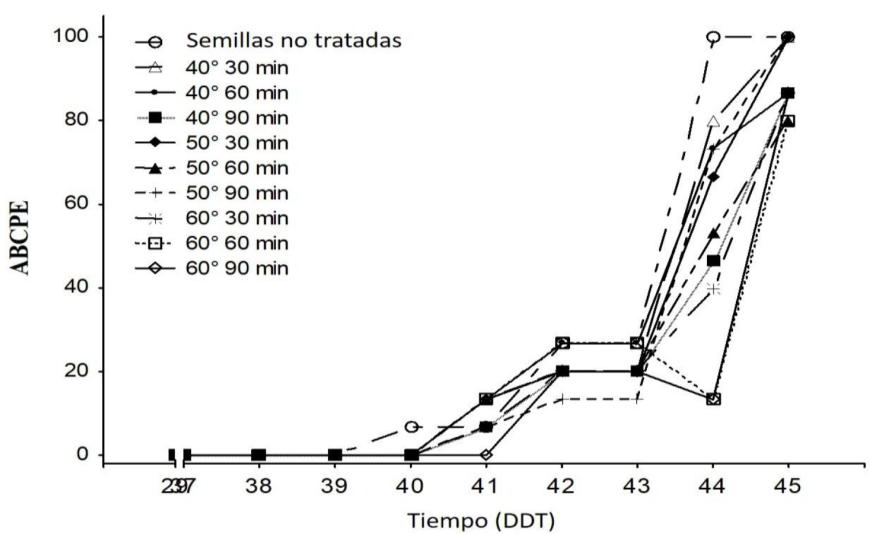
Figura 2 El área bajo la curve del progreso de la enfermedad (ABCPE) en plantas de albahaca infectadas naturalmente con Peronospora belbahrii de semillas no tratadas y plantas de semillas tratadas a 40, 50 y 60°C y tiempos de exposición de 30, 60 y 90 min.
Al analizar los datos de cada tratamiento de temperatura sin tomar en cuenta el factor tiempo, se observó una relación lineal significativa con la humedad relativa (Figuras 3a, b, c, d). Las plantas procedentes de semillas tratadas mostraron un aumento en la sobrevivencia, al incrementarse la humedad relativa; sin embargo, la magnitud con que aumentó es menor para las plantas de semillas sometidas a 60 °C (Figura 3a). La relación entre la sobrevivencia y la temperatura fue significativa para las plantas de semillas no tratadas y para el tratamiento de 40 °C en temperaturas entre 21 y 24 °C (Figura 3b). La respuesta de sobrevivencia del patógeno en plantas de semillas tratadas a 50 y 60 °C, no parece depender de la temperatura ambiente durante el tiempo de experimentación. La incidencia al igual que la sobrevivencia, presentaron una relación lineal con la humedad relativa, siendo de magnitud menor las plantas de semillas sometidas a 50 y 60 °C (Figura 3c). La relación de incidencia con la temperatura fue lineal para todos los tratamientos a excepción de 60 °C (Figura 3d). El pre-acondicionamiento de semillas de albahaca a diferentes temperaturas y tiempos permite determinar umbrales en los que la incidencia y la sobrevivencia del patógeno, fueron menores. Este umbral se detectó cuando las semillas se trataron con 60 °C independientemente de los tiempos a los cuales se expusieron.
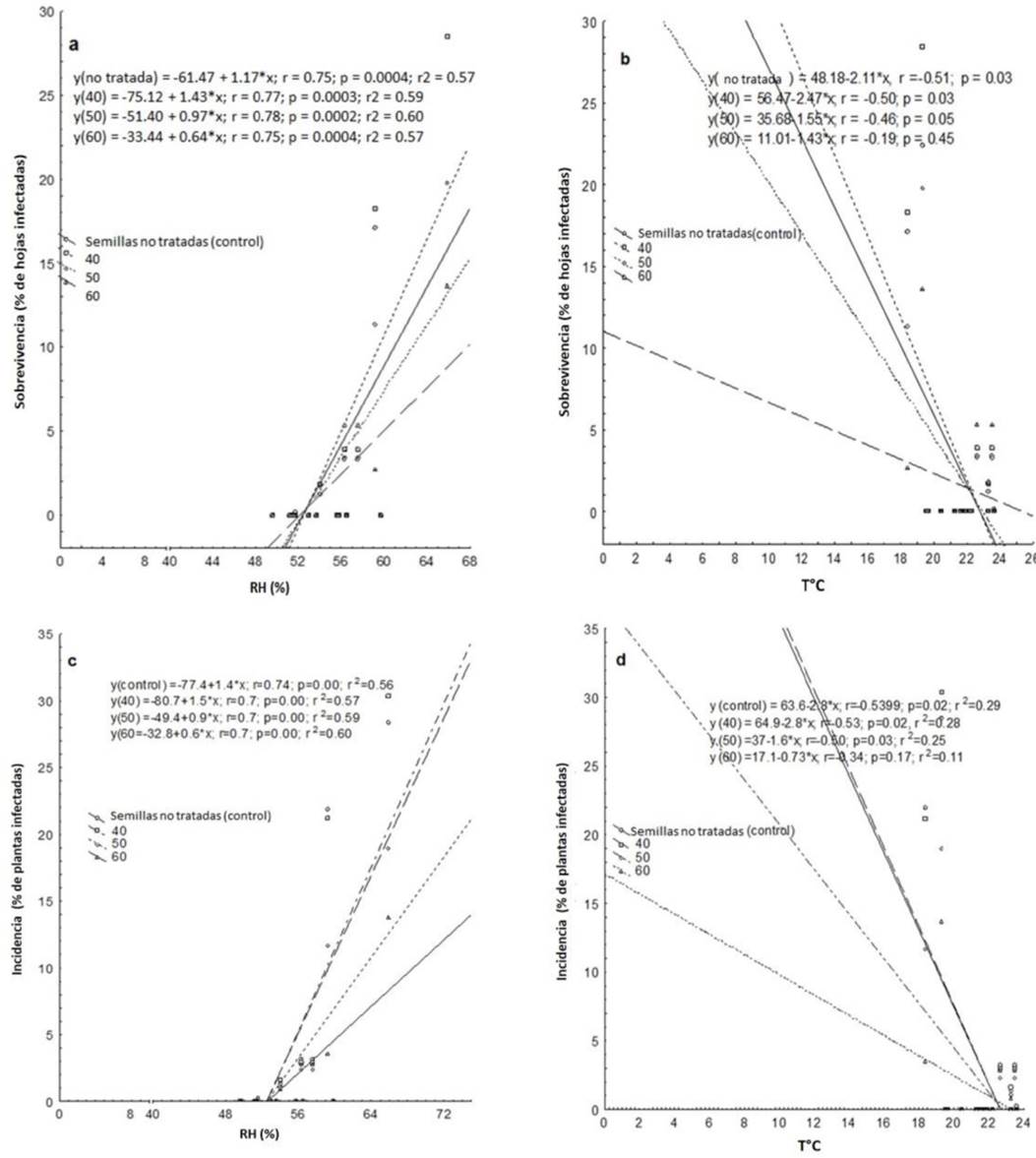
Figura 3 Relación entre la sobrevivencia del patógeno mildiu (hojas esporulantes a, b), incidencia (c, d) con la humedad relativa y la temperatura ambiental durante el tiempo experimental, en plantas de albahaca provenientes de semillas no tratadas y semillas tratadas con termoacondicionamiento a 40, 50 y 60° C.
Para la relación entre la temperatura ambiente y el porcentaje de hojas infectadas, se observó que éste último disminuyó con el aumento de la temperatura. Esta relación se observó significativamente en plantas de semillas no tratadas y tratadas a 40 °C. La tendencia observada fue igual en plantas de semillas tratadas con 50 y 60 °C; sin embargo, no fueron significativas lo que sugiere que el porcentaje de hojas infectadas es independiente de la temperatura ambiente y que además disminuye, debido al tratamiento de calor que recibe la semilla.
El peso fresco, seco y longitud de la parte aérea de la planta no presentaron diferencias significativas entre temperaturas, pero si entre tiempos y en la interacción temperaturas x tiempos (Tablas 2 y 3). Las diferencias en los tiempos de exposición corresponden a plantas de semillas cuya exposición fue de 90 min, observándose los valores menores, mientras que para los tiempos de 30 y 60 min los valores fueron significativamente altos (Tabla 2). En la interacción de los factores, las plantas de semillas no tratadas, seguidas por plantas procedentes de semillas tratadas con 60 °C y 60 min de exposición, presentaron los valores más altos de peso seco, fresco y longitud de la parte aérea, mientras que las plantas de semillas tratadas a 60 y 40 °C a 90 min y 50 °C a 60 min de exposición, disminuyeron los valores en esta variable (Tabla 3), demostrando que, la interacción de los factores en estudio es más evidente en la exposición de 90 min y produce un efecto negativo en el crecimiento.
Tabla 2 Efecto de variables morfométricas de albahaca a partir de semillas sometidas a termoacondicionamiento a diferentes intervalos de tiempo de exposición.
| Tiempo (min) | PSPA (g)** | PSR (g)** | PFPA (g)** | PFR (g)** | LPA (cm)* | LR (cm)* |
|---|---|---|---|---|---|---|
| 30 | 0.74 a | 0.48 a | 10.1 a | 5.4 a | 21.8 a | 24.15 a |
| 60 | 0.72 a | 0.50 a | 10 a | 6.1 a | 22.3 a | 24.42 a |
| 90 | 0.30 b | 0.19 b | 4.3 b | 2.3 b | 13.6 b | 14.9 b |
| P< | 0.001 | 0.001 | 0.00011 | 0.00011 | 0.001 | 0.00013 |
PSPA = Peso seco de la parte aérea, PSR = Peso seco de raíz, PFPA = Peso fresco de la parte aérea, PFR = Peso fresco de raíz, LPA = Longitud de parte aérea y LR = Longitud de raíz. * = significativo para p ≤ 0,05 ** = significativo para p ≤ 0,01. ns = no significativo. *Medias dentro de columna seguidas de letras diferentes son diferentes según la prueba de Tukey (P < 0.05).
Tabla 3 Variables morfométricas de albahaca sometidas a temperaturas y tiempos de exposición.
| Temperatura (°C) | Tiempo (min) | PSPA (g)** | PSR (g)** | PFPA (g)** | PFR (g)** | LPA (cm)* | LR (cm)* |
|---|---|---|---|---|---|---|---|
| Semillas no tratadas | 1 a | 0.5 a | 13 a | 7 a | 27 a | 28 a | |
| 40 | 30 | 0.7 ab | 0.2 a | 10 ab | 5 a | 22 abc | 25 ab |
| 60 | 0.7 ab | 0.9 a | 8 ab | 4 a | 19 a−d | 26 ab | |
| 90 | 0.2 b | 0.7 a | 4 b | 1 a | 11 de | 8 c | |
| 50 | 30 | 0.4 ab | 0.8 a | 7 ab | 3 a | 17 b−e | 20 abc |
| 60 | 0.3 ab | 0.8 a | 5 b | 3 a | 17 bcd | 18 abc | |
| 90 | 0.4 ab | 0.8 a | 6 b | 3 a | 20 abc | 21 ab | |
| 60 | 30 | 0.6 ab | 0.9 a | 9 ab | 6 a | 20 a−d | 25 ab |
| 60 | 0.7 ab | 1 a | 13 a | 8 a | 25 ab | 26 a | |
| 90 | 0.2 b | 0.8 a | 4 b | 2 a | 14 cde | 14 bc |
PSPA = Peso seco de la parte aérea, PSR = Peso seco de raíz, PFPA = Peso fresco de la parte aérea, PFR = Peso fresco de raíz, LPA = Longitud de parte aérea y LR = Longitud de raíz. * = significativo para p ≤ 0,05 ** = significativo para p ≤ 0,01. ns = no significativo. *Medias dentro de columna seguidas de letras diferentes son diferentes según la prueba de Tukey (P < 0.05).
El peso fresco y seco de raíz tuvo diferencias significativas entre temperaturas y tiempos (Tabla 2), pero no en la interacción temperaturas x tiempos (Tabla 3). Las plantas procedentes de semillas no tratadas y aquellas derivadas de semilla tratada a 60 °C incrementaron el peso seco de raíz, mientras que las procedentes de semilla tratada con 40 y 50 °C mostraron lo contrario (Tabla 3). Las diferencias en los tiempos de exposición corresponden a plantas de semillas cuya exposición fue de 90 min, observándose los valores más bajos, mientras que para 30 y 60 min los valores fueron significativamente más altos (Tabla 2). La longitud de raíz no exhibió diferencias significativas entre temperaturas (p ≥ 0.07) pero si entre tiempos (p ≤ 0.00013) y en la interacción temperaturas x tiempos (p ≤ 0.003). En los tiempos de exposición, la longitud de raíz fue mayor en plantas cuya semilla se expuso a 30 y 60 min (Tabla 2). Los resultados indican que a 90 min de exposición, independientemente de la temperatura, causó un efecto negativo en la morfometría de las plantas, disminuyendo el peso seco, fresco y longitud de raíz y parte aérea de la planta. Al comparar los tratamientos de calor y tiempo como interacción no se presenta una diferencia en las variables morfométricas con respecto al grupo de semillas sin tratar.
Las condiciones climáticas y microclimáticas en la aparición de los síntomas de la enfermedad del mildiu son relevantes y es preciso determinar la relación de variables fisiológicas con la presencia de enfermedad.
Para la temperatura, muestreo x temperatura, temperatura x tiempo y en la interacción muestreo x temperatura x tiempo se encontraron diferencias estadísticas. La temperatura de la hoja fue mayor en las plantas de semillas sometidas a 60 °C. Para el análisis de los factores muestreo y temperatura se observó que la diferencia mayor correspondió a una temperatura más alta en plantas no tratadas en el segundo muestreo con respecto a plantas de semillas tratadas a 40 °C en el segundo muestreo. La interacción de la temperatura y tiempo mostró que la temperatura de la hoja fue mayor a las plantas de semillas tratadas con 60 °C independientemente del tiempo de exposición. En la interacción de los factores la temperatura de la hoja mostró diferencias mayores en las plantas de semillas tratadas con 60 °C a los 30, 60 y 90 minutos de exposición, siendo mayor para el primer muestreo que para el segundo muestreo (Tabla 4).
Tabla 4 Variables fisiológicas de albahaca tratadas a temperaturas y tiempo de exposición.
| T (°C) | Tiempo (min) | TH (°C) | A* (µmol m −2 s −1 ) | g (mol m−2 s−1) | E (mmol m−2 s−1) | Ci* (µmol mol −1 ) | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| MUESTRA | MUESTRA | MUESTRA | MUESTRA | MUESTRA | |||||||
| 1 | 2 | 1 | 2 | 1 | 2 | 1 | 2 | 1 | 2 | ||
| No tratada | No tratada | 30 e−h | 30 c−h | 8 a | 6.5 a−c | 0.2 ns | 0.15 ns | 4 ns | 3 ns | 303 b−d | 292 b−d |
| 30 | 60 | 30 c−h | 30 h | 8 ab | 3.6 c−e | 0.2 ns | 0.09 ns | 4 ns | 2 ns | 306 b−d | 299 b−d |
| 30 | 90 | 30 e−h | 30.7 b−e | 1.5 d−f | 3 c−e | 0.1 ns | 0.10 ns | 3 ns | 3 ns | 363 a−c | 338 b−d |
| 40 | 30 | 30 d−h | 30.8 a−c | 5 a−d | 5 a−d | 0.2 ns | 0.08 ns | 3 ns | 2 ns | 325 b−d | 265 d |
| 40 | 60 | 30 c−h | 30.7 b−e | 4 b−e | 3 c−e | 0.2 ns | 0.08 ns | 3 ns | 2 ns | 338 b−d | 306 b−d |
| 40 | 90 | 30 c−h | 30 fgh | 1.8 de | 1.7 de | 0.1 ns | 0.06 ns | 3 ns | 2 ns | 364 a−c | 328 b−d |
| 50 | 30 | 30 c−h | 30.7 b−e | 4.4 a−e | 3.7 c−e | 0.1 ns | 0.10 ns | 3 ns | 3 ns | 337 b−d | 307 b−d |
| 50 | 60 | 30.5 b−g | 30.7 b−e | 2 de | 3.5 c−e | 0.1 ns | 0.07 ns | 3 ns | 2 ns | 365 a−c | 285 cd |
| 50 | 90 | 30 c−h | 30 c−h | 1.5 d−f | 1.4 d−f | 0.1 ns | 0.07 ns | 2.5 ns | 2 ns | 365 a−c | 341 b−d |
| 60 | 30 | 31.5 a | 30 hg | 4 b−e | 1.7 d−f | 0.1 ns | 0.06 ns | 2.5 ns | 2 ns | 311 b−d | 327 b−d |
| 60 | 60 | 31 ab | 30.5 b−g | 1.5 d−f | 2 f | 0.2 ns | 0.04 ns | 3 ns | 2 ns | 381 ab | 455 a |
| 60 | 90 | 31 b−d | 30.7 b−e | 0.9 ef | 3 c−e | 0.1 ns | 0.05 ns | 2 ns | 2 ns | 380 a−c | 290 b−d |
TH = Temperatura de la hoja, A = Tasa de fotosíntesis, g = conductancia estomática, E = transpiración, Ci = contenido de carbono subestomatico. * *Medias dentro de columna seguidas de letras diferentes son diferentes según la prueba de Tukey (P < 0.05).
La tasa fotosintética presentó diferencias entre los muestreos, temperaturas, tiempos, muestreos x tiempos, temperaturas x tiempos, muestreos x temperaturas x tiempos. La tasa fotosintética fue mayor en la primera evaluación, mientras que en plantas de semillas tratadas con 60 °C fue menor comparada con el resto de los tratamientos y las semillas no tratadas (Tabla 4). Las plantas de semillas expuestas a 90 minutos presentaron una A menor. Al considerar la interacción muestreos x tiempos, la A disminuyó en las plantas de semillas expuestas a 90 min en los dos muestreos, comparado con las semillas no tratadas, al presentar una A mayor en el primer muestreo con respecto al segundo. La A se incrementó en plantas de semillas no tratadas disminuyendo en valor del primer muestreo con respecto al segundo muestreo. La A disminuyó en las plantas de semillas expuestas a 60 °C durante 60 y 90 minutos (Tabla 4). Dentro de los efectos de los tratamientos de preacondicionamiento con calor de las semillas está la estimulación metabólica lo que se puede traducir en un incremento en la fotosíntesis, sin embargo, cada planta puede presentar diferentes umbrales en esta estimulación. En este caso fue claro que plantas cuyas semillas se trataron a los 60 °C no presentaron un incremento en A, por lo que sugiere un umbral de estas plantas.
La E presentó diferencias significativas entre los muestreos, temperaturas, tiempos y la interacción muestreos x tiempos. La E disminuyó en las plantas de semillas tratadas con 60 °C e incrementó en las plantas de semillas sin tratar (Tabla 3). La E fue mayor en plantas de semillas tratadas durante 30 min; pero disminuyó conforme el tiempo de exposición se incrementó a 90 min. La E se incrementó en el primer muestreo en las plantas de semillas expuestas a 60 min y a 30 min en el segundo muestreo (Tabla 4). Las diferencias de la E parecen deberse más probablemente a otro factor que al preacondicionamiento de las semillas con temperatura.
La g presentó diferencias significativas entre muestreos, temperaturas, tiempos y muestreos x tiempos. La g fue mayor en el primer muestreo con respecto al segundo muestreo (Tabla 4). Las plantas de semillas sometidas a 60 °C presentaron una g menor y las de semillas no tratadas incrementaron la g. Las plantas de semillas expuestas a 30 min incrementaron la g y lo contrario ocurrió con las semillas expuestas 90 min. En el primer muestreo las plantas de semillas expuestas a 60 min presentaron una g mayor pero esta disminuyó en el segundo muestreo (Tabla 4).
El contenido de carbono subestomático presentó diferencias entre los factores estudiados y en la interacción. Las plantas procedentes de semillas tratadas a 50 y 60 °C presentaron un contenido mayor de carbono subestomático con respecto al grupo control (Tabla 4). El contenido de carbono subestomático se incrementó en las plantas de semillas expuestas a 90 min y lo contrario correspondió al grupo control. El Ci se incrementó en las plantas cuya semilla se trató durante 30 y 60 min, mientras que los valores menores lo presentaron las de semillas no tratadas. En el segundo muestreo la respuesta fue similar para las plantas de semillas tratadas a 60 °C con un incremento del Ci en plantas expuestas a 90 min (Tabla 4).
Ninguna de estas variables mostró diferencias significativas entre temperaturas, tiempos, ni en la interacción temperaturas x tiempos, donde se observó que estas presentaron un nivel de significancia superior a la p > 0.05 de probabilidad (Tabla 5). Las diferencias obtenidas en las variables fisiológicas permitieron observar que las plantas del tratamiento a 60°C tuvieron un cierre estomático parcial, mismo que se vio reflejado en las dos mediciones realizadas antes y después de haberse presentado la sintomatología de la enfermedad, donde esto, consecuentemente repercutió en una disminución de su tasa fotosintética.
Tabla 5 Efecto de temperatura en la clorofila a, b y total de albahaca infectada con P. belbahrii.
| Temperatura (°C) | Ca (µg cm−2) ns | Cb (µg cm−2) ns | Ctot (µg cm−2) ns |
|---|---|---|---|
| Semillas no tratadas | 22 a | 6.6 a | 29 a |
| 40 | 25 a | 7 a | 33 a |
| 50 | 23 a | 7 a | 33 a |
| 60 | 22 a | 7 a | 29 a |
| Nivel de significancia | p ≥ 0.05 | p ≥ 0.05 | p ≥ 0.05 |
Ca = clorofila a, Cb = clorofila b, Ctot = clorofila total, ns = no significativo. La misma letra en las columnas indica que no hay diferencias significativas.
Discusión
La búsqueda de soluciones a los efectos de la enfermedad del mildiu velloso, se ha incrementado en la última década, debido a las pérdidas económicas que ésta enfermedad produce para el cultivo de albahaca. Estas soluciones serán acertadas en la medida que se conozca la relación que guarda el hongo y la aparición de la sintomatología de la enfermedad con su medio ambiente y la respuesta de su huésped. El pre-acondicionamiento de semillas, ha sido un tema de estudio a través del cual, se conoce la respuesta de la planta ante enfermedades provocadas por patógenos, al mismo tiempo permite identificar aquellos tratamientos que mejoran la respuesta y el desarrollo de la planta (Chandra et al. 2010). La ventaja es que estos métodos son económicos, fácilmente aplicables, además, diversifican las posibilidades de control en una agricultura que se desea amigable con el ambiente, especialmente aquella cuya normatividad debe ser cumplida, como lo es el caso de la agricultura orgánica certificada. Este pre-acondicionamiento de semillas de albahaca a diferentes temperaturas y tiempos permitió determinar umbrales en los que la incidencia y la sobrevivencia del patógeno, fue menor. Dicho umbral, se detectó cuando las semillas fueron tratadas a 60°C independientemente de los tiempos a los cuales se expusieron. Estos resultados coinciden con lo encontrado por Gilardi et al. (2015) quienes observan que el tratamiento de calor, es uno de los más efectivos para el control de la posible infección de la semilla, que consecuentemente puede tener relevancia en una disminución en la presencia de la enfermedad en la planta (Niranjan et al. 2004). Asi mismo, estudios realizados por Bänziger et al. (2022) en plantas de avena, confirmaron que, al someter semillas a un pretratamiento con agua caliente, disminuyó la enfermedad por Microdochium spp. de acuerdo a Garibalbi et al. (2004), la enfermedad del mildiu requiere temperaturas medias (20°C) para desarrollarse y se inhibe con temperaturas altas y bajas (25, 27 y 30°C). En este trabajo, las temperaturas medias presentadas hasta los 11 días antes de la aparición de los síntomas de la enfermedad, se encontraron entre los rangos que Garibalbi et al. (2004), describen. Para la relación entre la temperatura ambiente y el porcentaje de hojas, se observó que éste último disminuyó con el aumento de la temperatura. Esta relación se observó en plantas de semillas no tratadas y las tratadas a 40°C. Aunque la tendencia se observa igual en plantas tratadas a 50 y 60°C, la no significancia sugiere que el porcentaje de hojas infectadas se vuelve independiente de la temperatura ambiente y que además disminuye, debido al tratamiento de calor de la semilla. Al respecto, Thakur et al. (2020) mencionan, que esto se puede deber a que los tratamientos de calor en semillas, han sido reportados como estimulantes en los procesos bioquímicos como la sobreproducción de azúcares y proteínas, dentro de los cuales, algunos se relacionan como precursores de compuestos con acción de señalización para contrarrestar factores causantes de estrés como la infección de patógenos y de esta manera, regular de forma efectiva su sistema fisiológico sin sufrir daño en su metabolismo (Pal et al. 2015, Qu et al. 2020). Los resultados indican que un tiempo de 90 minutos independientemente de los tratamientos con temperatura, causó un efecto negativo en las variables morfométricas, disminuyendo el peso seco, fresco y longitud de raíz y parte aérea de la planta. Cuando se comparan los tratamientos de calor y tiempo como interacción no se refleja una diferencia en las variables morfométricas con respecto al grupo de semillas sin tratar. De acuerdo a lo reportado por Van et al. (2006)) y López-Sánchez et al. (2021), señalan que estos caracteres morfométricos se reducen durante la activación directa de la defensa de la planta, debido a un costo ecológico de ésta, una exposición a 90 min independientemente de los tratamientos de temperatura, representó un umbral en donde se afectan los caracteres morfométricos. Para los tratamientos de temperaturas, se observó que las variables morfométricas no se afectaron, probablemente debido a algún proceso de regulación que la planta pueda activar para inhibir el daño del patógeno (Perez y Lehner 2019). Al respecto, Pal et al. (2015), mencionan que es probable que el daño por el patógeno se minimice por el acondicionamiento de la misma planta, ya que una sobreexpresión de proteínas relacionadas al metabolismo de la glucosa sugiere que el acondicionamiento de la semilla asegura la protección de la planta contra enfermedades sin comprometer su crecimiento y desarrollo normal. Otra de las respuestas de la planta para mantener su crecimiento y desarrollo aun enfrentando un estrés ocasionado por un patógeno, se logra a través del ajuste de estrategias fisiológicas (Maroufi et al. 2011). En el presente estudio, las diferencias obtenidas en las variables fisiológicas permitieron observar que las plantas del tratamiento a 60°C tuvieron un cierre estomático parcial, mismo que se vio reflejado en las dos mediciones realizadas antes y después de haberse presentado la sintomatología de la enfermedad, donde esto, consecuentemente repercutió en una disminución de su tasa fotosintética. También se observó que el contenido de carbono sub-estomático en este tratamiento de 60°C, también fue el mayor comparado con el resto de los tratamientos y el grupo de semillas sin tratar. Este mecanismo es descrito por Wall et al. (2011) en alfalfa, quienes explican que cantidades elevadas de CO2 inducen una acumulación de carbohidratos no estructurales en el tejido de la hoja que causa una limitación no estomática, sino más bien una inhibición bioquímica transitoria basada en la capacidad fotosintética. Así mismo, Zheng et al. (2019) señalan que una concentración elevada de CO2 induce la regulación a la baja de la fotosíntesis con cambios en la estructura de la hoja, los carbohidratos no estructurales y el contenido de nitrógeno de la soja. Por lo que, aun a bajas tasas fotosintéticas, la planta mantiene el crecimiento y desarrollo de los órganos (raíz, tallo y hojas), a través de conservar el contenido de carbón sub-estomático como materia prima (Mahatma et al. 2009). El cierre parcial de estomas, explica también la mayor temperatura de la hoja y la menor transpiración con respecto a las plantas sin tratar y el resto de los tratamientos. La relación de estas variables fisiológicas se evidenció también en el grupo de plantas sin tratar presentaron los mayores valores de tasa fotosintética, transpiración y apertura estomática. Estas relaciones entre las variables fisiológicas han sido explicadas por Raven y Griffiths (2015) y por Yong-Jiang (2017), quienes explican que el cierre estomático regula la pérdida de agua disminuyendo la transpiración, con el costo que implica la limitación del intercambio gaseoso y por lo tanto una disminución de la fotosíntesis. Por otro lado, los resultados de este trabajo nos llevan a formular la hipótesis de la posible relación entre el tratamiento de calor a 60°C, donde se obtuvo un menor porcentaje de hojas y plantas infectadas, y el cierre estomático como una limitante en la emergencia de esporangióforos a través de los estomas. Por lo tanto, la expresión de la sintomatología de la enfermedad disminuye probablemente por la disminución de la emergencia de los esporangióforos. Al respecto Driesen et al. (2020), menciona que la apertura de los estomas puede ser afectado por varios factores, entre éstos la temperatura y el viento, los cuales indirectamente afectan la emergencia de los esporangioforos, lo que limita la esporulación y diseminación del patógeno (Su et al. 2004).
Conclusiones
El tratamiento más efectivo para disminuir la incidencia y severidad de los síntomas de la enfermedad causada por Peronospora belbahrii fue 60 °C por 30 y 60 min de exposición. Se encontró relación entre severidad e incidencia con la humedad relativa en todos los tratamientos de temperatura y con la temperatura ambiental, excepto para las semillas tratadas a 60 °C en el caso de este último. Los resultados proponen la hipótesis de la relación entre el tratamiento térmico a 60 °C, el cierre estomático y un porcentaje menor de hojas y plantas infectadas como consecuencia de una limitación de la emergencia de esporangiofros a través de los estomas.











 nueva página del texto (beta)
nueva página del texto (beta)



