Introducción
En la costa del Pacífico mexicano, la producción de ostras se concentra principalmente en cinco especies, cuatro nativas (Crassostrea virginica, C. rhizophorae, Ostrea equestris en el Golfo de México y mar caribe, y C. corteziensis en el Pacífico mexicano) y una introducida (C. gigas originaria de Japón y Corea), y en menor medida se capturan Striostrea prismática y Saccostrea palmula (Ríos-González et al. 2018). En 2018 la producción nacional de ostión fue de 53 443 toneladas de las cuales 42 107 t (78.7%) provienen de acuacultura y 11 336 t (21.3%) son de captura. En la costa del Pacífico mexicano, Nayarit es el principal productor de ostras alcanzando una producción de 5 736 t, lo que significa casi el 43.3% de la producción de esta costa en 2018 (SAGARPA 2018). Los reportes nacionales de producción de ostión, en el Pacífico mexicano se basan en tres especies principales, Crassostrea gigas (Thunberg 1793), C. corteziensis (Hertlein 1951) y Striostrea prismática (INAPESCA 2018). Pero en dichos informes de producción no se reporta la producción de cada especie y la fuente de obtención, es decir, si se capturan en el medio silvestre o se cultivan. No obstante, la producción del ostión de roca en Nayarit y en el Pacífico Mexicano se basa en las capturas (Ríos-González et al. 2018). De acuerdo con Lodeiros et al. (2020), el ostión de roca es una de las de especies de ostras más abundantes en los sistemas rocosos costeros y en la mayoría de los casos puede proporcionar la mayor biomasa pesquera de este grupo. La pesquería de esta especie es ribereña y se realiza a lo largo de todo el Pacífico mexicano y en algunas zonas representa uno de los principales recursos capturados por las sociedades cooperativas de producción pesqueras, alcanzado elevada derrama económica como sucede en Acapulco, Guerrero (Sánchez-Telumbre et al. 2021). Por lo que se considera que esta especie tiene gran potencial de cultivo, y en ese sentido algunos trabajos se han enfocado en el control de la reproducción y la producción de juveniles bajo condiciones controladas, además, del cultivo en sistemas suspendidos (Robles et al. 2020, Rodríguez Pesantes et al. 2022).
A finales de la década de los 70´s la explotación del ostión de roca soportaba altos volúmenes de capturas frente a las costas de Nayarit (Cuevas-Guevara y Martínez-Guerrero 1978). De acuerdo con Patiño Valencia et al. (2006), este recurso presenta un declive poblacional en la zona, el cual determinaron con datos de captura y talla de los organismos. A pesar de no contar con datos precisos sobre la presión pesquera sobre esta especie, su escasa presencia en lugares donde era común encontrarlas, y el pequeño tamaño de los ejemplares extraídos hacen pensar que se ha superado la capacidad de explotación natural (Patiño Valencia y Ulloa- Ramírez 2008) Se sabe que para el manejo de los recursos pesqueros se requiere el conocimiento y la integración de factores socioeconómicos, biológicos y ecológicos (Seijo y Defeo 1997). En ese sentido, es imprescindible conocer los aspectos reproductivos de algunas especies sujetas a explotación, y esto será un indicador de su continua producción y por ende de su disponibilidad para ser explotadas. En cuanto a la reproducción de esta especie, se ha documentado que son gonocóricos y los machos suelen ser de menor tamaño, lo que sugiere una característica común del hermafroditismo protándrico (Lodeiros et al. 2020). Además, se ha reportado que factores como la temperatura y salinidad influyen en el desove (Loor y Sonnenholzner 2016, Robles et al. 2020), lo que se refleja en el hecho que el evento reproduc- tivo se presente en diferente época de acuerdo a la zona. Por ejemplo, en Sinaloa el desove es de mayo a agosto (Zarain-Hersberg y Villalobos-Fernández 2012), mientras que en Michoacán es de agosto a septiembre (Meléndez-Galicia et al. 2015), poniendo en evidencia que el ostión de roca puede adaptarse a distintas condiciones ambientales, por lo que es necesario determinar la biología reproductiva para cada zona. Por esa razón y dada la importancia del ostión de roca en la región, el objetivo de este estudio fue determinar la biología reproductiva del ostión de roca S. prismatica y su relación con la temperatura y la clorofila-a, con el fin de proporcionar información básica de esta especie de importancia comercial.
Materiales y métodos
Sitio de muestreo y obtención de muestras
Se obtuvieron ostiones provenientes de la pesca comercial, tratando de incluir todas las tallas posibles, de los bancos que existen en el área rocosa en Santa Cruz de Miramar, Nayarit (Oeste de México), que es una playa semi-protegida dentro de la Bahía de Matanchén, San Blas, localizada en los 22° 26 ’ LN y 105° 12’ LO, cerca del desembocadura del río Naranjo. El clima local es cálido sub- húmedo con lluvias en verano e invierno menores de 5 mm con temperatura media anual de 24 °C. La temperatura media de la superficie se estima entre 22 y 30 °C. El rango medio de las mareas primaverales es de 0.98 m y el promedio es de 0.70 m, las mareas son semi-diurnas mixtas (González et al. 2009).
Se realizaron muestreos mensuales aleatorios de enero a diciembre, tomando alrededor de60 organismos por mes. Los ostiones se transportaron en hieleras al laboratorio, para luego lavar- los y cepillarlos para eliminar los epibiontes, mientras que se registraron las medidas (ancho, longitud, altura) y el peso total de cada uno. Para luego desconcharlos y pesar el tejido fresco, 30 organismos se secaron en estufa (65 °C por 48 h). El resto de los organismos, alrededor de 30 organismos por mes, se fijaron en formalina al 10% preparada con agua de mar filtrada, para el posterior análisis histológicos.
Factores ambientales
Para estimar la temperatura superficial del mar (TSM) se obtuvieron imágenes de satélite mensuales de la zona costera de la Bahía de Matanchén, para lo cual se utilizó una composición de los sensores MODIS-Terra y MODIS-Aqua. Para estimar la concentración de clorofila se utilizaron imágenes mensuales, de los sensores MODIS-Terra, Aqua MODIS y VIIRS. Todas las imágenes fueron proporcionadas por Scripps, Universidad de California, San Diego, con una resolución de 1 km. La gestión, el análisis y la extracción de datos de imágenes se realizó con el software Windows Image Manager (WIM), Wim- Soft versión 9.06 Copyright Mati Kahru 1991-2015. Para establecer la eficiencia de los datos obtenidos a través de sensores remotos, se realizó una comparación de datos tomados in situ y de las imágenes satelitales tomadas de las fechas exactas, en función de que no se observaron diferencias significativas (± 0.5°C) entre dichos datos y que estas estimaciones siguen la misma tendencia, se consideró que los datos pueden ser usados como buenos indicadores del comportamiento de las variables en la zona.
Proporción sexual.
El sexo de cada organismo se determinó mediante un examen microscópico del tejido gonadal. La proporción de sexos se estimó dividiendo el número de hembras entre el número de machos. Se aplicó una prueba de Chi-cuadrada (χ2) para determinar si la proporción de sexos difería de 1: 1 (Zar 2010).
Índice de condición
El índice de condición (IC) se calculó como la proporción de peso del tejido seco (PTS) con respecto al peso de la concha seca (PCS) mediante la fórmula: IC = w1 x 1,000 / w2. Donde w1 es el PTS y w2 es el PCS, como lo describen Walne y Mann (1975). Además, la relación entre el peso seco y húmedo del tejido (Ps/Ph) se utilizó como método para estimar la condición, como lo propuso Fournier (1992). Para obtener el tejido y concha seca, estas estructuras se colocaron en la estufa de secado a temperatura de 65°C por 48 horas.
Ciclo reproductivo
Para determinar el ciclo reproductivo se utilizaron alrededor de 30 ostiones previamente fijados en formalina, de los cuales se obtuvieron cortes transversales de 5 mm de espesor de la masa visceral posterior (entre la cavidad pericárdica y la glándula digestiva), se colocaron en casetes para histología. Para luego deshidratar en una serie graduada de soluciones de etanol, aclarar en xileno e incluir en parafina en un procesador de tejidos (Thermo Scientific Shandon Excelsior; Thermo Scientific, Alemania). Después, los bloques de para- fina se cortaron a un grosor de 4 µm en un microtomo motorizado automático (HM355S, Thermo Scientific Microm, Alemania), y montar los cortes en portaobjetos para teñirlos con hematoxilina-eosina para su análisis. Las imágenes de los cortes histológicos se tomaron con un microscopio unido a una cámara serie Motic B2. Para determinar el desarrollo gonadal se clasificó en cinco fases: indiferenciado, desarrollo, maduro, desove y post-desove (George- Zamora et al. 2003). Basado en Mazón-Suastegui et al. (2011), se consideró el período de la temporada en la Tabla 1. La temperatura superficial del mar varió entre 25.5 °C (marzo) y 30.6 °C (julio y agosto). Mientras que la concentración de clorofila-a varió entre 0.96 (junio) y 3.17 µg L−1 (abril). Tabla 1. Valores promedio de temperatura (Temp) y clorofila a (Chl-a) estimados a través de sensores remotos, durante enero a diciembre de 2014 en Santa Cruz de Miramar, Nayarit, México. de reproducción cuando las hembras se encontraban en fase madura y de desove.
Tabla 1 Valores promedio de temperatura (Temp) y clorofila a (Chl-a) estimados a través de sensores remotos, durante enero a diciembre de 2014 en Santa Cruz de Miramar, Nayarit,
| Mes | Temp (°C) | Chl-a (µg.L−1) |
|---|---|---|
| Enero | 25.7 | 1.35 |
| Febrero | 25.8 | 2.25 |
| Marzo | 25.5 | 2.61 |
| Abril | 25.8 | 3.17 |
| Mayo | 27.6 | 3.02 |
| Junio | 30.1 | 0.96 |
| Julio | 30.6 | 1.83 |
| Agosto | 30.6 | 2.87 |
| Septiembre | 29.9 | 3.06 |
| Octubre | 30.1 | 2.16 |
| Noviembre | 28.3 | 1.83 |
| Diciembre | 26.4 | 1.43 |
Talla de primera madurez
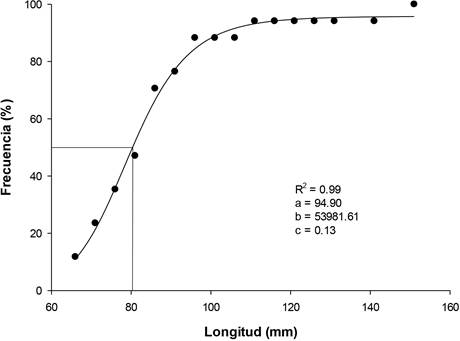
Se ajustó una curva logística a los datos para estimar la longitud a la que el 50% de los individuos eran sexualmente maduros. Para obtener la talla de madurez, se consideraron solo los organismos que se encontraban en etapa de maduración y desove (Mena-Alcántar et al. 2017). Se calculó la frecuencia relativa y la longitud acumulada del intervalo de frecuencia (5 mm). Ajustando el modelo logístico de la siguiente manera:
Dónde: M% = porcentaje de organismos maduros, a = intersección, b = pendiente, c = constante y L = longitud total.
Análisis estadístico
Se evaluó si la proporción de sexos esperada de 1: 1 es diferente estadísticamente, mediante una prueba de Chi-cuadrada. Para determinar la asociación de cada fase del ciclo reproductivo (frecuencia relativa) con los factores ambientales, se aplicó un análisis de correlación de Spearman. El análisis estadístico se realizó con el software Statistica 7.1 (StatSoft), considerando la significancia estadística de p < 0.05.
Resultados
Factores ambientales
Los parámetros ambientales estimados durante el período de muestreo del estudio se muestran en la Tabla 1. La temperatura superficial del mar varió entre 25.5 °C (marzo) y 30.6 °C (julio y agosto). Mientras que la concentración de clorofila-a varió entre 0.96 (junio) y 3.17 µg L−1 (abril).
Proporción de sexos
Se muestrearon 322 ostiones de roca, la longitud osciló entre 14 y 150 mm. En la mayoría de los meses (excepto de mayo a septiembre) predominaron organismos en estadio indiferenciado (Tabla 2). En la proporción sexual predominaron los machos de marzo a septiembre. En marzo solo se encontraron machos, que es el único mes en el que la relación fue diferente de 1: 1 (χ2 = 8.0, p = 0.04). Mientras que en noviembre se observó una proporción similar de machos y hembras. La proporción sexual general fue 1M: 0.6H, que según la prueba de independencia χ2 es diferente de 1: 1 (χ2 = 8.5 y p = 0.03).
Tabla 2 Número de hembras (H), machos (M) y organismos indiferenciados (I) de ostiones de roca Striostrea prismarica en Santa Cruz de Miramar, Nayarit, México (Ene-Dic / 2014).
| Mes | M | H | I | M:H | χ2 | P |
|---|---|---|---|---|---|---|
| Enero | 0 | 0 | 26 | - | 0 | 1.00 |
| Febrero | 0 | 0 | 28 | - | 0 | 1.00 |
| Marzo | 8 | 0 | 28 | 1:0.0 | 8.00 | 0.004* |
| Abril | 6 | 2 | 18 | 1:0.3 | 2.00 | 0.157 |
| Mayo | 14 | 10 | 6 | 1:0.7 | 0.67 | 0.413 |
| Junio | 14 | 6 | 8 | 1:0.4 | 3.20 | 0.073 |
| Julio | 16 | 12 | 0 | 1:0.8 | 0.57 | 0.450 |
| Agosto | 14 | 11 | 0 | 1:0.8 | 0.36 | 0.548 |
| Septiembre | 10 | 7 | 2 | 1:0.7 | 0.53 | 0.466 |
| Octubre | 0 | 0 | 32 | - | 0 | 1.00 |
| Noviembre | 3 | 3 | 18 | 1:1 | 0 | 1.00 |
| Diciembre | 0 | 0 | 20 | - | 0 | 1.00 |
* Indica diferencias significativas (p < 0.05).
Índice de condición
El IC y la relación Ps/Ph mostraron el mismo patrón, ya que ambos fueron bajos de enero a marzo (IC = 17.5-19.9 y Ps/Ph = 0.22-0.23). El IC fue mayor de abril a junio (26.95-31.99) mientras que la relación Ps/Ph fue mayor de abril a agosto (0.25- 0.31), en tanto que en julio (20.1), el IC disminuye y se mantiene bajo hasta diciembre (11.8) y la relación Ps/Ph disminuye de septiembre a diciembre (0.22- 0.21) (Figura 1).
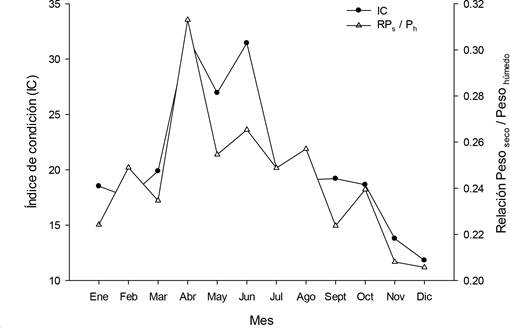
Figura 1 Índice de condición y relación peso seco / peso húmedo del ostión de roca Striostrea prismatica en Santa Cruz de Miramar, Nayarit, México. (Ene-Dic / 2014).
Ciclo reproductivo y relación con factores ambientales
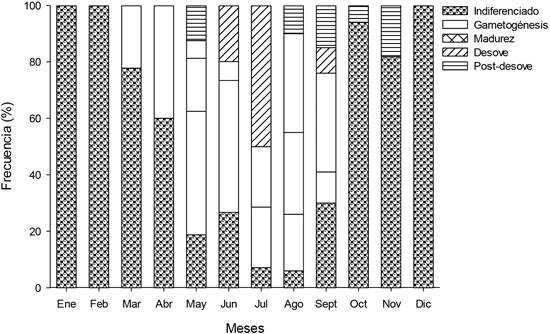
De acuerdo con la presencia de células gametogénicas, se definieron las etapas de desarrollo gonadal de indiferenciado, gametogénesis, madurez, desove y post desove (Figura 2). La observación cualitativa de estas etapas de desarrollo gonádico durante el muestreo permitió describir el ciclo reproductivo del ostión. El periodo de desove ocurrió de mayo a septiembre, pero, en el mes de julio se presentó la mayor frecuencia de organismos desovando, mientras que de octubre a febrero se observó un periodo de reposo (Figura 3). En cuanto a la relación de las variables ambientales con el ciclo re- productivo, se observó que la temperatura juega un papel importante en el evento reproductivo (Tabla3). Específicamente, el desove fue en los meses más cálidos (mayo-septiembre, 27.6 - 30.6 °C) (R= 0.77, p = 0.00), mientras que la mayor frecuencia de organismos indiferenciados se encontró en los meses más fríos (diciembre-febrero, 25.6 - 26.4 °C) (R = -0.65, p = 0.01). La concentración de clorofila- a no estuvo relacionada con el ciclo reproductivo. El IC no se relacionó con ninguna de las variables ambientales, pero sí con la etapa de desarrollo de indiferenciado (R = -0.68, p = 0.01) y la de desarrollo (R = 0.92, p = 0.00) (Tabla 3).

Figura 2 Etapas de desarrollo gonadal del ostión de roca Striostrea prismatica, en Santa Cruz de Miramar, Nayarit, México (Ene-Dic / 2014). a) Indiferenciado, 40X; b) gametogénesis en machos 40X; c) gametogénesis en hembras 40X; d) Madurez en machos 40X; e) Madurez en hembras 40X; f) Desove en machos 40X; g) Desove en hembras 10X; h) Postdesove en machos, 40X; i) PosTdesove en hembras 10X. cg: células goniales; e: espermatozoides; el: espermatozoides liberados; ev: espacios vacíos; f: folículo; fr: folículoslos rotos; gd): glándula digestiva; o: ovocito; om: ovocito maduro; ol: ovocitos liberados; pf: pared folicular; re): reabsorción de espermatozoides; ro: reabsorción de ovocitos; tc): tejido conectivo; y tgi: tejido gonadal indiferenciado.
Tabla 3 Correlación entre variables ambientales y la reproducción del ostión de roca Striostrea prismática en Santa Cruz de Miramar, Nayarit, México (Ene-Dic / 2014).
| Variables | R Spearman | P |
|---|---|---|
| Temperatura y Indiferenciado | -0.6596 | 0.0196* |
| Temperatura y Madurez | 0.6718 | 0.0167* |
| Temperatura y Desove | 0.7733 | 0.0031* |
| IC y Indiferenciado | -0.6831 | 0.0143* |
| IC y Gametogénesis | 0.9281 | 0.0000* |
| Relación Ps/Ph y Indiferenciado | 0.6297 | 0.0134* |
| Relación Ps/Ph y Gametogénesis | 0.6961 | 0.0001* |
| Clorofila-a y IC | 0.3566 | 0.2551 |
| Clorofila-a y Desove | 0.0077 | 0.9708 |
Talla de primera madurez
El intervalo de longitud en la cual se observaron organismos maduros fue de 69 a 153mm. Sin embargo, el tamaño del reclutamiento a la reproducción (L50) fue de 80.2 mm para Striostrea prismatica (Figura 4).
Discusión
Factores ambientales
La determinación de la TSM y la clorofila-a se realizó a través de sensores remotos, de acuerdo con Veneros et al. (2020) este tipo de tecnología ha sido empleada para realizar análisis sobre cobertura vegetal y cuerpos de agua en estudios de conservación y medio ambiente, resultando de gran utilidad. Tanto la temperatura como la clorofila a estimadas en este estudio son similares a las reportadas en otras zonas de distribución del ostión de roca (Loor y Sonnenholzner 2016).
Proporción de sexos
Los machos fueron más abundantes que las hembras lo que coincide con lo reportado para esta misma especie en la costa del Pacífico de Costa Rica, con una proporción sexual de 3: 1 (M: H) y hermafrodistismo (2%) (Fournier 1992). Pero también se ha reportado que en Ecuador la proporción sexual fue de 1: 1 (Loor y Sonnenholzner 2016). Lo que se atribuye al tamaño de los organismos muestreados. Por lo que se especula que S. prismática presenta características de hermafroditismo y dioecia protándrica (Ríos-González et al. 2018), mostrando una mayor proporción de machos que hembras en una etapa temprana, pero disminuye con la edad o el tamaño debido a la inversión de sexo (Loor y Sonnenholzner 2016) como se ha re- portado en Crassostrea corteziensis (Chávez-Villalba et al. 2008) y C. gigas (Baghurst y Mitchell 2002). A diferencia de este estudio, Fournier (1992) reportó hermafroditismo para esta especie, lo que se puede atribuir a que, en el Golfo de Nicoya, la actividad re- productiva es constante durante todo el año y puede ocasionar que no exista una reabsorción completa de los gametos del evento reproductivo anterior y una nueva gametogénesis, como ha sido reportada por Paniagua-Chávez y Acosta-Ruiz (1995), mientras que en Santa Cruz de Miramar, Nayarit muestra un período de reposo durante el cual se podría llevar a cabo el cambio de un sexo a otro.
Índice de condición
El índice de condición (IC) permite evaluar parámetros, como el estado nutricional, los cambios en las reservas nutricionales del área y la calidad comercial (Crosby y Gale 1990), y además se encuentra una relación entre el IC y la madurez sexual de ostiones y otros bivalvos (Okumus y Stirling 1998). Se observó una tendencia en IC y la relación Ps/Ph a ser mayor cuando se acerca la madurez sexual, aunque solo muestran correlación positiva con la fase de gametogénesis y correlación negativa con la etapa indiferenciada. Pero no se encontró correlación entre el IC y madurez y/o desove como lo reportaron Lango-Reynoso et al. (1999) y Chávez-Villalba et al. (2007) para Crassostrea gigas y Mena-Alcántar et al. (2017) para C. corteziensis. Mientras que en S. prismaticaFournier (1992) reportó una fuerte correlación positiva entre la madurez y la relación Ps/Ph. Esto puede deberse al hecho de que en el Golfo de Nicoya, Costa Rica, la proporción de organismos en la misma etapa de desarrollo (maduros o desove) fue alta (más del 50%), mientras que en Santa Cruz de Mirarmar, las proporciones de organismos en la misma etapa de desarrollo no alcanzó el 50%, excepto en la fase indiferenciada.
Ciclo reproductivo y relación con factores ambientales
El ostión de roca Striostrea prismatica pre- sentó un ciclo reproductivo sincrónico entre machos y hembras con un patrón unimodal como lo reportan Meléndez-Galicia et al. (2015) y, Loor y Sonnen- holzner (2016), seguido de un período de reposo. El período de desove fue a finales de primavera y verano (junio a agosto) y el período de descanso de otoño a invierno (octubre-febrero), algo similar a lo ocurrido en la costa de Michoacán (Meléndez-Galicia et al. 2015) y en la costa sur de Ecuador (Loor y Sonnenholzner 2016) para esta misma especie. En contraste, Fournier (1992) reportó que esta especie en el Golfo de Nicoya, Costa Rica, tiene actividad reproductiva de manera continua durante todo el año, sin evidencia de un periodo de reposo. Lo que puede deberse a que en esa zona la temperatura presenta baja variación a lo largo del año (alrededor de 3 °C).
La temperatura tiene un papel importante en la reproducción, ya que la maduración gonadal y el desove presentaron asociación directa con la temperatura, encontrando que la mayor proporción de organismos maduros y en desove se encontraron entre 27.6 y 30.6 °C. Lo que coincide con la temperatura máxima reportada durante la madurez sexual de 28.1 y 29.6 °C (Loor y Sonnenholzner 2016). Pero se difiere con Fournier (1992) quien reporta que en el Golfo de Nicoya, Costa Rica, la actividad reproductiva se presenta durante todo el año sin un período de descanso y temperaturas promedio entre 29 y 32 °C. Lo que se puede atribuir a la temperatura que prevalece en la zona muestreada. De acuerdo con Robles et al. (2020), la temperatura de desove en condiciones de laboratorio ocurre entre los 28 y 30°C.
Para la concentración de clorofila-a, no se observó relación con el ciclo reproductivo. Lo que difiere con Loor y Sonnenholzner (2016) quienes reportan que para poblaciones de S. prismática la mayor concentración de clorofila-a en invierno se relacionada con el inicio de la gametogénesis, lo que se atribuye a que los ostiones utilizan clorofila-a y materia orgánica particulada como reservas energéticas (Chávez-Villalba et al. 2002, Chávez-Villalba et al. 2008, Rodríguez-Jaramillo et al. 2008). En ese sentido, esta diferencia puede deberse a que en Santa Cruz de Miramar la alimentación puede no ser una limitación a lo largo del año para esta especie debido a que se encuentra dentro del rango encontrado para otras zonas (Loor y Sonnenholzner 2016). Pero, sobre todo, no presenta un patrón estacional determinado por la temperatura, mientras que en la costa ecuatoriana las variaciones fueron mayores con un patrón en el cual la concentración de clorofila-a fue determinada por la temperatura (Loor y Sonnenholzner 2016). Lo que puede deberse a que en la costa de Santa Cruz de Miramar durante los meses más cálidos del año se presenta la temporada de lluvias, lo cual provoca que grandes cantidades de nutrientes lleguen a la costa desde los arroyos que allí desembocan.
Talla de primera madurez
La talla de primera madurez se ha definido de diferentes formas. Por ejemplo, Campbell y Ming (2003)) lo definieron como la talla del primer ostión maduro detectada durante el muestreo en el que todos los individuos pertenecen a la misma cohorte tanto en edad como en tamaño. Para este trabajo se definió como el momento en que el 50% de la población se encuentra en una fase de madurez o cuando la suma de las fases de madurez y desove es mayor o igual al 50%, de acuerdo con Mazón- Suástegui et al. (2011) y Mena-Alcántar et al. (2017). Pero son pocos los estudios realizados para S. prismática sobre aspectos reproductivos (Arguello- Guevara et al. 2013, Hernández-Covarrubias et al. 2013, Meléndez-Galicia et al. 2015, Loor y Sonnenholzner 2016) y solo dos reportan la talla de primera madurez en esta especie. Al respecto, Hernández- Covarrubias et al. (2013) reportaron organismos maduros en un rango de tallas de 5.8 a 15.8 cm, lo que coincide con lo encontrado (6.9 a 15.3 cm). Pero reportan una L50 de 90 mm, mientras que en el presente trabajo se observó una L50 de 80.2 mm. Mientras que Fournier (1992) encontraron que los organismos más pequeños sexualmente maduros presentan tallas de 15 mm. En recientes investigaciones sobre la producción de esta especie en cautiverio, se reportó como un criterio de selección de los reproductores que presentaran una talla superior a los 12 cm (Robles et al. 2020).
En este sentido, se ha observado que las diferencias encontradas entre las tallas de madurez pueden atribuirse a factores como las diferencias fenotípicas de los stocks a lo largo de un gradiente latitudinal o temporal (Zhu et al. 2011), a la calidad y estructura de los datos (Punt et al. 2006), la elección del modelo (Zhu et al. 2011) e incluso a la presión pesquera que recibe un recurso (González et al. 2012). En ese sentido, no existe información disponible sobre el volumen de producción neta de S. prismática, sin embargo, un ejercicio realizado por Patiño-Valencia et al. (2006) con datos de captura de dos localidades de la costa de Nayarit determinaron que presenta un declive poblacional, como se ha establecido por Arreguín-Sánchez y Arcos-Huitrón (2011) que la mayoría de los recursos pesqueros se encuentran en algún tipo de agotamiento o sobre explotación.
Conclusiones
El desove de S. prismática se presenta entre mayo y septiembre. El ciclo reproductivo de esta especie está regulado por la temperatura del agua, con desove entre los 27.6 y 30.6 °C, mientras que la clorofila-a no tiene relación con este evento en la zona, así mismo demostró que el ostión de roca alcanza la talla de primera madurez a los 80.2 mm de longitud.











 nueva página del texto (beta)
nueva página del texto (beta)