Introducción
El surgimiento de enfermedades infecciosas emergentes en seres humanos, plantas y fauna silvestre ha acaparado la atención de especialistas en salud pública y de la conservación de la biodiversidad a nivel mundial. La aparición de estas enfermedades se ha asociado con el cambio climático global, el cual ha alterado las condiciones ambientales y con ello la relación parásito-huésped favoreciendo a los primeros, incrementando su incidencia, capacidad infecciosa y propagación (Mendoza-Almeralla et al. 2015, Herath et al. 2021). Los anfibios han sido uno de los grupos taxonómicos más afectados por las enfermedades infecciosas emergentes, sobre todo las causadas por hongos (Daszak et al. 2004, Mendoza-Almeralla et al. 2015). Sus características anatómicas como su delgada piel y alta dependencia a las condiciones ambientales los hacen altamente susceptibles (Johnson y Speare 2005, Wells 2007).
Para evitar el crecimiento de organismos patógenos en su piel, los anfibios secretan péptidos, aminas biogénicas, alcaloides entre otros compuestos (Cortázar-Chinarro et al. 2020), además tienen una comunidad microbiana como línea de defensa contra patógenos (Rollins-Smith 2020). Para muchas especies esta estrategia no es suficiente ya que, en las últimas décadas, alrededor del mundo, las poblaciones de cientos de especies se han reducido acercándolas a su extinción (Thumsová et al. 2021). La quitridiomicosis, es una enfermedad provocada por el hongo Batrachochytrium dendrobatidis, que se desarrolla en las células de la piel de los anfibios, alterando su permeabilidad lo que provoca su muerte (Mendoza-Almeralla et al. 2015, Russo et al. 2018, Rollins-Smith 2020).
Los trabajos sobre hongos patógenos en anfibios en México se han enfocado en determinar la presencia y prevalencia principalmente de B. dendrobatidis y la quitridiomicosis (García-Feria et al. 2019, Hernández-Martínez et al. 2019, Bolom-Huet et al. 2019). Pero poco se ha documentado sobre otros géneros de hongos potencialmente patógenos como Penicillium, Trichoderma, Aspergillus, Mucor y Cladosporium que desarrollan enfermedades como dermatitis micótica, cromomicosis, mucormicosis y queratitis potencialmente mortales por sí mismas o interaccionan con otros parásitos, generando coinfecciones con consecuencias también mortales (Mendoza-Henao et al. 2012, Herczeg et al. 2021).
El cambio de uso de suelo ha alterado la relación natural de las variables ambientales, incrementado la presencia y el desarrollo de hongos patógenos en México (Mendoza-Almeralla et al. 2015). Los cambios en la temperatura ambiental, salinidad, humedad, pH del suelo (por el uso de agroquímicos como el sulfato de amonio, el nitrato de amonio y la urea que aumentan la acidez del suelo), y la movilización continua de ganado, benefician el crecimiento y dispersión de la mayoría de las especies de hongos patógenos (Cingolani et al. 2008, Mendoza-Henao et al. 2012, Turner et al. 2021).
Las cuencas hidrográficas del estado de Chiapas en México han experimentado importantes alteraciones de la estructura y la extensión de la vegetación original para dar paso a actividades de ganadería, agricultura y de urbanización (Cayuela et al. 2006, Castro 2010). Por ejemplo, la cuenca del río Coatán, al sureste de este estado, mantiene solo el 17.4% de la vegetación original; en esta cuenca el clima es cálido húmedo, con precipitación que va los 1 500 a los 3 500 mm anuales (SMN 2010), condiciones propicias para el desarrollo tanto de anfibios como de hongos. El conocimiento sobre la incidencia de hongos en anfibios en la región sursureste de México es escaso, los únicos registros que se tienen son los de Cheng et al. (2011) quienes reportan a B. dendrobatidis y el de Bolom-Huet et al. (2019) que describe la distribución potencial del hongo B. dendrobatidis, a partir de registros directos de la zona alta de la sierra madre de Chiapas.
Debido a que algunos hongos patógenos pueden incrementar su incidencia en ambientes perturbados (Cingolani et al. 2008, Mendoza-Almeralla et al. 2015) y desarrollar enfermedades que pueden provocar la muerte en sus hospederos. El presente trabajo tuvo como objetivo determinar la presencia y riqueza de especies de hongos de la dermis de anuros de la cuenca del río Coatán, en el estado de Chiapas, México.
Materiales y métodos
Área de estudio
La cuenca del río Coatán se localiza al oriente de la Sierra Madre del estado de Chiapas y de la Planicie Costera del Pacífico Mexicano (Figura 1). Es una cuenca binacional compartida con Guatemala con una extensión de 733 km2 de los cuales el 75% se encuentra en territorio mexicano (García-García y Kauffer-Michel 2011) y cuenta con un clima general cálido húmedo con dos temporadas definidas: lluvias, de mayo a octubre y secas, de noviembre a abril (García 2004).
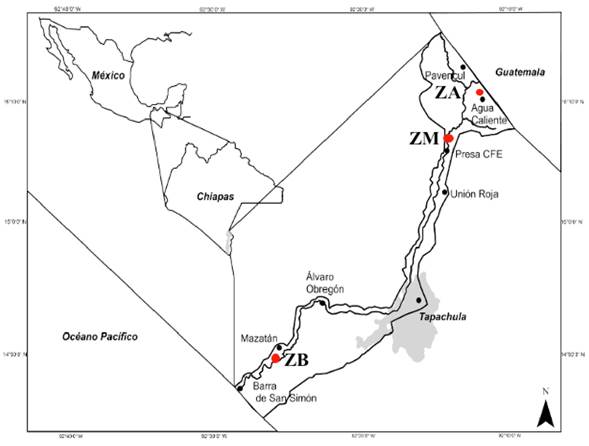
Figura 1 Área de la cuenca del río Coatán, los puntos corresponden a los sitios de colecta de los anuros en tres zonas de la cuenca. ZA = zona alta, ZB = zona media, ZB zona baja.
La cuenca presenta tres tipos de relieves: 1) La Sierra Alta Volcánica ocupa el 42.81% del área total. La vegetación predominante es el bosque mesófilo de montaña, el bosque de pino-encino y la pradera de alta montaña, las principales actividades humanas de esta zona son la agricultura y ganadería de autoconsumo (Grajales et al. 2008). 2) La Sierra Baja de laderas tendidas y lomeríos, se ubica entre la zona media de la cuenca, ocupa el 35.45% de la superficie. La vegetación característica de esta zona es la selva baja subcaducifolia y la selva mediana perennifolia. La principal actividad humana es el cultivo comercial de café de sombra, y la agricultura y ganadería de autoconsumo (Grajales et al. 2008). 3) La llanura costera abarca el 21.74% del área y se ubica en la zona más baja de la cuenca, la mayor parte de la superficie de esta zona está destinada a la agricultura y ganadería intensiva, tanto de temporal como permanente. La vegetación original en esta zona es prácticamente inexistente, en esta zona el cauce principal del río Coatán, atraviesa la ciudad de Tapachula, la segunda más poblada del estado de Chiapas (CNA 2014).
Recolecta de las muestras
El área de la cuenca del río Coatán se dividió en tres zonas de acuerdo con el tipo de vegetación: zona alta-Sierra Alta Volcánica (ZA), zona media-Sierra Baja (ZM) y zona baja-Llanura costera (ZB). En cada zona se eligió un sitio de muestreo que tuviera actividad humana característica de la zona (ZA: cultivo de maíz, ZM: cultivo de café y ZB: cultivo de maíz-potrero) y con al menos un arroyo para que la ausencia de agua no fuera un factor limitante para la presencia de anfibios. En cada sitio se recolectaron 10 individuos del orden Anura mediante el método de encuentro visual descrito por Rueda-Almonacid et al. (2006). Cada individuo localizado fue manipulado con guantes de látex estériles y colocado de forma individual en bolsas nuevas de polietileno, adicionalmente se registró el tipo de hábitat del individuo (Arborícola, Charca u Hojarasca), así como los valores de temperatura ambiental y humedad relativa mediante una sonda multiparamétrica (Sper-Scientific, 850070), de temperatura del agua con un termómetro de alcohol, el pH de agua con un potenciómetro portátil (Hanna HI 98107) y el pH del suelo con un potenciómetro para suelo. La identificación de las especies se realizó en campo utilizando las claves de identificación de Köhler (2011) y se trasladaron al laboratorio para su procesamiento.
Aislamiento de hongos
A cada individuo se le aplicó la eutanasia y se enjuagaron con abundante agua destilada. A cada ejemplar se le hicieron cuatro cortes de 1 cm2, dos en el vientre y dos en el dorso, los cuales se colocaron individualmente en solución salina débil (DS) (KH2PO4) y en agitación para el desprendimiento de esporas. Posteriormente se inocularon 100 μL de solución DS tanto del vientre como del dorso en medio de cultivo agar papa dextrosa (PDA) y se incubaron durante 20 días entre 27 y 30 °C. Este medio se utilizó para favorecer el crecimiento de hongos que no necesariamente fueran patógenos para los anuros. De igual manera se inocularon 100 μL de muestra del vientre y del dorso de cada anfibio en medio de cultivo TGhL y se incubaron durante 21 días entre 17 y 23 °C; este medio se utilizó para el crecimiento de hongos que pudieran estar infectando a los anuros. Cada medio de cultivo fue acondicionado con ácido tartárico (10% p/v) para evitar la proliferación de bacterias.
Purificación e identificación morfológica de los hongos
La purificación de las cepas se realizó mediante la resiembra del micelio en el medio de cultivo correspondiente y su incubación durante 20 días bajo las condiciones arriba mencionadas. La identificación de las cepas se realizó con base en las estructuras microscópicas de los micelios teñidos con azul de lactofenol, observando en un microscopio de contraste de fases, y utilizando las claves de identificación morfológica de Barnett y Hunter (1998) y Kieffer y Morelet (2000). Cuando fue posible reconocer el género, pero no se tuvo certeza de la especie las cepas fueron reconocidas como una unidad taxonómica y se nombraron con el nombre del género y un valor numérico para distinguir entre formas distintas (sp1, sp2).
Análisis estadístico
Para identificar diferencias en la composición de especies de hongos presentes en los anuros de las distintas zonas de la cuenca, se realizó un análisis de escalas multidimensionales no métricas (nMDS), utilizando el índice de similitud de Sorensen como criterio de clasificación. Los valores de las variables ambientales fueron normalizados y se realizó un análisis de componentes principales para identificar las variables que contribuyeron en mayor medida en la diferenciación ambiental entre las zonas de la cuenca. Los análisis estadísticos fueron realizados con el software PAST versión 3.14 (Hammer et al. 2001).
Resultados
Se identificaron 14 géneros y 24 especies de hongos (Tabla 1) en la piel de 34 individuos de siete especies de anuros en las distintas zonas de la cuenca del río Coatán. Las especies de anuros identificadas para la ZB fueron: Craugastor rhodopis, Craugastor loki, Leptodactylus melanonotus y Engystomops pustulosus; para la ZM: Smilisca baudinii, Lithobates maculatus, C. rhodopis, C. loki y para la ZA: L. maculatus y Smilisca cyanosticta. El mayor número de especies de hongos se encontró en la ZB con 16 especies, seguido de la ZM con 12 especies y la ZA con 11 especies. En la ZB también se encontró el mayor número de especies por hospedero con 4, seguido de la ZA con tres especies y la ZM con una especie. El tejido ventral presentó el mayor número de especies de hongos (Figura 2). Las especies Penicillium sp1, Penicillium sp3, Aspergillus sp1 y Aspergillus sp2 se encontraron en las tres zonas de la cuenca. Las especies Penicillium sp1 y Periconia sp1 fueron las más frecuentes, ya que se encontraron en todos los individuos de la ZB, y la especie Penicillum sp3 en todos individuos de la ZM.
Tabla 1 Tabla de presencia-ausencia de los géneros de hongos en diferentes especies de anuros de la cuenca del río Coatán, Chiapas, México. ZB = zona baja, ZM = zona media, ZA = zona alta. Tipo de hábitat de la especie: H = hojarasca, CH = charca, A = arborícola.
| ZB | ZM | ZA | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Especies de anfibios | C. rhodopis H | E. pustulosus CH | C. loky H | L. melanonotus H | S. baudinii H | L. maculatus CH | C. rhodopis H | C. loky H | S. cyanosticta A | L. maculatus CH |
| Arthrobotryum sp. 1 | - | - | - | - | + | - | - | - | - | - |
| Aspergillus Sp. 1 | + | + | + | - | - | + | - | - | + | + |
| Aspergillus Sp. 2 | + | + | + | - | - | - | - | + | + | - |
| Aspergillus Sp. 3 | + | - | + | - | - | - | - | - | + | + |
| Aspergillus Sp.4 | - | - | - | + | - | - | - | - | - | - |
| Aspergillus Sp. 5 | - | - | - | + | - | - | - | - | - | - |
| Aspergillus Sp.6 | - | - | - | - | - | + | - | - | - | - |
| Clasterosporium Sp.1 | - | - | + | - | - | - | - | - | - | |
| Dendrographyum Sp.1 | - | - | - | - | - | + | - | - | - | - |
| Fusarium solani | + | - | - | - | - | - | - | - | - | - |
| Gonytrichum Sp.1 | - | - | - | - | - | - | - | - | - | + |
| Hongo perfecto Sp.1 | - | - | - | - | - | - | - | + | - | - |
| Memnoniella Sp.1 | - | - | + | - | - | - | - | - | + | - |
| Paecilomyces Sp.1 | - | - | + | - | - | - | - | - | - | - |
| Penicillium Sp.1 | + | + | + | + | + | + | + | - | + | + |
| Penicillium Sp.2 | - | - | + | + | - | - | - | - | + | - |
| Penicillium Sp.3 | - | - | + | - | + | + | + | + | + | - |
| Penicillium Sp.4 | - | - | + | - | + | + | - | - | - | - |
| Penicillium Sp. 5 | - | - | - | - | - | - | + | - | - | - |
| Penicillium Sp. 6 | - | - | - | - | - | - | - | - | + | - |
| Periconia Sp.1 | + | + | + | + | - | - | - | - | + | - |
| Rhizoctonia Sp.1 | - | - | - | + | - | + | - | - | - | - |
| Scopulariopsis Sp.1 | + | + | - | - | - | - | - | - | + | + |
| Trichoderma Sp.1 | - | - | - | - | - | - | + | - | - | - |

Figura 2 Número total de especies de hongos presentes por región de la piel de anuros colectados en las diferentes zonas de la cuenca del río Coatán. V = región ventral, D = región dorsal; ZB = zona baja, ZM = zona media, ZA = zona alta.
Las especies Penicillium sp5, Trichoderma sp1, Paecilomyces sp1, Clasterosporium sp1, Fusarium solani, Arthrobotryum sp1, Aspergillus sp4 y Aspergillus sp5 fueron encontradas exclusivamente en individuos de hábitat de hojarasca. Aspergillus sp6, Dendrographium sp1, Rhizoctonia sp1 y Gonytrichum sp1 se encontraron únicamente en individuos de hábitat acuático, mientras que Penicillium sp6 estuvo presente solo en anuros de hábitat arborícola.
Penicillum sp6 estuvo presente solo en anuros Los anfibios de hábitat acuático tuvieron el mayor número de especies de hongos en la piel (Figura 3). De manera general la composición de especies de hongos fue similar zona ZB y la zona ZA (Figura 4).

Figura 3 Número de especies de hongos en la piel de anfibios encontrados según su hábitat y especie de anuro en tres zonas de la cuenca del río Coatán. C rho = Craugastor rhodopis, C Lok = Craugastor loki, L me = Leptodactylus melanonotus, E pos = Engystomops pustulosus, L mac = Lithobates maculatus, S bau = Smilisca baudinii, S c = Smilisca cyanosticta. ZB = zona baja, ZM = zona media, ZA = zona alta. Lugar de colecta: H = hojarasca, CH = charca, A = arborícola.

Figura 4 Diagrama de ordenación MDS de especies de hongos encontrados en la piel de anuros colectados en las diferentes zonas de la cuenca del río Coatán, los puntos encerrados en el ovalo de color gris corresponden a la ZM. Zona baja (ZB) = Puntos negros, Zona alta (ZA) = círculos color blanco.
En la ZB de la cuenca se encontraron los valores más bajos de pH tanto en suelo como en agua y mayor temperatura ambiental. Los valores de humedad relativa fueron similares entre la ZM y ZA (Tabla 2). En el diagrama de ordenación del análisis de componentes principales se observó una diferenciación de cada zona de la cuenca en términos ambientales, las variables que tuvieron mayor contribución fueron el pH del agua (CP1 = -0.6829), la temperatura ambiental (CP1 = 0.472), la humedad relativa (CP2 = 0.75) y pH del suelo (CP2 = 0.12), la variación explicada al CP1 fue del 94.46% y acumulada al CP2 del 99.8% (Figura 5).
Tabla 2 Parámetros ambientales en las diferentes zonas de la cuenca del río Coatán. ZA = zona alta, ZM = zona baja, ZB = zona baja. +/- = desviación estándar.
| ZB | ZM | ZA | ||||
|---|---|---|---|---|---|---|
| Media | +/- | Media | +/- | Media | +/- | |
| Temperatura ambiental | 30.19 | 0.0672 | 26.08 | 0.1095 | 20.44 | 0.7635 |
| Temperatura agua | 22.43 | 0.1177 | 21.56 | 0.0894 | 18.08 | 0.0447 |
| pH suelo | 5.67 | 0.1797 | 6.70 | 0.0083 | 7.2 | 0 |
| pH agua | 6.03 | 0.0433 | 9.91 | 0.1878 | 10.50 | 0.0887 |
| Humedad Relativa | 74.582 | 0.0460 | 79.14 | 0.1341 | 56.52 | 1.6917 |
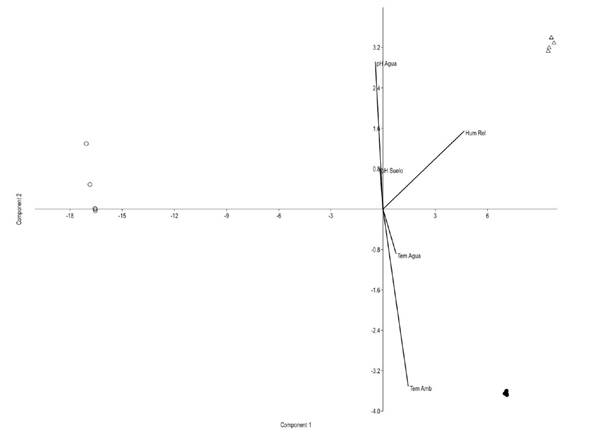
Figura 5 Análisis de componentes principales de las variables ambientales de la cuenca del río Coatán. Zona baja = círculos color negro, Zona media = triángulos, Zona alta = círculos color blanco. El porcentaje de la variación explicada al componente uno es del 94.46% y acumulada al componente dos del 99.8%.
Discusión
Los géneros más representativos de los anuros de cuenca del río Coatán fueron Penicillium y Aspergillus, para ambos géneros no se reporta evidencia sobre su relación con alguna enfermedad en anuros. Pero la especie Penicillium griseofulvum se reporta como patógena de la tortuga Megalochelys gigantea (Mendoza-Henao et al. 2012). Los géneros encontrados en este trabajo como Memnoniella, Arthrobotryum y Scopulariopsis, no han sido reportados como agentes patógenos en anuros, por lo que su presencia en ellos probablemente sea ocasional al entrar en contacto con el suelo, o material en descomposición ya que Arthrobotryum y Scopulariopsis son saprobicos de restos de plantas y animales en descomposición, respectivamente (Heredia et al. 2018, da Silva-Peixoto et al. 2020, Pérez-Cantero y Guarro 2020). Los géneros Periconia, Paecilomyces, Fusarium y Rhizoctonia, tampoco han sido reportados como agentes patógenos en anuros, no obstante, algunos de ellos son patógenos de plantas de cultivo como soya, maíz, papa y frijol, de insectos y de vertebrados incluyendo al hombre (Carr et al. 2003, Juárez-Becerra et al. 2010, da Silva-Peixoto et al. 2020). La presencia de estos géneros se observó principalmente en las ZB y ZA de la cuenca, en donde estos cultivos predominan (ZB maíz y soya, ZA maíz, frijol y papa), su presencia en anuros sugiere que fueron ocasionalmente adheridos al entrar en contacto directo con el suelo o materia vegetal. Una composición de especies de hongos similar a la del presente trabajo fue reportada por da Silva-Peixoto et al. (2020) de la piel de Rhinella major y Rhinella marina de la región de Santarém en Brasil, encontrando los géneros Scopulariosis, Trichoderma, Paecilomyces, Aspergillus y Penicillum, siendo los dos últimos los más representativos. Es probable que la composición de especies reportada por da Silva-Peixoto et al. (2020) como la del presente trabajo sean producto de la proximidad a zonas agropecuarias. En este sentido, incluir sitios de muestreo en zonas no perturbadas, permitiría conocer la micobiota nativa de la piel de los anuros. Conocer la biota nativa de la piel de los anuros tiene importantes implicaciones para su conservación. Evidencia reciente ha mostrado que la microbiota (bacterias principalmente) de la piel de los anfibios funciona como la primera línea de defensa contra enfermedades, incluyendo la quitridiomicosis (Rebollar et al. 2020, Pereira y Woodley 2021); no obstante el papel de los hongos en esta microbiota es poco entendido (Kearns et al. 2017), especies de los géneros Penicillium, Paecilomyces, Trichoderma producen sustancias con propiedades antimicrobianas, probióticas y antioxidantes que pueden contribuir a la resistencia ante la incidencia de patógenos (Kearns et al. 2017, da Silva-Peixoto et al. 2020).
En los anuros de la ZB de la cuenca se encontró el mayor número de especies de hongos, el mayor número de hongos por hospedero y la zona ventral el mayor número de especies. En esta zona también se presentaron los valores más bajos de pH en suelo y agua. Se ha reportado que las actividades agropecuarias favorecen la presencia y propagación de hongos, ya que los fertilizantes agrícolas acidifican el suelo, lo cual propicia el crecimiento de la mayoría de ellos (Cingolani et al. 2008). Al haber una mayor presencia de hongos, la región ventral de la piel de los individuos es más vulnerable por estar en contacto directo con el medio ya sea acuoso o terrestre (Pough et al. 2004). Al respecto Prakash et al. (2015) y Gómez-Cornelio y Morón Ríos (2018) mencionan que la diversidad de hongos en la hojarasca varía de acuerdo con las condiciones ambientales, al grado de descomposición y la biomasa. En las zonas ZB y ZM la cantidad de hojarasca donde fueron capturados los individuos era un elemento importante y presentaba un avanzado grado de descomposición, sobre todo en la ZM donde se determinó mayor humedad relativa. Es importante mencionar que la hojarasca difirió entre zonas en cuanto a composición de especies que la originan, siendo predominantemente de pastos y maíz en la ZB y de café en la ZM. Es probable que esta diferencia en la composición de la hojarasca sea responsable del menor número de especies por hospedero, ya que en la ZM las hojas de café tienen un alto contenido de fenoles (Hasanah et al. 2016), los cuales persisten durante la descomposición de las hojas, lo que dificultan la colonización de hongos sapróbicos (Paulus et al. 2006), y por consiguiente se reduce la probabilidad de encuentro entre hongos y anuros. el menor número de especies de hongos por hospedero en la ZM sugiere que el tipo es un factor que influye en la presencia o ausencia de los hongos en la piel de los anuros.
Los anuros de hábitat acuático (charca), también presentaron un importante número de especies, probablemente porque fueron colectados en ríos o charcas que se encontraban dentro de las zonas de actividad agrícola. Además de que en estas charcas fluyen aguas residuales agropecuarias y domésticas, además algunas (ZB) son utilizadas como abrevaderos. Los resultados coinciden con los reportado por Woodhams y Alford (2005), Kriger et al. (2007) y Mendoza-Henao et al. (2012) quienes mencionan que los anfibios asociados a cuerpos de agua en zonas agropecuarias tienen mayor probabilidad de ser hospederos de hongos, ya que están más expuestos a esporas que se adhieren a las patas del ganado que pasa a través de ellos o cuando se acercan a tomar agua.
De acuerdo con Bolom-Huet et al. (2019), en las zonas altas de la Sierra Madre de Chiapas, se ha reportado el hongo B. dendrobatidis, el cual en ningún individuo recolectado y analizado se encontró evidencia de su presencia. Al respecto, Moura-Campos et al. (2021) mencionan que la patogenicidad de B. dendrobatidis puede ocurrir de manera estacional, especialmente cuando la temporada de secas se extiende de forma anómala, lo que influye en el sistema inmune de los anfibios y en la probabilidad de propagación de la enfermedad entre individuos. El no haber encontrado individuos infectados por B. dendrobatidis pudo deberse a la genética, la microbiota en la piel, el uso de pesticidas y fertilizantes en la región, la susceptibilidad de los hospederos o la temperatura no fueron favorables para su presencia (Fisher y Garner 2020, Turner et al. 2021).
Conclusiones
La riqueza de especies de hongos de la piel de anuros de la cuenca del río Coatán fue de 24 especies. Los anuros de la ZB tuvieron la mayor riqueza, el mayor número de especies por hospedero y en el tejido ventral se tuvo el mayor número de especies de hongos. La presencia de hongos patógenos de plantas de cultivo en la piel de los anuros hace que estos organismos puedan actuar como agentes dispersores, sobre todo porqué más de la mitad de las especies de hongos encontradas pertenecen a géneros con alto éxito en la dispersión por esporas (Aspergillus y Penicillium), por lo que se requiere estudiar el papel de los anuros en la propagación de hongos en plantaciones agrícolas y áreas de ganadería para considerarlo en las estrategias de manejo de parasitosis y patogenia de hongos.











 nueva página del texto (beta)
nueva página del texto (beta)



