Introducción
La diversidad de murciélagos (Orden: Chiroptera) representa el 25% de la riqueza total de mamíferos (Simmons 2005), posicionándolos cómo el segundo grupo más diverso (Wilson y Kays 2009). Los murciélagos cumplen funciones ecológicas como la polinización, la dispersión de semillas y control de plagas, estos servicios ambientales los ubica como el grupo funcional con mayor relevancia para el equilibrio del ecosistema (Zamora-Gutiérrez et al. 2021). La diversidad, los tipos de dieta (Denzinger y Schnitzler 2013) y los servicios ambientales que provee la comunidad de murciélagos, son el resultado de las complejas interacciones bióticas y abióticas que ocurren en los hábitats y que influyen en su riqueza y distribución (Barrios-Gómez et al. 2019).
Los murciélagos insectívoros cumplen la función de reguladores de poblaciones de insectos que, en su mayoría, son plagas para los cultivos agrícolas (Charbonnier et al. 2021). Los murciélagos frugívoros y varias especies vegetales han co-evolucionado, el murciélago una vez que consume la pulpa de la fruta madura, dispersa a la planta durante el vuelo mediante una lluvia de semillas, esto trae otros beneficios como la reforestación pasiva de selvas y bosques (Saldaña-Vázquez et al. 2019). Los murciélagos nectarívoros funcionan como reguladores de la diversidad genética para especies de cactáceas, cuyo grado de dependencia varía a lo largo de la distribución geográfica y de la habilidad alimenticia de los murciélagos para complementar alguna fase de su ciclo reproductivo (Munguía-Rosas et al. 2009). Los murciélagos carnívoros y hematófagos (tres especies con distribución en México) cumplen una relación antagónica con otras especies, al fungir como depredadores (Marques-Dracxler y Kissling 2021) y muestran un potencial para la salud humana como la saliva del murciélago vampiro Desmodus rotundus, que contiene un anticoagulante eficaz para el tratamiento de padecimientos del sistema vasodilatador (Kakumanu et al. 2019).
Los ecosistemas presentan cierto grado de intervención humana, como las actividades antropogénicas que afectan el hábitat de los murciélagos, pero hay diversos trabajos que demuestran que la modificación del paisaje no afecta de la misma forma a todas las especies y grupos funcionales (García-Morales et al. 2013). La fragmentación del bosque original donde se refugian los murciélagos genera un efecto que particiona el paisaje en parches más pequeños de vegetación, al incorporarse nuevos elementos al paisaje como la agricultura, ganadería, infraestructura o vías de comunicación (Vázquez-Domínguez et al. 2011). Este impacto cambia la estructura y función del hábitat de los murciélagos, ya que los pocos remanentes de hábitat quedan menos conectados y más aislados entre sí, lo que genera variación en la comunidad de murciélagos como respuesta de borde (Carballo-Morales et al. 2021).
El Bosque Mesófilo de Montaña (BMM) es importante debido a la amplia diversidad biológica que alberga y a los valiosos servicios ecológicos que provee (CONABIO 2010), desafortunadamente, en México es el ecosistema más amenazado (Gual-Díaz y Rendón-Correa 2017), debido a que el actual BMM está caracterizado por parches de bosque original con bordes entre la matriz agrícola, ganadera y/o urbana (Toledo-Aceves 2017). En México y Veracruz, el BMM es uno de los ecosistemas menos abundantes en términos de superficie, además es el ecosistema que presenta mayor riesgo de extinción, debido a la fragmentación de la cobertura forestal original, promovida por la alta tasa de reconversión para generar actividades como la producción de ganado a libre pastoreo y la instalación de huertas de aguacate y chayote (Villaseñor 2017).
En los bosques concurren condiciones bióticas y abióticas que pueden indicar cómo algunas especies de murciélagos se afectan/benefician con la nueva configuración del paisaje (Alavéz-Martínez et al. 2020). Por ejemplo, los bordes de la matriz agrícola y el bosque son espacios con una mayor variedad y disponibilidad de recursos, que benefician a especies que forrajean en espacios abiertos, mientras que otras podrían verse afectadas por la pérdida de refugios, de zonas de forrajeo y disminución de recursos de hábitat debido a la deforestación (Bolívar-Cimé et al. 2016). Sin embargo, son escasos los estudios que aborden la diversidad, tipos de dieta y los efectos de la perturbación y de borde sobre la comunidad de murciélagos en los BMM de Huatusco, Veracruz (Williams-Linera 2015), los cuales son importantes para calibrar los impactos del cambio del hábitat sobre la estructura de la comunidad de murciélagos (Pineda et al. 2005, Saldaña-Vázquez et al. 2010). En este sentido, el objetivo del estudio fue comparar la diversidad y los tipos de dieta de una comunidad de murciélagos en diferentes tipos de borde del BMM en Huatusco, Veracruz, México.
Materiales y métodos
Área de estudio
El estudio se llevó a cabo en la localidad conocida como Finca La Pastoría, localizado en el municipio de Huatusco, Veracruz, México (Figura 1a), en un predio de 300 ha con una altitud que varía de 1 200 a 1 400 m, dedicado a la ganadería, al cultivo de aguacate y un área con presencia de BMM (Figura 1b ). La vegetación presente tiene una composición y estructura variable de especies vegetales, compuesta por una mezcla de especies neárticas y neotropicales, también de algunas especies de origen antiguo y otras de origen reciente, como pinos, encinos, liquidámbar, magnolias, caudillo, helechos arborescentes y epífitas como bromelias, orquídeas y cactus (Carvajal-Hernández et al. 2014), con un estrato arbóreo de 15 a 60 m de altura con árboles del género Quercus, Liquidambar, Juglans, Dalbergia y Podocarpus (Partida-Sedas et al. 2017).

Figura 1 (a) Localización, (b) límites (amarillo) del predio y ubicación espacial de las Unidades de Muestreo (círculos rojos con negro) y (c) vista del paisaje de Finca Pastoría, Huatusco, Veracruz: pastizal (centro), cultivos de aguacate (fondo-derecha) y BMM (borde de la imagen) (c).
El paisaje del área de estudio está caracterizado por una proporción del 50% de remanentes de vegetación de BMM (aproximadamente 150 ha), el 26.6% corresponden a coberturas de cultivos de aguacate (80 ha) de aproximadamente 4 años de edad, el 16.8% es cobertura con presencia de vegetación secundaria en etapa de crecimiento tardío y desarrollo temprano (50 ha) y, el resto 6.6% de la superficie (20 ha) está constituida por potreros destinados a la ganadería extensiva.
Selección de las unidades de monitoreo (UM) y descripción de la condición de perturbación
Antes de realizar el monitoreo de murciélagos, se realizó una expedición previa, con la finalidad de ubicar cuatro UM con diferentes tipos de bordes considerando el contexto paisajístico del predio. Estas UM se colocaron a una distancia promedio de 1 182 m entre UM, cada una abarcó una superficie de 50 m de diámetro (Figura 1c ) y fueron descritas in situ mediante una caracterización del porcentaje de la cobertura herbácea, arbustiva y arbórea (FMCN et al. 2018).
La UM1 contiene BMM con un 80% de cobertura herbácea y arbustiva, más del 90% de cobertura arbórea, con gran diversidad de plantas y la presencia de un cuerpo de agua (1 328 msnm). La UM 2 comprende un borde de pastizal-BMM, con más del 70% de cobertura arbórea, 50% de cobertura arbustiva con plantas de la familia Piperaceae; la cobertura herbácea está representada por helechos que cubren más del 90% (1 420 msnm). La UM 3 fue un borde de BMM rodeado de pastizal y cultivo de aguacate, tiene una cobertura herbácea del 90%, cobertura arbustiva del 20% y arbórea del 60%, rodeado por vegetación secundaria y especies de árboles representativos del BMM (1 370 msnm). La UM 4 conforma un sitio de borde entre BMM-vegetación secundaria y riparia, con una cobertura herbácea del 10%, arbustiva del 30% y arbórea del 50%, representado mayormente por helechos, Piperáceas, y especies del género Juglans (1 402 msnm). Las UM presentaron diferente distancia lineal entre sí, buscando la interdependencia espacial entre UM.
Monitoreo y captura de murciélagos
El periodo de muestreo fue de siete salidas de campo, con un intervalo de 28 días entre salidas, estas tuvieron una duración de dos noches consecutivas, iniciaron en el mes de febrero y finalizaron en agosto de 2019. Para la captura de los murciélagos, de manera simultánea en cada UM se colocaron dos redes (una de 9 m y otra de 12 por 2.5 m de alto), cada una instalada a una distancia de 5 m del borde de cada UM, sujetadas a postes extensibles de 1.8 a 3.6 m; los monitoreos iniciaron de manera simultánea en las cuatro UM a las 18:00 h y finalizaron a las 02:00 h, cada 30 min las redes se revisaron para verificar la captura de murciélagos, y registrar las especies de cada UM (Rizo-Aguilar et al. 2015); este método es efectivo para realizar estudios sobre diversidad y análisis comparativos de la comunidad de murciélagos (Bracamonte 2018). Para determinar la eficiencia del monitoreo, se obtuvieron las h red-1, al multiplicar los m2 de las redes usadas por cada UM por el número de horas activas y por el número de días de monitoreo (Briones-Salas et al. 2005). En este sentido, el esfuerzo de muestreo fue el mismo para cada UM, y se finalizó con un récord de 14 noches de muestreo, 448 h y 1 176 m de red, lo que indica una eficiencia de muestreo de 23 520 h por red.
Los murciélagos atrapados en la red se colocaron en bolsas de manta y se llevaron al punto de revisión, donde se les tomaron las siguientes características: peso, edad (Wilkinson y Brunet-Rossinni 2009), sexo, estado reproductivo y largo de antebrazo, con las que se identificó a nivel de especie (Medellín et al. 2008). Estos murciélagos se clasificaron con base en su tipo de dieta (insectívoros, nectarívoros-polinivoros, frugívoros, carnívoros y hematófagos) consultada en diferentes fuentes bibliográficas (Kunz 1982, Wilson 1997, Wilkinson 1984, Giannini y Kalko 2004) y se estimó la frecuencia de especies correspondiente a cada tipo de dieta. En una base de datos en Excel se llevó un registro del número de especies y el número de individuos por especie por UM por salida de campo. Previo a la liberación, los murciélagos se marcaron usando esmalte para identificar capturas dobles el mismo día de monitoreo.
Clasificación de los murciélagos con base en su respuesta a la fragmentación
Los murciélagos se clasificaron respecto a su respuesta a la fragmentación de hábitat en: Tipo I: Dependientes del hábitat: especies que habitan en la selva o bosque continuo o en grandes fragmentos. Tipo II: Vulnerables: especies que habitan los fragmentos de selva o bosque pero utilizan la vegetación riparia y los corredores que atraviesan los pastizales, pero sin salir hacia campo abierto. Tipo III: Adaptables: son especies que toleran la fragmentación del ambiente y se benefician con esta; utilizan selvas, bosques, ambientes transformados, remanentes, vegetación riparia, secundaria y árboles y arbustos aislados en los pastizales (Galindo-González 2004).
Análisis de datos de la comunidad de murciélagos
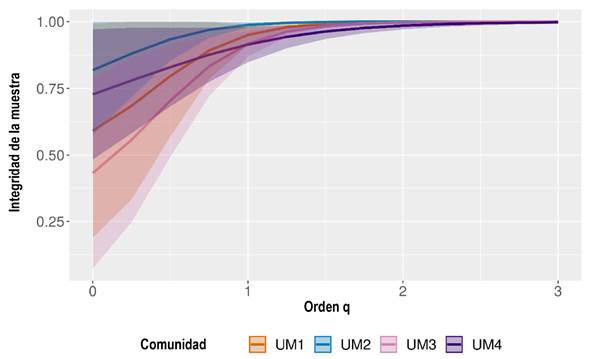
Para evaluar la cobertura de la muestra de la comunidad de murciélagos registrada en cada UM, se construyeron y compararon las curvas de acumulación de especies y la proporción de la cobertura de la muestra (Ĉ), mediante interpolaciones y extrapolaciones desarrollados en el software iNext (Chao et al. 2016). Con el mismo software, para cada UM se estimó el número efectivo de especies (Hill 1973) del orden 0 (q0), que se interpreta como la riqueza de especies (S), pues no es sensible a especies abundantes y brinda igual peso a especies raras; orden 1 (q1) o exponencial del índice de Shannon, que pondera a cada especie de acuerdo con su abundancia en la comunidad y se interpreta como el número de especies “comunes” en la comunidad; y orden 2 (q2) o inverso del índice de Simpson, el cual se considerada como el número de especies “muy abundantes” en la comunidad (Jost 2006). Se realizó un análisis comparativo de q0, q1 y q2 entre las UM a partir de inter y extrapolaciones con los cuales se obtuvieron sus intervalos de confianza calculados al 95% de confiabilidad. Cuando los intervalos de confianza no se traslapan indica que existen diferencias significativas entre sí (Cumming et al. 2007).
Para evaluar la estructura de la comunidad entre UM, se estimó el número compartido de especies entre UM y se calcularon los índices de similitud de Jaccard, Sørensen y Morisita-Horn (Chao et al. 2015) con el software SpadeR (Chao et al. 2015).
Resultados
Se capturaron 561 ejemplares de murciélagos de 26 especies, agrupadas en 5 familias, 7 subfamilias y 18 géneros (Tabla 1). Del total de especies registradas, 19 pertenecen a la familia Phyllostomidae, cuatro a la familia Mormoopidae, y las familias Emballonuridae, Molossidae y Natalidae estuvieron representadas por una especie, cada una. La especie más abundante fue Anoura geoffroyi con 131 individuos, la cual estuvo presente en la UM2 con 130 individuos y la UM3 con 1 individuo; la segunda especie más abundante fue Carollia perspicillata con 101 individuos, la cual estuvo presente en las cuatro UM. Las especies menos abundantes fueron Dermanura watsoni, Molossus molossus, Balantiopteryx plicata, Choeronycteris mexicana, Pteronotus fulvus, Leptonycteris nivalis, Natalus mexicanus, Centurio senex y Mormoops megalophylla con 1 individuo capturado, para cada especie.
Tabla 1 Murciélagos en diferentes bordes de BMM con distinta condición de perturbación en Finca La Pastoría, Huatusco, Veracruz. UM1: BMM, UM2: borde de pastizal-BMM, UM3: borde entre BMM-pastizal-área de cultivo de aguacate, UM4: borde entre BMM-vegetación secundaria y riparia.
| Abundancia | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Familia | Subfamilia | Género y especie (autor y año) | UM1 | UM2 | UM3 | UM4 | |||||
| Absoluta | Relativa | Absoluta | Relativa | Absoluta | Relativa | Absoluta | Relativa | Total | |||
| Phyllostomidae | Carollinae | Carollia perspicillata (Linnaeus, 1758) | 46 | 38.3 | 35 | 10.8 | 10 | 11.9 | 10 | 29.4 | 101 |
| Carollia sowelli (Baker et al. 2002) | 8 | 6.6 | 15 | 4.6 | 8 | 9.5 | 1 | 2.9 | 32 | ||
| Stenodermatinae | Sturnira ludovici (Anthony, 1924) | 23 | 19.1 | 48 | 14.9 | 15 | 17.9 | 6 | 17.6 | 92 | |
| Sturnira lilium (Geoffroy, 1810) | 22 | 18.3 | 49 | 15.2 | 15 | 17.9 | 5 | 14.7 | 91 | ||
| Dermanura tolteca (Saussure, 1860) | 11 | 9.1 | 0 | 0.0 | 0 | 0.0 | 0 | 0.0 | 11 | ||
| Dermanura phaeotis (Miller, 1902) | 1 | 0.8 | 3 | 0.9 | 4 | 4.8 | 7 | 20.6 | 15 | ||
| Artibeus jamaicensis (Leach, 1821) | 1 | 0.8 | 3 | 0.9 | 1 | 1.2 | 0 | 0.0 | 5 | ||
| Dermanura watsoni (Thomas, 1901) | 0 | 0.0 | 1 | 0.3 | 0 | 0.0 | 0 | 0.0 | 1 | ||
| Dermanura azteca (Andersen, 1906) | 2 | 1.7 | 4 | 1.2 | 3 | 3.6 | 0 | 0.0 | 9 | ||
| Artibeus lituratus (Olfers, 1818) | 0 | 0.0 | 2 | 0.6 | 1 | 1.2 | 0 | 0.0 | 3 | ||
| Platyrrhinus helleri (Peters, 1866) | 2 | 1.7 | 6 | 1.9 | 0 | 0.0 | 0 | 0.0 | 8 | ||
| Centurio senex (Gray, 1842) | 1 | 0.8 | 0 | 0.0 | 0 | 0.0 | 0 | 0.0 | 1 | ||
| Glossophaginae | Anoura geoffrogyi (Gray, 1838) | 0 | 0.0 | 130 | 40.2 | 1 | 1.2 | 0 | 0.0 | 131 | |
| Glossophaga mutica (Pallas, 1766) | 0 | 0.0 | 4 | 1.2 | 0 | 0.0 | 0 | 0.0 | 4 | ||
| Choeronycteris mexicana (Tschudi, 1844) | 0 | 0.0 | 0 | 0.0 | 1 | 1.2 | 0 | 0.0 | 1 | ||
| Leptonycteris nivalis (Saussure, 1860) | 0 | 0.0 | 1 | 0.3 | 0 | 0.0 | 0 | 0.0 | 1 | ||
| Glyphonycterinae | Glyphonycteris silvestris (Thomas, 1896) | 1 | 0.8 | 3 | 0.9 | 0 | 0.0 | 0 | 0.0 | 4 | |
| Mormoopidae | Desmodontinae | Desmodus rotundus (Geoffroy, 1810) | 0 | 0.0 | 2 | 0.6 | 8 | 9.5 | 3 | 8.8 | 13 |
| Diphylla ecaudata (Spix, 1823) | 0 | 0.0 | 1 | 0.3 | 3 | 3.6 | 0 | 0.0 | 4 | ||
| Mormoopidae | Pteronotus measoamericanus (Gray, 1843) | 0 | 0.0 | 1 | 0.3 | 7 | 8.3 | 0 | 0.0 | 8 | |
| Pteronotus fulvus (Gray, 1838) | 0 | 0.0 | 0 | 0.0 | 1 | 1.2 | 0 | 0.0 | 1 | ||
| Pteronotus personatus (Wagner, 1843) | 1 | 0.8 | 15 | 4.6 | 4 | 4.8 | 1 | 2.9 | 21 | ||
| Mormoops megalophylla (Peters, 1864) | 0 | 0.0 | 0 | 0 | 1 | 1.2 | 0 | 0.0 | 1 | ||
| Molossidae | Molossinae | Molossus molossus (Pallas, 1766) | 0 | 0.0 | 0 | 0 | 1 | 1.2 | 0 | 0.0 | 1 |
| Natalidae | Natalidae | Natalus mexicanus (Gray, 1838) | 0 | 0.0 | 0 | 0 | 0 | 0 | 1 | 2.9 | 1 |
| Emballonuridae | Emballonurinae | Balantiopteryx plicata (Peters, 1867) | 1 | 0.8 | 0 | 0 | 0 | 0 | 0 | 0.0 | 1 |
| Individuos por UM | 120 | 100 | 323 | 100 | 84 | 100 | 34 | 100 | 561 | ||
| Especies por UM (q0) | 13 | 18 | 17 | 8 | |||||||
La UM que presentó mayor abundancia absoluta de murciélagos fue la UM2, seguido la UM1, UM3 y UM4. La riqueza y abundancia de especies de murciélagos fue mayor en la UM2, seguida la UM3, UM1 y UM4 (Tabla 1). La UM2 y UM3 compartieron un mayor número de especies con respecto a las demás UM evaluadas. La UM1 compartió 10 especies con la UM2, ocho con la UM3, y seis con la UM4. La UM2 y la UM 3, compartieron, cada una, siete especies con la UM 4 (Tabla 2).
Tabla 2 Especies de murciélagos compartidas entre pares de UM (debajo de la diagonal), valor de similitud de Jaccard entre pares de UM (encima de la diagonal) y distancia en metros lineales entre UM (entre paréntesis).
| UM1 | UM2 | UM3 | UM4 | |
|---|---|---|---|---|
| UM1 | - | 0.54 | 0.31 | 0.48 |
| UM2 | 10(770) | - | 0.54 | 0.48 |
| UM3 | 8(1150) | 13 (650) | - | 0.32 |
| UM4 | 6(1900) | 7 (1124) | 7(1500) | - |
El índice de Sørensen indicó que las cuatro UM tienen una similitud del 0.7143 ± 0.039 (ICS = 0.784, ICI = 0. 645), mientras que el índice de Jaccard indicó un 0.73 ± 0.025 (ICS = 0.78, ICI = 0.683), es decir, comparten en promedio entre el 71 y 73% de la estructura de la comunidad de murciélagos, respectivamente. Por su parte, el índice Morisita-Horn mostró un valor promedio de 0.598 ± 0.041 (ICS = 0.678, ICI = 0.518) y un valor de traslape regional de 0.8563 ± 0.024 (ICS = 0.902, ICI = 0.8111) de semejanza en la estructura de la comunidad de murciélagos.
La comunidad de murciélagos se clasificaron en cuatro tipos de dieta: Frugívoro (14 spp; 53%), Insectívoro (8 spp; 31%), Nectarívoro/Polinivoro (2 spp; 7.5%) y Hematófago (2 spp; 7.5%). Por su parte, la respuesta de la comunidad de murciélagos ante la fragmentación estuvo compuesta por 13 (50%) especies de murciélagos que son “vulnerables” a la perturbación, 11 (42%) especies de murciélagos “adaptables” y dos especies “dependientes” de hábitat (8%) (Tabla 3).
Tabla 3 Clasificación de los murciélagos con base en los tipos de dieta (F: frugívoros; N/P: nectarívoros/polinivoros; H: hematófagos; I: insectívoros) y por su respuesta a la perturbación en fragmentos de borde de BMM, Huatusco, Veracruz.
| Especie | Tipo de dieta | Clasificación por tipo de respuesta al hábitat | |||||
|---|---|---|---|---|---|---|---|
| F | N/P | H | I | Tipo I. | Tipo II. | Tipo III. | |
| Dependientes | Vulnerables | Adaptables | |||||
| C. perspicillata | 101 | ||||||
| C. sowelli | 32 | ||||||
| S. ludovici | 92 | ||||||
| S. lilium | 91 | ||||||
| D. tolteca | 11 | ||||||
| D. phaeotis | 15 | ||||||
| A. jamaicensis | 5 | ||||||
| D. azteca | 9 | ||||||
| B. plicata | 1 | ||||||
| G. silvestris | 4 | ||||||
| P helleri | 8 | ||||||
| P. personatus | 21 | ||||||
| A. geoffrogyi | 131 | ||||||
| C. senex | 1 | ||||||
| D. watsoni | 1 | ||||||
| A. litoratus | 3 | ||||||
| D. rotundus | 13 | ||||||
| G. mutica | 4 | ||||||
| P. measoamericanus | 8 | ||||||
| L. nivalis | 1 | ||||||
| D. ecaudata | 4 | ||||||
| M. megalophylla | 1 | ||||||
| P fulvus | 1 | ||||||
| M. molossus | 1 | ||||||
| C. mexicana | 1 | ||||||
| N. mexicanus | 1 | ||||||
| Abundancia/proporción | 501 | 5 | 17 | 38 | |||
| Riqueza/Especies | 14 | 2 | 2 | 8 | |||
En todas las UM se obtuvo una cobertura de muestreo superior al 90% (ĈUM1 = 0.95, ĈUM2 = 0.99, ĈUM3 = 0.92, ĈUM4 = 0.91), es decir, que se capturó más del 90% de la riqueza de murciélagos esperada, lo cual es indicador de que el muestreo fue representativo. La cobertura de muestreo fue significativamente similar entre las UM con respecto al número efectivo de especies del orden q0, q1 y q2 (Figura 2).
Discusión
El muestreo de este estudio fue representativo de la estructura de la comunidad de murciélagos, ya que se registraron valores superiores al 90% de la cobertura de la muestra teórica-esperada en cada UM. Esta efectividad en la cobertura de la muestra refleja la estructura de la comunidad de murciélagos en los diferentes tipos de borde, pues se muestrearon los horizontes del paisaje desde el nivel del suelo, el sotobosque y parte del dosel, aunque las especies que forrajean por encima del dosel tuvieron menores probabilidades de ser capturadas (Mellado et al. 2022). Esto posiblemente explica por qué las especies de la familia Phyllostomidae estuvieron mejor representadas en este estudio, ya que forrajean en los estratos bajos e intermedios del bosque, además, superaron en número de especies a otras familias de murciélagos que forrajean sobre el dosel del bosque como la Mormoopidae, Molossidae, Natalidae y Emballonuridae que presentaron bajos valores riqueza y abundancia (Kraker-Castañeda et al. 2013).
La riqueza de murciélagos registrados en este estudio supera a las reportadas en BMM y plantaciones de café reportados en estudios realizados en el centro de Veracruz (11 especies de murciélagos, Pineda et al. 2005), representa más de la mitad especies de murciélagos registrados en la Reserva de la Biosfera Montes Azules, la cual cuenta con presencia de BMM (50 especies de murciélagos, Medellin 1993). Al comparar nuestros resultados con otras zonas con presencia de BMM que se consideran como las de mayor riqueza de murciélagos de México, son diferentes por cuatro especies en la Sierra de Taxco, Guerrero (30 especies de murciélagos, León-Paniagua y Romo-Vázquez 1993) y seis especies en el Valle de Tehuacán-Cuicatlán (34 especies de murciélagos, Martínez y Banuet 1996).
En el estudio se capturó la mayor riqueza y abundancia de murciélagos en el borde de pastizal-BMM (UM2, 323 individuos pertenecientes a 18 especies) comparado con los bordes de las otras UM. Este comportamiento de relación diversidad-borde también se ha registrado en otros estudios, en los que los bordes presentan mayor riqueza y abundancia de especies de murciélagos en relación con sitios donde la vegetación aparenta estar más conservada (Calderón-Patrón et al. 2013), sin embargo, es en las áreas de borde con vegetación del bosque original y vegetación secundaria con diferentes estados sucesionales, donde concurre una mayor diversidad de recursos alimenticios que los murciélagos aprovechan para complementar su dieta (Willig et al. 2007, García-García y Santos-Moreno 2014). La variación en la diversidad de murciélagos en los bordes de la diferentes UM pueden estar asociadas a los cambios en la diversidad y disposición de la vegetación, donde los murciélagos se desplazan hacia estos sitios que ofrecen mayor variedad de recursos (Sosa et al. 2008). Sin embargo, observamos una similitud entre la diversidad de murciélagos en el borde de BMM-cultivo de aguacate-pastizal, posiblemente por ser espacios que los murciélagos frugívoros también usan como área de forrajeo o de desplazamiento (Galindo-González y Sosa 2003).
Los cuatro tipos de dieta en los que se clasificaron los murciélagos registrados en este estudio, presentaron proporciones diferentes a las reportadas en otros estudios, por ejemplo, para un gradiente altitudinal con presencia de BMM en la Sierra Mazateca, Oaxaca se reportan especies con tres tipos de dieta (insectívora, hematófaga y frugívora) y una especie omnívora (Briones-Salas et al. 2005), mientras que en zonas cafetaleras cercanas a BBM en el Volcán de Tacaná también se encontraron los cuatro tipos de dieta, donde las especies frugívoras estuvieron mejor representadas (Sáenz y Horváth 2013). Es importante resaltar que A. geoffrogyi con tipo de dieta frugívora fue la especie dominante y la del mayor número de individuos registrados en el borde pastizal-BMM (UM2), esta especie aprovecha los sitios perturbados entre los bosques, ya que le proveen una mayor variedad de recursos alimentarios en comparación con sitios conservados (Caballero-Martínez et al. 2009). Pteronotus personatus con tipo de dieta insectívora se registró en las cuatro UM, esta presencia puede deberse a que en los sitios de borde existe disponibilidad de insectos que forman parte de su dieta (Calderón-Patrón et al. 2013). Las especies de murciélagos con tipo de dieta nectarívora y hematófaga estuvieron representados por un bajo número de individuos, pero su presencia en estos sitios de borde se debe a la existencia de plantas con flores y al ganado bovino que pastorea en el área estudio, respectivamente (Galindo-González 2004).
Las especies agrupadas en la categoría Tipo II “Vulnerables” corresponden a las familias Phyllostomidae, Mormoopidae y Natalidae, pero exclusivamente registramos que nueve especies con tipo de dieta frugívora, una hematófaga y una insectívora (Tabla 3) son las más afectadas por el efecto de borde. Esto coincide con otros estudios en los que especies representantes de estas familias, principalmente de la Subfamilia Phyllostominae, son las que presentan esta respuesta ante la fragmentación del hábitat; esto además de indicarnos que aunque estas especies son tolerantes a la fragmentación del bosque, el incremento de la fragmentación sumado con otros factores de origen antrópogenico que amenazan el bosque, afectarían a P. personatus y N. mexicanus ya que podrían estar riesgo de extinción local, debido a su dependencia de hábitat (Medellín et al. 2000, Medellín et al. 2014).
Las especies agrupadas en la categoría Tipo III “Adaptables” corresponden a las familias Phyllostomidae, Mormoopidae y Molossidae, las cuales se registraron con más abundancia en las UM2 y UM3, posiblemente se adaptan/benefician con los cambios en la estructura de la vegetación, pues su alta abundancia es una respuesta esperada para esta categoría. Las especies de las familias Phyllostomidae y Emballonuridae del Tipo I “Dependientes del hábitat” se encontraron únicamente en la UM1, posiblemente porque la masa de BMM está más conservada en el área de estudio (Galindo-González 2007, Sosa et al. 2008).
Especies cómo Centurio senex y Balantiopteryx plicata registradas en este estudio, tienen requerimientos de hábitat y de alimentación específicos que solo encuentran dentro de la masa de BMM, lo que los hace sensibles a la perturbación del hábitat (Santos-Moreno et al. 2010, Nagy et al. 2014), por lo que encontrarlas exclusivamente en el área de estudio indica que el fragmento de BMM estudiado se encuentra en buen estado de conservación a pesar de la fragmentación. Esto también puede evaluarse a través de los valores de los índices de Jaccard, Sørensen y Morisita-Horn, los cuales mostraron valores superiores al 50% de asociación o semejanza en la comunidad de murciélagos estudiada, esta estructura espacial de la comunidad indica que áreas con bordes de BMM albergaron una estructura en la comunidad de murciélagos con diferentes necesidades de hábitat, donde la permanencia de cada especie depende directamente del grado de conservación o fragmentación del bosque (Mendoza-Sáenz et al. 2017).
Conclusiones
El fragmento de BMM en Finca La Pastoría en Huatusco, Veracruz, México, presenta condiciones favorables para el mantenimiento de la comunidad de murciélagos, aunque el lugar tiene condiciones de perturbación, algunas especies de la comunidad de murciélagos lejos de verse afectadas, se adaptaron a los cambios y variaciones en diferentes bordes del BMM. La UM2 en un borde entre BMM y pastizal presentó una estructura de la comunidad de murciélagos similar al de UM en zonas conservadas; esto indica que los bordes juegan un papel importante como sitios de forrajeo para los murciélagos y como conexiones entre el BMM y la matriz agropecuaria. Los tipos de dieta de la comunidad de murciélagos son un indicador de la diversidad de recursos alimenticios y del estado de conservación del fragmento de BMM, ya que en este paisaje los murciélagos encuentran espacios de hábitat como refugios, zonas de reproducción y alimentación, por lo que el área de estudio podría protegerse mediante diferentes programas de manejo, conservación e investigación que existen en México.











 nueva página del texto (beta)
nueva página del texto (beta)