Introducción
En el manejo de las enfermedades fitopatógenas, la nanotecnología ha tomado gran importancia, mediante el uso de nanopartículas y nanomateriales, por poseer la propiedad de penetrar distintas membranas biológicas (Rojas et al. 2020). El uso de nanopartículas tiene como objetivo reducir las cantidades de plaguicidas y mejorar la eficiencia con nanopartículas de plata (Ghosh et al. 2012) así mismo el uso de nanocompuestos Fe3O4/Ag con efectos antibacterianos (Changanaquí et al. 2019), otro ejemplo clave del uso de nanotubos de carbono es para el transporte de fármacos que favorecen la actividad antibacteriana (Andrade et al. 2012).
Por otra parte, la producción de cultivos hortofrutícolas se ve afectada por varias enfermedades agrícolas, como aquellas inducidas por hongos, generando daños severos en los cultivos y ocasionando pérdidas económicas significativas. Por lo que, enfermedades como fusariosis, marchitez o secadera, causadas por Fusarium oxysporum y F. solani, ocasionan daños en chile, tomate, papa, apio, fresa, entre otros (Mariscal et al. 2017, García et al. 2018). Otra enfermedad es la caspa negra y cancro en tallo de la papa causada por Rhizoctonia solani (Arcos y Zúñiga 2015), el patógeno causa daños cuantitativos y cualitativos en los cultivos de papa en todo el mundo, aunque también puede infectar a un extenso grupo de plantas de diferentes especies de importancia económica (Gour 2012).
El moho negro causado por Alternaria alternata afecta plantas y frutos de tomate (Coromoto y Reyes 2018). Algunas especies de Alternaria producen metabolitos secundarios (alternariol y las altertoxinas I, II y III) con propiedades toxicas (Benavidez et al. 2013). Sin embargo, la antracnosis causada por Colletotrichum acutatum y C. gloeosporoides en frutos de aguacate (Campos et al. 2016), afecta numerosas plantas y frutos (Farr y Rossman 2021) siendo la enfermedad de postcosecha más importante en muchas regiones y en los países productores (Dann et al. 2013).
Actualmente se hace uso indiscriminado de fungicidas sintéticos para el control de estas enfermedades, ocasionando resistencia de fitopatógenos, contaminaciones al medio ambiente y en consecuencia daños a la salud humana (Dadaby y Tulk 2015). Por tanto, el uso de microorganismos benéficos del género Bacillus spp. (Pedraza et al. 2019), particularmente B. subtillis y B. amyloliquefaciens producen lipopéptidos o metabolitos secundarios como: iturina, surfactina, fengicina y bacilomicina (Mora et al. 2011, Beric´ et al. 2012) con actividad funguicida sobre fitopatógenos comunes y con resistencia a funguicidas químicos (Cochrane y Vederas 2014). En este sentido, en la presente investigación se consideraron aspectos para buscar una alternativa de manejo utilizando insumos de menor impacto ambiental, pero con alta efectividad, para integrarla a las prácticas del manejo de enfermedades fungosas. El objetivo de este trabajo fue evaluar el efecto inhibitorio de nanotubos de carbono de pared múltiple suplementados con extractos de B. amyloliquefaciens sobre el desarrollo micelial de F. solani, R. solani, A. alternata y C. acutatum en condiciones in vitro.
Materiales y métodos
Microorganismos utilizados
Los hongos fitopatógenos F. solani, R. solani, A. alternata y C. acutatum, fueron aislados, purificados e identificados en el laboratorio de Toxicología de la UAAAN, los cuales se cultivaron en medio de cultivo Agar Dextrosa y Papa (PDA) (BD Bioxon®). La cepa de B. amyloliquefaciens fue proporcionada por la empresa Culta S.A. de C.V. con domicilio en Cd. Mante Tamaulipas, México, y preservada en medio de cultivo Agar Nutritivo (AN) (TM Media®) para su posterior uso.
Obtención de extractos de B. amyloliquefaciens
Se preparó un litro de medio de cultivo líquido para la producción de iturinas (Mckeen et al. 1986); se ajustó el pH a 6.0 y se esterilizó en autoclave durante 15 min a 121 ◦C. Posteriormente se dejó enfriar a temperatura ambiente y después se inoculó con 1 mL de suspensión bacteriana 1x106 UFC, dejando en incubación a 30 ◦C y en agitación constante (150 rpm) por tres días. Transcurrido el tiempo se realizó el extracto, removiendo las bacterias por centrifugación a 5 000 rpm por 20 min y filtración con filtros de 0.22 µm de diámetro de poro (Linktor® Syringe filters) obteniendo el extracto crudo de B. amyloliquefaciens (EBa) y se conservó a 4 ◦C protegida de la luz.
Funcionalización de nanotubos de carbono de pared múltiple (MWCNT)
Se utilizaron MWCNT (Sigma-Aldrich®) con un diámetro externo de 50 a 60 nm y 95% de pureza. Para la funcionalización de los MWCNT se modificó la técnica usada por (Cabello et al. 2016), procediendo a dispersar 5 mg de MWCNT en 25 mL de ácido clorhídrico al 11%, la solución ácida se sonificó sumergiendo la sonda de ultrasonido (Branson® Sonifier 450) a 35% de potencia constante durante 20 min y una temperatura de 60 ◦C. Transcurrido el tiempo de sonificación se centrifugó a 10 000 rpm por 15 min eliminando el sobrenadante por decantación y se realizaron tres lavados con agua destilada estéril. Posteriormente, los MWCNT modificados se mezclaron en 25 mL de agua destilada estéril y otra muestra en 25 mL de extracto de B. amyloliquefaciens, las muestras fueron almacenadas a 4 ◦C para su conservación.
Evaluación in vitro de MWCNT funcionalizados con extractos de B. amyloliquefaciens sobre hongos fitopatógenos
Se seleccionó el hongo F. solani para determinar la ventana biológica de los bioensayos de inhibición donde se evaluaron tres tratamientos: Extracto de B. amyloliquefaciens (EBa), MWCNT modificados mezclados en agua destilada estéril (MWCNT + H2O), MWCNT modificados y mezclados con extracto de B. amyloliquefaciens (MWCNT + EBa) y Testigo (PDA sin tratamiento) con 10 repeticiones, se prepararon nueve dosis (0.1, 0.5, 1, 2.5, 5, 8, 16, 32 y 40 mL L−1 de medio de cultivo PDA) para cada tratamiento y una vez que se obtuvieron las dosis inhibitorias (Di 70 y Di 90), se realizó una prueba de efectividad biológica usando las dosis recomendadas para (Di 70 y Di 90) de cada tratamiento con 20 repeticiones sobre los fitopatógenos F. solani, R. solani, A. alternata y C. acutatum. Se usó el método de medio de cultivo envenenado (Ochoa et al. 2012), posteriormente se colocaron explantes de 0.5 cm de diámetro al centro de la placa con cada fitopatógeno evaluado y se incubaron a 25 ± 2 ◦C en oscuridad hasta que el crecimiento de micelio del testigo (PDA sin tratamiento) alcanzó las medidas de la placa. El crecimiento micelial se midió cada 24 h con un vernier, los datos de crecimiento se usaron para calcular los porcentajes de inhibición mediante la siguiente fórmula: (PICR = [(R1-R2)/R1] x 100), donde PICR = Porcentaje de inhibición del Crecimiento Radial, R1 = crecimiento micelial del testigo, R2 = crecimiento micelial del tratamiento.
Análisis estadístico
Se utilizaron los datos obtenidos de porcentaje de inhibición donde se calculó el promedio inhibitorio en cada dosis y para cada tratamiento utilizado, los cuales fueron graficados mediante el programa estadístico R Studio versión 4.0.0. Para la determinación de las dosis inhibitorias (D i 70 y D i 90) se calcularon por análisis Probit mediante el programa estadístico Statistical Analysis System versión 9.0 utilizando los datos de PICR obtenidos por medio de la fórmula. En las pruebas de efectividad biológica se realizó un análisis de varianza completamente al azar (ANOVA) y una comparación de medias por Tukey con un nivel de significancia (p 0.05) mediante el programa estadístico R Studio versión 4.0.0.
Resultados y discusión
Evaluación in vitro de MWCNT funcionalizados con extractos de B. amyloliquefaciens sobre hongos fitopatógenos
Se evaluaron nueve dosis por cada tratamiento sobre F. solani donde se observó efecto inhibitorio a partir de 2.5 a 40 mL L−1 (Figura 1). El tratamiento de MWCNT+ EBa presentó el 100% de inhibición de F. solani desde la dosis de 8 mL L−1, seguido del tratamiento EBa que presentó inhibiciones de 57 y 90% de F. solani a las dosis de 32 y 40 mL L−1, respectivamente y el tratamiento que presentó menor inhibición fue MWCNT+ H2O (60%) a la dosis de 40 mL L−1, esto puede deberse al efecto sinérgico que se produce al combinarse los nanotubos funcionalizados con los metabolitos (Iturinas) presentes en el extracto de B. amyloliquefaciens, ya que fue cultivada en medio de cultivo especifico. Con los datos obtenidos PICR se realizó la determinación de las dosis inhibitorias de los tratamientos evaluados (Tabla 1), muestran que el tratamiento MWCNT+ EBa presentó las concentraciones más bajas para inhibir F. solani con D i 70 = 5.94 mL L−1 y D i 90 = 8.14 mL L−1, lo cual muestra un alto efecto inhibitorio sobre este fitopatógeno al aplicar los nanotubos funcionalizados con el extracto. A continuación, el tratamiento EBa presentó concentraciones de D i 70 = 35.46 mL L−1 y D i 90 = 64.43 mL L−1, y las dosis más altas requeridas para inhibir F. solani fueron de MWCNT + H2O, que presentó concentraciones de D i 70 = 62.46 mL L−1 y D i 90 = 186.58 mL L−1, al comparar estas dosis difieren con las utilizadas por Mejía et al. (2016) donde para inhibir la germinación de conidios de Fusarium sp. en un 100% usaron la cantidad de 1 mL de extracto de B. subtilis disueltos en 1 mL de suspensión de 1x108 conidios/mL (1:1 v/v), lo que correspondería a usar 125 mL de EBa por cada 125 mL de medio de cultivo PDA y obtener un volumen final de 250 mL de medio envenenado, sin embargo, en este estudio la cantidad máxima a utilizada de EBa fue de 64.43 mL L−1 (D i 70), dosis que alcanzó el 100% de inhibición micelial en los cuatro hongos fitopatógenos evaluados. Es importante señalar que a la fecha no se tienen reportes científicos sobre las dosis inhibitorias obtenidas de la inhibición micelial de nanotubos de carbono con extractos de B. amyloliquefaciens.
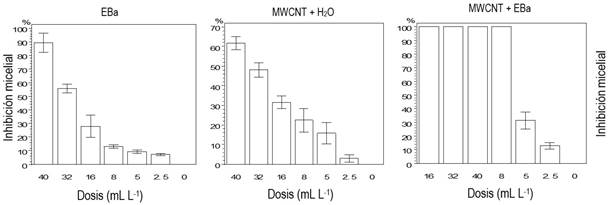
Figura 1 Efecto inhibitorio de nanotubos funcionalizados sobre F. solani. EBa = Extracto de B. amilolyquefaciens, MWCNT + H2O = Nanotubos de carbono funcionalizados y mezclados con agua, MWCNT + EBa = Nanotubos de carbono funcionalizados y mezclados con EBa
Tabla 1 Determinación de dosis inhibitorias de los tratamientos sobre F. solani
| Tratamiento | Dosis inhibitoria | Dosis probable (mL L−1) | Limite fiducial inferior 95% | Limite fiducial superior 95% |
| MWCNT + EBa | D i 70 | 5.94 | 5.37 | 6.73 |
| D i 90 | 8.14 | 7.13 | 9.84 | |
| EBa | D i 70 | 35.46 | 31.03 | 42.53 |
| D i 90 | 64.43 | 51.81 | 89.52 | |
| MWCNT + H2O | D i 70 | 62.46 | 51.21 | 79.65 |
| D i 90 | 186.58 | 137.83 | 272.97 |
EBa = Extracto de B. amilolyquefaciens, MWCNT + H2O = Nanotubos de carbono funcionalizados y mezclados con agua y MWCNT + EBa = Nanotubos de carbono funcionalizados y mezclados con EBa
Mediante las pruebas de efectividad biológica se demostró que aplicando las dosis obtenidas por el análisis Probit sobre los diferentes hongos fitopatógenos (Figura 2), los tratamientos presentaron diferencias significativas Tukey (p ≤ 0.05): para el caso de R. solani y F. solani, los EBa (T1.1 y T1.2) correspondieron a las D i (70 y 90) ambos tratamientos presentaron efecto inhibitorio de 100%, desde las primeras 24 h hasta 120 y 168 h ya que en este tiempo el crecimiento del testigo alcanza las medidas de la placa (Figura 3), mientras que en los hongos C. acutatum y A. alternata los T1.2 alcanzaron el 100% de inhibición a partir de 24 h hasta 168 y 216 h y en los T1.1 se obtuvieron valores de inhibición superiores a 90 y 80%, respectivamente. Los resultados obtenidos concuerdan con lo reportado por Badía et al. (2011), quienes indicaron que Fusarium sp. es inhibido en 90.42% y A. alternata en 87.28% utilizando cepas de Bacillus spp. (LSB9 y LSB10). Rios et al. (2015) reportaron que B. amyliliquefaciens inhibió el desarrollo de A. alternata en 64%, además Leyva et al. (2017) señalaron que los metabolitos de B. amyloliquefaciens (CCIBP-A5) inhibieron el crecimiento de F. oxysporum f. sp. cubense en 77.18%, También, Mizumoto et al. (2006) indicaron que al usar la iturina A obtenida por fermentación de B. subtilis se redujo la incidencia de R. solani en 76%. Por su parte, Ragazzo et al. (2011) reportaron efecto inhibitorio de la iturina A, detectada en halos de inhibición en confrontaciones de B. subtilis y B. licheniformis frente a C. gloeosporoides y Colletotrichum sp.
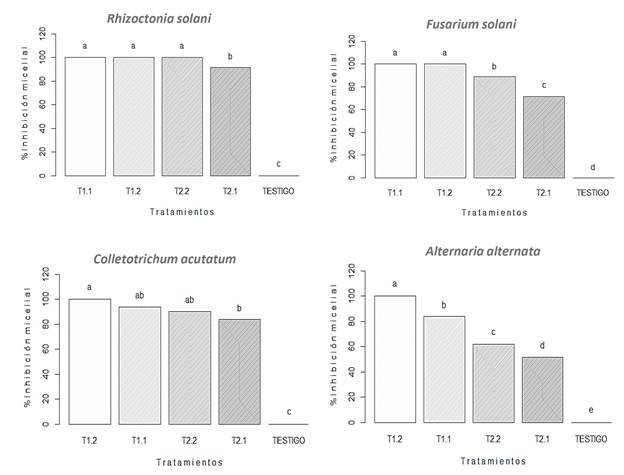
Figura 2 Efectividad biológica de dosis inhibitorias sobre hongos fitopatógenos. T1.1 = Di 70 EBa, T1.2 = Di 90 EBa, T2.1 = Di 70 NTCMW + EBa, T2.2 = Di 90 NTCMW + EBa. Medias con la misma letra en cada grafica son iguales y tratamientos con diferente letra son estadísticamente diferentes Tukey (p ≤ 0.05)

Figura 3 Efecto inhibitorio in vitro de dosis inhibitorias sobre hongos fitopatógenos. T1.1 y T1.2 = Di 70 y Di 90 de EBa, T2.1 y T2.2 = Di 70 y Di 90 de NTCMW + EBa y Tx = Testigo
Los MWCNT + EBa (T2.1 y T2.2, de la Figura 2), que equivalen a las Di (70 y 90): en R. solani el T2.2 presentó un valor de 100% de inhibición y el T2.1 superó el 90%. Se obtuvo un efecto similar en C. acutatum, donde el T2.2 inhibió el 90% y el T2.1 superó el 80%. Por otra parte, en F. solani ambos tratamientos lograron obtener los valores esperados de 70 y 90% de inhibición, solo en el caso de A. alternata los tratamientos evaluados T2.1 y T2.2, mostraron valores de 50 y 60% de inhibición, respectivamente. Hasta el momento el único estudio donde reportan el efecto antifúngico de MWCNT lo realizó Sarlak et al. (2014), reportando efectos inhibitorios sobre A. alternata ya que usaron MWCNT-g-PCA-EP (Material hibrido de nanotubos de carbono de pared múltiple con encapsulados de moléculas fungicidas de zineb) en condiciones in vitro. En otros estudios se ha demostrado el efecto inhibitorio que tienen las nanopartículas sobre los hongos fitopatógenos, Pariona et al. (2018) señalaron que las nanopartículas de cobre (NPs-Cu) lograron un 87 y 90% de inhibición de crecimiento de micelio de F. solani con dosis de 0.75 y 1 mg mL−1, respectivamente. Correa et al. (2018) reportaron un 100% de inhibición micelial en los hongos: A. alternata, C. gloeosporoides, C. fragariae y Rhizopus stolonifer usando nanoparticulas de quitosano y aceite esencial de tomillo (NPs-TEO- Np 3 y 5%).
Los extractos de B. amyloliquefaciens (EBa) mostraron efecto inhibitorio de 100% sobre el crecimiento micelial de los hongos fitopatógenos evaluados, usando una dosis alta de 64.43 mL L−1, pero la ventaja de utilizar nanotubos de carbono de pared múltiple funcionalizados y mezclados con el extracto (MWCNT + EBa) se demostró que se requieren dosis bajas ya que con 8.14 mL L−1 se logró un efecto inhibitorio en los hongos R. solani, F. solani, C. acutatum y A. alternata de (100, 90, 90 y 60%) a partir de 24 h, respectivamente, ya que estos patógenos afectan a los cultivos en crecimiento y postcosecha, por lo que este tratamiento se puede considerar como una alternativa en el manejo de hongos fitopatógenos, con insumos de bajo costo y amigables con el medio ambiente











 nueva página del texto (beta)
nueva página del texto (beta)



