Introducción
La marchitez prematura o damping off es una enfermedad que se presenta en plántulas, originada por diversos agentes fitopatógenos, se manifiesta con síntomas de estrangulamiento, marchitez, declive del crecimiento y muerte repentina (Vásquez et al. 2009, Robledo 2016, Stouvenakers et al. 2020). El grupo de organismos denominados oomycetes, acoge especies señaladas como causantes predominantes de la marchitez prematura de plántulas, especialmente las pertenecientes al género Pythium (Sweet 2020). Para ese género se han descrito aproximadamente 160 especies cosmopolitas, versátiles y patogénicas (Grijalba y Ridao 2017, Marciulynas et al. 2020). La mayoría de especies de Pythium son homotálicas y se caracterizan por formar estructuras de origen sexual y asexual; desarrollan micelio hialino con hifas cenocíticas, hinchamientos, oosporas, esporangios globosos o irregulares que liberan zoosporas como fuente de inóculo (Del Castillo et al. 2019). Esas zoosporas tienen capacidad de desplazamiento y dispersión a largas distancias en ambientes acuáticos, lo que facilita su obtención con cebos trampa colocados en dichos hábitats (Oudemans 1999, Bush et al. 2003, Redekar et al. 2020). Algunos ejemplares encontrados en aguas superficiales son: P. aphanider- matum, P. catenulatum, P. debaryanum, P. deliense, P. mamillatum y P. ultimum (Hong y Moorman 2005, Nongnuch et al. 2014, Slavov et al. 2018). Por otro lado, West et al. (2003) señalan que las enfermedades originadas por Pythium spp. son comunes y originan pérdidas estimadas en miles de millones de dólares en todo el mundo. Especies como: P. lutarium, P. oopapillum, P. sylvaticum y P. torulosum causaron pérdidas del 20% en soya y maíz (Zitnick y Nelson 2015, Matthiesen et al. 2016) y P. aphanider-matum del 75% en plántulas de pepino (Al-Balushi et al. 2018, Morris et al. 2016). Mientras que en México, P. aphanidermatum, P. cylindrosporum, P. dissotocum, P. irregulare, P. ultimum, P. splendens, P. arrhenomanes y P. amazonianum causan pérdidas económicas en plantas de ornato, alfalfa, frijol, maíz, chile, tomate y aguacate (Vázquez et al. 2009, Díaz et al. 2011, Martínez et al. 2016, Rivera y Fernández 2017, Ochoa et al. 2018, Reyes et al. 2018, Velásquez et al. 2018).
Por otro lado, la identificación de organismos fitopatógenos convencionalmente se realizaba mediante observación y medición de estructuras vegetativas y de origen sexual o/y asexual, también por observación y comparación mediante el uso de microscopio óptico y claves pictóricas, respectivamente; pero actualmente se sabe que algunas especies comparten características morfológicas, razón por la que su identificación y diagnóstico como agentes fitopatógenos puede resultar erróneo con esas prácticas (Díaz et al. 2011). No obstante, técnicas de laboratorio basadas en extracción, amplificación y secuenciación de regiones específicas de ácidos nucleicos, contribuyen a la identificación concreta y eficaz de organismos (Robledo 2016, Trzewik et al. 2016).
Por otra parte, con la finalidad de detectar o monitorear oomycetes presentes en agua o suelo, se emplearon frutos, hojas o semillas de diversas especies vegetales, con el propósito de atraer zoosporas que infecten el tejido vegetal y a partir del tejido infectado aislarlos (Bennet y Thines 2020, Frankel et al. 2020, Rai y Guest 2020). Debido a lo anterior, el objetivo de esta investigación fue determinar la presencia de especies fitopatógenos del género Pythium en aguas empleadas para la irrigación agrícola en Culiacán, Sinaloa, México.
Materiales y métodos
Obtención, purificación y conservación de aislados de Pythium spp
Del 1 de septiembre de 2018 al 20 de febrero de 2019, se recorrió y muestreó en 28 localidades un total de 39 puntos en sitios de almacenamiento y transporte de agua para uso agrícola (Presas, ríos, canales, diques, entre otros) de la red hídrica del municipio de Culiacán, Sinaloa, México. Los sitios (Tabla 1), se localizaron con información sobre fuentes de almacenamiento y distribución de agua de uso agrícola disponible en la Comisión Nacional del Agua.
Tabla 1 Sitios de muestreo, Culiacán, Sinaloa, México
| Localidad | Cuerpo de agua | Coordenadas del punto de muestreo |
| 25° 10’ 08” N 107° 26’ 10” W | ||
| 25° 09’ 10” N 107° 26’ 11” W | ||
| Presa Adolfo López Mateos | Presa | 25° 09’ 56” N 107° 26’ 30” W |
| 25° 09’ 10” N 107° 26’ 11” W | ||
| 25° 09’ 56” N 107° 26’ 30” W | ||
| La Presita | Rio | 24° 55’ 49” N 107° 25’ 39” W |
| Empaque Castro | Rio | 24° 55’ 28” N 107° 31’ 59” W |
| Rio | 24° 55’ 07” N 107° 33’ 32” W | |
| El Tamarindo | 24° 55’ 11” N 107° 32’ 57” W | |
| Canal de distribución | 24° 53’ 20” N 107° 29’ 17” W | |
| Empaque Valle del sol | 24° 48’ 37” N 107° 08’ 11” W | |
| Presa | 24° 48’ 46” N 107° 08’ 14” W | |
| Presa Sanalona | 24° 48’ 49” N 107° 08’ 30” W | |
| Rio | 24° 49’ 00” N 107° 11’ 16” W | |
| Río Tamazula | 24° 48’ 53” N 107° 21’ 29” W | |
| Río Humaya | Rio | 24° 51’ 48” N 107° 24’ 25” W |
| Estanque | 24° 49’ 23” N 107° 23’ 06” W | |
| Jardín Botánico | 24° 49’ 24” N 107° 23’ 04” W | |
| Imala | Rio | 24° 51’ 21” N 107° 13’ 11” W |
| Rio | 24° 48’ 43” N 107° 24’ 24” W | |
| Tres Ríos | 24° 48’ 24” N 107° 24’ 33” W | |
| Bellavista | Canal de distribución | 24° 48’ 45” N 107° 27’ 56” W |
| Bachigualato | Canal de distribución | 24° 46’ 59” N 107° 26’ 48” W |
| Aguaruto | Canal de distribución | 24° 47’ 49” N 107° 30’ 24” W |
| Río | 24° 46’ 10” N 107° 30’ 19” W | |
| Campo Batan | Reservorio agrícola | 24° 45’ 40" N 107° 30’ 45” W |
| Campo Moroleón | Río | 24° 41’ 14” N 107° 31’ 09” W |
| Campo Cardenal | Río | 24° 45’ 10” N 107° 28’ 39” W |
| Dique La Primavera | Dique | 24° 43’ 48” N 107° 24’ 10” W |
| Estación Hazera | Canal de distribución | 24° 43’ 32” N 107° 27’ 24” W |
| Estación Enza Zaden | Canal de distribución | 24° 40’ 58” N 107° 28’ 47” W |
| Estación Monsanto | Canal de distribución | 24° 40’ 37” N 107° 28’ 50” W |
| Campo Divemex | Canal de distribución | 24° 39’ 46” N 107° 26’ 58” W |
| Estación US Agriseeds | Canal de distribución | 24° 38’ 11” N 107° 26’ 38” W |
| Estación Syngenta | Canal de distribución | 24° 37’ 08” N 107° 26’ 41” W |
| Estación Rijk Zwaan | Canal de distribución | 24° 36’ 12” N 107° 26’ 41” W |
| Estación Bayer | Canal de distribución | 24° 36’ 14” N 107° 27’ 22” W |
| Dique Los Becos | Dique | 24° 35’ 44” N 107° 18’ 33” W |
| Facultad de Agronomía | Canal de distribución | 24° 37’ 28” N 107° 26’ 34” W |
Trampas flotantes (selladas con cuerdas de polipropileno y poliestireno para permanecer suspendidas) con dos frutos de peras inocuos, desinfectados con alcohol etílico 96◦ y libre de lesiones, se colocaron sobre las periferias de cada sitio por 48 h, mientras que frutos desinfectados y sin desinfectar se mantuvieron en condiciones de laboratorio como testigos libres de oomycetes fitopatógenos. La temperatura del agua se registró con la inmersión de un termómetro de mercurio (Thomas -10 - 150 C) en cada punto de muestreo al momento de la instalación y el retiro de la trampa (entre las 8:00 y 10:00 AM) (Frankel et al. 2020). Posteriormente, las trampas colectadas se transportaron al laboratorio de fitopatología de la Facultad de Agronomía de la Universidad Autónoma de Sinaloa. Los frutos se extrajeron y bajo observación se logró identificar síntomas de infección (lesiones de color café). Los frutos lesionados fueron lavados con agua destilada estéril y desinfestados con alcohol etílico 96◦. De cada fruto, se tomaron aleatoriamente cinco cortes de pericarpio infectado de 1 cm2 de diámetro y 5 mm de profundidad. El tejido vegetal enfermo se depositó sobre cajas Petri con medio de cultivo PARP, para lo cual se empleó como base el medio Harina de maíz Agar (HMA, BD Difco) 17 g L−1 de agua destilada estéril, al cual se le agregaron: 200, 25, 10 y 10 µg L−1 de ampicilina, pentacloronitrobenceno, penicilina y rifampicina, respectivamente (Jeffers y Martin 1986, Soto et al. 2017) y se incubaron a temperatura ambiente (27 ± 2 ◦C) por 48 h. Posteriormente, cultivos puros se obtuvieron con transferencias hifales individuales (técnica de punta de hifa) sobre placas con medio de cultivo HMA incubadas por 48 h a temperatura ambiente. Una vez obtenido el aislado y con la finalidad de conservación, se efectuaron cinco cortes de 0.5 cm de diámetro con sacabocados sobre las colonias puras activas, y se colocaron en tubos eppendorf con 5 mL de agua destilada estéril. Los tubos se almacenaron en una incubadora a 15 ◦C para posteriores estudios de laboratorio (Jeffers y Martin 1986, Martin et al. 2012, Soto et al. 2017).
Características morfológicas
Los estudios de morfología se realizaron a partir de las cepas almacenadas. Crecimiento micelial de 48 h se colocó de forma individua sobre cajas Petri con los medios de cultivo HMA o V8-agar (agua destilada 800 mL, jugo V8 200 mL, CaCO3 2 g L−1 y agar 15 g L−1), una vez que el organismo llenó por completo la superficie de la caja, se agregó agua destilada estéril; las cajas con crecimiento de los organismos se conservaron en condiciones ambientales de laboratorio (27 ± 2 ◦C) durante cinco días para inducir el crecimiento y la reproducción de estructuras sexuales y asexuales de los organismos (Jeffers y Martin 1986, Martin et al. 2012, Soto et al. 2017). Adicionalmente y con la finalidad de inducir la formación de estructuras de reproducción, cilindros de 0.5 cm de diámetro con medio de cultivo y crecimiento micelial de 48 h se colocaron en cajas de Petri que contenían agua destilada estéril. Un microscopio óptico (Leica DM100), se utilizó para observar y caracterizar la morfología de cada aislado. La inducción al crecimiento y reproducción de los aislados fue realizada en tres diferentes ocasiones con cinco replicas cada uno.
Identificación molecular
La extracción de ADN genómico se realizó con el método bromuro de cetiltrimetilamonio (CTAB) propuesto por Doyle (1990), al cual se le realizó modificaciones con la finalidad de optimizar la extracción y pureza de ADN. Inicialmente se procedió a desarrollar cepas sobre medio de cultivo Papa Dextrosa Agar (PDA, 39 g L−1 de agua destilada estéril), cinco días después se colectaron 100-200 mg de micelio con una punta esterilizada y se depositaron en morteros individuales que contenía nitrógeno líquido; se maceró el micelio congelado hasta obtener polvo fino. El polvo de cada muestra se colocó en microtubos fríos, posteriormente se añadió 1 mL de buffer de extracción (CTAB 2%, TRISH-HCl 100 mM pH 8, EDTA 20 mM pH 8, NaCl 1.4 M, β-mercaptoetanol 2%) a cada tubo. Se utilizó un vortex para homogenizar el contenido de los tubos durante un minuto. Los tubos se centrifugaron a 12 000 rpm por 15 min. El sobrenadante se recuperó, se transfirió a tubos eppendorf nuevos y se homogenizaron con 1 mL de alcohol cloroformo-isoamílico (49:1). Las muestras se centrifugaron por 10 min. Se recuperó la fase acuosa, cuidando de no perturbar la interface, y se transfirió a nuevos tubos eppendorf para mezclarse con 100 µL de acetato de sodio 3M y 1 mL de alcohol isopropílico, se incubaron a -20 °C por 20 min. Los tubos se centrifugaron a 12 000 rpm por 15 min, la fase líquida se decantó cuidando de no perturbar la pastilla de DNA. A los tubos se les añadió 1 mL de etanol y se centrifugaron por 3 min. La fase acuosa se eliminó sin perturbar la fase sólida, los tubos se colocaron 10 min boca abajo a temperatura ambiente para la eliminar los restos líquidos, la pastilla de ADN se disolvió en 50 µL de buffer TE. La concentración del ADN se midió por NANODROP a 260 nM, su calidad se determinó con una proporción 280/260 y la integridad se visualizó por electroforesis en gel de agarosa 0.8% con solución amortiguadora 1X TAE.
Amplificación, purificación y secuenciación del ADN
La mezcla de PCR se preparó con 2.5 µL de buffer específico para la Taq (10X), 1.25 µL de MgCL2 (50 mM), 0.5 µL de mezcla de DNTP’s (200 mM), 0.625 µL de cada primer individual (0.25 µM) (tabla 2),1 µL de ADN (50 ng µL−1), 0.25 µL de Taq ADN polimerasa (5 UI mL−1), todo se disolvió en agua de grado molecular suficiente para completar el volumen total de 25 µL. El ADN se amplificó con un termociclador (Bio rad T100). Condiciones utilizadas en el termociclador: desnaturalización inicial a 94 ◦C por 2 min, 35 ciclos de desnaturalización a 94 ◦C por 30 seg a ITS (60 seg COX y NADH), alineamiento por 30 seg, extensión a 72 ◦C por 60 seg y extensión final 72 ◦C por 10 min. La temperatura de alineamiento fue de 62 ◦C para ITS, 52 ◦C para COX y 53 ◦C para NADH. La amplificación se verificó con el gel de electroforesis. La purificación de los productos de PCR se realizó con el kit wizard SV Gel and PCR CleanUp System (Promega, USA). Las dos cadenas del amplicón fueron enviadas para ser secuenciadas en Macrogen, Korea. Las secuencias se compararon en la base de datos del GenBank del National Center for Biotechnology information (NCBI 1988).
Tabla 2. Iniciadores utilizados para la amplificación de ADN de Pythium spp.
| Primer | Secuencia de primer | Tamaño (pb) |
| ITS4C0569 | TCCTCCGCTTATTGATATGC | 930 |
| ITS6C0570 | GAAGGTGAAGTCGTAACAAGG | |
| COXF4N | GTATTTCTTCTTTATTAGGTG | 972 |
| COXR4N | CGTGAAGTAATGTTACATATAC | |
| NADHF1 | CTGTGGCTTATTTTACTTTAG | 897 |
| NADHR1 | CAGCAGTATACAAAAAGCAAC |
El árbol filogenético y el historial evolutivo se construyeron partir del método de máxima verosimilitud y modelo Tamura-Nei (Tamura y Nei 1993), utilizando 848 pares de bases correspondientes al espacio transcrito del ADNr (los gaps/missing se consideraron como deleciones completas) y con la máxima verosimilitud posible. La búsqueda heurística se aplicó automáticamente con los algoritmos de Neighbor-Join y BioNJ para emparejar las distancias estimadas utilizando el modelo de Tamura-Nei y después seleccionar el valor de máxima topología posible. Para establecer los valores de confianza entre las agrupaciones del árbol resultante, se utilizaron 1000 bootstraps. Este análisis filogenético se realizó empleando el software MEGA X (Kumar et al. 2018).
Pruebas de patogenicidad
La actividad patogénica de los aislados se comprobó mediante la inoculación de plántulas y frutos de tomate saladette cv SV-3543, chile bell cv Caravaggio y pepino tipo slicer cv Luxell.
Obtención de plántulas
Las semillas de cada especie (tomate, chile y pepino) se sembraron por separado en charolas de poliestireno con 256 cavidades y sustrato peat moss (Berger), se regaron y condujeron bajo condiciones de invernadero. La emergencia de plántulas ocurrió siete días después de la siembra, las plántulas se trasplantaron a macetas plásticas con capacidad de 2 kg con sustrato peat moss 15 días después de la emergencia. Los riegos se efectuaron todos los días y se fertilizó cada tres días con una mezcla de agua más fertilizante Maxi-grow® Excel (COSMOCEL, composición porcentual g L−1: extractos orgánicos 112, auxinas 0.09, giberelinas 0.10, citoquininas 1.5, nitrógeno 6.6, fósforo 13.3, potasio 13.3, calcio 2.0, magnesio 4.0, hierro 17.2, zinc 26.5, manganeso 13.3 y cobre 13.3).
Inoculación de plantas y frutos
Los aislados se transfirieron de forma individual a cajas Petri con medio de cultivo PARP y se incubaron por 10 días. Transcurridos 25 días después del trasplante, la inoculación se realizó mediante un cilindro de 0.5 cm de diámetro con medio de cultivo y crecimiento de micelio, colocado en la base del tallo en cada plántula inoculada (para el caso de plántulas testigo se colocó sólo cilindro con medio de cultivo sin crecimiento de patógeno). El inóculo se cubrió con sustrato para evitar su degradación. Cinco días después de la inoculación, los riegos se efectuaron con mayor intensidad con el propósito de favorecer la infección del patógeno. La actividad patogénica de los aislados se determinó 20 días después de la inoculación mediante observación para lo cual, se empleó la escala propuesta por Molina et al. (2010) donde: 0 = sin síntomas, 1 = ligera marchitez o ligero daño en tallo, 2 = severa marchitez o severo daño en tallo y 3 = muerte de planta.
Con la finalidad de demostrar que los organismos inoculados fueron patogénicos, se realizaron postulados de Koch, para lo cual, muestras individuales de tejido enfermo de las plantas inoculadas con los aislados fueron transferidos a cajas de Petri con medio de cultivo (PARP) y permanecieron a temperatura ambiente (25 a 32 ◦C).
La actividad patogénica de los aislados en frutos se comprobó mediante frutos inocuos, inmaduros, de tomate, chile y pepino. Previo a la inoculación de los aislados, los frutos fueron lavados con agua destilada estéril y desinfestados con etanol de 70◦. Cada fruto se inoculó con cilindros de 0.5 cm de diámetro, con medio de cultivo y crecimiento micelial (para el caso de frutos testigo se colocó sólo cilindro con medio de cultivo sin crecimiento de patógeno); los frutos inoculados, se colocaron dentro de cámaras húmedas, elaboradas con recipientes de plástico y algodón humedecido con agua destilada estéril. La severidad se determinó a las 48 h después de la inoculación, con base a la cantidad de tejido dañado por el patógeno (diámetro promedio de tejido dañado). Las pruebas de patogenicidad se establecieron en un diseño completamente al azar, con cuatro repeticiones y su respectivo tratamiento control. Las pruebas de patogenicidad se establecieron en cámara de incubación con temperatura que fluctuó de 25 a 32 ◦C y humedad relativa del 100%. Concluidas las evaluaciones, del tejido enfermo en las plantas inoculadas se reaislaron los organismos para comprobar su patogenicidad mediante los postulados de Koch.
Los datos de ambas pruebas patogénicas se procesaron con el software INFOSTAT, y se realizó prueba de normalidad y homogeneidad de los datos para posteriormente analizarlos mediante análisis de varianza y prueba de comparación de medias (Tukey P ≥ 0.05).
Resultados
La temperatura promedio del agua entre los 5 y 10 cm de profundidad, al momento de la instalación de las trampas osciló de 21 a 32 ◦C, mientras que al momento del retiro osciló de 20 y 33 ◦C. Las temperaturas más bajas se registraron durante el mes de diciembre con 20 ± 1◦C; mientras que las temperaturas más altas se registraron en septiembre 33 ± 1◦C (Figura 1).

Figura 1 Temperatura promedio (±1◦C) del agua en 39 puntos de muestreo en el periodo 1 de septiembre de 2018 al 20 de febrero de 2019. Culiacán Sinaloa, México
En total se obtuvieron 107 aislados de oomycetes, pero sólo cinco aislados (Tabla 3) mostraron características morfológicas pertenecientes al género Pythium como: micelio hialino, cenocítico, esporangios lobulados terminales, intercalares y presencia de oosporas apleróticas (Figura 2). El análisis de algunas características morfológicas determinó que los aislados colectados del género Pythium mostraron micelio hialino y cenocítico, esporangios lobulados terminales e intercalares, presencia de oosporas apleróticas, las cuales se observaron en los aislados: EC17, JB56 y PP106 (Figura 2).
Tabla 3. Localidad y coordenadas de sitios de muestreo donde se obtuvieron aislados del género Pythium.
| Nombre de aislado | Localidad | Coordenadas del punto de muestreo |
| EC17 | Empaque Castro | 24◦ 55’ 28” N 107◦ 31’ 59” W |
| JB56 | Jardín Botánico | 24◦ 49’ 23” N 107◦ 23’ 06” W |
| PP106 | Facultad de Agronomía | 24◦ 37’ 28” N 107◦ 26’ 34” W |
| PV1 | Presa Adolfo López Mateos | 25◦ 10’ 08” N 107◦ 26’ 10” W |
| PS33 | Presa Sanalona | 24◦ 48’ 46” N 107◦ 08’ 14” W |

Figura 2 Características morfológicas de Pythium spp. a) esporangios lobulados (EC17); b) oosporas apleróticas, anteridio intercalar (aislado JB56) y c) grupo de oosporas en tejido de pepino (aislado PP106)
Las secuencias propias de cada aislado se compararon con secuencias depositadas del Gen-Bank. El análisis por BLAST del NCBI, mostró 99.8% de similitud a Pythium aphanidermatum para las secuencias de los aislados EC17, JB56 y PP106 (número de acceso MW488307, MW486431 y MT232874, respectivamente), de 98.0% a P. pachy- caule para el aislado PV1 (número de acceso MT261893) y de 98.0% de similitud a P. torulosum para el aislado PS1 (número de acceso MT232848).
El árbol filogenético creado (Figura 3), permitió observar la relación estrecha que existe entre las secuencias obtenidas con otras de distintas regiones. Ese árbol separó diferentes clados con las especies del género Pythium: el clado I, incluyó al aislado PV1 que corresponde a P. pachycaule; en el clado II al aislado PS1 de P. torulosum y el clado III incluyó los aislados EC17, JB56 y PP106 de P. aphanidermatum.
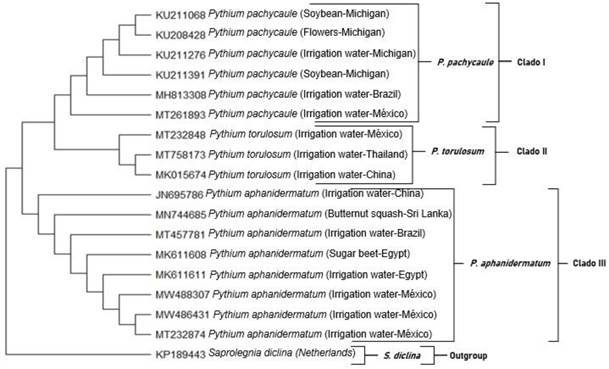
Figura 3 Árbol filogenético resultante de las especies de Pythium elaborado con el método de máxima verosimilitud. Los aislados colectados de agua de uso agrícola en el Culiacán, Sinaloa, están marcados con la leyenda de “Irrigation water-México”. Los aislados pertenecen a P. aphanidermatum (número de acceso MW488307-EC17, MW486431-JB56 y MT232874-PP106); P. pachycaule (número de acceso MT261893- PV1) y P. torulosum (número de acceso MT232848-PS1). Como secuencia outgroup se colocó a Saprolegnia diclina
Los cincos aislados de Pythium fueron patogénicos en plántulas de tres semanas de edad (Tabla 4). La severidad en plantas de tomate y chile originada por P. aphanidermatum (aislados PP106, JB56 y EC17) fue significativamente superior (P≥ 0.05) a la originada por P. torulosum (aislado PS1), y semejante a la originada por P. pachycaule (aislado PV1). En contraste, la severidad inducida por los cinco aislados en plantas de pepino fue estadísticamente igual. La Figura 4 muestra el daño originado por el aislado EC17 (P. aphanidermatum) sobre plán tulas de tomate, chile y pepino.
Tabla 4. Severidad del daño en plántulas de tomate, chile y pepino originada por cinco aislados de Pythium sp. obtenidos de aguas de uso agrícola en Culiacán, Sinaloa.
| Aislado | Especie | Tomate | Chile Pepino |
| PS1 | P. torulosum | 1.5a* | 1.5a2.5a |
| PV1 | P. pachycaule | 1.8ab | 2.0ab1.8a |
| PP106 | P. aphanidermatum | 3.0b | 3.0b2.3a |
| JB56 | P. aphanidermatum | 3.0b | 3.0b3.0a |
| EC17 | P. aphanidermatum | 3.0b | 3.0b3.0a |
*Medias con diferente literal en la misma columna son estadísticamente diferentes según Tukey (P ≥ 0.05)

Figura 4 Pruebas de patogenicidad, izquierda plantas testigo, derecha plantas inoculadas con P. aphanidermatum aislado EC17: a) plántulas de tomate, b) plántulas de chile y c) plántulas de pepino
En frutos, todos los aislados de Pythium fueron patogénicos (Tabla 5). La severidad en frutos de tomate, chile y pepino originada por los tres aislados de P. aphanidermatum (aislados PP106, JB56 y EC17) fue estadísticamente igual (P ≥ 0.05). En tanto que, con P. pachycaule (aislado PV1) la severidad fue significativamente inferior en frutos de tomate con el aislado JB56. Para P. torulosum (aislado PS1), la severidad fue estadísticamente igual a la originada por P. pachycaule y P. aphanidermatum, excepto en frutos de tomate con el aislado JB56, y en frutos de chile y pepino con el aislado EC17.
Tabla 5. Severidad en frutos de tomate, chile y pepino originada por cinco aislados de Pythium spp. obtenidos de aguas para el uso agrícola en Culiacán, Sinaloa.
| Aislado | Especie | Tomate | Chile | Pepino |
| Diámetro (cm) | ||||
| PS1 | P. torulosum | 4.5a* | 5.3a | 5.0a |
| PV1 | P. pachycaule | 4.8a | 7.5ab | 6.3ab |
| PP106 | P. aphanidermatum | 7.5ab | 8.5ab | 5.5ab |
| JB56 | P. aphanidermatum | 7.5ab | 8.50ab | 5.5ab |
| EC17 | P. aphanidermatum | 7.3ab | 9.8b | 8.5b |
*Medias con diferente literal en la misma columna son estadísticamente diferentes según Tukey (P ≥ 0.05)
Discusión
Las características morfológicas de micelio, esporangio y oospora registradas, coinciden con lo descrito por Díaz et al. (2011), Al-Sheikh y Abdelza-her (2012) y Saelee et al. (2021) para P. aphanider-matum, P. pachycaule y P. torulosum. Se ha descrito que las especies P. pachycaule y P. torulosum, en reproducción sexual forman oosporas apleróticas al igual que P. aphanidermatum (Abdelzaher y Kageyama 2020). Pero, es posible que las condiciones en las que se realizó la identificación morfológica no permitieron que esa estructura se formara, no obstante, la secuenciación de los ácidos nucleicos permitió la identificación del género y especie de cada aislado. Lo que es congruente con lo descrito por Díaz et al. (2011) quienes señalan que la caracterización morfológica de estos organismos debe complementarse con la molecular, debido a que dentro del mismo género existe la posibilidad de similitud morfológica entre especies (Herrero et al. 2020). La identificación morfológica de los aislados se confirmó con los resultados obtenidos de la secuenciación de las regiones ITS, el BLAST del NCBI y por la construcción del árbol filogenético. Por otro lado, las especies P. aphanidermatum, P. torulosum y P. pachycaule se han encontrado en ambientes acuáticos con temperaturas entre 30 y 40 ◦C (Choudhary et al. 2016, Kachour et al. 2016, Salmaninezhad y Ghalamfarsa 2019), lo cual es congruente con las condiciones en las que se realizó el presente trabajo.
Las tres especies encontradas fueron capaces de infectar tanto plántulas como frutos de tomate, chile y pepino, con diferente severidad de daño en cada especie de planta y con diferencias en el nivel de severidad interespecífica, pero no se presentó dicha diferencia en los aislados de la misma especie.
Tanto P. aphanidermatum como P. pachycaule y P. torulosum son organismos que, en investiga- ciones previas se han obtenido de aguas de uso agrícola en otras regiones del mundo (Al-Sheikh y Abdelzaher 2012, Parke et al. 2019, Redekar et al. 2019, Abdelzaher y Kageyama 2020). Pero para el caso de México es la primera vez que se determina la patogenicidad en plantas de interés hortícola de los organismos P. pachycaule y P. torulosum. Los resulta- dos obtenidos en este estudio morfológico, molecular y de pruebas de patogenicidad en plántulas y frutos de tomate, chile y pepino, permitió confirmar la presencia en aguas de uso agrícola en el valle de Culiacán, Sinaloa, de tres especies fitopatógenas del oomycete Pythium, lo que proporciona información que sustenta que el agua de riego debe ser un componente a considerar en la implementación del manejo integrado de enfermedades en plantas de hortalizas susceptibles.
Conclusiones
Se determinó la presencia de los oomycetes P. aphanidermatum, P. torulosum y P. pachycaule en aguas empleadas para el riego agrícola en el Valle de Culiacán, Sinaloa, México. Con diferencia interespecífica en el nivel de severidad de la enfermedad. Los aislados de P. aphanidermatum originaron la mayor severidad de le enfermedad en plantas y frutos de tomate, chile y pepino. El agua empleada para el riego agrícola constituye un medio de dispersión de oomycetes fitopatógenos











 nueva página del texto (beta)
nueva página del texto (beta)



