INTRODUCCIÓN
En México, la familia Cichlidae constituye el segundo grupo de peces dulceacuícolas más diverso (Miller et al. 2005). La diversidad de las especies de cíclidos del género Herichthys que se distribuye al norte es pobremente conocida, sobre la distribución geográfica y morfología de las especies alopátricas, la evidencia molecular sostiene que el género está conformado por dos clados monofiléticos importantes H. labridens y H. cyanoguttatus (Pérez-Miranda et al. 2018). Dentro del grupo de H. labridens se incluyen las especies H. bartoni, H. labridens, H. steindachneri, H. pame, y H. pantostictus (Taylor y Miller 1983); y dentro del grupo de H. cyanoguttatus se han incluído la especie que le brinda la denominación (H. cyanoguttatus, Baird y Girard 1854), las especies H. carpintis (Jordan y Snyder 1899), H. minckleyi y H. tamasopoensis (Artigas-Azas 1998, 2005); H. tepehua (De la Maza-Benignos et al. 2015) y H. deppii (Heckel 1840). Para el estado de Tamaulipas, se ha reportado la presencia de H. cyanoguttatus, H. carpintis, H. pantosticus (Hulsey et al. 2004, Pérez-Miranda et al. 2018).
La importancia de estas especies reside en la pesca deportiva, recreativa y de subsistencia. En particular, H. cyanoguttatus conocida como Mojarra Copetona o Guapota. Aunque las especies del grupo Heichthys se encuentran mundialmente en la categoría de menor preocupación de acuerdo a la Lista Roja de Especies Amenazadas de la Unión Internacional para la Conservación de la Naturaleza (IUCN 2019). Para el estado de Tamaulipas, se ha sugerido que debido a su popularidad en la pesca recreativa y de subsistencia, su población se ha reducido considerablemente, razón por la cual se han establecido programas de repoblamiento (Aguilar 2018).
Debido a que los programas de repoblamiento se basan en capturas de organismos vivos de regiones nativas en las que se observan ejemplares requeridos, es necesario identificar y confirmar la especie de estos organismos, sobre todo cuando se trata de especies de evolución simpátrica. Pero la identificación temprana es complicada, debido a la falta de desarrollo en las claves taxonómicas utilizadas y a su utilidad predominantemente en ejemplares adultos (Pérez-Miranda et al. 2018). Algunos métodos moleculares se han sugerido para sobrellevar la dificultad de identificación, entre ellos las utilizadas para estudios de diversidad genética como el Citocromo B mitocondrial (Farias et al. 2001, Hulsey et al. 2004, Pérez-Miranda et al. 2018) y el gen de la Citocromo Oxidasa I mitocondrial o variaciones genes nucleares (S7i, ddRAD, Pérez-Miranda et al. 2018). Por lo anterior, el objetivo del presente estudio fue identificar molecularmente especies dentro del género Herichthys en dos sitios de Tamaulipas corroborar su agrupamiento filogenético utilizando la secuenciación del CitB.
MATERIALES Y MÉTODOS
Origen y procesamiento de muestras
Se colectaron 20 muestras de aleta caudal, presuntivamente de H. cyanoguttatus del río Panal ubicado en las coordenadas 23° 30’ 05.4" LN y 97° 46’ 37.4" LO, en Tepehuajes, Soto la Marina, Tamaulipas; y 10 muestras del Río Carrizal ubicado en las coordenadas 23° 09’ 45.9" LN y 97° 56’ 46.0" LO, en Nuevo Progreso, Aldama, Tamaulipas. Los organismos del primer sitio corresponden al programa de repoblación de la Universidad Tecnológica del Mar Tamaulipas Bicentenario, y los del segundo sitio fueron regresados a vida libre después de la colecta. Ambos, correspondieron a estadios juveniles, de los que se extrajo el ADN de las muestras utilizando el kit de extracción Promega Wizard® Genomic DNA Purification (Promega).
Diseño de secuenciación
Considerando la secuencia de referencia (No. de acceso. AY323983.1) de la especie H. cyanoguttatus reportada por Hulsey et al. (2004), se diseñó en el Software Primer Select de DNAStar (Lasergene) el par de iniciadores Forward: 5‘ATGGCCAGCCTCCGAAAAAC y Reverse: 5‘GTGGGAAGTAAGATAAGGAAGATA, que es específico para amplificar 1.2 Kb del gen citocromo B mitocondrial.
Las reacciones de amplificación se llevaron a cabo en un volumen final de 10 μL, utilizando 50 ng de ADN genómico, 1.5 Mm de MgCl2, 0.2 mM de dNTP’s, 0.05μM de cada iniciador y 1U Taq polimerasa (Promega). La PCR se llevó a cabo en el termociclador MJ Research bajo el siguiente perfil de temperaturas: un ciclo a 95°C por 5 min; cinco ciclos a (95 °C por 45 s; 62°C por 45 s; disminución de 2°C cada ciclo y 72 °C por 45s); 30 ciclos a (95 °C por 45 s; 55 por 45 s y 72 °C por 45s) y una incubación final a 72 °C por 5 min. Se verificó la amplificación de ADN mitocondrial mediante una electroforesis en gel de agarosa al 1.5% que se visualizó en un fotodocumentador de luz UV y el ADN se cuantificó en el sistema Kodak Digital Science v 5.0 (Eastman Kodak Company).
Secuenciación
Previo a la secuenciación, los fragmentos de PCR se purificaron utilizando el protocolo de Exo-SAP-it (Thermo-Fisher Scientific, Whaltam). Los productos purificados se secuenciaron con los mismos iniciadores de amplificación y utilizando el protocolo del estuche comercial BigDye® Terminator. La secuenciación de las muestras procesadas se realizó mediante el secuenciador automático ABI-3130 (Applied Biosystems). Posteriormente se verificó la calidad e identidad de las secuencias obtenidas utilizando el programa Chromas lite versión 2.1.1. Todas las secuencias obtenidas tuvieron en promedio 1 058 pares de bases, lo que corresponde una cobertura de alrededor de 95% de la secuencia de referencia.
Análisis bioinformático
Las secuencias del CitB se cambiaron al formato FASTA y se verificaron mediante un análisis BLAST (Basic Local Aligment Search Tool) de la base de datos del NCBI (Altschul et al. 1990). Posteriormente, se realizó el alineamiento múltiple entre las secuencias estudiadas y la secuencia de referencia (No. de acceso. AY323983.1) de Herichthys cyanoguttatus, y complementariamente se incluyeron 72 secuencias de CitB de diferentes especies de cíclidos estudiadas por Hulsey et al. (2004). La estructura de los árboles se consideró como criterio de verificación de las especies encontradas y corroborar el agrupamiento filogenético de las especies identificadas. La longitud de las secuencias analizadas fueron de 724 nucleotidos, incluyendo regiones conservadas del CitB, para inferir la filogenia del grupo se usó el método Neighbor Joining basado en distancia genética con un modelo de sustitución Jukes-Cantor y un bootstrap de 1 000 submuestreos. Los análisis se realizaron en el software MAFFT ver 7.471 (Rozewicki et al. 2019).
Complementariamente, se realizó un análisis de inferencia de la historia evolutiva usando el método de máxima verosimilitud y el modelo de Tamura-Nei (Tamura y Nei 1993). El árbol de consenso bootstrap inferido con 1 000 réplicas (Felsenstein 1985) representa la historia evolutiva de los taxones analizados (Felsenstein 1985). Las ramas correspondientes a particiones reproducidas en menos del 50% de réplicas de bootstrap se colapsan. El porcentaje de árboles replicados en los que los taxones asociados se agruparon en la prueba de arranque (1 000 repeticiones) se muestran junto a las ramas (Felsenstein 1985). Los árboles iniciales para la búsqueda heurística se obtuvieron automáticamente aplicando los algoritmos Neighbour Joining y BioNJ a una matriz de distancias pareadas estimadas usando el enfoque de máxima verosimilitud compuesta (MCL), y luego seleccionando la topología con un valor de probabilidad de registro superior. El análisis incluyó 79 secuencias de nucleótidos que incluyen 16 diferentes especies de cíclidos (Hulsey et al. 2004). Los análisis y el árbol de consenso se realizaron en MEGA X (Kumar et al. 2018).
RESULTADOS Y DISCUSIÓN
En el presente estudio se logró la resecuenciaron exitosa del gen CitB mitocondrial en muestras de dos sitios del estado de Tamaulipas. El análisis de BLAST de acuerdo a las similitudes de las secuencias disponibles en el GenBank, reveló que las muestras del río Panal en Playa Tepehuajes pertenecen H. cyanoguttatus con un promedio de porcentaje de identidad de 97%. Por otra parte, las muestras correspondientes al río Carrizales en Aldama fueron identificadas como H. carpintis, con un promedio de identidad del 99%.
En la Figura 1, se muestra el árbol filogenético considerando las regiones conservadas mediante Neighbor Joining de diferentes especies de cíclidos incluyendo las muestras analizadas en el presente estudio. En particular se observa que existe una importante relación filogenética entre las muestras estudiadas (Figura 1); sin embargo, las muestras de Tepehuajes se agrupa primordialmente con H. cyanoguttatus, y las de Aldama como un clado parafilético estrecho con H. carpintis y H. tamasopoensis con quienes comparten el clado más específico. Por su parte, el árbol consenso de inferencia evolutiva (Figura 2), muestra dos clados monofiléticos aislados de H. minckleyi, de los cuales, en el plano inferior, se observan dos subdivisiones parafiléticas de las muestras estudiadas, correspondientes al clado de H. carpintis y las muestras de Aldama, compartiendo el clado H. tamasopoensis, y en la parte superior el clado de H. cyanoguttatus, compartida con las muestras de Tepehuajes.
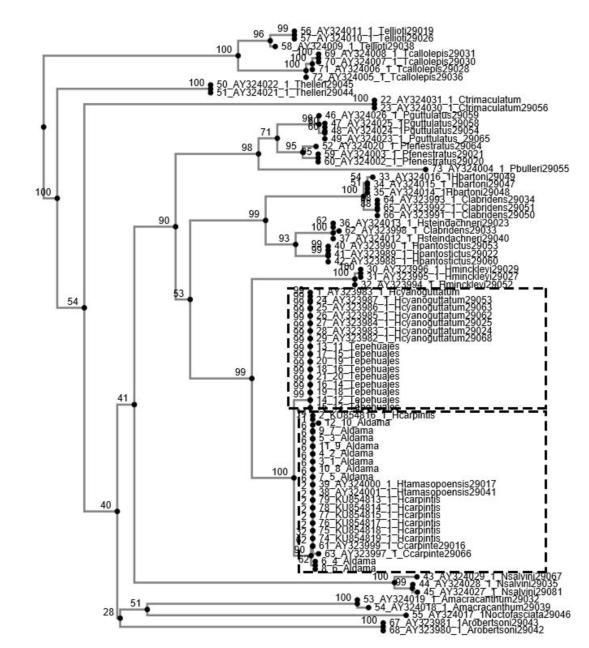
Figura 1 Árbol filogenético considerando las regiones conservadas mediante Neighbor Joining de diferentes especies de cíclidos americanos utilizando el gen Citocromo B mitocondrial.
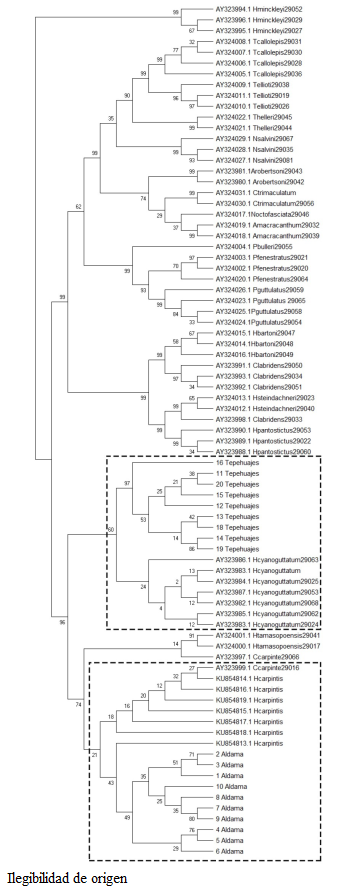
Figura 2: Árbol consenso de inferencia evolutiva de diferentes especies de cíclidos americanos utilizando el gen Citocromo B mitocondrial.
Aunque se han observado algunas limitaciones en peces Neotropicales como las del genero Herichthys, el gen mitocondrial CitB es ampliamente utilizado en estudios sistemáticos para resolver diveregencias a diferentes niveles taxonómicos (Farias et al. 2001), también ha sido propuesto para la identificación genética de especies de peces en productos de pescado (Pepe et al. 2005) y particularmente utilizado para inferir relaciones filogenéticas en diferentes especies, entre ellas cíclidos americanos (Lydeard y Roe 1997, Martin y Bermingham 1998, Hulsey et al. 2004, Pérez-Miranda et al. 2018).
Se observó que los análisis filogenético y de consenso evolutivo fueron efectivos para identificar la relación genética entre las especies estudiadas. De manera general, se observó una correspondencia entre las muestras del sitio Tepehuajes y H. cyanoguttatus, y las muestras de Aldama con H. carpintis. Adicionalmente, los patrones de agrupamiento de acuerdo a sus distancias genéticas identificadas corresponden a los sugeridos por Pérez-Miranda et al. (2018) quienes lograron encontrar patrones filogenéticos confiables al utilizar las secuencias de CitB, comparados con los resultados de COI y confirmaron los dos clados monofiléticos entre los grupos de H. cyanoguttatus y H. labridens. De la misma manera, los árboles estimados son similares a los reportados por Hulsey et al. (2004). Un hallazgo interesante fue el patrón filogenético estrecho entre H. carpintis y H. tamasopoensis, similar al encontrado por Pérez-Miranda et al. (2018) quienes reportan patrones filogenéticos entre H. carpintis y H. tamasopoensis que sugieren la posibilidad de hibridación entre las especies, e incluso entre especies de cíclidos de los diferentes grupos monofiléticos.
El estudio permitió identificar de forma efectiva una especie no esperada en el muestreo de los dos sitios en los que presumiblemente solo se encontraría la especie H. cyanoguttatus. Dada la evidencia que sugiere que H. cyanoguttatus y H. carpintis posiblemente se hibriden en secciones de la cuenca del río Soto la Marina (Miller et al. 2005), los estudios de caracterización genética de las especies presentes en las cuencas del estado de Tamaulipas son necesarios. El hecho de que se estén realizando proyectos de repoblamiento enfocados a la especie conocida como Mojarra Copetona o Guapota a presas y cuerpos de agua del estado de Tamaulipas (Aguilar 2018), realza la importancia de su caracterización para discriminar entre especies simpátricas que tienen características morfológicas similares que solamente pueden ser diferenciadas mediante códigos taxonómicos en estadios adultos. También se desconoce la tasa de extracción de estas especies, pero se sabe que son especies de alto valor para las poblaciones locales tanto para uso recreacional o de subsistencia. Realizar más estudios de las especies de cíclidos de la región ayudaría a comprender mejor su distribución y evitar la introducción de otras especies que pudieran afectar la historia evolutiva de las especies nativas. De la misma manera el uso de otros marcadores moleculares ayudaría a confirmar la posible hibridación de especies.
A pesar de que la mayoría de los estudios de identificación genética hacen referencia al uso del gen de la Citcromo Oxidasa I (COI o COX), el presente estudio sugiere que el CitB es efectivo para la identificación y discriminación entre especies del genero Herichthys, específicamente entre H. cyanoguttatus y H. carpintis. La combinación de CitB y otros marcadores moleculares incluyendo la caracterización morfológica podrían ayudar a caracterizar posibles polimorfismos y divergencias entre las especies estudiadas y otras nativas de cuencas cercanas.




![Calidad nutrimental y nutracéutica en ejotes de caupí (Vigna unguiculata [L] walp.) de la península de Yucatán](/img/es/prev.gif)






 nueva página del texto (beta)
nueva página del texto (beta)



