INTRODUCCIÓN
De los múltiples sectores responsables de las emisiones de gases efecto invernadero (GEI), la agricultura, silvicultura y otros usos del suelo, han incrementado sus emisiones en más del 130% en los últimos 50 años en América Latina (Allen et al. 2006). Del 10 al 17% de los GEI, que contribuyen al cambio climático provienen de las actividades agrícolas (Yadav y Wang 2017, Li et al. 2020, Musafiri et al. 2020), correspondiendo el 5% al CO2 (Töro et al. 2017). Especialmente, la concentración de CO2 en la atmósfera, ha aumentado drásticamente de 280 a 370 ppm y es probable que se duplique en el siglo XXI (Haque et al. 2020), por lo que requieren ser evaluados tanto en sistemas, prácticas y manejos (Blagodatsky y Smith 2012).
Entre 2001 y 2010, se tuvo la mayor fuente de emisiones dentro del componente suelo y fue el uso del suelo en la agricultura (50%), seguido por la conversión de bosques (38%), la degradación de sabanas (11%) y quema de biomasa (1%); mientras que los bosques aportaron el 100% de la captación de carbono (Marengo et al. 2014). La emisión de dióxido de carbono procede de la disminución de la materia orgánica, aunque esta emisión también está influenciada por la humedad del suelo, temperatura, biomasa microbiana, calidad del suelo y cultivo (Töro et al. 2017, Chen et al. 2020, Li et al. 2020). La humedad del suelo es el factor más importante para regular las emisiones de GEI de las tierras de cultivo, ya que controla las actividades microbianas y todos los procesos relacionados (Li et al. 2020). El riego aumenta las emisiones de N2O y CO2 al promover la actividad microbiana, mineralización de carbono y nitrógeno (N) y la respiración del suelo (Li et al. 2020).
El dióxido de carbono (CO2) es el gas de efecto invernadero más importante y representativo, aportando el 77% de las emisiones de gases antropogénicos (Abbas et al. 2020, Musafiri et al. 2020). Las emisiones netas de CO2 del suelo son producidas por el proceso metabólico de respiración del suelo, la respiración microbiana y radicular, tanto aeróbica como anaeróbica y la descomposición de la materia orgánica (Sun et al. 2019, Musafari et al. 2020). Liberado a la atmósfera, se almacena en la biomasa vegetal a través de la fotosíntesis; como materia orgánica sirve como alimento para animales; los cuales cuando mueren, se descomponen y regresan al suelo como C orgánico, el cual es utilizado nuevamente por los microorganismos como sustrato, oxidando el C en el suelo a CO2 que se libera al suelo y la atmósfera (Abbas 2020).
La principal fuente de emisiones de CO2 en la atmósfera son los procesos erosivos y oxidativos asociados a los cultivos agrícolas y sus prácticas agrícolas que alteran el balance a largo plazo de C y N orgánico del suelo (Muñoz et al. 2010). También las variantes en las prácticas agrícolas pueden causar variación en las cantidades del material orgánico del suelo, lo que causa fluctuación, espacial, temporal e interanual en la emisión de CO2 (Yadav y Wang 2017). Por lo anterior el objetivo del trabajo fue, determinar los flujos de emisión de CO2 y su relación con algunas propiedades bioquímicas en cultivos de rosa, clavel, tomate y fresa en dos épocas (lluvias y sequía) en invernadero.
MATERIALES Y MÉTODOS
El estudio se realizó en invernaderos de la unión de floricultores Los Morales, en el municipio de Tenancingo, al sur del Estado de México. El sitio se localiza a los 18o 58’ LN y 99o 36’ LO, altitud de 1 842 m, temperatura entre 12 y 22 oC y clima templado con verano fresco y largo Cb (w2) (w). El 57.72% del suelo se explota con rubros florícolas, principalmente rosa, clavel, agapando, lilis, orquídeas, alcatraces, gerbera, estatice, gladiola (INEGI 2018). El suelo dentro del invernadero se labra a profundidad de entre 20 y 40 cm, y se le agregan abonos, fertilizantes y plaguicidas, así como desinfectantes del suelo si se repite el cultivo. Las características físicas y químicas de los suelos en los invernaderos los clasifican taxonómicamente como Andosol con textura franco arenoso (F-Ar), con pH de 6 a 8 y conductividad eléctrica moderadamente salina, además alta materia orgánica (MO) entre 4 y 6%.
Los cultivos se fertilizan por hidroponía, que se realiza cada 15 días para adelantar la producción y la calidad de la flor. Cada tercer día se aplican plaguicidas como: Glifosato, Fenpropatrin, Zineb, Mancozeb, Atrazina, Metalaxil, Captan, Endosulfán, Abamectina, entre otros, para el control de hierbas, insectos, ácaros y hongos en los cultivos. También se adiciona composta, con excepción del cultivo de fresa. El riego se realiza con agua que se bombea de pozos a tanques de 1 500 L desde donde se distribuye por medio de mangueras en cada uno de los cultivos. Durante la temporada de lluvias los cultivos de rosa, clavel, jitomate y fresa se riegan una vez a la semana, debido a que el porcentaje de humedad dentro del invernadero es mayor al 50%; mientras que en la temporada de sequía los cultivos se riegan cada tercer día, ya que los porcentajes de humedad están por debajo del 50%.
El muestreo se realizó en el mes de julio de 2017 en la época de lluvias, en el que se tomaron muestras por 13 días; mientras que en febrero de 2018 en la época de sequía, se tomaron muestras durante 11 días. Los suelos seleccionados cuentan con 3 diferentes manejos de suelo: 1) Suelos de invernaderos con más de 12 años continuos cultivando rosa (R), 2) Suelos con más de cuatro años continuos cultivando clavel (Cl) y 3) Suelos con rotación de cultivos de jitomate y fresa (J y F). En los cuatro tipos de cultivo (rosa, clavel, jitomate y fresa) se utilizó la siembra directa.
El muestreo del suelo se llevó a cabo en parcelas dentro del invernadero de 50 x 5 m (250 m2) en tres parcelas; una para el cultivo de rosa, otra para cultivo de clavel y en la última se rotaron cultivos de jitomate y fresa. Se realizó un muestreo preferencial para los tipos de cultivos que representaron a los tratamientos, de cada cultivo se obtuvieron cuatro muestras compuestas (para cada mes) colectadas en los primeros 20 cm de suelo con una pala. Las muestras de suelo se transportaron al laboratorio donde se secaron al aire a temperatura ambiente para luego tamizar con una malla de 2 mm para retirar el material vegetal y las partículas grandes para determinar las propiedades físicas, químicas y bioquímicas del suelo de acuerdo con la NOM-021 (SEMARNAT 2000).
Los parámetros físicos, químicos y bioquímicos del suelo determinado fueron la textura por el método de Bouyoucos AS-09, densidad aparente por el método de la probeta. El pH se determinó en agua en una relación 1:2.5 (método AS-02) mientras que la conductividad eléctrica (CE) por el método AS-18 de la misma solución que el pH, y el contenido de la MO del suelo por el método AS-07 por Walkley y Black (1934). En todos los métodos se tomaron en cuenta lo establecido en la NOM-021 (SEMARNAT 2000).
El carbono de la biomasa microbiana se determinó por el método de fumigación-extracción (Vance et al. 1987). Mientras que la respiración se cuantificó por el método de Alef y Nannipieri (1995), y el nitrógeno inorgánico por el método de Bremner y Keeney (1965). La determinación del CO2 en el suelo, que es una medida de la actividad biológica total del suelo, se realizó mediante una trampa álcali de NaOH 0.1 normal (N) y por titulación con HCl 0.1 N en presencia del indicador fenolftaleína según el método descrito por Alef y Nannipieri (1995). Para fines del estudio se realizaron algunas modificaciones al método, modificando las cámaras cerradas del diseño original, para lo cual se utilizaron tubos sellados de PVC que se enterraron 0.5 cm en el suelo, con mediciones in situ. Se utilizó un testigo que no se enterró en el suelo y se le puso un trozo de madera, para evitar contacto con el suelo; dentro de las cámaras se pusieron frascos con NaOH para atrapar el CO2 que se produce por la actividad microbiana.
En cada cultivo se colocaron cuatro cámaras para cada día de muestreo, dentro de cada cámara se colocaron tres frascos, cada uno con una trampa álcali de NaOH al 0.2 N para el cultivo de rosa, clavel, fresa y 0.5 N para jitomate. Se utilizó mayor concentración en el jitomate, porque se observó que emitía más CO2 que los otros cultivos. Cada frasco contenía 10 mL de NaOH y el CO2 liberado de la actividad microbiana se recupera en los frascos con NaOH. En los testigos se utilizaron cámaras sin suelo y con la misma trampa de álcali de NaOH. Los muestreos del CO2 se realizaron cada tercer día, con tiempo de espera para que el CO2 se acumule dentro de la cámara de 6 h (9:00 a 15:00 h) para evitar alteraciones del flujo de CO2 causadas por modificación de las condiciones en el interior de la cámara. Después de las 6 h de espera se tituló el NaOH con ácido HCl al 0.2 N o 0.5 N (cultivo de jitomate) y fenolftaleína como indicador para conocer la cantidad de CO2 liberado de la actividad microbiana del suelo de cada cultivo. El CO2 emitido se determinó con la formula: QCO2 = (T - C) (N) (E) (Vtr / Vti). Donde: QCO2 = Cantidad de CO2 absorbido por NaOH, T = mL HCl gastados por blanco, C = mL HCl gastados por muestra, N = normalidad, E = Factor de conversión 22, Vtr = Volumen NaOH en el captor y Vti = Volumen NaOH usado.
Se realizó un análisis de estadística descriptiva para elaborar los gráficos y tablas de las variables emisión de CO2, temperatura, humedad, y de los parámetros físicos, químicos y bioquímicos del suelo de los cuatro cultivos en las dos temporadas (lluvias y secas). También se aplicó una prueba de ANOVA, con una prueba de comparación múltiple (LSD) para determinar las diferencias entre los cultivos. Todos los análisis se realizaron con el programa Statgraphics Centurion XV.II, a un nivel de confianza del 95%.
RESULTADOS
En la época de lluvias el pH fue medianamente alcalino para el clavel y neutro para los cultivos de jitomate y rosa. Mientras que en el periodo de sequía no se encontraron diferencias significativas en el pH, el cual fue neutro para rosa y fresa, y medianamente alcalino para clavel (Tabla 1). La conductividad eléctrica (CE) en la temporada de lluvias, en los cultivos de clavel y jitomate mostró cantidades mínimas de sales (0.37 ± 0.08 y 1 ± 0.51 μS m-1), mientras que el cultivo de rosa mostró seis veces más contenido de sales (2.48 ± 1.08 μS m-1) como se observa en la Tabla 1, el cual es moderadamente salino. Este valor evidencia un proceso de salinización en el suelo asociado con el uso de fertilizantes y plaguicidas como atrazinas. En la época de estiaje la salinidad fue baja ya que no sobrepasa 1.68 ± 1.41 μS m-1, presentando los tres cultivos valores mínimos de salinidad. Por lo que las diferencias encontradas en las variables químicas pueden deberse a condiciones de manejo y no a su textura. Mientras que los valores de densidad aparente, oscilan entre 0.89 y 1.00 g cm-3 para las dos épocas (Tabla 1).
Tabla 1 Propiedades físicas, químicas y biológicas del suelo en época de lluvias de secas.
| Parámetro | Época de lluvias | Época de sequía | ||||
| Rosa | Clavel | Jitomate | Rosa | Clavel | Fresa | |
| Clase Textural | F-Ar | F-Ar | F-Ar | F-Ar | F-Ar | F-Ar |
| DA (g/cm3) | 0.8 ± 0.1 b | 0.9 ± 0.1 α | 0.9 ± 0.1 α | 0.9 ± 0.1 c | 0.9 ± 0.1 b | 1 ± 0.1 α |
| pH | 6.7 ± 0.12 c | 7.5 ± 0.1 α | 7.2 ± 0.3 b | 6.9 ± 0.1 α | 7.5 ± 0.2 α | 7.3 ± 0.2 α |
| CE (dSm-1) | 2.4 ± 1.08 α | 0.3 ± 0.1 b | 1 ± 0.5 b | 0.5 ± 0.46 b | 0.3 ± 0.1 α | 1.6 ± 1.4 α |
| MO (%) | 2.9 ± 0.4 α | 3.1 ± 0.5 α | 1.7 ± 0.1 b | 4 ± 0.4 b | 1.6 ± 0.3 b | 0.4 ± 0.2 c |
| Respiración basal (mgCO2/100g) | 612 α | 631 α | 506.4 α | 292.8 α | 359.4 α | 289.3 α |
| C-Biomasa (mgC/100g) | 38.9 b | 21.7 b | 125.4 α | 40.8 b | 138.8 α | 29.8 b |
| qCO2 | 19.9 | - | 5.1 | 9.1 | 3.3 | 12.3 |
Promedio ± Desviación Estándar, DA: Densidad aparente, CE: Conductividad eléctrica, MO: Materia orgánica. Letras diferentes en el mismo renglón indican diferencias significativas (p < 0.05) con la aprueba de Fisher (LSD).
En el periodo de lluvias se presentan diferencias significativas (p < 0.05) entre los cultivos con respecto a la MO, se observa que el cultivo de clavel presenta el porcentaje más alto de MO (3.10%), mientras que los cultivos de rosa y jitomate tuvieron valores más bajos (2.99 y 1.74%). Al comparar los resultados de MO en ambas temporadas (Tabla 1), se observa un aumento para el cultivo de rosa con mayor uso de agroquímicos y la adición de composta. En el periodo de sequía los cultivos de clavel y fresa, tuvieron porcentajes menores de MO (1.64 y 0.47%), que en la época de lluvias.
El flujo de CO2 en la época de lluvias mostró valores para el cultivo de jitomate entre tres y cinco veces mayores que en clavel y rosa, respectivamente; valores que son diferentes significativamente (p < 0.05), presentando el mayor valor el cultivo de jitomate (Figura 1). En sequía, los valores son muy similares entre los cultivos y más bajos que en la época de lluvias, con diferencias significativas (p < 0.05) entre las tasas de respiración del cultivo de rosa con respecto a los otros dos cultivos (Figura 1). Por lo que los mayores valores de CO2 en el suelo donde se cultivan rosas están correlacionados con el porcentaje de MO (r = 0.89). Mientras que para el cultivo de fresa y clavel se observa una disminución del flujo de CO2 durante los primeros 13 días (Figura 2b).
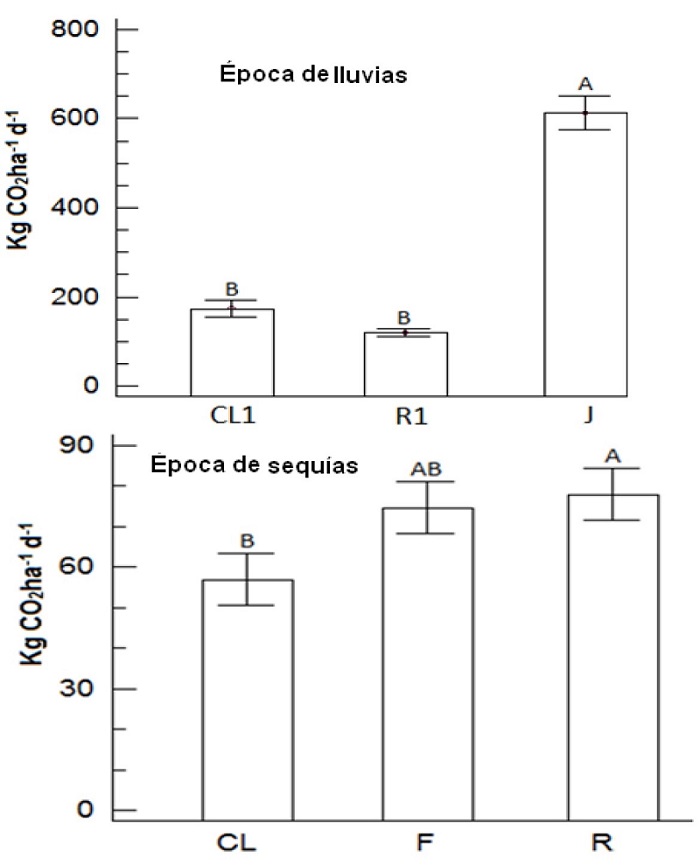
Figura 1 Flujo del CO2 que desprende cada cultivo en la época de lluvias y de sequías. Clavel (CL1), Clavel (CL), Rosa (R1), Rosa (R), Fresa (F) y Jitomate (J). Letras diferentes en el mismo renglón denotan diferencias significativas (p < 0.05), con la Prueba de Fisher (LSD).

Figura 2 Comportamiento del flujo de CO2 que se desprende de cada cultivo de acuerdo con la fertilización (F) y riego (R) en el A) primer muestreo y B) segundo muestreo.
La mineralización del nitrógeno, presentó diferencias entre los cultivos en los distintos parámetros determinados en la época de lluvias (Tabla 2). Para el N inorgánico total, no se observaron diferencias significativas, mientras que para el NH4 en los cultivos de clavel y jitomate se observaron valores más altos que en el cultivo de rosas. Mientras que para NO-3 y NO-2 el cultivo de rosa mostró los mayores valores entre los cultivos. En la época de sequía el cultivo de fresa tuvo el valor más alto (1.31 mg N-1 100g) de nitrógeno inorgánico total, así como NH4, mientras que para el NO-3 y NO-2 el cultivo de clavel muestra los mayores valores (Tabla 2). La generalidad es que hay poca variación entre los cultivos en ambas épocas, con contenidos bajos de N inorgánico en todos los cultivos.
Tabla 2 Valores de la mineralización del nitrógeno en suelos en la época de lluvias y de secas.
| Cultivo Época de lluvias |
N-inorgánico (mg N100g-1) |
NH4-N (mg N100g-1) |
NO-2NO-3 (mg N100g-1) |
| Clavel | 1.19 ± 0.40 α | 0.75 ± 0.20 α | 0.44 ± 0.20b |
| Jitomate | 1.11 ± 0.45 α | 0.70 ± 0.25αb | 0.41 ± 0.19 b |
| Rosa | 1.18 ± 0.02 α | 0.45 ± 0.25 b | 0.73 ± 0.17αb |
| Época de sequía | |||
| Fresa | 1.31 ± 0.17 α | 0.95 ± 0.18αbc | 0.36 ± 0.13b |
| Rosa | 1.21 ± 0.15αb | 0.69 ± 0.15bc | 0.52 ± 0.15αb |
| Clavel | 1.24 ± 0.18 α | 0.58 ± 0.12bc | 0.66 ± 0.12αb |
Promedio ± Desviación estándar. Letras diferentes en la misma columna denotan diferencias significativas (p < 0.05), utilizando una ANOVA y aprueba de Fisher (LSD).
El Carbono de la biomasa microbiana (CBM) para los cultivos en la época de lluvias (Tabla 1) tuvo diferencias significativas (p < 0.05). Los mayores valores de CBM se tuvieron en el cultivo de jitomate (125.4 mg C 100 g-1); mientras que los menores valores de CBM fue en los cultivos de rosa y clavel con 38.9 y 21.7 mg C 100g-1, respectivamente. Para la época de sequía, también se presentaron diferencias significativas (p < 0.005) para el contenido de CBM, presentando el cultivo del clavel el mayor valor con138.8 mg C 100g-1, siguiendo en orden de importancia los cultivos de rosa y fresa con 40.8 y 29.8 mg C100 g-1, respectivamente. El comportamiento del CBM en las dos épocas, indica que el cultivo del rosa no manifestó cambios, mientras que en el cultivo del clavel se incrementó hasta seis veces más en la época de secas. Los mayores valores de qCO2 se registraron en el cultivo de rosa en la época de lluvia y en la época de sequía, mientras que el contenido en los cultivos de rosa y fresa fueron similares. En tanto que los menores valores de qCO2 se presentaron en la época de lluvias en el cultivo de jitomate y en clavel en la época de sequía.
DISCUSIÓN
Para el pH no se observaron diferencias significativas entre las dos épocas de muestreo. Mostrando el cultivo de rosa un pH neutro (6.72 y 6.94, respectivamente) en la época de lluvias y de sequía, pero en general los valores de pH de todos los cultivos se encuentran dentro del rango normal NOM-021-SEMARNAT (SEMARNAT 2000). Además de que valores de pH entre 6.0 y 7.0 son óptimos para el crecimiento de la mayoría de los cultivos. Por lo que la interpretación y papel que juega el pH con respecto a la calidad del suelo, depende del uso y la tolerancia de los cultivos, y de la especie cultivada (Luters y Salazar 2000). Pero el pH del suelo se ve afectado por las prácticas agrícolas, principalmente por el uso de fertilizantes y plaguicidas, los cuales pueden producir cambios importantes en las propiedades químicas del suelo. Al respecto, se sabe que la adición de nitrógeno amoniacal produce una acidificación del suelo (Chen et al. 2020). En la zona de estudio, el cultivo de rosa tiene una mayor aplicación de agroquímicos, lo que coincide con lo reportado por Mogollón et al. (2015), quienes señalan que las altas dosis de adición de productos químicos, incrementan la salinización. Mientras que la adición de fertilizantes incrementa la presencia de sales con sus iones respectivos, que dan como resultado, mayores valores de CE. Por otro lado, Mogollón et al. (2010), encontraron que altos niveles de salinidad en los cultivos, influyen en la inhibición de la descomposición de la MO del suelo, lo que podría traducirse en una disminución en la emisión de CO2.
La MO presente en los suelos se clasificó, como deficiente en ambas temporadas de acuerdo con Stevenson (1982). Pero el porcentaje de MO presente en los cultivos es adecuado y coincide con lo reportado por Andrades y Martínez (2014), quienes mencionan que el rango de MO en suelos con textura arenosa oscila entre 0.7 y 2.2%. Por lo que la disminución de la MO puede deberse o a la acción de los microorganismos del suelo que descomponen y degradan compuestos orgánicos y a los procesos de mineralización de la MO como fuente de carbono (Castellanos et al. 2000). El flujo de CO2 mostró los mayores valores en el cultivo de jitomate (750 Kg CO2 ha-1d-1), lo que indica mayor actividad biológica de los microorganismos del suelo. Este aumento del flujo de CO2 probablemente es el resultado del manejo de la rotación (jitomate-fresa) que se da a estos cultivos, así como del incremento en la respiración después del riego, lo que coincide con Musafiri et al. (2020) quien señala que la rehumectación del suelo activa a microorganismos y aumenta la emisión de CO2 (Figura 2a y 2b). Igualmente coinciden con los reportados con Sainju et al. (2012), los cuales mencionan que la operación de labranza puede aumentar las emisiones de CO2 porque se incrementa la aireación debido a la alteración de los agregados del suelo.
Los menores valores de CO2 en el cultivo de rosa (162 Kg CO2 ha-1d-1), podrían atribuirse a los mayores niveles de salinidad (Tabla 1), al respecto Maucieri (2017) señala que la salinidad disminuye las emisiones de CO2. Por lo que la baja en el flujo de CO2 influye en la inhibición de la descomposición de la MO del suelo, como lo señalan Qadir et al. (2003) y Mogollón et al. (2010). El cultivo de rosa, presentó en los tres primeros días, un aumento de CO2 debido a una mayor actividad biológica medida por la emisión de CO2 (Figura 2a y 2b). Al respecto Zhang et al. (2020) indican que el aumento de la emisión de CO2 obedece al crecimiento de la planta por consumo de carbohidratos, ácidos carboxílicos, polímeros y aminas. En el día después del riego, la emisión de CO2 aumentó, lo que coincide con lo reportado Li et al. (2020), quienes encontraron que cuando el riego aumenta hay mayor emisión de CO2 en comparación con suelos sin riego. Al respecto, se sabe que el riego aumenta la disponibilidad del agua del suelo, pero sobre todo la descomposición y la mineralización de la MO, activando la actividad microbiana y mejorando el suministro de sustratos Musafiri et al. (2020). Sobre lo mismo Sainju et al. (2008) reportan que los flujos de CO2 van de 300 a 600 Kg CO2 ha-1d-1 después de fuertes lluvias o alta intensidad en el riego en tierras de cultivo y pastizales; mientras que en el presente estudio se encontraran valores que van de 373 a 750 Kg CO2 ha-1d-1 para los cultivos en la época de lluvias, lo cual es superior un 20%, lo que genera mayor emisión de CO2. Mientras que Sánchez et al. (2005), reportan que la actividad respiratoria se incrementa cuando se tienen mayor contenido de MO, lo que indica que a mayor contenido de MO se tiene mayor fuente de energía, de nutrimentos y mayor actividad microbiológica, lo que se refleja en mayor producción de CO2.
En los primeros seis días de medición en la época de lluvias, se observó que los cultivos de clavel y jitomate presentaron un decremento en la cantidad de CO2 que se desprendió por la actividad microbiana en comparación con el cultivo de rosa (Figura 2a), probablemente esta disminución sea resultado de la aplicación de algún agroquímico. Aunque estos valores fueron similares a los reportados por Rodríguez et al. (2009) y Zen et al. (2018) quienes indican que la disminución de la respiración es producto del efecto inhibitorio de pesticidas tipo organoclorado que actúan sobre poblaciones microbianas, lo que se traduce en menor actividad biológica. Los resultados en la emisión de CO2 evidencian que el manejo (riego, labranza, rotación, levantamiento de tierra y uso de plaguicidas), tiene efecto significativo sobre la actividad biológica del suelo, debido a que se observaron aumentos y disminuciones de flujos de CO2 al realizarse algún tipo de manejo (Figuras 2a y 2b). El CO2, mostró una variación estacional, con mayores flujos de CO2 en la época de lluvias y menores en la época de sequía. Lo que coincide con Muñoz et al. (2011), quienes encontraron que la tasa de respiración se ve influenciada por las variaciones estacionales, principalmente por la temperatura y humedad del suelo. Mientras que Peng et al. (2011), observaron que los flujos de CO2 mayores se presentaron de junio a agosto y los menores de noviembre a enero.
La adición de fertilizantes nitrogenados, en estudios realizados por Smolander et al. (1994) y Al-Kaisi et al. (2008), explican la disminución de las emisiones de CO2, en tanto que efectos ontrarios fueron reportados por Conti et al. (1997) quienes señalan que la fertilización con N incrementa las emisiones de CO2, y proporciona mayor producción de biomasa en las plantas. Por lo que el impacto de la fertilización nitrogenada en la liberación de CO2 son inconsistentes, lo cual se puede deber a una cantidad variable de C, cuando esta es alta se promueve la respiración, mientras que si es baja se inhibe (Li et al. 2020).
La adición de abonos orgánicos se encuentra relacionado con el proceso de mineralización y el contenido de N. A los cultivos de clavel y rosa se le adicionaron composta antes del muestreo, lo que causó el incremento de la MO (Tabla 1). Este aumento de la MO y el N inorgánico total, favorece al proceso de mineralización y conlleva a un aporte de nutrientes y energía para los microorganismos, lo que beneficia el ciclo del N. Dentro de las bondades de las compostas se encuentra el proceso de mineralización, y por tanto hacen disponibles los nutrientes (Roig et al. 2012, Bourioug et al. 2014). Las causas por que el N total es bajo en los suelos de los cultivos estudiados, pueden deberse a que se pierde de manera natural por medio de la desnitrificación, debido a que las bacterias convierten los nitratos y nitritos en nitrógeno gaseoso (N2), óxido nítrico (NO) y estos se pierden por volatilización, mientras que el amoniaco, nitrito y nitrato cuando están en el suelo en solución se pierden por lixiviación y escorrentía. Por lo que una manera de recuperar los nutrientes es mediante la implementación de formas de cultivo que permitan un mejor reciclado de los nutrientes, por lo que los agricultores optan por la rotación de cultivo y aunque se ha observado que esta operación puede conservar el suelo estable y productivo, no resuelve el problema de manera total, porque cuando se adicionan fertilizantes nitrogenados se acidifica el suelo y se favorece la desnitrificación y volatización.
La MO facilita el acceso del N inorgánico al ambiente edáfico, lo que se observa con el incremento durante el periodo de lluvias y de sequias en los cultivos, además del incremento del N total, la que ayuda al proceso de mineralización y proporciona mayor cantidad de compuestos nitrogenados disponibles para la planta (Navarro et al. 2002). Al respecto se sabe que los grupos amino (RNH2), contenidos en las proteínas son atacados por los microorganismos del suelo, para producir nitratos (NO3-) y sulfatos (SO4-2 ), lo que ocurre debido a la descomposición de la MO, lo que libera iones que están disponibles para las plantas y microorganismos (Navarro et al. 2002). El CBM en los suelos disminuyó, lo que se asocia a la cantidad de agroquímicos utilizados, que dañan a los microorganismos que habitan el suelo, ocasionando inhibición en el crecimiento y reducción en el metabolismo de las poblaciones microbianas (Rivera et al. 2010, Karas et al. 2018). Además, el uso de agroquímicos, como sucede en el cultivo de rosa, disminuye la biomasa microbiana por el uso de la fertilización excesiva, o causa como el caso del cultivo de fresa, toxicidad y reducción del pH (Chu et al. 2007). El CBM en los suelos de los cultivos de rosa y fresa, indican que el cultivo de rosa al ser un sistema de monocultivo, presenta una disminución del CBM. Lo que puede tener graves problemas desde el punto de vista de la calidad del suelo y del reciclaje de nutrientes (Chu et al. 2007). El incremento de la CBM en el cultivo de clavel entre la primera y segunda época se puede deber a la adición de composta en el suelo, lo que trae alta concentración de carbono orgánico que es fácilmente degradable. Al respecto, la composta eleva el crecimiento en la población microbiana, por lo que el CBM aumenta, la entrada al suelo de carbono disponible que se utiliza por la biomasa microbiana autóctona y por la nueva biomasa en crecimiento, debido a que la MO es fácilmente biodegradable. Sobre esto se tienen reportes que indican que el material orgánico añadido al suelo, suministra energía después de su descomposición, inclusive estimula la actividad microbiana y aumenta la población de estas (Pedra et al. 2007). Mientras que otros estudios indican que la biomasa microbiana y la actividad microbiana están estrechamente relacionadas con el contenido de MO del suelo, lo que puede explicar la correlación encontrada entre la fresa y jitomate con la MO de 0.94, la que se puede deber a la adición de las enmiendas orgánicas al suelo (Mondal et al. 2015).
La manera como se comporta el qCO2 en los suelos de cultivo de rosa, clavel, jitomate y fresa, obedece a incrementos que podrían estar asociados a una condición de estrés edáfico en las dos épocas de muestreo. Lo que se puede atribuir a una disminución de la biomasa microbiana activa, y pone en evidencia una demanda energética mayor y eficiencia metabólica reducida para mantener la integridad de las células bajo condiciones de estrés (Sánchez et al. 2005). También este estrés edáfico puede provenir del proceso de salinización, lo cual se puede deber a los mayores valores de conductividad eléctrica en el cultivo de rosa. Al respecto Saviozzi et al. (2011), reportan que el aumento de la salinidad genera una comunidad microbiana pequeña, estresada, y menos eficiente en la mineralización del carbono del suelo, lo que hace que se pierda carbono en forma de CO2 debido al aumento de la actividad respiratoria. También se observó aumento del qCO2, el cual depende del nutriente del suelo, ya que con la aplicación de fertilizantes aumenta el qCO2 en situaciones de ambientes de no estrés. Mientras que otros factores que incrementan el qCO2 son el contenido de metales pesados y la adición de agentes tenso activos (Bending et al. 2004). Al respecto Álvarez et al. (2010), relacionan la rotación de cultivos y de monocultivos con el qCO2, con valores menores cuando se rota los cultivos, debido a la presencia de una comunidad vegetal diversa, lo que favorece la eficiencia de la comunidad microbiana al reducir las demandas energéticas.
CONCLUSIONES
Las prácticas de uso y manejo que se llevan a cabo en cada cultivo influyen en las propiedades bioquímicas y biologías del suelo. El flujo de C que se desprende de la actividad microbiana del suelo depende de la actividad agrícola, de la adición de agroquímicos, del contenido de MO y de la humedad del suelo. El proceso de mineralización de nitrógeno fue favorecido en todos los cultivos. El CBM disminuyó en los cultivos debido a la fertilización excesiva, mientras que el cultivo de clavel que tuvo aporte de composta aumento el CBM. El índice qCO2 se incrementó en la mayoría de los cultivos, lo que indican estrés edáfico, lo que puede deberse a la disminución del CBM o de un proceso de salinización.











 nueva página del texto (beta)
nueva página del texto (beta)



