Introducción
El ganado bovino es un reservorio natural de Escherichia coli productora de toxina Shiga (STEC) (Heredia and García 2018). E. coli STEC pertenece a un grupo zoonótico emergente de patógenos al humano, caracterizado por poseer dentro de su genoma los genes stx1 y stx2, responsables de codificar dos potentes verocitotoxinas llamadas toxina Shiga 1 (Stx1) y toxina Shiga 2 (Stx2), las cuales son reconocidas como su principal factor de patogenicidad (Schuller 2011, Terajima et al. 2017). Además, algunas STEC poseen factores de virulencia adicionales, como proteínas de adhesión a células epiteliales (eaeA) y/o toxinas de tipo hemolíticas (ehxA) (Soledad-Cadona et al. 2018).
La dosis infectiva de las STEC es de 5 a 100 células para el humano, pudiendo causar diarrea, colitis hemorrágica (CH), síndrome urémico hemolítico (SUH), y en casos severos la muerte (Amézquita-López et al. 2018, Joseph et al. 2020, Nguyen et al. 2016). El ganado es portador asintomático de un gran número de serotipos STEC, encontrándose principalmente en su tracto gastrointestinal y recto cuando estos tienen pocas horas de nacido, y hasta los primeros meses de vida (Callaway et al. 2013). Algunas STEC causan al bovino enfermedades gastrointestinales, por ejemplo, la STEC O26 (Blanchard 2012). Otros serotipos patógenos al humano como las STEC O157 y STEC O104 no provocan síntomas en el ganado (Shridhar et al. 2017, Swaggerty et al. 2018). El ganado bovino es capaz de excretar hasta 104 UFC (Unidades formadoras de colonia) de STEC por gramo de heces, las cuales son capaces de permanecer viables hasta por 90 días (Chase-Topping et al. 2008, Mir et al. 2020).
En México la crianza y engorda de ganado bovino con fines de exportación representa una actividad con gran demanda y rentabilidad. En el 2017 se registró una producción de 842 372 cabezas de ganado; reportando este mismo año el estado de Sonora una producción de 321 133 cabezas de ganado bovino, lo que lo posicionó como el estado con mayor producción del país (SIAP 2018). Por lo que el alto número de producción de cabezas de ganado bovino en el estado podría significar un riesgo de infección zoonótica para los habitantes.
En México el estudio de propagadores STEC como lo es el reservorio bovino, ha sido escasamente abordado en la última década (Amézquita-López et al. 2012, Navarro et al. 2018). El objetivo de este estudio fue identificar el serotipo STEC O157:H7 en bovinos asintomáticos criados en el sur de Sonora, México empleando PCR multiplex para con ello avanzar en el entendimiento de su capacidad propagadora.
Materiales y métodos
Durante el año 2018 se realizó un muestreo a conveniencia de 60 bovinos, en dos hatos ganaderos dedicados a la crianza de ganado para la producción de carne de exportación y nacional, de los cuales el 50% se encontraban registrados en el Sistema Nacional de Identificación Individual de Ganado (SINIIGA), en el municipio de Cajeme, Sonora. Las razas muestreadas fueron Charolais, Simental Charbray, Simbrah y sus cruzas; la edad osciló entre 6 y 24 meses. De cada animal se colectaron de manera aséptica aproximadamente 100 g de heces fecales del recto, para luego conservarse en doble empaquetado en recipientes estériles con cierre hermético en refrigeración a 4 °C, hasta su análisis en el laboratorio (OIE 2018). El aislamiento y caracterización bioquímica de cepas sospechosas STEC se realizó de acuerdo con el Bacteriological Analytical Manual-FDA (Feng et al. 2017), con modificaciones, consistente en enriquecimiento de 25 g de muestra en 225 mL de buffer de fosfatos butterfield que se incubaron a 37 ± 1 °C por 24 h, seguido de diluciones seriadas (hasta 10-4). Posteriormente se sembraron 50 µL de las diluciones 10-2 y 10-4 en placas de agar Rainbow® O157 (Biolog, cat. 80102) mediante estría por agotamiento. Las colonias típicas STEC a partir del agar Rainbow® O157 (azules y/o negras) se inocularon en caldo tripticasa de soya (Oxoid LTD, cat. CM0129), posteriormente las cepas fueron criopreservadas en glicerol 20% a -70 °C en el Laboratorio de Investigación en Microbiología Molecular del Instituto Tecnológico de Sonora.
La morfología de los aislados se determinó por medio de tinción de Gram, y la prueba del indol en papel filtro no. 1 (Whatman TM , cat. 1001125) impregnado con 0.9 mL de reactivo de Kovac (Sigma-Aldrich, cat. 1092930100). La capacidad de producción de la enzima β-D-glucuronidasa (GUD) se determinó tomando 1 mL de caldo Escherichia coli-MUG (Oxoid LTD, cat.1791486), que se inoculó con 10 µL del cultivo que se incubaron por 24 h a 37 ± 1 ºC; para luego observar por fluorescencia (azul) bajo luz UV. La extracción de ADN genómico se realizó con el DNeasy® Blood and Tissue kit (Qiagen®, cat.69504) protocolo para bacterias Gram-negativas. La concentración y pureza del ADN se evaluó con espectrofotómetro Nanodrop 2000c (ThermoFisher Scientific) y la integridad se verificó por electroforesis. Para el análisis por PCR se utilizó como control positivo ADN genómico de E. coli O157:H7 (cepa CIBNOR-México) y como control negativo ADN de la E. coli ATCC 25922.
La PCR multiplex (mPCR) se estandarizó de acuerdo con lo indicado por Feng et al. (2017) con modificaciones. Se utilizaron oligonucleótidos para amplificar los genes stx1 y stx2; otro par de oligonu-cleótidos para amplificar un fragmento del gen γ - eaeA; un par para amplificar una región específica del gen uidA; y un par para amplificar un fragmento del gen ehxA (Tabla 1). Los genes stx1 y stx2 participan en la producción de toxina Shiga 1 y 2. El gen γ - eaeA amplifica un fragmento del gen de la proteína intimina de la membrana plasmática externa. Los oligonucleótidos +93 uidA amplifican una región específica del gen de la enzima β -glucuronidasa (uidA) que contiene el polimorfismo de nucleótido simple +93. Los oligonucleótidos ehxA amplifican un fragmento del gen de la toxina hemolisina.
Tabla 1. Iniciadores utilizados para los análisis por PCR.
| Gen | Secuencia (5’→3') | Tamaño | Referencia |
| stx2 | f-ATCCTATTCCCGGGAGTTTACG | ||
| r-GCGTCATCGTATACACAGGAGC | 584 pb | ||
| stx1 | f-CAGTTAATGTGGTGGCGAAGG | ||
| r-CACCAGACAATGTAACCGCTG | 348 pb | ||
| γ eaeA | f-ATTACCATCCACACAGACGGT | ||
| r-ACAGCGTGGTTGGATCAACCT | 397 pb | (Feng et al., 2017) | |
| +93 uidA | f-GCGAAAACTGTGGAATTGGG | ||
| r-TGATGCTCCATCACTTCCTG | 252 pb | ||
| ehxA | f-GTTTATTCTGGGGCAGGCTC | ||
| r-CTTCACGTCACCATACATAT | 166 pb | ||
| •fliCH7 | f- GCTGCAACGGTAAGTGAT | ||
| r- GGCAGCAAGCGGGTTGGT | 984 pb | (Ateba and Mbewe, 2011) | |
| •rfB | f-TAAGTAATGGAACGGTTGCTCT | ||
| r-CCCCACTCGTAAAATCCATC | 1000 pb | (Thapa et al., 2012) |
•; iniciadores utilizados en PCR punto final, pb; pares de bases.
Adicionalmente, para las cepas que presentaron el perfil molecular del serotipo O157:H7 (Feng et al. 2017), se determinó la presencia de los antígenos O157 (gen rfB) y H7 (gen fliCH7) para confirmar su identidad como O157:H7 (Ateba and Mbewe 2011, Thapa et al. 2012).
La reacción de PCR se llevó a cabo en 25 µL, las concentraciones utilizadas fueron 0.32 µM de cada iniciador (Tabla 1), buffer 1X (-MgCl2), 3 mM de MgCl2, 0.6 mM de dNTPs (Invitrogen, cat.10297018), 1.25 U de Taq DNA polimerasa recombinante (Invitrogen, cat.11615010), 1 µL de ADN (15 - 20 ng µL 1) y agua ultra pura (Invitrogen, cat.10977015). La PCR se realizó con el programa siguiente: desnaturalización inicial a 94 °C por 4 min, 31 ciclos (desnaturalización a 94 °C por 30 s, anillamiento a 62.5 °C por 30 s y extensión a 72 °C por 1 min), y una extensión final a 72 °C por 7 min, en un termociclador Labnet (modelo TC9610). Los fragmentos amplificados se visualizaron mediante electroforesis en gel de agarosa al 2%, utilizando buffer TAE 0.5 X y teñido con bromuro de etidio (0.33 mg mL-1). El tamaño de los amplicones se observó bajo luz UV en fotodocumentador MiniBis Pro (DNR BioImaging Systems).
Resultados y discusión
Una cepa sospechosa se identifica como STEC O157:H7 cuando presenta el perfil molecular establecido en la Figura 1 (Feng et al. 2017). Los iniciadores para los genes de virulencia stx1, stx2 y ehxA utilizados permiten detectar su presencia en todos los serotipos de E. coli enterohemorrágica (EHEC), por lo que es un método adecuado para establecer la presencia de STEC a partir de cultivos puros (Feng and Monday 2000). A partir de las heces de 17 bovinos asintomáticos se aislaron en agar Rainbow® O157, 131 cepas STEC sospechosas; este chromagar permite recuperar hasta un 70% de otras STEC no O157 (Zelyas et al. 2016).
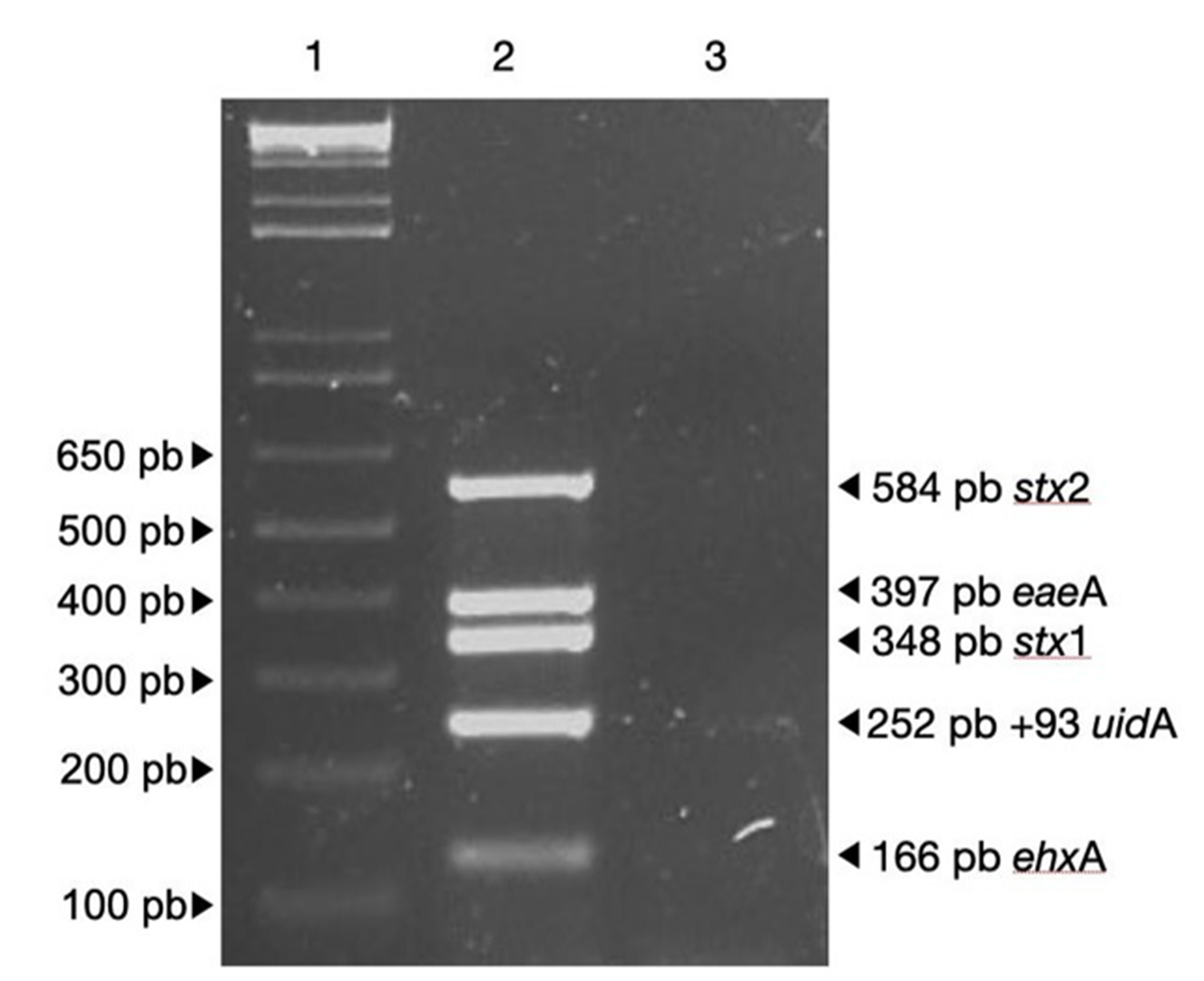
Figura 1 Detección de genes de patogenicidad de E. coli O157:H7 mediante PCR múltiplex. Línea 1; marcador de peso molecular (1 Kb DNA plus ladder), línea 2; control positivo (E. coli O157:H7), línea 3; control negativo (E. coli ATCC 25922).
El 100% (131 cepas) fueron bacilos cortos Gram negativos, el 93.1% (122 cepas) indol positivos y el 54.4% (71 cepas) fueron Escherichia coli-MUG positivos. El estudio molecular diferenció cuatro grupos de STEC establecidos por la presencia de los genes de patogenicidad (stx1, stx2, γ-eaeA, ehxA, +93 uidA y rfB) (Tabla 2), siendo este el primer reporte en México en presentarse con esta propuesta.
Tabla 2. Resultados de PCR en cepas aisladas a partir de heces de bovinos.
| Perfil molecular n (%) | |||||
| Aislados STEC | Aislados no STEC | ||||
| Grupo 1 | Grupo 2 | Grupo 3 | Grupo 4 | ||
| ehxA, +93 uidA, γ - eaeA, stx2, rfB, fliCH7 | ehxA, stx1, stx2 | ehxA, stx2 | ehxA, stx1 | ehxA | sin amplificación |
| 4 (3.1) | 4 (3.1) | 17 (12.9) | 5 (3.8) | 74 (56.5) | 27 (20.6) |
*serotipo O157:H7
El gen stx2 se detectó en el 19.1% (25 cepas), mientras que el gen stx1 en el 6.9% (5 cepas). El 3.1% (4 cepas) presentaron el gen rfB y el gen fliCH7. Un aspecto importante a resaltar en las cepas positivas a STEC O157:H7 es que generalmente se encuentran vinculadas a afecciones clínicas graves, como diarrea con sangre y SUH en humanos. Por lo que varios estudios han seleccionado los genes de los antígenos O157 y H7 como marcadores genéticos para la identificación de STEC O157:H7 mediante PCR (Ateba and Mbewe 2011, Bertrand and Roig 2007, Thapa et al. 2012).
Algunos autores sugieren que la STEC O157:H7 puede ser excretada en las heces por manadas de terneros hasta en un 4% (McCabe et al. 2019); en el presente estudio solo se detectó el serotipo O157:H7 en el 1.6% de las muestras. Así mismo, el bovino es reportado como portador de cepas STEC no-O157 con índices del 0 al 60% dependiendo de la zona geográfica (Farrokh et al. 2013, Shridhar et al. 2017), en el presente estudio la raza Simbrah presentó el mayor índice de excreción de STEC no O157 con un 16.6% (Tabla 3). No existen reportes previos de STEC O157:H7 en el estado de Sonora; solamente se había reportado la presencia de la STEC O104 en heces de bovinos (Navarro et al. 2018), sin embargo nuestros resultados demuestran la presencia de STEC O157:H7 y STEC no O157, lo que sugiere que el contacto con las heces de bovinos asintomáticos pueden significar un riesgo hacia la población en esta región del país.
Tabla 3 Bovinos con presencia de STEC O157:H7 y no O157.
| Genes identificados | ||||
| Clave del bovino | Raza | Clave de los aislados | STEC | O157:H7 |
| •H11 | Charolais | H11-1 | stx2, ehxA | - |
| •H24 | Simmental Charbray | H24-1 | stx1, stx2, ehxA | - |
| •H28 | Simmental Charbray | H28-1, H28-2, H28-3, H28-5; | stx2, γ eaeA, ehxA | +93 uidA, rfB,fliCH7 |
| H28-4, H28-6 | stx2, ehxA | - | ||
| M1 | Simmental Charbray | M1-1, M1-4 | stx2, ehxA | - |
| M3 | Cruza1 | M3-4, M3-5 | stx1, stx2, ehxA | - |
| M4 | Simbrah | M4-3 | stx2, ehxA | - |
| M8 | Cruza1 | M8-1, M8-2, M8-3 | stx2, ehxA | - |
| M10 | Cruza1 | M10-1, M10-2 | stx2, ehxA | - |
| M11 | Simbrah | M11-2; | stx1, ehxA | - |
| M11-3 | stx2, ehxA | - | ||
| M12 | Simbrah | M12-2 | stx2, ehxA | - |
| M14 | Simbrah | M14-4 | stx2, ehxA | - |
| M17 | Cruza1 | M17-4 | stx1, ehxA | - |
| M18 | Simbrah | M18-4, M18-5, M18-7 | stx2, ehxA | - |
| M21 | Simbrah | M21-2 | stx1, ehxA | - |
| M22 | Simbrah | M22-3 | stx1, ehxA | - |
| M27 | Simbrah | M27-1 | stx1, ehxA | - |
| M33 | Simbrah | M33-3 | stx1, stx2, ehxA | - |
Clave bovino M/H: Macho/Hembra, •; Bovinos con registro SINIIGA, Cruza1 se refiere a la mezcla entre hembra y macho de las razas Simbrah, Simmental Charbray y Charolais.
Este es el primer reporte de la presencia de STEC O157:H7 en heces de bovinos asintomáticos en el Noroeste de México. Se identificaron 4 cepas STEC O157:H7 y 26 cepas STEC no O157, lo que sugiere que pueden constituir un vector importante de contaminación de otras matrices, sin embargo, esto deberá ser demostrado en estudios posteriores.











 nueva página del texto (beta)
nueva página del texto (beta)


