INTRODUCCIÓN
La roza-tumba-quema (RTQ) es un sistema itinerante de cultivo fundamentado en alternar el uso intensivo de un terreno con periodos largos de descanso. Esta técnica, consiste en derribar una sección de bosque maduro, extraer la parte maderable y la leña, dejar secar y luego quemar el resto del material vegetativo. Sobre el terreno se siembra de uno a tres ciclos anuales (Pérez-García y del Castillo 2016). Luego se permite la recuperación de la vegetación, con o sin intervención humana, durante varios años (Riveiro-Filho et al. 2013). El conocimiento de los recursos locales proporciona la base para el funcionamiento de este sistema y su racionalidad se sustenta en los descansos largos y el policultivo (Toledo et al. 2008). Esta técnica se practica en la zona tropical del mundo desde hace aproximadamente diez mil años, aunque históricamente, no se limita a estas latitudes (Tomson et al. 2016).
El cambio de uso de tierra mediante esta técnica, en condiciones de trópico seco, modifica el ciclo de nutrientes (Amorim et al. 2014), y presenta mayor disponibilidad de estos después de la quema (Giardina et al. 2000a); aunque hay evidencia de que estos incrementos son significativos después del primer mes del fuego (Singh et al. 2017). Con frecuencia, el carbono lábil resultante de la quema incrementa la actividad microbiológica, misma que facilita múltiples procesos en el ambiente edáfico (Giardina et al. 2000b). Al respecto, Riveiro-Filho et al. (2013) indican que el fuego y los descansos cortos impactan de forma negativa en el componente biológico y que el aspecto crítico para que el sistema se sostenga es el periodo de descanso. La calidad del suelo es la capacidad que tiene para cumplir con sus funciones dentro de límites establecidos, permitiendo la limpieza del agua y el aire, así como la salud y sustento de animales, plantas y seres humanos (Karlen et al. 1997). La cual se estima mediante diversos parámetros, como el carbono lábil (Ginebra et al. 2015), el carbono de la biomasa microbiana (Fregoso 2008), las propiedades físicas y químicas (Jaurixje et al. 2013), la mesofauna (Socarrás 2013), la actividad enzimática (Ochoa et al. 2007), entre otras. Las comunidades microbianas constituyen un aspecto importante en la calidad del suelo (Jackson et al. 2003). Los microorganismos son responsables de procesos fisiológicos y metabólicos edáficos (Bastida et al. 2008); además de que presentan una rápida respuesta a los cambios en el manejo del suelo, en su condición ambiental o contaminación (Ferreras et al. 2009, Pagano et al. 2011). Las propiedades físicas y químicas del suelo, son más fácil de medir (Di Ciocco et al. 2014), y están asociados a los cambios biogeoquímicos del ecosistema (Jackson et al. 2003) y se reconocen como buenos indicadores de la calidad del suelo (Doran y Zeiss 2000, Ochoa et al. 2007).
En la región de Tierra Caliente de Michoacán, con bosque tropical caducifolio (Rzedowski 2006), se practica la RTQ desde tiempos prehispánicos, para la producción de maíz (Rojas 1991). En los últimos 50 años se ha incorporado la fertilización y el uso de herbicidas, además de la presencia histórica y generalizada de la ganadería (Cochet 2001); por lo que la conversión temporal en potrero reduce el periodo de descanso. Dadas las condiciones para la producción de maíz en esta región, se desconoce si las comunidades microbianas son un indicador adecuado para valorar la calidad de los suelos, de igual manera la relación entre la diversidad funcional microbiana y el periodo de descanso, y si esta diversidad se relaciona con la materia orgánica. Por lo anterior, el objetivo fue describir la influencia que tiene el tiempo de descanso sobre las comunidades microbianas al nivel de diversidad funcional, la materia orgánica y la condición macro nutrimental del suelo en un ambiente de bosque tropical caducifolio, para conocer su papel en la recuperación de la calidad del suelo y su utilidad como indicadores de calidad en estas condiciones.
MATERIALES Y MÉTODOS
Ubicación
El área de estudio se encuentra en el ejido Acatén, en la parte suroeste del municipio de Madero, en la región Tierra Caliente de Michoacán, México. La vegetación original fue bosque tropical caducifolio (Rzedowski 2006) y el clima dominante es cálido sub-húmedo con lluvias en verano (Aw0) (García 2004). De acuerdo con el Instituto Nacional de Estadística, Geografía e Informática y con la verificación en campo, el tipo de suelo dominante es leptosol, lo que indica que son suelos jóvenes y someros de origen volcánico (Gómez-Vasconcelos et al. 2015).
Identificación de los sitios de muestreo
Se identificaron dos sitios que conformaron, en conjunto, una cronosecuencia de descanso después de la RTQ, para tener la opción de conocer los cambios temporales en la composición de las comunidades sin que el tiempo requerido fuera necesariamente prolongado (Smith et al. 2015).
El primer sitio se localiza a 19° 16'15" LN y 101° 17'46" LO, a una altitud de 1 660 m, corresponde a una parcela con vegetación secundaria que tiene más de 30 años sin manejo, identificada como A, con un área aproximada de 1 680 m2, orientación oeste y pendiente media de 64.5%. El segundo sitio se encuentra aproximadamente a 2.3 km al noroeste del primero, se localiza 19° 17'22" LN y 101° 18'18" LO y altitud de 1 685 m; es una parcela segmentada, donde cada sección tiene distinto tiempo de uso o descanso después de la RTQ. Tiene un área total aproximada de 6 754.4 m2, orientación suroeste, con pendiente dominante homogénea de 62.9%. Las parcelas se identificaron como B, C y D. En B han pasado tres años después de la RTQ, correspondientes a dos años de cultivo y uno de descanso; en C han pasado cinco años después de la RTQ, de los cuales dos fueron de cultivo y tres de descanso; y D tiene ocho años desde que se realizó la RTQ, dos de ellos de cultivo y los otros seis de descanso.
Muestreo de suelo
Se realizó un muestreo sistemático en abril de 2017, con nueve puntos en cada parcela, con distribución equitativa con respecto a la pendiente. De cada punto se tomó una muestra simple con pala recta, a profundidad de 0 a 15 cm, la cual se almacenó a temperatura ambiente durante una semana. Las muestras se secaron a temperatura ambiente, se tamizaron en malla calibre 10 y de tres muestras se obtuvo una muestra compuesta.
Análisis físico y químico del suelo
Las características físicas determinadas fueron la densidad aparente (Dap) por el método del terrón parafinado; textura, por el método de Bouyoucos (Arteta 2001) modificado, separando las arenas a través de un tamiz calibre 30 (0.595 mm). Capacidad de campo (CC) y punto de marchitez permanente (PMP), por medio de membranas de presión; y el contenido de humedad. También se determinó el contenido de materia orgánica total (MO) por el método de Walkley y Black, el pH en una solución 1:2 de suelo/agua, N total por el método de Kjeldhal; nitratos (Singh 1988), amonio (Baethgen y Alley 2008), y fósforo extraíble por el método de Bray y Kurtz (1945).
Para el estudio de las comunidades bacterianas heterotróficas se utilizó el enfoque de perfiles fisiológicos a nivel de comunidad (CLPP), construidos a partir del desarrollo de color durante la incubación de muestras diluidas de suelo en placas BIOLOG-ECOPLATETM por triplicado para cada sitio, con un total de 12 placas.
Esta técnica de placas se basa en la reducción de tetrazolium y su cambio de incoloro a violeta, a partir del uso de distintas fuentes de C (Garland y Mills 1991, Kaffe-Abramovich y Steinberger 2006). Para preparar las placas, primero se pesaron 3.33 g de cada muestra compuesta, que se agregaron a frascos con 30 ml de agua destilada, previamente esterilizada, para luego mezclar y agitar a 150 rpm durante 30 minutos.
Se realizaron diluciones hasta 10-3, de esta última se tomaron 150 μL para inocular cada uno de los 96 pozos de la placa BIOLOG-ECOPLATETM , con 31 fuentes distintas de carbono por triplicado, y tres pozos con agua destilada como testigo. La actividad metabólica microbiana se calculó con base en seis grupos de fuentes de C: 1) ácidos carboxílicos, 2) aminas y amidas, 3) aminoácidos, 4) carbohidratos, 5) misceláneos y 6) polímeros.
Las placas se incubaron a 28 °C durante 96 h, pero se realizaron lecturas cada 24 h en espectrofotómetro Synergy2 (Biotek), a longitud de onda de 590 nm. El análisis de los datos se realizó con el uso del software Gen5 Microplate Reader (Biotek, Versión 5.1). El promedio de la respuesta metabólica (RM), también llamado desarrollo promedio de color (AWCD), se calculó por fuente de carbono mediante la fórmula:
Donde: DO i es la densidad óptica promedio de la muestra, DOc la densidad óptica promedio del control (agua destilada), y n el número de fuentes de carbono.
Las DO i se utilizaron para obtener la abundancia relativa por grupo funcional (pi) con la fórmula:
Donde: n i es la DO de la fuente de carbono i y N es la sumatoria de todas las DO i .
A partir de estos datos, se calculó el índice de Shannon (H') de la fórmula:
Donde: S es el número de fuentes de C por tipo de actividad metabólica. Para ácidos carboxílicos es nueve, aminas y amidas dos, aminoácidos seis, carbohidratos siete, misceláneos tres y polímeros cuatro.
Se partió de la medición indirecta de la actividad metabólica por medio del desarrollo de color en la placa (AWCD), para obtener un índice de diversidad de Shannon (H') para cada parcela. Para calcular los índices de Shannon (H') se consideraron las lecturas realizadas 96 h después de la inoculación, que corresponden a un desarrollo de color más estabilizado. Se realizó el conteo, en cajas Petri, de las unidades formadoras de colonias (UFC) presentes en el suelo de las parcelas. Se prepararon los medios de cultivo de agar nutritivo (AN), Rennie (R) y papadextrosa-agar con rosa de bengala (PDA), para bacterias totales (Bt), bacterias fijadoras de nitrógeno (Bfn) y hongos totales (Ht), respectivamente.
Se prepararon tres muestras compuestas de suelo por cada parcela. Por cada muestra se realizó una dilución de 10-1 en agua destilada estéril, la cual se agitó durante 30 min a 150 rpm. Posteriormente, se realizaron las diluciones de 10-2 a 10-6 de cada muestra. Se inocularon cajas Petri, por triplicado, con 1 ml de las diluciones 10-5 y 10-6 para Bt, 10-3 y 10-4 para Bfn y 10-2 y 10-3 para Ht. Estas se incubaron a 28°C durante 24 h, para luego cuantificar de forma visual las UFC.
Análisis estadísticos
Los análisis se realizaron con el software libre de R-project. Para verificar la normalidad de los datos se empleó la prueba de chi cuadrada a partir del comando pearson.test de la librería nortets. Para conocer la existencia de diferencias entre las medias de las variables MO, FL, FP, H' y tiempo de descanso en años (t), se realizaron análisis de varianzas en el software libre de R-project utilizando el comando aov(), posteriormente se aplicó la prueba de Tukey con el comando HSD.test() de la librería agricolae con α = 0.05.
RESULTADOS
Propiedades físicas y químicas
Las variables físicas (Dap, CC, PMP, humedad aprovechable) no presentaron diferencias significativas (p < 0.05) con respecto al tiempo de descanso del terreno. En todos los sitios hubo un porcentaje bajo de humedad aprovechable, debido a la poca diferencia entre la CC y el PMP (Tabla 1). Los contenidos de nitrógeno total, amonio y fósforo extraíble no presentaron diferencias significativas (p < 0.05) con relación al tiempo de descanso. El contenido de nitrato fue mayor en suelo con descanso de más de 30 años (Tabla 2).
Tabla 1 Propiedades físicas evaluadas con respecto al tiempo de descanso en suelos leptosoles donde la vegetación original fue bosque tropical caducifolio.
| Tiempo después de la quema (años) |
Tiempo de descanso (años) |
Textura dominante |
Capacidad de campo (CC %) |
Punto de marchitez permanente (PMP %) |
Humedad aprovechable (CC-PMP, %) |
Humedad al momento del muestreo (%) |
Densidad aparente - Dap (Mg m-3) |
|---|---|---|---|---|---|---|---|
| 3 | 1 | Franco limoso | 24.4 | 18.8 | 5.6 | 4.0 | 1.54 |
| 5 | 3 | Arcillo limoso | 25.6 | 20.7 | 4.9 | 6.6 | 1.57 |
| 8 | 6 | Franco | 22.1 | 16.9 | 5.2 | 3.9 | 1.58 |
| >30 | >30 | Franco limoso | 25.5 | 20.6 | 4.9 | 7.8 | 1.52 |
Tabla 2 Variables químicas del suelo con respecto al tiempo de descanso de la tierra.
| Tiempo después de la quema (años) |
Tiempo de descanso (años) |
Nt (%) |
P (mg•kg-1) |
NO3- (mg•kg-1) |
NH4+ (mg•kg-1) |
Contenido de MO (%) |
Reacción del suelo (pH) |
|---|---|---|---|---|---|---|---|
| 3 | 1 | 0.16 a | 39.7 a | 46.7 b | 37.3 a | 4.3 ab | 6.05 c |
| 5 | 3 | 0.15 a | 36.5 a | 28.0 b | 23.3 a | 4.5 ab | 6.43 ab |
| 8 | 6 | 0.18 a | 36.1 a | 65.3 ab | 42.0 a | 3.3 b | 6.23 bc |
| >30 | >30 | 0.18 a | 21.6 a | 144.7 a | 65.3 a | 6.1 a | 6.58 a |
Se muestran los valores promedio. Las letras denotan diferencia significativa entre los valores (Tukey, α = 0.05).
La concentración de fósforo extraíble, nitrato y amonio presentó valores bajos. Al observar el comportamiento de estos nutrimentos a través del tiempo de descanso, se observó un decremento notorio en la parcela con un año de descanso (C), con respecto a la parcela con tres años de descanso (B) y posteriormente un nuevo incremento en la parcela con seis años de descanso (D), presentando el valor mayor la parcela con más de 30 años de descanso (A).
La materia orgánica y el pH tuvieron una tendencia creciente en función del tiempo de descanso. Los índices de Shannon (H') presentaron diferencias significativas (p < 0.05) entre las condiciones más contrastantes, es decir, entre la parcela con un año de descanso y la parcela con más de 30 años de descanso (B y A, respectivamente); estos valores fueron, en general, elevados. El pH es un factor importante, ya que al ser un valor exponencial, indica grandes cambios en las características reactivas del suelo. El pH tuvo diferencias significativas para los sitios con más de 30 años de descanso (A) y con un año de descanso (B); fue más próximo a la neutralidad en la parcela más descansada (A) y ligeramente ácido en el sitio más recientemente cultivado (B).
Características microbiológicas
La diversidad microbiana (índice H') presentó diferencias entre la parcela con 3 años de descanso que superó sólo al área natural con más de 30 años de descanso (Tabla 3). El consumo aminas/amidas, carbohidratos, misceláneos y polímeros no presentó diferencias significativas (p < 0.05) entre los distintos tiempos de descanso del terreno, mientras que el uso de ácidos carboxílicos fue significativamente distinto (p < 0.05) para la parcela con tres años de descanso y la que tiene más de 30 años de descanso, siendo más alto en la primera (Figura 1).
Tabla 3 Presencia de UFC en parcelas con distinto tiempo de descanso después de la RTQ. Los conteos se realizaron en cajas Petri después de 24 h de inoculación.
| Tiempo de descanso (años) |
Bacterias totales (BT) |
Bacterias fijadoras de nitrógeno (Bfn) |
Hongos totales (Ht) |
Índice de diversidad de Shannon (H´) |
|---|---|---|---|---|
| UFC x 104 | UFC x 102 | |||
| 1 | 38.9 | 42.2 | 12.33 | 3.32 bc |
| 3 | 73.9 | 43.7 | 40.67 | 3.36 a |
| 6 | 60.0 | 64.3 | 43.00 | 3.34 ab |
| >30 | 27.8 | 28.6 | 10.89 | 3.29 c |
Se muestran los valores promedio. Las letras denotan diferencia significativa entre los valores (Tukey, α = 0.05).
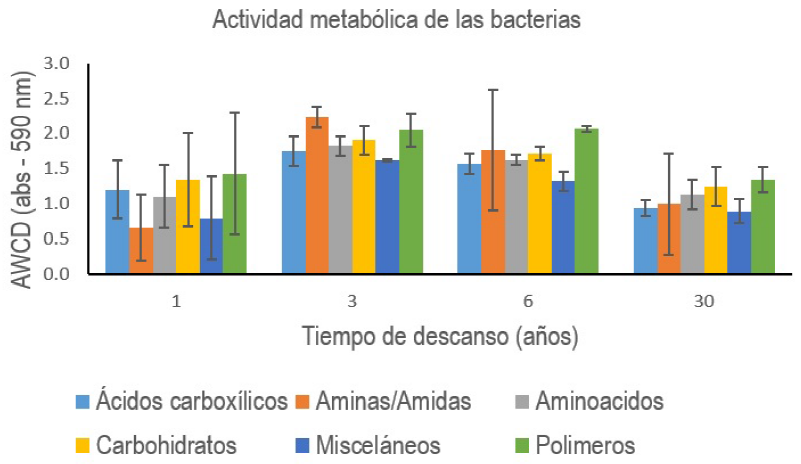
Figura 1 Actividad metabólica de las bacterias del suelo por fuente de carbono utilizada, se reportan las lecturas de absorbancia a las 96 h de incubación. Las barras representan la desviación estándar.
El análisis de varianza no mostró diferencias significativas (p < 0.05) en el tamaño de la población de Bt, Bfn y Ht para todos los tiempos de descanso (Tabla 3). La cantidad de UFC de Bt fue mucho mayor que la de Ht, mientras que las Bfn se mantuvieron en niveles altos, estando presentes en todas las parcelas y sin diferencia significativa (p < 0.05) con respecto a Bt.
DISCUSIÓN
Los resultados de las variables físicas concuerdan con lo reportado por Medeiros et al. (2017), quienes tampoco observaron diferencias en variables físicas a una profundidad de 5 a 10 cm en estados de sucesión de 15, 30 y 50 años en un bosque tropical seco; pero, sí encontraron mejoras en las propiedades químicas con los tiempos de descanso más largos. Al respecto Alegre y Cassel (1996) indican que la RTQ no afecta la estructura y densidad aparente del suelo; aunque la quema deja expuesta una mayor superficie de suelo que favorece la erosión hídrica y eólica, sobre todo en los primeros años de cultivo (Dos Santos et al. 2017). Esta es la razón principal por la que se presentan grandes pérdidas de suelo y, por ende, nutrimentos después de la quema; lo que se ha documentado después de incendios forestales (Giardina et al. 2000b). Los efectos se manifiestan con la pérdida de la cubierta vegetal, reducción de la infiltración y aumento en la erosión hídrica (Wilson et al. 2018, Fernández et al. 2019, Rodrigues et al. 2019). La baja humedad disponible en el suelo acentúa la fuerte estacionalidad de la zona con respecto a la precipitación (Rzedowski 2006), y es una restricción importante durante la temporada de crecimiento en estos suelos poco desarrollados y someros (Maass et al. 2005, Gómez-Vasconcelos et al. 2015). En los primeros años después de la quema se esperara un descenso de las formas disponibles de nitrógeno por la quema misma y por consecuencia de la erosión superficial. La quema incrementa la mineralización de las formas orgánicas de nitrógeno, pero las pérdidas por volatilización resultan en un balance negativo para este elemento (Giardina et al. 2000a), pero la fertilización practicada por los dueños de las parcelas compensa estas pérdidas.
La mayor presencia de P después de la quema, se puede explicar por el aumento de la temperatura del suelo, lo que favorece la mineralización del P orgánico (Giardina et al. 2000b) y libera los fosfatos ocluidos en los agregados del suelo (Mataix-Solera et al. 2011). Los efectos de la quema en el contenido de P disponible pueden ser drásticos en los primeros años, llegando a un equilibrio en años subsecuentes de descanso, principalmente provocados por el establecimiento de la vegetación natural y el restablecimiento de los ciclos biogeoquímicos (Moya et al. 2018). Los valores de pH contrastan con el hecho de que la ceniza, producida por la quema, tiende a alcalinizar el suelo (Giardina et al. 2000a, Urretavizcaya, 2010). Este efecto es inmediato al evento fuego y los suelos del sitio son de origen volcánico, más tendientes a la acidez (Gómez-Vasconcelos et al. 2015). No se encontró una correspondencia entre el tiempo de descanso y el contenido de MO, ya que este último fue mayor en la parcela con más tiempo de descanso, con diferencia significativa (p < 0.05) solo con respecto al sitio con seis años de descanso. Al respecto, Medeiros et al. (2017) reportan un incremento significativo de carbono orgánico del suelo en los sitios con mayor tiempo de regeneración natural en un área tropical seca. Mientras que Kotto-Same et al. (1997) encontraron una fuerte correlación lineal positiva entre el tiempo de descanso y el carbono total del sistema en un área tropical húmeda.
La biomasa de la hojarasca en los bosques tropicales secos no es tanta, comparada con la producida en áreas de trópico húmedo, aun así, representa un reservorio significativo en el reciclaje del carbono y otros nutrientes (Amorim et al. 2014). No obstante, el suministro más importante de carbono proviene de la constante regeneración de las raíces finas, fenómeno que fue descrito por Castellanos et al. (2001), quienes señalan que el tiempo medio de residencia de las raíces finas es menor que el de otros residuos vegetales, incorporándose más pronto al suelo, llegando a tener aportes de biomasa significativos en condiciones naturales.
La constancia que mantuvo el índice de diversidad de Shannon (H') en los distintos tiempos de descanso confirma la resiliencia de las comunidades microbianas, que se puede explicar por su homeostasis estequiométrica (Spohn, 2016) y la posible redundancia de especies dentro de las poblaciones (Zamora et al. 2012). Comparados con reportes que indican menores índices de biodiversidad microbiana (Arteaga-Garibay et al. 2016, WingChing-Jones y Uribe 2016), los valores de H' fueron elevados en este trabajo, lo que indica que la diversidad biológica presente en los bosques tropicales y subtropicales, en los horizontes superficiales (Sharmah y Jha 2014).
En otros trabajos, hay evidencia de que la actividad bacteriana es estimulada por el suministro de materiales orgánicos en el suelo (Riveiro-Filho et al. 2013, Amorim et al. 2014, Kumar et al. 2017 Manjunath et al. 2018), sin embargo, y en contra de la hipótesis propuesta, la diversidad funcional bacteriana no estuvo correlacionada con el contenido de MO y sólo fue mayor con tres años de descanso en comparación con el sitio natural con más de 30 años de descanso. Lo anterior, indica capacidad de resiliencia entre las comunidades microbianas del suelo durante uno, tres y seis años después de la quema. Posiblemente, el manejo de las parcelas provoca activación de los microorganismos. Sin embargo, con periodos de descanso mayores a 30 años, los procesos biogeoquímicos se estabilizan y la biodiversidad microbiana se mantiene en tasas basales. En tamaño de la población, las comunidades microbianas no cambiaron debido a los diferentes periodos de descanso.
Se ha reportado mayor actividad microbiana en el suelo de la rizósfera de dos razas de maíz en la etapa inicial y final del cultivo, indicando que los hechos que pudieron incentivarla son: el contenido de carbono orgánico en los residuos de la cosecha anterior y la mayor producción de exudados radicales en las últimas semanas del ciclo (Arteaga-Garibay et al. 2016). Esto puede explicar por qué en la parcela con menos descanso, o más recientemente cultivada, el índice de diversidad mantiene un valor elevado y sin diferencia estadística con la que tiene más tiempo de descanso, dada la presencia reciente de maíz. En el caso de la parcela con tres años de descanso, aunque su contenido de MO no tuvo diferencia significativa con el contenido de MO de la parcela con menos tiempo de descanso, la diversidad funcional de bacterias (H') sí la tuvo, presentando un valor más alto en la parcela con tres años de descanso, lo que confirma la independencia entre contenido de MO y H' en el área de estudio. Al respecto, Li et al (2020) indican que la mayor diversidad microbiana del suelo se asocia a mayores aportes de MO (cobertura vegetal, incorporación de abonos o residuos vegetales) o por no manejar el suelo (labranza cero); por lo contrario, en las condiciones de este estudio, el cambio en diversidad microbiana (H') se asoció al manejo de la parcela y los cambios en la actividad microbiana del suelo; cómo aceleración de la mineralización de la MO, modificación de los diferentes tipos de sustratos disponibles. De manera similar, Li et al (2020) indicaron que en área naturales, periodos largos de sucesión vegetal traen consigo cambios benéficos en las propiedades del suelo, pero no necesariamente aumentos en la biodiversidad microbiana.
Se sabe que la presencia de vegetación aporta fuentes de carbono para los microorganismos edáficos (Revillini et al. 2016), por lo que la mayor diversidad en la parcela con tres años de descanso se debe posiblemente a la alta cobertura de teocintle, presente de manera natural durante la temporada lluviosa, que aporta residuos vegetales al suelo (Johnston-Monje y Raizada 2011), algunos de ellos fijadores de nitrógeno, como Azospirillum y Klebsiella (Carcaño-Montiel et al. 2006). Esto se refuerza con el hecho de que los exudados producidos por las raíces de maíz y teocintle contribuyen a mejorar la microbiota del suelo y algunos de los microbios endófitos presentes en sus raíces son capaces de emigrar hacia la rizosfera circundante y colonizarla, lo que sugiere un aporte directo de microorganismos al suelo (Johnston-Monje y Raizada 2011).
CONCLUSIONES
Se confirmó la resiliencia de las comunidades microbianas del suelo en el sistema de RTQ. Se encontraron niveles similares de diversidad funcional (H') en el suelo de parcelas con uno, tres, seis años de descanso y la biodiversidad fue menor en la parcela con más de 30 años de descanso, lo que indica estabilización basal de los microorganismos cuando el suelo no se maneja durante mucho tiempo. Las propiedades físicas del suelo no se modificaron con el tiempo de descanso de las parcelas, pero el pH, el contenido de MO y el de nitratos si se modificó; teniendo los valores más altos la parcela con más de 30 años de descanso.











 nueva página del texto (beta)
nueva página del texto (beta)



