Introducción
El género Capsicum, además de proveer proteínas y minerales necesarias en la dieta humana, posee propiedades terapéuticas y antimicrobianas (Lu et al. 2017). Su efecto, está asociado con la acción de antioxidantes, como fenoles, flavonoides, capsaicinoides, carotenoides, vitaminas, saponinas y terpenoides (Tag et al. 2014, Iqbal et al. 2015). La mayoría de los estudios referentes a estas sustancias, se han dirigido principalmente a problemas de salud humana y poco se ha observado en patógenos relacionados con plantas (Dorantes et al. 2000). Una de las principales problemáticas comunes en campo, es el daño causado por enfermedades fúngicas (Knogge 1996). Como las provocadas por los hongos Fusarium andiyazi y Cochliobollus spp., principales patógenos en el cultivo de espárrago y albahaca, respectivamente. Debido a su rápida diseminación y poseen amplio rango de hospederos, lo que ocasiona la aplicación indiscriminada de fungicidas sintéticos para su control (López y Hermann 2004).
Algunos estudios reportan que las sustancias presentes en los extractos de Capsicum, son de especial interés en el ámbito agrícola, para el control de microorganismos fitopatógenos (Corato et al. 2010). Estudios recientes, han comprobado que además de la capsaicina, se destaca la acción antifúngica de los fenoles, uno de los antioxidantes de mayor concentración que interfiere en el metabolismo microbiano, al inhibir su crecimiento (Kabara y Marshall 2005, Bacon et al. 2016). La baja toxicidad de éstas sustancias y su poca persistencia en el ambiente, lo hacen un excelente compuesto para ser empleado en la agricultura orgánica (Mahlo et al. 2010) para la producción de alimentos vegetales, donde hay una demanda creciente de alimentos inocuos; además de que se pretende reducir la contaminación y disminuir la emergencia de nuevas especies resistentes a los agroquímicos (Corato et al. 2010). Debido a lo expuesto anteriormente, los compuestos bioactivos de los extractos de Capsicum, podrían ser eficaces en la inhibición de diversas enfermedades fúngicas presentes en plantas cultivadas. Por lo anterior, el objetivo fue evaluar la actividad antifungica de antioxidantes derivados del extracto de cuatro cultivares de Capsicum spp. en la inhibición de F. andiyazi y Cochliobollus spp.
Materiales y métodos
Material vegetal
Se utilizaron muestras de frutos de chile frescos, maduros y firmes de las variedades: habanero (Capsicum chínense), serrano (Capsicum annuum var. Serrano), jalapeño (Capsicum annuum var. Jalapeño) y pimiento morrón (Capsicum annuum var. annuum) que se obtuvieron en mercados regionales de La Paz, Baja California Sur, México durante el mes de septiembre del 2018.
Cepas fúngicas
Las cepas de F. andiyazi (FA0017) y Cochliobollus spp. (CH0016), se obtuvieron de la colección fúngica del Laboratorio de Fitopatología de la Universidad Autónoma de Baja California Sur, La Paz, México. Aisladas previamente de cultivos orgánicos de espárrago y albahaca, respectivamente. Para el análisis in vitro, se reactivaron las cepas mediante la toma de una alícuota de cada suspensión, la cual se inoculó en medio de cultivo papa dextrosa agar (Difco) e incubaron a 28 °C por siete días.
Preparación de los extractos vegetales
La obtención de los diferentes extractos, se realizó mediante la metodología propuesta por Alam et al. (2015) con modificaciones. Los frutos de chile se lavaron con agua destilada estéril para eliminar partículas adheridas. La placenta con las semillas se removió y el resto del fruto se cortó en trozos de 0.5 cm. La deshidratación de las muestras de frutos de chile, se llevó a cabo mediante congelamiento por 48 h en un liofilizador (Freezone, series Labconco). Posteriormente, la materia seca se maceró hasta obtener un polvo fino. El extracto etanólico (EE), se obtuvo pesando 7 g de la muestra seca, la cual se colocó en tubos de ensayo de 100 mL, a los que se les añadieron 70 mL del solvente etanol al 96% sin desnaturalizar. Inmediatamente después, cada muestra se colocó en un sonicador (Branson 5210R-MT, Ultrasonic Cleaner) por 10 min. El sobrenadante fue sujeto a tres subsecuentes extracciones, repitiendo los pasos anteriores. La mezcla final, se filtró con papel filtro Whatman No. 1 (Whatman International) y el solvente se evaporó en un rota-evaporador (Buchi B-480 Waterbath) a 40 °C, hasta su secado total. Para luego almacenar el extracto crudo concentrado a -4 °C hasta su uso.
Determinación de la actividad antioxidante
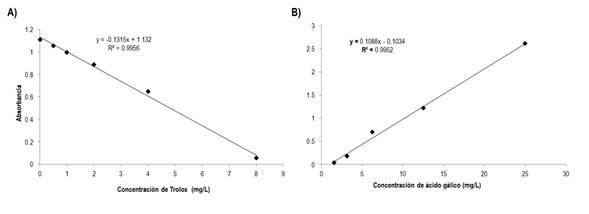
La capacidad antioxidante en frutos de chile, se determinó con la metodología propuesta por Yamaguchi et al. (1998), mediante el reactivo 1,1-Difenil-2-picrilhidrazil (DPPH), como compuesto antioxidante estándar. La curva estándar se obtuvo a partir de diluciones seriadas de una solución stock de 200 ppm de Trolox (6-hydroxy, 2, 5, 7, 8-tetramethylchroman-2-carboxylic acid). El reactivo de DPPH se preparó, pesando 8 mg de reactivo DPPH, disolviendo en metanol y aforando a 100 ml. Posteriormente se cubrió de la luz. Después de mezclar la solución del antioxidante (100 µL) con la solución de DPPH (1 ml), se dejó reposar por 30 min en oscuridad, antes de hacer la medición. Las lecturas de absorbancia se realizaron a una longitud de onda de 517 nm en un espectrofotómetro (GENESYSTM 10S UV-Vis Spectrophotometer - Thermo Fisher Scientific). Las muestras de extracto de chile, se midieron de la misma manera que el Trolox. El contenido de antioxidantes totales de cada muestra se expresó como mg equivalentes de Trolox por g del extracto etanólico (EE) a través de la curva de calibración con Trolox (mg ET*g-1 EE) (Figura 1).
Cuantificación del contenido total de fenoles
El contenido de fenoles totales en frutos de chile, se determinó por el método de Folin-Ciocalteau (Sigma), propuesto por Alam et al. (2015), usando ácido gálico como compuesto fenólico estándar. La curva estándar se obtuvo a partir de diluciones seriadas de una solución stock de ácido gálico de 50 ppm. La mezcla de reacción consistió en mezclar 100 µL de ácido gálico con 250 µL con reactivo de Folin-Ciocalteu 2N, dejando reposar por 8 min. Posteriormente se agregaron 1250 µL de Na2CO3 al 7.5%, y se dejó reposar por 2 h. Las lecturas de absorbancia se realizaron a una longitud de onda de 765 nm en un espectrofotómetro (GENESYSTM 10S UV-Vis Spectrophotometer-Thermo Fisher Scientific). Las muestras de extracto chile se analizaron de la misma manera que el ácido gálico. El contenido de fenoles totales de las muestras, se expresó como mg equivalentes de ácido gálico por gramo del extracto a través de la curva de calibración con ácido gálico (mg GAE*g-1 EE) (Figura 1).
Evaluación in vitro de la actividad antifúngica
Preparación del inóculo
Para la preparación del inoculo fúngico utilizado con los extractos, se colectaron las esporas de los hongos presentes en las placas con agar, después de siete días de crecimiento, como lo describe Broekaert et al. (1990). La concentración de suspensión de esporas se estimó con una cámara de conteo, donde se cuantificó el número de esporas por mililitro de cada patógeno a evaluar.
Inhibición del crecimiento micelial con el método de difusión de pozo en agar
La actividad antifúngica de los cuatro extractos de chile, sobre el crecimiento micelial de los patógenos a evaluar, se determinó mediante la técnica de pozo en agar, propuesta por Ríos et al. (1988), la cual consiste en inocular por difusión, para lo cual se tomaron 100 µL de la suspensión de esporas previamente preparada a concentración de 1x107 esporas mL-1 de cada patógeno y se sembraron en medio de PDA. Posteriormente se realizaron cuatro perforaciones equidistantes de 5 mm de diámetro en cada una de las placas, donde se colocaron 50 µL de extracto de chile en concentraciones de 300 ppm, como control negativo se utilizaron pozos que contenían 50 µL de agua destilada estéril, mientras que control positivo fue el fungicida comercial Captan (1% N-trichloromethylthio-4-cyclohexano-1,2-dicarboximida) a 0.2 mg mL-1. Las placas se incubaron a 28 ± 2°C y después de cinco días, se determinó la actividad antifúngica de los extractos, al medir el diámetro de la zona de inhibición micelial en centímetros alrededor de los pozos.
Efecto de los extractos en la germinación de esporas
El efecto de los extractos de chile, sobre la germinación de esporas, se realizó mediante la técnica del conteo de esporas germinadas en medio líquido, propuesta por Hadi et al. (2013). Para lo cual se tomaron 100 µA de cada uno de los extractos, así como los tratamientos control, que se disolvieron en matraces que contenían 100 mL de medio líquido de papa-dextrosa. Posteriormente, un disco de 0.5 cm de diámetro con crecimiento activo de F. andiyazi o Cochliobollus spp. se colocó en matraces que se sellaron y agitaron en un Shaker (150 rpm) (Brinkmann Rockermix 1030). A las 48 h posteriores, se tomó una alícuota de 10 A de cada tratamiento y se cuantificó el número de esporas germinadas, mediante el uso del microscopio óptico (Labomed LX 400) y una cámara de conteo. La eficacia de los extractos, se expresó como porcentaje de inhibición de esporas germinadas, mediante la fórmula propuesta por Dissanayake (2014):
Dónde: C y T, representan las esporas germinadas del control (C) y de los tratamientos (T) con los extractos, respectivamente.
Diseño experimental
Los resultados obtenidos de cada uno de los experimentos, se analizaron estadísticamente mediante un diseño completamente al azar, con tres repeticiones, realizándose análisis de varianza y comparación múltiple de medias de Tukey, mediante el paquete de diseños experimentales GraphPad Prism v.7.
Resultados
Propiedades antioxidantes de extractos de Capsicum spp.
Para obtener una perspectiva completa del potencial antioxidante de los diferentes cultivares de chile habanero, serrano, jalapeño y morrón, se llevaron a cabo ensayos para evaluar la eliminación de radicales libre y el poder reductor total (Tabla 1). Todas las especies de chile, mostraron actividad antioxidante. Pero el extracto de chile serrano mostró el menor valor, al presentar 7.94 mg g-1 de antioxidantes, mientras que la mayor actividad lo presentó el extracto de chile habanero con 11.9 mg g-1, seguido del chile de morrón (9.10 mg g-1) y el chile jalapeño (8.59 mg g-1). Los resultados muestran que el extracto obtenido del pericarpio de chile habanero, fue el mejor en relación al contenido de antioxidantes.
Contenido fenólico de los cuatro cultivares de Capsicum spp.
El contenido de fenoles totales (CFT), se determinó por la prueba de Folin-Ciocalteu, de muestras liofilizadas del pericarpio de frutos de chile. El análisis del CFT, indica variaciones entre los extractos etanólicos (EE) de las muestras de Capsium (Tabla 1). El mayor contenido de fenoles totales se encontró en el extracto de chile jalapeño, con 46.76 mg g-1, mientras que en orden de importancia le siguió el pimiento morrón (44.76 mg/g-1) y habanero (43.63 mg g-1); mientras que el serrano tuvo el menor contenido (30.22 mg g-1).
Actividad antifúngica de los extractos
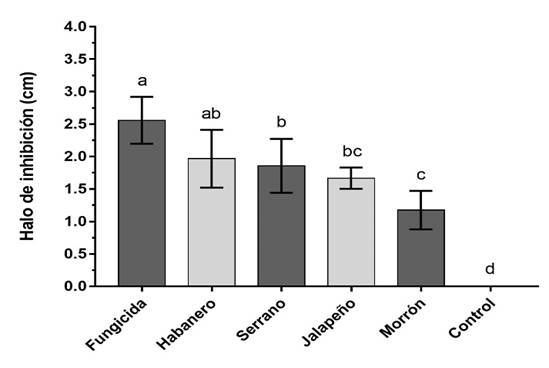
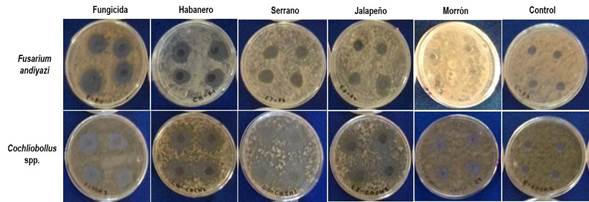
El análisis de varianza indica que los cuatro extractos etanólicos de Capsicum, tienen potencial antifúngico contra los hongos patógenos evaluados. Pero su efectividad en la inhibición del crecimiento micelial mostró diferencias significativas (p < 0.05) entre los extractos (Figura 2 y 3), ya que solo uno tuvo una marcada inhibición fúngica. Para el chile habanero se observó mayor inhibición de F. andiyazi y Cochliobollus spp., con halo de inhibición de 1.78 y 1.96 cm. La respuesta expresada en el tratamiento de chile habanero, no tuvo diferencias significativas con el tratamiento del fungicida comercial (1.96 y 2.55 cm), lo que demuestra que la eficacia de este extracto vegetal fue igual al del producto sintético que comúnmente se utiliza en campo. Mientras que los extractos de chile jalapeño (1.47 y 1.66 cm), serrano (1.45 y 1.85 cm) y morrón (1.34 y 1.1 cm), presentaron menor inhibición en ambos patógenos. Al comparar la respuesta de los dos microorganismos patógenos sobre el efecto de los extractos de Capsicum y el fungicida, se observó que Cochliobollus spp. fue más susceptible a este tipo de sustancias, al mostrar un mayor diámetro de la zona de inhibición comparado con la respuesta de F. andiyazi a los mismos compuestos (Figura 4).
Inhibición de la germinación de esporas
Entre los extractos de Capsicum evaluados, se observó que en el caso de F. andiyazi, los extractos de chile morrón, habanero y jalapeño, presentaron mayor inhibición en la germinación de esporas al mostrar 64.87, 55.61 y 53.17%, respectivamente. Éstos no presentaron diferencias significativas con respecto al tratamiento del fungicida (74.63%), demostrando similitud en la efectividad antifúngica de dicho patógeno (Tabla 2). Mientras que, en el caso del extracto de chile serrano, éste solo presentó un porcentaje de inhibición de 9.75%, siendo el que menor efecto tuvo contra la germinación de esporas de F. andiyazi.
Tabla 2 Efecto de extractos de Capsicum spp. en la inhibición de la germinación de esporas.
| Inhibición de la germinación de esporas (%) | |||
|---|---|---|---|
| Tratamientos | Fusarium andiyazi | Cochliobollus spp. | |
| Habanero | 55.61a | 82.29a | |
| Serrano | 9.75b | 79.16a | |
| Jalapeño | 53.17a | 44.79b | |
| Morrón | 64.87a | 72.91ab | |
| Fungicida | 74.63a | 88.54a | |
*Letras diferentes en las columnas indican diferencias significativas (p ≤ 0:05).
El efecto de los extractos de Capsicum en la germinación de esporas del hongo Cochliobollus spp. fue variable. Los resultados mostraron que el extracto de chile habanero (82.29%) y serrano (79.16%) fueron iguales estadísticamente junto con el fungicida comercial (88.54%), al presentar mayor efecto de inhibición sobre el hongo. Sin embargo, estos tratamientos mostraron diferencias significativas con los extractos de chile morrón (72.91%) y jalapeño (44.79). Al comparar el efecto de cada extracto, entre el crecimiento micelial y la germinación de esporas de F. andiyazi y Cochliobollus spp. se observó que el mayor efecto antifungico, se presentó sobre el hongo Cochliobollus spp. al mostrar más susceptibilidad a estos tipos de compuestos. No así en el caso de F. andiyazi, debido probablemente a que este último, es uno de los géneros más comunes en las plantas y el que está mayormente expuesto a diversas sustancias naturales o sintéticas, lo que le confiere algún tipo de tolerancia.
Discusión
Diversos estudios indican que el chile habanero, es uno de los del genero de Capsicum que presenta mayor cantidad de compuestos antioxidantes, por ello, su consumo en diferentes tipos de presentaciones, es de gran importancia (Gurnani et al. 2016). Lo que se corroboró, ya que dentro de los diferentes extractos de Capsicum evaluados, el extracto de chile habanero presentó la mayor concentración de antioxidantes. Resultados similares fueron reportados por Castro-Concha et al. (2014), al evaluar por separado la capacidad antioxidante del pericarpio y la placenta de dos variedades de chile habanero (naranja y rojo) y encontraron que el chile habanero color naranja presentó mayor actividad antioxidante en el pericarpio y la placenta, pero este último tejido, superó cinco veces la capacidad antioxidante que el pericarpio. Esta respuesta podría deberse a que en la placenta se encuentran adheridas las semillas, las cuales poseen la mayor concentración de fitoquímicos, como carotenoides, vitaminas, compuestos fenólicos y capsaicinoides (Castro-Concha et al. 2012). También se observó que algunos extractos con menor contenido de fenoles, tuvieron menor capacidad antioxidante, como el caso del chile serrano, que presentó la menor cantidad de compuestos en el pericarpio y la placenta. En tanto en el resto de los extractos, dicha relación no fue concisa, ya que, en el caso del chile habanero, la actividad antioxidante fue mayor, pero no el contenido de fenoles. Este tipo de respuestas, podría estar relacionada a que no todas las plantas presentan una relación en la misma cantidad de estos compuestos, y a la vez pueden no presentar la misma función biológica durante los procesos relacionados a mecanismos fisiológicos de cada especie como lo menciona Gambacorta et al. (2009), al reportar que algunos tipos de fenoles, presentan acción protectora contra algunas enfermedades, mientras que otros contribuyen a dar forma, textura y color en frutos y planas. Al respecto Gougoulias et al. (2012), mencionan que en el caso de los compuestos fenólicos, son considerados metabolitos secundarios que las plantas sintetizan directamente para adaptarse frente a condiciones de estrés. Sobre lo mismo Núñez-Ramírez et al. (2011), mencionan que las técnicas y los sistemas de cultivo, así como la fertilización, riego y variedad afectan los niveles de la actividad antioxidante en el cultivo de chile.
Estos resultados concuerdan con los de Bertao et al. (2016), quienes determinaron relación entre el contenido de compuestos bioactivos de diferentes genotipos de Capsicum (C. annuum L., C. baccatum L., C. chinense Jacq., C. frutescens L. y C. praetermissum) y su actividad antioxidante, encontrando que no todos tienen relación. Por el contrario Lee et al. (1995), observaron correlación lineal entre la concentración de fenoles y la actividad antioxidante en chiles, principalmente de tipo habanero. Para el contenido de fenoles, se observó una concentración variable en cada extracto de Capsicum spp., presentando el chile serrano la menor concentración. Lo que difiere de lo reportado por Cerón et al. (2016) quienes señalan que el chile serrano tuvo mayor contenido fenólico (144 mg 100 g-1 GAE) que el chile habanero (34 mg 100 g-1 GAE). De forma contraria, en los resultados obtenidos en los tratamientos del extracto de chile morrón y jalapeño, se observó que éstos presentaron la mayor concentración de compuestos fenólicos. Esta diferencia de concentración, podría estar ligada al estado de madurez de los diferentes tipos de chiles, los cuales la mayoría normalmente se consumen inmaduros. Al respecto, Marinova et al. (2005) y Navarro et al. (2006), encontraron que las frutas en la etapa de maduración verde representan más concentración de fenoles en sus tejidos que en estado maduro. De forma contraria Conforti et al. (2007) estudiaron la actividad antioxidante de chiles verdes y rojos de C. annuum L. var. Acuminatum, y encontraron que la concentración de compuestos orgánicos incrementó conforme los chiles alcanzaron la madurez. Así mismo, otros autores han encontrado que la concentración de dichas sustancias depende del cultivar y no de su estado fisiológico (Howard et al. 2000). Estos resultados coinciden con los reportados por Medina-Juárez et al. (2012), los cuales evaluaron el contenido total de fenoles en chile anaheim, morrón, caribe, jalapeño y serrano y encontraron que el extracto de chile morrón presentó el mayor nivel. Los diferentes niveles de fenoles totales obtenidos, también pueden atribuirse a las diversas especies de Capsicum seleccionadas, así como el procedimiento y los tipos de estándares utilizados, tal como lo señala Vashisth et al. (2011), quienes indican que para algunas variedades de chile, la deshidratación por congelamiento incrementa la porosidad del tejido, lo que provoca mayor eficiencia de extracción de compuestos fenólicos. Esto concuerda con los estudios realizados por Materska (2014), quien determinó el impacto del proceso de enfriamiento en el contenido de fitoquimicos en la placenta y pericarpio de diferentes variedades de chile (C. annuum var. Red Knight, C. annum var. Shanghai, C. annuum var. Socrates y C. annuum var. Capel) y observó que el mayor CFT se presentó en el pericarpio. Resultados contrarios son reportados por Ornelas-Paz et al. (2010), los cuales analizaron el contenido de fenoles totales por el método de cocción en muestras de chile poblano, bell, chilaca, caribe, jalapeño, serrano, habanero y manzano, concluyendo que se incrementó de forma secuencial en el CFT. Al respecto Loizzo et al. (2015), confirman que esta variación de respuestas indica que no todas las especies de chile son sensibles al mismo tipo de procesamiento, lo que puede tener impacto en el contenido de compuestos bioactivos. Así mismo, los resultados mostraron que el contenido de fenoles no está relacionado con la pungencia de la variedad de chile en estudio, la cual aunque no se determinó, si se conoce el nivel de Capsaicinoides. Como lo confirma Aguiar etal. (2016), quienes no reportan correlación entre el total de capsaicinoides y el contenido de fenoles totales, los cuales varían con el estado de madurez del fruto y color.
Las propiedades antioxidantes, antiinflamatorias, antialergénicos, antibacteriales y antimutagenicos, varia con la especie de Capsicum. Lo que está relacionado con la expresión de compuestos como, caroteonides, capsaicinoides y vitaminas (Loizzo et al. 2015). Los extractos de Capsicum spp. mostraron una respuesta antifúngica diversa en el control de hongos fitopatógenos. La comparación de la inhibición del crecimiento micelial de los extractos de chile y su respectiva concentración de compuestos fenólicos y antioxidantes, mostró, que el chile habanero, tuvo efecto dependiente de la concentración de antioxidantes, pero en el resto de los extractos no se encontró esta relación. Esto podría deberse al estado de maduración avanzada que presentaban dichos frutos y/o a la diferencia de coloración de su pulpa o tejidos, donde se ha señalado previamente la influencia de estas características en el contenido de este tipo de sustancias. Lo que indica que la actividad antifúngica del extracto de chile habanero fue mayor, debido probablemente al incremento de la concentración de compuestos antioxidantes. Lo que concuerda con lo reportado con Pan y Wang (2010), quienes señalan que el incremento de compuestos antioxidantes se correlacionan con el incremento de la tolerancia a diversos tipos de estrés. Estudios previos, han establecido que el extracto de chile habanero contiene numerosos compuestos con actividad antioxidante incluyendo β-carotenos, alcaloides, fenoles y ácido ascórbico (Shahidi 2000). Este tipo de compuestos antioxidantes podrían estar implicados en la supresión del crecimiento fúngico al dañar su metabolismo celular, como lo menciona Govindappa et al. (2011), quienes reportaron la actividad antifungica de antioxidantes derivados de Crotalaria pallida Aiton contra diferentes hongos fitopatogenos, incluyendo a A. nidulans, A. flaviceps, F. solani, F. oxysporum, F. verticilloides, y N. oryzae, atribuyendo la inhibición positiva a la presencia de compuestos polifenoles, como alcaloides, flavonoides, taninos, esteroides, terpenoides, fenoles y saponinas. Sobre lo mismo Srinivasan y Sarada (2012), encontraron resultados similares al reportar la actividad antifungica de derivados de fenoles aislados de Psoralea corylifolia contra F. oxysporum, F. moniliforme y F. graminearum. Mientras que Gurnani et al. (2016), evaluaron la actividad antimicrobiana y potencial antioxidante de semillas de Capsicum frutescens, encontrando una asociación entre la extracción de compuestos antioxidantes y la eficaz inhibición de los microorganismos patógenos evaluados, como Pesudomaonas aeruginosa, Klebsilla pneumonae, Staphylococcus aureus and Candida albicans, C. krusei, Alternaría alternata y Aspergillus niger.
Para los fenoles, diversos estudios han confirmado que muchos compuestos fenólicos poseen acción antimicrobiana. Su principal función es como precursores para la formación de polímeros estructurales como la lignina y moléculas de señalización (Akila et al. 2011). Diversos reportes indican que estos compuestos alteran la funcionalidad de la membrana (Lanciotti et al. 2014). Al respecto Cruz-Rodríguez (2017), asociaron el efecto de los compuestos fenólicos aislados del extracto de Crotalaria longirostrata con la efectiva inhibición del crecimiento micelial y esporulación de F. verticillioides y A. flavus, debido a la inactivación de enzimas celulares. Sobre lo mismo Guzman de Peña (1998), señalan que cuando la enzima decarboxilasa ornitina es inhibida, el micelio y la esporulación sexual y asexual se bloquean, lo cual induce estrés en la membrana celular y conduce a reacciones que suprimen las proteínas relacionadas con el crecimiento celular, el desarrollo de hifas y la germinación de esporas. Otros estudios indican que los compuestos fenólicos inhiben el crecimiento celular a través de la desestabilización de la homeostasis celular redox y/o el sistema antioxidación (Hernández-Ortega et al. 2011). De la misma manera, estudios realizados por Wilson et al. (1997), informaron que los compuestos derivados de aceites esenciales de las variedades de C. annum, C. chinense y C. frutescens presentan alta actividad antifúngica al inhibir un 99% la germinación de esporas de Botrytís cinerea. Así mismo Rodríguez et al. (2015), reportaron la eficacia de extractos fenólicos derivados de chile chiltepin sobre la inhibición de F. oxysporum y A. alternata, señalando que esta respuesta podría deberse a la formación de complejos con proteínas solubles y extracelulares, generando una disrupción de la pared celular de los hongos. Además de inhibir las rutas enzimáticas vitales, como, el sistema P450 dependiente de oxidasa, mediante el bloqueo de las enzimas hidrolasas esteroides (Treutter 2005).
Conclusiones
El extracto de chile habanero, presento mayor concentración de antioxidantes y actividad antifungica sobre el crecimiento micelial y la inhibición de la germinación de esporas de F. andíyazí y Cochliobollus spp. Mientras que el mayor contenido de fenoles se presentó en el extracto de chile jalapeño, pero con menor actividad antifungica. Estos resultados sugieren que algunos extractos de Capsicum spp. son una buena fuente de compuestos antioxidantes para la obtención de sustancias con acción antifúngica y posiblemente contra otras enfermedades microbianas. Los resultados muestran la posibilidad de usar extractos derivados de Capsicum spp. para el desarrollo de métodos ecológicos en el control de hongos fitopatógenos.











 nova página do texto(beta)
nova página do texto(beta)