Introducción
Las aves desempeñan un papel clave en la dinámica de los ecosistemas acuáticos, cumpliendo diversas funciones en su estructura trófica o incluso como agentes modificadores del ambiente al aportar materia orgánica y nutrientes a los cuerpos de agua (Comín et al. 2000). Particularmente, los humedales localizados en las zonas intermareales representan un importante espacio para muchas aves que los utilizan de forma permanente o estacional, como sitios de refugio, alimentación y anidación, siendo áreas de concentración para especies migratorias (Boere et al. 2006). A pesar de la importancia de estos ambientes, aún existen notables vacíos de información sobre los patrones que definen la riqueza y abundancia en muchos sistemas costeros en los trópicos y subtrópicos (Zogaris y Kallimanis 2016).
Las franjas costeras continentales constituyen ecotonos influenciados tanto por procesos marinos como terrestres, y están conformadas por una matriz de ambientes o hábitats que puede incluir estuarios, lagunas costeras, dunas, playas, pantanos, manglares y marismas (Lara-Lara et al. 2008). El hábitat, desde una perspectiva de manejo de la biodiversidad, comprende una unidad espacial con atributos físico-ambientales y biológicos específicos que determinan la presencia y abundancia de un grupo o taxón (Gallina-Tessaro 2011). Para el caso de las aves acuáticas, la heterogeneidad de hábitats de un ecosistema puede relacionarse con la disponibilidad temporal de alimento y con la complejidad física del humedal y de la vegetación dominante (Paracuellos y Tellería 2004, Zárate-Ovando et al. 2008).
Los humedales costeros del Pacífico Sur mexicano integran una extensa red de hábitats con potencial para el sostenimiento de una alta diversidad avifaunística que ha sido escasamente estudiada (Bojorges-Baños 2011). Particularmente, el estado de Chiapas cuenta con más de 80 000 ha de humedales costeros, incluyendo algunos sistemas lagunares-estuarinos como La Joya-Buenavista, Carretas-Pereyra y Chantuto-Panzacola, que sobresalen por sus extensas lagunas y manglares con elevado valor ecológico (De la Lanza-Espino et al. 2013). El sistema lagunar La Joya-Buenavista (LJB) destaca como un área ecológica importante al presentar las categorías de Humedal de Importancia Internacional (Ramsar No. 1823), Región Marina Prioritaria (No. 39), Región Hidrológica Prioritaria (No. 32) y Área Natural Protegida federal Santuario Playa Puerto Arista (CONANP 2012). No obstante, es también uno de los sistemas que enfrenta acelerada transformación de sus ecosistemas por azolvamiento y cambio de uso de suelo, eutrofización, contaminación y sobrepesca de cuerpos lagunares (Tovilla-Hernández 2004).
Los estudios sobre avifauna y las variables que definen sus atributos ecológicos han adquirido especial relevancia, al tratarse de un grupo con potencial bioindicador y con posibilidad de manejarse bajo un esquema de sustentabilidad mediante el aviturismo (Carrillo-García 2017). En los sistemas lagunares costeros de Chiapas, pocas investigaciones sobre avifauna se han orientado a determinar la riqueza de especies y la dinámica espacio-temporal de estos organismos. Algunas de estas corresponden a los humedales de la Reserva de la Biosfera La Encrucijada (Acuna et al. 1994, Becerril-Tinoco 2015), y a otros sistemas de la costa sur y norte del estado (Gerardo-Tercero et al. 2010, Mera-Ortiz et al. 2016). Debido a la escasa información sobre la avifauna del sistema LJB, es necesario contar con datos acerca de los cambios en la distribución de especies por tipo de hábitat, a fin de generar estrategias de manejo adecuadas. Por lo anterior el objetivo del estudio fue comparar los patrones de composición de la avifauna entre tres hábitats representativos del sistema LJB.
Materiales y métodos
Área de estudio
El sistema lagunar LJB se localiza en la costa del Pacífico Sur mexicano, en el municipio de Tonalá, Chiapas, entre los 15° 48’ y 15° 59’ LN y los 93° 32’ y 93° 47’ LO (Figura 1), posee una extensión de 47.5 km2. El sistema LJB se considera una laguna costera típica separada del mar por una barra arenosa, tipo III-A (Lankford 1977). Los principales aportes fluviales provienen de la subcuenca del río Zanatenco (Ovalle-Estrada y Vásquez-Lule 2009). El clima prevaleciente en la región es cálido-subhúmedo con precipitación anual de 1 441 mm y temperatura media de 28 °C. Se distinguen dos temporadas durante el ciclo anual: lluviosa (junio-octubre) y seca (noviembre-mayo) (Contreras-Espinosa y Zabalegui-Medina 1991).
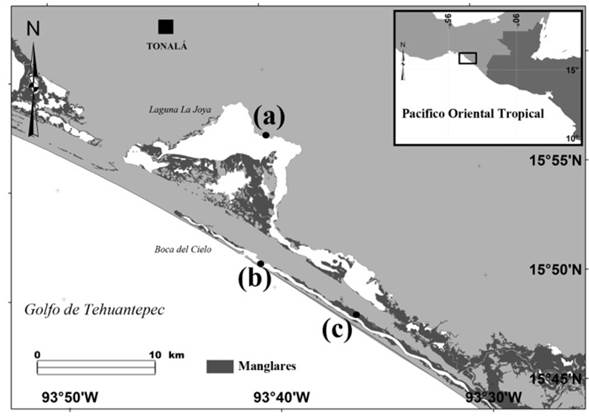
Figura 1 Área de estudio y localización de los transectos (•) dentro de los hábitats analizados en el sistema lagunar costero La Joya-Buenavista, Chiapas: (a): Laguna, (b): Bocabarra, (c): Canal.
El cuerpo lagunar del sistema LJB comprende tres humedales principales interconectados (Cabeza de Toro, La Joya y Buenavista). Es un sistema somero con profundidad media de 1.5 m, temporalmente polihalino y con sustrato predominantemente lodoso. Se encuentra rodeado por parches de manglar de cuenca (Avicennia germinans, Conocarpus erectus), vegetación de marismas y pastizales inducidos. El canal estuarino presenta una anchura aproximada de 300 m, longitud de 23 km y profundidad media mayor a 1.5 m. Tiene comunicación con la laguna por un canal de dragado de 2.4 km de longitud; en su parte media y alta presenta sustratos lodosos rodeado por manglares ribereños (Rhizophora mangle, Laguncularia racemosa). La bocabarra comprende la zona baja del canal (Boca del Cielo) y está conformada por una barra arenosa con vegetación de duna costera y especies arbustivas introducidas. Se comunica con el Golfo de Tehuantepec por una boca de 157 m de ancho, siendo la zona más expuesta al oleaje (Romero-Berny et al. 2018). El sistema se encuentra impactada por la expansión de áreas agropecuarias, urbanas y extracción selectiva de manglares (Ovalle-Estrada y Vásquez-Lule 2009).
Muestreo de campo
Se llevaron a cabo muestreos mensuales durante cuatro meses para dos temporadas: abril y mayo de la estación seca y, julio y agosto de la estación lluviosa de 2017. Se caracterizó la avifauna con relación al hábitat: Laguna, Canal y Bocabarra. Se empleó un muestreo basado en transectos de longitud variable (Villaseñor-Gómez y Santana 2003, González-García 2011) para cada hábitat: Laguna 800 m; Canal 900 m y Bocabarra 1000 m. Las diferencias de longitud tuvieron por objetivo abarcar una mayor variación de las condiciones ecológicas locales y estructura espacial (van der Heiden et al. 2018). Las observaciones de aves se realizaron en los mismos segmentos de transecto en cada visita entre las 07:00 y 12:00 horas. Se utilizó una embarcación con motor fuera de borda con velocidad de 5 km h-1 para recorrer los transectos sobre el Canal, para el caso de la Laguna la embarcación se utilizó solo durante el mes de agosto. Se consideraron a los individuos encontrados a una distancia de hasta 50 m a cada lado del transecto en actividades de anidación, percha, nado o alimentación (Ortiz-Pulido et al. 1995). Solo se tomaron en cuenta organismos en vuelo cuando estos fueron observados a una altura no mayor a 30 m sobre el área cubierta por el transecto (Zárate-Ovando et al. 2008). Para la observación se utilizaron binoculares Vanta (8x40) y la identificación se realizó in situ con las guías de Peterson y Chalif (1989), Van Perlo (2006) y Sibley (2015).
Categorización de la avifauna y análisis de datos
Por cada hábitat se determinó la composición, riqueza y abundancia relativa específica de la comunidad de aves. Para la integración del listado taxonómico se empleó el sistema de clasificación y nomenclatura propuesto por la Unión de Ornitólogos Americanos (AOU 2017); los nombres comunes y la categoría de residencia se basó en Escalante et al. (2014) y Berlanga-García et al. (2015). El grado de vulnerabilidad de cada especie se determinó con base en la NOM-059-SEMARNAT-2010 (SEMARNAT 2010), la lista roja de especies amenazadas (UICN 2017) y la Convención sobre el Comercio Internacional de Especies Amenazadas de Fauna y Flora Silvestres (CITES 2013). Para describir el patrón estructural de la comunidad avifaunística, se asignaron cinco categorías de abundancia relativa calculadas con la proporción de organismos por especie en cada muestreo (Pettingill 1984): raras (R, 1-9%), no comunes (NC, 10-30%), moderadamente comunes (MC, 31-64%), comunes (C, 65-89%) y abundantes (90-100%).
La riqueza esperada se calculó con el estimador no paramétrico Chao 2 (Chao 1989). Se utilizó una rarefacción [E(Sn)] para calcular el tamaño mínimo de muestra comparable por hábitat y temporada, a fin de compensar las diferencias entre las longitudes de los transectos (Colwell et al. 2012). Posteriormente, la prueba de hipótesis de no diferencia espacio-temporal en la abundancia se realizó con análisis de varianza no paramétrico (prueba de Kruskal-Wallis), al detectar heterocedasticidad en los datos. El grado de similitud de la avifauna entre eventos de muestreo (hábitat x mes) se determinó con el índice de Bray-Curtis sobre los datos de abundancia transformados a raíz cuadrada para estabilizar las varianzas por valores extremos. A partir de la matriz resultante se construyeron diagramas de clasificación (UPGMA) y ordenación (nMDS). La significancia de grupos en el dendrograma (a = 0.05) se realizó con perfiles de similitud (SIMPROF, a 1000 permutaciones y 999 simulaciones). La prueba SIM-PROF es una alternativa objetiva frente a los métodos tradicionales de evaluación de grupos en una clasificación, y prueba la hipótesis nula de que no hay estructura interna multivariante en la comunidad (Clarke et al. 2008). Las tendencias de los grupos formados en la ordenación se determinaron con análisis de similitud de una vía (ANOSIM) con 9999 permutaciones. Complementariamente, se realizó un análisis de porcentaje de similitud (SIMPER) para tipificar a la avifauna en función de su abundancia media y contribución porcentual para diferenciar las comunidades entre hábitats (Clarke 1993). Los análisis estadísticos se realizaron con los paquetes PAST 3.16 (Hammer et al. 2001) y PRIMER 6 (Clarke y Gorley 2006).
Resultados
En el sistema LJB se registraron 69 especies de aves, pertenecientes a 58 géneros, 31 familias y 16 órdenes, con un total de 1 701 registros visuales. Los ordenes mejor representado fueron los Charadriiformes con 17 especies (24.6%), y los Passeriformes y Pelecaniformes, cada uno con 14 especies (40.4% entre ambos). Las familias de aves con mayor número de especies fueron Ardeidae (10), Scolopacidae (9) y Laridae (5). El resto de las familias presentó entre una y cuatro especies. Las especies más importantes en abundancia fueron Pelecanus occidentalis con 216 registros (12.6% del total de aves observadas), Phalacrocorax brasilianus con 190 (11.1%) e Himantopus mexicanus con 146 (8.5%). Se reportan 15 especies con un solo registro visual durante el periodo de muestreo (Tabla 1). Con respecto a la categorías de abundancia relativa, se obtuvo que el 34.7% de las especies fueron no comunes, 23.1% abundantes, 20.1% moderadamente comunes y 20.2% comunes. De acuerdo con la categoría de residencia, 28% se consideran residentes, aunque en algunas regiones presentan algún comportamiento migratorio; 21% fueron residentes estrictas; 14% son migratorias de invierno; 7% migratorias de verano y 6% transitorias o en migración. Tomando en cuenta los cuatro meses del muestreo y el total de especies encontradas, siete se reportan bajo alguna categoría de riesgo nacional o internacional: Dendrocygna autumnalis (CITES: III), Mycteria americana (NOM-059: A, CITES: I), Tigrisoma mexicanum (NOM-059: A), Egretta rufescens (NOM-059: Pr, UICN: NT), Rostrhamus sociabilis (NOM-059: Pr, CITES: II), Buteogallus anthracinus (NOM-059: Pr, CITES: II) y Psittacara holochlorus (NOM-059: A).
Tabla 1 Distribución y abundancia de la avifauna en tres hábitats y dos temporadas en el sistema lagunar La Joya-Buenavista.
| Taxón | Nombre común | Categoría de riesgo | Hábitat | Estacionalidad | Abundancia relativa | Residencia | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| NOM-059 | UICN | CITES | Bocabarra | Canal | Laguna | Lluvias | Secas | ||||
| Anseriformes | |||||||||||
| Anatidae | |||||||||||
| Dendrocygna autumnalis | Pijije alas blancas | 0 | 2 | 6 | 8 | 0 | MC | R | |||
| Spatula clypeata | Pato cucharón norteño | 0 | 0 | 79 | 0 | 79 | NC | MI | |||
| Galliformes | |||||||||||
| Cracidae | |||||||||||
| Ortalis leucogastra | Chachalaca vientre blanco | 0 | 1 | 0 | 0 | 1 | NC | R | |||
| Columbiformes | |||||||||||
| Columbidae | |||||||||||
| Patagioenas flavirostris | Paloma morada | 0 | 1 | 0 | 0 | 1 | NC | R | |||
| Columbina inca | Tortolita cola larga | 23 | 5 | 4 | 3 | 29 | A | R | |||
| Columbina talpacoti | Tortolita canela | 0 | 3 | 0 | 3 | 0 | NC | R | |||
| Zenaida asiatica | Paloma alas blancas | 18 | 0 | 4 | 19 | 3 | A | R-M | |||
| Cuculiformes | |||||||||||
| Cuculidae | |||||||||||
| Crotophaga sulcirostris | Garrapatero pijuy | 5 | 0 | 0 | 4 | 1 | C | R | |||
| Caprimulgiformes | |||||||||||
| Caprimulgidae | |||||||||||
| Chordeiles acutipennis | Chotacabras menor | 8 | 0 | 0 | 5 | 3 | MC | R-M | |||
| Charadriiformes | |||||||||||
| Recurvirostridae | |||||||||||
| Himantopus mexicanus | Monjita americana | 0 | 0 | 146 | 7 | 139 | A | R | |||
| Recurvirostra americana | Avoceta americana | 0 | 0 | 5 | 5 | 0 | MC | R-M | |||
| Charadriidae | |||||||||||
| Pluvialis squatarola | Chorlo gris | 0 | 0 | 1 | 0 | 1 | NC | MI | |||
| Charadrius semipalmatus | Chorlo semipalmeado | 10 | 0 | 0 | 10 | 0 | NC | MI | |||
| Scolopacidae | |||||||||||
| Numenius phaeopus | Zarapito trinador | 23 | 0 | 1 | 0 | 1 | MC | MI | |||
| Arenaria interpres | Vuelvepiedras rojizo | 0 | 0 | 3 | 0 | 3 | NC | MI | |||
| Calidris pusilla | Playero semipalmeado | 8 | 0 | 88 | 16 | 80 | C | M-T | |||
| Calidris mauri | Playero occidental | 0 | 0 | 53 | 0 | 53 | NC | M-T | |||
| Actitis macularius | Playero alzacolita | 3 | 2 | 4 | 4 | 5 | C | MI | |||
| Tringa flavipes | Patamarilla menor | 4 | 0 | 2 | 4 | 2 | C | MI | |||
| Tringa semipalmata | Playero pihuiuí | 0 | 0 | 10 | 0 | 10 | MC | MI | |||
| Tringa melanoleuca | Patamarilla mayor | 0 | 0 | 1 | 0 | 1 | NC | MI | |||
| Phalaropus tricolor | Falaropo pico largo | 0 | 0 | 60 | 0 | 60 | MC | M-T | |||
| Laridae | |||||||||||
| Leucophaeus atricilla | Gaviota reidora | 56 | 1 | 30 | 4 | 83 | C | R-M | |||
| Larus argentatus | Gaviota plateada | 0 | 0 | 4 | 0 | 4 | MI | ||||
| Sterna hirundo | Charrán común | 0 | 0 | 1 | 0 | 1 | NC | M-T | |||
| Thalasseus maximus | Charrán real | 105 | 1 | 5 | 14 | 98 | C | R-M | |||
| Rynchops niger | Rayador americano | 2 | 0 | 0 | 2 | 0 | NC | R-M | |||
| Ciconiiformes | |||||||||||
| Ciconiidae | |||||||||||
| Mycteria americana | Cigüeña americana | A | I | 0 | 10 | 17 | 24 | 3 | C | R-M | |
| Suliformes | |||||||||||
| Fregatidae | |||||||||||
| Fregata magnificens | Fragata tijereta | 19 | 7 | 18 | 28 | 16 | A | R | |||
| Phalacrocoracidae | |||||||||||
| Phalacrocorax brasilianus | Cormorán neotropical | 0 | 54 | 136 | 115 | 75 | A | R | |||
| Anhingidae | |||||||||||
| Anhinga anhinga | Anhinga americana | 0 | 0 | 3 | 0 | 3 | NC | R | |||
| Pelecaniformes | |||||||||||
| Pelecanidae | |||||||||||
| Pelecanus erythrorhynchos | Pelícano blanco americano | 0 | 0 | 22 | 22 | 0 | MC | MI | |||
| Pelecanus occidentalis | Pelícano café | 17 | 0 | 199 | 133 | 83 | A | R-M | |||
| Ardeidae | |||||||||||
| Tigrisoma mexicanum | Garza tigre mexicana | A | 0 | 4 | 0 | 2 | 2 | C | R | ||
| Ardea herodias | Garza morena | 1 | 0 | 5 | 2 | 4 | C | R-M | |||
| Ardea alba | Garza blanca | 1 | 2 | 37 | 22 | 18 | A | R-M | |||
| Egretta thula | Garza dedos dorados | 2 | 0 | 14 | 7 | 9 | A | R-M | |||
| Egretta tricolor | Garza tricolor | 1 | 1 | 6 | 3 | 5 | C | R | |||
| Egretta rufescens | Garza rojiza | Pr | NT | 0 | 1 | 6 | 5 | 2 | A | R-M | |
| Bubulcus ibis | Garza ganadera | 0 | 2 | 0 | 2 | 0 | NC | R-M | |||
| Butorides virescens | Garcita verde | 0 | 13 | 12 | 15 | 10 | A | R-M | |||
| Nycticorax nycticorax | Garza nocturna corona negra | 0 | 1 | 5 | 5 | 1 | MC | R-M | |||
| Nyctanassa violacea | Garza nocturna corona clara | 0 | 0 | 1 | 0 | 1 | NC | R-M | |||
| Threskiornithidae | |||||||||||
| Eudocimus albus | Ibis blanco | 0 | 42 | 8 | 3 | 47 | A | R-M | |||
| Platalea ajaja | Espátula rosada | 0 | 0 | 21 | 12 | 9 | A | R-M | |||
| Cathartiformes | |||||||||||
| Cathartidae | |||||||||||
| Coragyps atratus | Zopilote común | 12 | 7 | 11 | 11 | 19 | C | R | |||
| Accipitriformes | |||||||||||
| Pandionidae | |||||||||||
| Pandion haliaetus | Águila pescadora | 5 | 0 | 0 | 2 | 3 | A | R-M | |||
| Accipitridae | |||||||||||
| Rostrhamus sociabilis | Gavilán caracolero | Pr | II | 0 | 1 | 0 | 0 | 1 | NC | R | |
| Buteogallus anthracinus | Aguililla negra menor | Pr | II | 0 | 8 | 2 | 4 | 6 | C | MV | |
| Coraciiformes | |||||||||||
| Alcedinidae | |||||||||||
| Megaceryle torquata | Martín pescador de collar | 0 | 3 | 0 | 0 | 3 | NC | R | |||
| Chloroceryle americana | Martín pescador verde | 0 | 3 | 1 | 1 | 3 | R | ||||
| Piciformes | |||||||||||
| Picidae | |||||||||||
| Melanerpes aurifrons | Carpintero cheje | 3 | 0 | 3 | 1 | 5 | C | R | |||
| Falconiformes | |||||||||||
| Falconidae | |||||||||||
| Caracara cheriway | Caracara quebrantahuesos | 1 | 1 | 0 | 1 | 1 | MC | R | |||
| Herpetotheres cachinnans | Halcón guaco | 0 | 2 | 0 | 1 | 0 | MC | R | |||
| Psittaciformes | |||||||||||
| Psittacidae | |||||||||||
| Psittacara holochlorus | Perico mexicano | A | 0 | 8 | 0 | 8 | 0 | MC | R | ||
| Passeriformes | |||||||||||
| Tyrannidae | |||||||||||
| Pitangus sulphuratus | Luis bienteveo | 2 | 7 | 4 | 5 | 8 | A | R | |||
| Tyrannus melancholicus | Tirano pirirí | 8 | 2 | 4 | 6 | 8 | A | R | |||
| Tyrannus forficatus | Tirano tijereta rosado | 0 | 0 | 4 | 0 | 4 | NC | MV | |||
| Corvidae | |||||||||||
| Calocitta formosa | Urraca cara blanca | 0 | 3 | 0 | 3 | 0 | MC | R | |||
| Passerellidae | |||||||||||
| Arremonops rufivirgatus | Rascador oliváceo | 0 | 1 | 0 | 0 | 1 | NC | R | |||
| Icteridae | |||||||||||
| Cassiculus melanicterus | Cacique mexicano | 0 | 1 | 0 | 1 | 0 | NC | R | |||
| Icterus cucullatus | Calandria dorso negro menor | 0 | 0 | 1 | 1 | 0 | NC | MV | |||
| Icterus pustulatus | Calandria dorso rayado | 0 | 0 | 1 | 1 | 0 | NC | R | |||
| Icterus gularis | Calandria dorso negro mayor | 0 | 0 | 1 | 1 | 0 | NC | R | |||
| Quiscalus mexicanus | Zanate mexicano | 57 | 3 | 44 | 43 | 61 | A | R | |||
| Parulidae | |||||||||||
| Setophaga petechia | Chipe amarillo | 0 | 2 | 3 | 2 | MC | MV | ||||
| Cardinalidae | |||||||||||
| Pheucticus melanocephalus | Picogordo tigrillo | 1 | 0 | 0 | 1 | 0 | NC | MV | |||
| Thraupidae | |||||||||||
| Sporophila torqueola | Semillerito collar | 0 | 0 | 1 | 1 | 0 | NC | R | |||
| Volatinia jacarina | Semillero brincador | 0 | 2 | 0 | 2 | 0 | NC | R | |||
Los números indican el número de registros visuales para cada especie. Categorías de riesgo, NOM-059: A (Amenazada), Pr (Protección especial). UICN: NT (Near Threatened). Categoría de abundancia relativa: (No Común) MC, (Moderadamente Común), NC, C (Común), A (Abundante). Categoría de residencia: R (Residente), R-M (Residente con comportamiento migratorio), MI (Migratoria de invierno), MV (Migratoria de verano), M-T (Migratoria transitoria).
La riqueza específica y abundancia relativa mostraron patrones diferentes en los tres hábitats muestreados. Para la Laguna se observaron 50 especies, seguida del Canal con 35 y Bocabarra con 26. La riqueza en la Laguna representó el 71.4% del total de especies esperadas (Chao 2), mientras que para el Canal y Bocabarra, se calculó un 63.6 y 72.2% de la riqueza esperada, respectivamente. Para la Bocabarra las especies más abundantes fueron Thalasseus maximus (105 registros) y Quiscalus mexicanus (57), en el Canal fueron Phalacrocorax brasilianus (54) y Eudocimus albus (48), mientras que para la Laguna fueron Pelecanus occidentalis (199) e Himantopus mexicanus (146). Mediante la prueba de Kruskal-Wallis se detectaron diferencias en los valores de abundancia rarefaccionada entre hábitats (E(S199), H = 14.07, p < 0.001). Para el caso de la temporalidad, en los meses de secas las especies más abundantes fueron Himantopus mexicanus (139) y Thalasseus maximus (98), mientras que en lluvias fueron P. brasilianus (136) y P. occidentalis (133). Pero no se detectaron diferencias de abundancia entre ambas estaciones (E(S620), H = 2.403, p = 0.1176).
De acuerdo con el test SIMPROF, en el dendrograma (UPGMA) se forman tres subgrupos con estructura estadísticamente significativa (π = 4.48, p = 0.001): primero, un subgrupo formado por las comunidades del Canal para los meses de abril, mayo y agosto; después el subgrupo de comunidades para los meses de mayo, julio y agosto en la Laguna; y finalmente el subgrupo formado por las comunidades de la Bocabarra para todo el muestreo (Figura 2). En el análisis de combinación, se encontró una estructura significativa en los grupos Canal (π = 4.6, p = 0.04) y Laguna-Bocabarra (π= 4.2; p = 0.02) para la totalidad de los meses de muestreo (abril-julio). La ordenación por nMDS reflejó una agrupación por tipo de hábitat similar a la ilustrada en el dendrograma, mostrando un valor de estrés relativamente bajo (0.11) (Figura 3). La variación en la composición entre los hábitats para la clasificación y la ordenación se comprobó con la prueba de ANOSIM, que mostró diferencias significativas globales (R = 0.806, p = 0.0002) y en comparaciones pareadas (R > 0.729, p = 0.029).
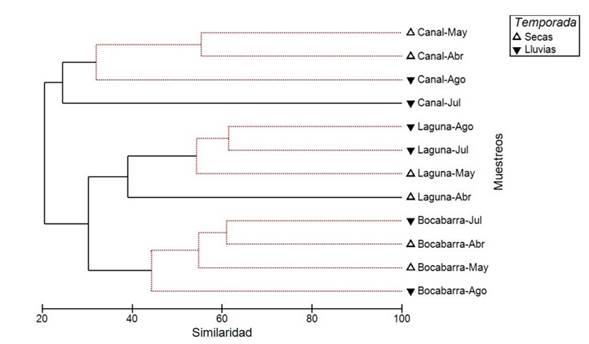
Figure 2 Dendrograma de clasificación de los muestreos de avifauna realizados por mes y hábitat en el sistema lagunar La Joya-Buenavista. Líneas punteadas indican grupos no separados significativamente (SIMPROF, p < 0.05).
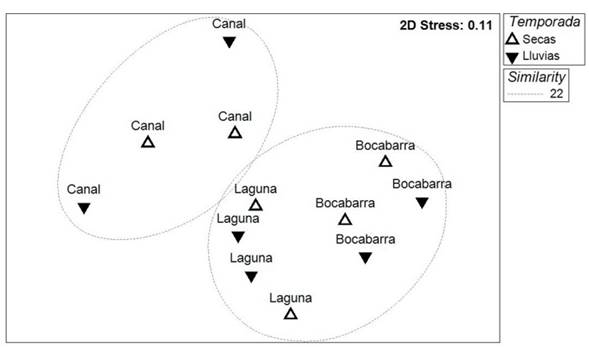
Figure 3 Ordenación nMDS de los eventos de muestreo en el sistema lagunar La Joya-Buenavista. Categorizaciones presentadas por hábitat y temporada. Las elipses punteadas indican los grupos formados a una similitud de 22%.
De acuerdo al análisis SIMPER, el rango de disimilitud de las comunidades entre hábitats varió de 32.2 a 50.6% (Tabla 2). Comparativamente, las mayores diferencias proporcionales para el grupo Bocabarra-Canal fueron por las especies T. maximus (5.3%), Q. mexicanus (4.9%) y Z. asiática (4.7%); mientras que para Bocabarra-Laguna y Canal-Laguna las diferencias recayeron en H. mexicanus (5.1,4.9%), P. brasilianus (4.4, 3.9%) y P. occidentalis (4.1,6.9%).
Tabla 2 Porcentaje de contribución de especies de aves dentro de cada hábitat. Las especies más representativas se seleccionaron de acuerdo al análisis SIMPER.
| Especies | Hábitat | |||||
|---|---|---|---|---|---|---|
| Bocabarra | Canal | Laguna | ||||
| Abundancia media | Contribución (%) | Abundancia media | Contribución (%) | Abundancia media | Contribución (%) | |
| Butorides virescens | - | - | 1.32 | 22.64 | 1.04 | 4.56 |
| Quiscalus mexicanus | 1.93 | 19.22 | - | - | 1.79 | 9.85 |
| Pandion haliaetus | - | - | 1.05 | 18.31 | - | - |
| Pelecanus occidentalis | 1.15 | 7.18 | - | - | 2.63 | 14.92 |
| Zenaida asiatica | 1.37 | 12.49 | - | - | - | - |
| Columbina inca | 1.42 | 12.38 | - | - | - | - |
| Fregata magnificens | 1.40 | 12.28 | 0.67 | 3.78 | 1.10 | 4.28 |
| Buteogallus anthracinus | - | - | 0.95 | 10.63 | - | - |
| Pitangus sulfuratus | - | - | 0.92 | 9.53 | 0.88 | 2.77 |
| Thalasseus maximus | 1.75 | 9.25 | - | - | - | - |
| Ardea alba | - | - | 0.50 | 3.18 | 1.64 | 8.86 |
| Himantopus mexicanus | - | - | - | - | 2.03 | 8.67 |
| Tigrisoma mexicanum | - | - | 0.80 | 8.01 | - | - |
| Platalea ajaja | - | - | - | - | 1.43 | 7.18 |
| Egretta thula | - | - | - | - | 1.31 | 7.05 |
Discusión
La riqueza de especies registrada corresponde al 9.9% del total de aves del estado de Chiapas (694 especies) (Escalante et al. 2014) y al 18.8% de la región Planicie Costera del Pacífico (366) (Rangel-Salazar et al. 2013). La riqueza de especies encontrada en el sistema LJB es relativamente alta (69 especies), considerando la amplitud del muestreo (cuatro meses) y la extensión del sistema (47.5 km2), con relación a otros sistemas en el Pacífico Sur mexicano: Chantuto-Panzacola y Carretas-Pereyra (48 especies, Acuna et al. 1994), Laguna Pampa-El Cabildo (39 especies, Gerardo-Tercero et al. 2010), Ventanilla-Manialtepec-Chacahua (67 especies, Bojorges-Baños 2011), Santa María del Mar (79 especies, Rioja-Paradela et al. 2014) y Mar Muerto (40 especies, Mera-Ortiz et al. 2016). La mayor abundancia de especies correspondió al componente avifaunístico acuático, asociado con la diversidad de ambientes intermareales como los manglares, playas y lagunas costeras. Con respecto a la categorización general de la abundancia, un mayor porcentaje de especies no comunes (> 30%) en el sistema, es coincidente con un patrón recurrente reportado para otras comunidades de aves en ambientes acuáticos (Rajashekara y Venkatesha 2010, Lwin et al. 2018). Se reporta un menor porcentaje de aves migratorias con respecto a las residentes, lo que puede deberse a que en el muestreo no se incluyó el periodo de mayor actividad migratoria (noviembre-enero). De igual manera, es probable que ocurran distribuciones diferenciales entre temporadas por parte de algunas especies residentes, cuyas abundancias fueron variables entre hábitats durante los meses de lluvias y estiaje (Leucophaeus atricilla, T. maximus, P. brasilianus), aunque esto no fue detectado en la comparación temporal. En el sistema lagunar Mar Muerto, contiguo a la LJB, Mera-Ortíz et al. (2016) encontraron cambios en la riqueza de aves en una escala temporal similar a la del presente trabajo, aunque estos no fueron determinantes para diferenciar a la avifauna entre los periodos de lluvias y secas. Esto puede deberse a las diferencias entre los hábitats que definieron los patrones de composición. Por lo tanto es recomendable extender el muestreo a un ciclo anual con esfuerzo mensual, y con repeticiones interanuales, para detectar cambios temporales y corroborar el efecto espacial en la estructura de la comunidad.
Los resultados sugieren que la variación espacial en la riqueza y abundancia de especies puede estar relacionada con los recursos que ofrece cada tipo de hábitat, como la disponibilidad de alimento o sitios de refugio, con efecto en la distribución y estructura de la comunidad (Jaquemet et al. 2004, Acevedo y Aide 2008). En humedales se ha encontrado que, a menor escala espacial, la distribución de aves migratorias y residentes, es influida por la estructura y fenología en la vegetación, así como por la disponibilidad de peces e invertebrados que representen un componente alimenticio en determinadas épocas para algunas especies (Jaquemet et al. 2004, Deppe y Rotenberry 2008). También se reporta que la extensión y profundidad de los cuerpos de agua son variables, lo que puede explicar más que el factor temporal en los patrones de riqueza y abundancia de aves asociadas a humedales (Pescador y Peris 2009). Para el caso de la costa de Chiapas, el promedio mensual de precipitación (EM-7386-San Isidro, Pijijiapan) para las estaciones seca (abril-mayo 2017, 81 ± 58 mm) y lluviosa (julio-agosto 2017, 183 ± 155 mm), muestra un patrón hidrometeorológico diferenciable que puede asociarse con variación en las características ambientales de cada hábitat.
La Laguna fue el hábitat en donde se registró el mayor número de individuos (1 094) pertenecientes a 50 especies. Para los hábitats costeros del Pacífico mexicano, los cuerpos lagunares son los que presentan mayor fuente de recursos para las aves, ya que proveen alimento y áreas para reproducción y descanso, lo que se refleja en su diversidad (Cupul-Magaña 2000, Zárate-Ovando et al. 2008). La mayor contribución en abundancia acumulada para la Laguna LJB, fue aportada para las especies P. occidentalis e H. mexicanus. La alta dominancia de P. occidentalis en este hábitat puede estar relacionado con las altas concentraciones de peces con hábitos marinos y residentes estuarinos, así como pequeños invertebrados, que ofrecen un recurso alimenticio para las poblaciones de aves presentes (Hernández-Vázquez et al. 2011). La elevada cantidad de nutrientes hace que el proceso productivo primario sea tan intenso en LJB, que este sistema se considere uno de los más productivos de México (Contreras-Espinosa y Zabalegui-Medina 1991). Por otro lado, H. mexicanus es una especie residente que suele ser abundante en zonas costeras de menor dinámica hídrica, protegidos de la influencia directa de mareas, como ocurre en algunas zonas del sistema LJB (Becerril-Tinoco 2015).
El Canal presentó durante el muestreo mayor variabilidad en su riqueza y abundancia específica, reflejada en los análisis de ordenación y clasificación. Se identificaron 35 especies con 209 registros. Dentro de los atributos del hábitat que pueden influir en la variabilidad se encuentra la compleja estructura vertical de sus manglares ribereños. Se sabe que la complejidad intrínseca de los manglares, independientemente del área que cubren en un sistema, es crucial para el sostenimiento de comunidades de aves altamente diversas en sistemas costeros (Mohd-Azlan et al. 2015), cumpliendo además una importante función como corredores para especies migratorias (Lefebvre y Poulin 1996). En este hábitat, la mayoría de las especies se encontraron en bajo número, destacando por mayor abundancia acumulada P. brasilianus y E. albus, especies reportadas como afines al manglar, ya que la estructura arbórea puede ofrecer sitios de percha, anidación (Hernández-Vázquez 2000) y áreas de forrajeo asociadas al sedimento acumulado en sus márgenes (Powell 1987). Así mismo fue un hábitat de importancia para algunas familias con registros notables en LJB, como Cracidae, Accipitridae, Alcedinidae, Falconidae y Psittacidae.
El hábitat Bocabarra se encuentra flanqueado por el océano y el canal estuarino, al ser un relieve plano, compuesto por una barra arenosa con vegetación típica de dunas costeras, es un sitio importante para aves marinas migratorias. En este habitat se tuvieron 398 registros, con el menor número de especies (26). Estudios similares en sistemas costeros han encontrado una menor diversidad avifaunística en zonas abiertas de playa, que en estuarios y manglares contiguos, debido a la menor heterogeneidad ambiental que reduce la disponibilidad de recursos (Zogaris y Kallimanis 2016). Las especies de mayor abundancia en este hábitat fueron T. maximus y L. atricilla, las cuales encuentran el hábitat adecuado para descanso y apareamiento (Barbieri y Paes 2008). Una característica del hábitat es su impacto por la actividad turística, desarrollo de infraestructura, fauna doméstica y vegetación introducida, lo que favorece la abundancia de Coragyps atratus, Q. mexicanus y Z. asiática, especies asociadas con ambientes perturbados.
Se determinaron los conjuntos de hábitats Canal y Bocabarra-Laguna en el sistema LJB con diferencias estructurales. El Canal contrasta por su cobertura de manglar y cuerpo acuático estrecho y relativamente profundo, el conjunto Bocabarra-Laguna ofrece espacios abiertos y áreas de forrajeo. Los patrones de similitud entre las comunidades mostraron el uso diferencial y las preferencias de algunas especies por determinado microhábitat (Cohen-Ballesteros et al. 2013). Son numerosos los factores que pueden influir en la distribución, densidad y uso de hábitat de las aves, incluyendo la estructura del paisaje y los eventos estocásticos (Zogaris y Kallimanis 2016). Por lo tanto es necesario realizar una evaluación a escalas espacio-temporales para una mejor interpretación de los atributos de la comunidad avifaunistica. Así mismo, las estimaciones teóricas para los tres hábitats evaluados reflejan que la riqueza de especies podría ser mayor a la observada. A pesar de las limitantes, se representa una aproximación a los patrones espaciales de la avifauna en un sistema costero poco evaluado, lo que demuestra el potencial de las aves como grupo indicador para monitoreos con enfoque de hábitat. Destaca la importancia de dos hábitats para las aves: la Laguna y el Canal. Aparentemente el primero representa un espacio crítico por el alto número de especies y mayor abundancia, incluyendo a aquellas con mayor afinidad por las planicies lodosas como sitios de alimentación. El Canal, aun con su menor abundancia, es un hábitat de importancia para especies con alguna categoría de riesgo como Mycteria americana, Buteogallus anthracinus y Psittacara holochlorus. Aun cuando los resultados mostraron un efecto significativo del hábitat en la avifauna, se sugiere implementar un manejo que permita mantener la conectividad entre el conjunto de hábitats. Al respecto Audsen et al. (2001) demostraron que para muchas especies, un hábitat óptimo es el mosaico integrado por diversos ambientes inundables, no inundables, lagos y áreas de vegetación. Es recomendable tomar en cuenta estas consideraciones ecológicas para proponer un adecuado manejo del sistema y sus áreas de conservación.
Conclusiones
En el sistema lagunar costero LJB se registraron 69 especies de aves, con mayor porcentaje de representación en los órdenes Charadriiformes, Passeriformes y Pelecaniformes. Siete especies se reportan bajo alguna categoría de riesgo nacional o internacional. El mayor porcentaje de especies correspondió a las no comunes (34.7%), seguido de las especies abundantes (23.1%), moderadamente comunes y comunes (20.2%). La riqueza específica y la abundancia relativa mostraron patrones diferentes entre los tres hábitats evaluados. La riqueza estimada sugiere que el número de especies podría ser mayor en los tres hábitats. Los análisis de ordenación y clasificación permitieron corroborar el patrón de diferencias espaciales, aunque no se encontró un gradiente temporal. Es recomendable extender el muestreo de la avifauna hacia una escala espacial más fina y una temporal más prolongada, relacionando los atributos de la comunidad con variables bióticas y abióticas que permitan comprender la dinámica de conectividad entre hábitats e incorporar estas consideraciones ecológicas en el manejo del sistema.











 text new page (beta)
text new page (beta)



