Introducción
La infestación por el ácaro Varroa destructor ocasiona la varroosis en abejas melíferas (Apis mellifera L.) (Anderson y Trueman 2000), la cual está distribuida en la mayoría de los países del mundo (Nazzi y Le Conte 2016). En México, la varroosis fue reportada por primera vez en 1992 en colonias de abejas del estado de Veracruz (Chihu et al. 1992); desde entonces, se ha dispersado a todas las entidades de la república mexicana (Guzman-Novoa et al. 2012). El acaro V. destructor es un parásito externo que se alimenta de la hemolinfa y tejido graso de las abejas adultas y de sus crías, reproduciéndose en estas últimas, lo que afecta severamente la salud de las abejas (Boecking y Genersch 2008). Este acaro es la mayor amenaza sanitaria de las abejas melíferas y una de las razones principales de la muerte y despoblamiento de colonias en el mundo, ocasionando pérdidas económicas mayores que las causadas por el resto de las enfermedades apícolas conocidas (Boecking y Genersch 2008, Guzmán-Novoa et al. 2010, Nazzi y Le Conte 2016). Se ha detectado a V. destructor en el 98% de las colonias afectadas por el síndrome del colapso de la colonia (SCC) y es un factor significativo correlacionado con este problema (Guzman-Novoa 2016). En México, anualmente se pierde más del 33% de las colonias de abejas de las regiones del altiplano y norte del país, atribuidas en gran medida a parasitosis causadas por V. destructor (Medina-Flores et al. 2018). Las infestaciones por V. destructor inhiben el sistema inmune de las abejas haciéndolas más propensas a otros patógenos y factores estresantes como los insecticidas (Koleoglu et al. 2017, 2018; Tarek et al. 2018). Además, hay evidencias de que V. destructor trasmite varios virus a las abejas, entre los que se encuentran el virus de las alas deformes, de la parálisis crónica y de la parálisis aguda israelí (Santillán-Galicia et al. 2010, Guzman-Novoa et al. 2012). A pesar de que las abejas africanizadas son relativamente más resistentes a la parasitosis por V. destructor que abejas de razas europeas (Guzman-Novoa et al. 2011), en México, se ha demostrado que infestaciones medianas y altas de V. destructor, disminuyen la producción de miel de colonias de abejas africanizadas (Arechavaleta-Velasco y Guzman-Novoa 2000, Medina-Flores et al. 2011).
Los daños causados por V. destructor a las abejas son difíciles de atenuar, debido a que la resistencia del parásito a los acaricidas usados para controlarlo se ha incrementado y aunque se hacen rotaciones en el uso de estos productos, cada vez se requiere una mayor cantidad de ellos para controlar al ácaro (Mitton et al. 2018). Además, algunos estudios han encontrado que factores climáticos como la temperatura y la humedad, influyen en la infestación de V. destructor, y en la mortalidad que la parasitosis causa a las abejas (Meixner et al. 2015, Hou et al. 2016). Sin embargo, en la actualidad se conoce poco sobre la situación de la varroosis y las relaciones que puede tener con variables geográficas y climáticas en apiarios de México. Por ello, el objetivo del presente estudio fue determinar la prevalencia de V. destructor, el porcentaje de infestación del ácaro y la relación del parásito con variables geográficas y climáticas en colonias de abejas melíferas de municipios de la región sur-sureste del estado de Jalisco, México.
Materiales y Métodos
El presente estudio se realizó en nueve municipios ubicados en dos zonas climáticas consideradas como templada subhúmedo y cálida subhúmedo, ubicados en el occidente de México (19° 24’, 21° 14’ LN; 101° 59’, 104° 5’ LO) e incluyen a Zapotlán el Grande, Gómez Farías y Tapalpa, con clima templado subhúmedo y los municipios de Tecalitlán, Tamazula, Unión de Guadalupe, Zacoalco de Torres, Sayula, y Cocula, con clima cálido subhúmedo (Gobierno del Estado de Jalisco 2012, INEGI 2013). Los municipios con clima cálido subhúmedo tienen una temperatura media anual de 21 °C sin cambio térmico invernal bien definido (INEGI 2015). El régimen de lluvias se registra de junio a septiembre, con una precipitación promedio de 801 mm y una altitud promedio de 1 495 msnm (INEGI 2013). Los municipios con clima templado subhúmedo presentan un cambio térmico invernal bien definido, temperatura media anual de 14.4 °C y precipitación media anual de 1 117 mm; la altitud promedio es de 1 711 msnm (INEGI 2015). En las dos zonas geográficas se tomaron al azar entre marzo y mayo del 2016, muestras de 369 colonias de abejas melíferas ubicadas en 143 apiarios. El tamaño de la muestra se calculó para aproximadamente un 5% de las colmenas existentes en los municipios evaluados; de las que se realizó un muestreo aleatorio estratificado (Tabla 1). Se utilizó un método cuantitativo para detectar la presencia de V. destructor en abejas adultas de cada colonia, así como su grado de infestación. De cada colmena a evaluar se colectaron aproximadamente 300 abejas tomadas de un panal del nido de cría, las que se depositaron en un envase de plástico de boca ancha (500 mL), el cuál contenía 200 mL de etanol al 70%. Las muestras se evaluaron posteriormente en el laboratorio de microbiología del Centro Universitario del Sur de la Universidad de Guadalajara de acuerdo con la metodología de De Jong et al. (1982). Cada envase se agitó durante 1 min con el fin de que los ácaros se desprendieran de las abejas. Posteriormente, se vació el contenido del envase con las abejas en una coladera que permitió el paso de los ácaros a través de una malla cribada (cuando la muestra era positiva), para ser recolectados en una tela blanca. Los ácaros y las abejas se contaron y se determinó el promedio de infestación de cada muestra positiva. Posteriormente se dividió el número de ácaros obtenidos entre el número de abejas por muestra y después se multiplicó el resultado por 100. En cada apiario muestreado se registró la altitud sobre el nivel del mar (msnm), con un GPS (Sportrack-color, Magellan). Además de los datos de temperatura ambiental (°C) y precipitación pluvial (mm) obtenidos de la Comisión Nacional del Agua (CONAGUA 2015). En los análisis estadísticos, las variables de respuesta fueron el número de colonias infestadas y el porcentaje de infestación con el ácaro V destructor en abejas adultas entre diferentes municipios y zonas, para determinar prevalencia y grados de infestación del ácaro, respectivamente. Los predictores (variables explicativas) incluidos en los análisis fueron, temperatura ambiental, precipitación pluvial y altura sobre el nivel del mar (msnm). Los análisis estadísticos se efectuaron con las siguientes técnicas: la prevalencia de varroosis (porcentaje de colonias infestadas) entre zonas y entre municipios se analizó mediante comparaciones múltiples por pares, cuyas probabilidades fueron ajustadas con el método de Benjamini y Hochberg. Para analizar el grado promedio de infestación de las colonias, la suposición de normalidad se verificó con la prueba de Shapiro-Wilk y el supuesto de homogeneidad se comprobó con la prueba de Bartlett, siendo ambas suposiciones no satisfactorias. Por ello, los municipios y zonas se compararon con respecto al nivel de infestación de las colonias con V. destructor, mediante las pruebas no paramétricas de Kruskal-Wallis y Mann-Whitney U, respectivamente, ya que los datos no pudieron normalizarse. Las medias se separaron mediante comparaciones múltiples por pares con la prueba de Dunn, ya que el número de observaciones por municipio eran desiguales. Además, con el objeto de evaluar la asociación entre las variables climáticas (temperatura y precipitación pluvial) y la variable geográfica (msnm) con la prevalencia y grado de infestación de varroosis de las colonias, se realizaron análisis de correlación de Kendall. Para los análisis estadísticos se empleó la versión R 3.3.1 con un nivel de significancia de p < 0.05.
Tabla 1 Número de apiarios, colonias muestreadas y prevalencia de Varroa destructor por municipio y zona climática, en el sur de Jalisco.
| Municipio | Apiarios | Colonias | Zona climática | Colonias positivas | Prevalencia (%) |
|---|---|---|---|---|---|
| Zapotlán el Grande | 10 | 24 | Templada | 21 | 87.50 b |
| Gómez Farías | 6 | 15 | Templada | 9 | 60.00 c |
| Tapalpa | 12 | 30 | Templada | 28 | 93.33 a,b |
| Cocula | 16 | 41 | Cálida | 22 | 53.66 c |
| Tamazula | 36 | 93 | Cálida | 93 | 100.00 a |
| Sayula | 20 | 53 | Cálida | 50 | 94.34 a,b |
| Unión de Gpe. | 8 | 20 | Cálida | 20 | 100.00 a |
| Tecalitlán | 21 | 54 | Cálida | 47 | 87.04 b |
| Zacoalco de Torres | 14 | 39 | Cálida | 34 | 87.18 b |
| Total | 143 | 369 | 324 | 87.80 |
Literales diferentes en la prevalencia, significan diferencias significativas basadas en comparaciones múltiples por pares con probabilidades ajustadas mediante el método de Benjamini y Hochberg (p < 0.05).
Resultados
La prevalencia de varroosis en las colonias de abejas de los nueve municipios incluidos se muestra en la Tabla 1. De 369 muestras evaluadas, V. destructor se detectó en 324 (87.8%), con rango de 54 a 100%, encontrándose diferencias significativas en la prevalencia de la parasitosis entre municipios (p < 0.05). El 88.7% de las colonias de la zona cálida subhúmeda estaban parasitadas con V. destructor, mientras que en la templada subhúmeda, el 84.1% tuvieron la presencia del acaro. Pero no se encontró diferencia significativa en la prevalencia de la varroosis entre colonias de ambas zonas (χ2 = 0.724, gl = 1, p = 0.394). El nivel de infestación con V. destructor de las colonias de los diferentes municipios se muestra en la Figura 1, con diferencias significativas para esta variable entre municipios (Kruskal-Wallis χ = 50.96, gl = 8, p < 0.01). Los municipios con los porcentajes de infestación de V. destructor por colonia más altos fueron Tecalitlán y Unión de Guadalupe, con 7.4 ± 0.13 y 8.3 ± 0.39%, respectivamente; mientras que los que tuvieron los niveles más bajos, fueron Gómez Farías y Cocula con 2.4 ± 0.23 y 2.4 ± 0.09 %, respectivamente. La infestación media de las colonias con V. destructor fue de 5.2 ± 0.14 en general y, de 5.5 ± 0.12 y 4.2 ± 0.16% para las zonas cálida y templada, respectivamente, con diferencias no significativas (W = 119, gl = 368, p > 0.05). La distribución del nivel de infestación con V. destructor entre las colonias de cada municipio se muestra en la Figura 2, donde se observa que el porcentaje de infestación del ácaro entre colonias de cada municipio fue variable, en particular en los municipios de la zona cálida subhúmeda. Cabe señalar que salvo para los municipios de Tamazula y Unión de Guadalupe, donde todas las colonias estaban infestadas, el nivel mínimo de infestación con el ácaro en los demás municipios fue 0%, mientras que el máximo fue de más del 10%, con colonias que llegaron a tener más del 35% de infestación (Unión de Guadalupe). Pero más del 50% de las colonias de siete de los nueve municipios, tienen niveles de infestación menores del 5%. Solo en Tecalitlán y Unión de Guadalupe, la mayoría de las colonias tienen niveles de infestación con V. destructor de más del 5%. No se encontraron correlaciones significativas entre las variables climáticas (temperatura y precipitación pluvial) y la variable geográfica (msnm) con la prevalencia y grado de infestación de varroosis de las colonias (p > 0.05).
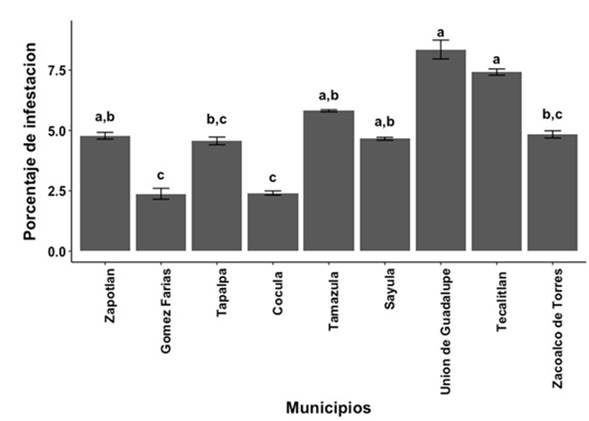
Figura 1 Medias ± errores estándar para el porcentaje de infestación de abejas melíferas adultas de colonias parasitadas con el ácaro Varroa destructor en nueve municipios del sur del estado de Jalisco, México. Literales diferentes sobre las barras, representan diferencias significativas basadas en pruebas de Kruskal-Wallis y de Dunn (p < 0.05).
Discusión
Este es el primer trabajo que se realiza en el occidente de México para determinar la prevalencia y niveles de infestación del ácaro V. destructor en colonias de abejas de municipios ubicados en regiones climáticas diferentes. El 88% de las colonias están parasitadas con el ácaro, alta prevalencia que concuerda con el 79% de prevalencia reportado y los niveles de infestación promedio de V. destructor por colonia para las zonas cálida y templada, fueron similares a lo reportado para zonas climáticas semicálida y templada (Medina-Flores et al. 2014b). Tanto la prevalencia como el nivel de infestación de V. destructor encontrado en este estudio y el de Medina-Flores et al. (2014b) fueron mayores que lo reportado para estos parámetros en estudios realizados en Yucatán, México; que reportan la prevalencia de colonias manejadas de 63 a 68%, con niveles de infestación mayores al 5% (Medina 1998, Martínez-Puc et al. 2011). Estas diferencias en prevalencia e infestación de V. destructor en las abejas entre Yucatán y regiones del altiplano mexicano, podrían explicarse por efectos climáticos y genotípicos. Climas más cálidos y secos, así como mayor grado de africanización de las abejas, como ocurre en Yucatán, restringen la dispersión y reproducción del ácaro (Medina y Martin 1999, Mondragon et al. 2005, Medina-Flores et al. 2014a). Aunque se encontraron diferencias entre municipios para prevalencia y niveles de infestación del ácaro, no se detectaron diferencias para estos parámetros entre las dos zonas climáticas evaluadas, ni correlaciones significativas entre variables climáticas y geográficas con la prevalencia y grado de parasitismo de la varroosis. Estos resultados son similares a los reportados por Anguiano-Baez et al. (2016), quienes no encontraron prevalencia significativa en el nivel de infestación por V. destructor en colonias de clima templado (altiplano mexicano) en comparación con colonias de clima tropical (costa de Nayarit) en México, pero se difiere de los resultados reportados por Meixner et al. (2015), quienes afirman que la infestación de las colonias de abejas con el ácaro está fuertemente influenciada por el clima. En relación al clima, se sabe que las diferencias entre estudios pueden deberse a múltiples variables como el manejo de las colonias, métodos de control de la varroosis, época del año en que se muestrea y genotipo de las abejas (Medina 1998, Harris et al. 2003, Giacobino et al. 2017). Además, se encontró alta variación en la prevalencia y niveles de infestación del ácaro dentro y entre municipios de ambas zonas, lo que probablemente no permitió detectar significancia con las variables climáticas y de altitud. La Secretaría de Agricultura, Ganadería, Desarrollo Rural y Pesca (SAGARPA) indica que el objetivo de la Campaña de Diagnóstico, Prevención y Control de la Varroosis es mantener el nivel de infestación del ácaro V. destructor en las colonias de abejas por debajo del 5%, para atenuar sus daños (SARH 1994). En relación a esta recomendación en la presente investigación el nivel de infestación con V. destructor encontrado en colonias de abejas de Jalisco fue de 5.2%, porcentaje similar al que la SAGARPA recomienda como nivel de tolerancia en México. Si se toma en cuenta solo el promedio de infestación encontrado para toda la región sur/sureste de Jalisco, puede concluirse que los apicultores de esta región de México, tienen relativamente controlado al ácaro V. destructor, en las colonias manejadas. Pero si se analiza la alta variación en niveles de infestación del ácaro en las colonias dentro y entre los municipios (Figura 2), esa conclusión no es válida para aproximadamente el 39% de las colonias, particularmente para los municipios de Tecalitlán y Unión de Guadalupe, donde más del 50% de las colonias tiene niveles de infestación mayores al 5%. Esta alta variación de infestación del ácaro entre municipios y apiarios, también fue observada en un estudio realizado en el este del estado de México, el que detectó un grado de parasitosis entre 0.5 y 22% (Martínez-Cesareo et al. 2016). El hecho de que un alto porcentaje de colonias tenga niveles de infestación mayores al 5%, aunado a que más del 87% de ellas estén parasitadas, es preocupante y amerita investigaciones sobre sus causas, así como programas para aminorar el impacto negativo de V. destructor en la salud y productividad de las colonias de abejas melíferas del estado de Jalisco.
Conclusiones
Se tiene una elevada prevalencia de la parasitosis en colonias de abejas del sur/sureste del estado de Jalisco, con alta presencia en algunos municipios. El nivel promedio de infestación fue similar al recomendado por la SAGARPA como tolerable en México, pero más de la tercera parte de las colonias rebasaron estos niveles. Ni los factores climáticos analizados o la altura sobre el nivel del mar tuvieron asociación con la prevalencia y niveles de parasitismo, lo que puede deberse a la alta variación de los datos, y sugiere que otros factores influyen en mayor medida la prevalencia y grado de infestación de las colonias de abejas dentro de cada región geográfica. Debido a la alta prevalencia de V. destructor y al porcentaje mayor del 5%, deben considerarse estudios posteriores para determinar las causas. Se recomienda que los productores monitoreen de forma periódica los niveles de infestación en sus colonias, para dar tratamientos oportunos que controlen la parasitosis y los daños que esta causa.











 nueva página del texto (beta)
nueva página del texto (beta)




