Introducción
El río Lerma forma parte de la cuenca Lerma-Santiago-Pacífico. Debido a que los manantiales que le daban origen en la laguna de Almoloya, han desaparecido, actualmente solo recibe agua en la época de lluvias. El río tiene su origen en un canal formado por una serie de ciénegas del sistema lacustre de la laguna de Almoloya a 2 588 msnm y desemboca en el lago de Chapala, en el Estado de Jalisco a 1 530 msnm (Cotler-Avalos et al. 2006). Sus aguas tienen uso doméstico, agrícola, pecuario, industrial y para la generación de energía eléctrica (Zarazúa et al. 2013). En su curso, recibe aguas de corrientes tributarias de los ríos: Laja, Guanajuato, Turbio, Tigre y Duero; y en su cauce se encuentran las presas Antonio Alzate, Tepuxtepec y Solís, que se utilizan para riego agrícola y generación de energía eléctrica (Cotler-Avalos et al. 2006).
Con base en el índice de calidad del agua (ICA), el rio Lerma presenta las siguientes condiciones de calidad: altamente contaminado, poco contaminado y aceptable, por lo que se recomienda su uso para la agricultura (López-Hernández et al. 2007). Al respecto Zamora et al. (2008) y Belaid et al. (2012) indican que las aguas residuales vertidas al río contienen nitrógeno y fósforo, por lo que sus aguas pueden influir de forma positiva en el rendimiento de los cultivos. Pero también representan un foco de infección para la salud humana (Cifuentes et al. 2000), y la toxicidad del ambiente (Robledo-Zacarías et al. 2017).
La alta concentración de nitrato y fosfato puede atribuirse a la aplicación excesiva de fertilizantes (Chávez-Alcántar et al. 2011), lo que provoca lixiviados y contaminación del agua subterránea, además de inducir eutrofización de los cuerpos de agua (Figueruelo-Alejano y Marino-Dávila 2004). Sobre lo mismo Ayers y Westcot (1987) indican que los problemas de calidad del agua están relacionados con su uso, desde la perspectiva agronómica, la concentración iónica de la solución afecta los cultivos debido al tipo de iones presentes (Sánchez-Bernal et al. 2008, Can-Chulim et al. 2014).
En la cuenca del río Lerma los principales cultivos son el sorgo, cebada, maíz, frijol, trigo, alfalfa, espárrago y brócoli (CONAGUA 2015), por lo que la irrigación con sus aguas puede afectar la germinación y el desarrollo (Can-Chulim et al. 2017). Debido a que el agua del río es bicarbonatada-sódica y bicarbonatada mixta con riesgo medio de salinidad (Pérez- Díaz et al. 2015), lo que puede ocasionar efectos negativos de salinidad en los cultivos y sodicidad en los suelos arcillosos (López-García et al. 2016). Los problemas de toxicidad por iones específicos se presentan en los cultivos con iones de B3+, Cl- y Na+, que son absorbidos y acumulados en los tejidos de las plantas en concentraciones que provocan daño y reducen el rendimiento (Ayers y Westcot 1987), aunque la toxicidad depende de la tolerancia del cultivo (Sánchez-Bernal etal. 2013, Can-Chulim etal. 2017).
En lo referente al boro, la toxicidad se presenta en concentraciones entre 1 y 2 mg L-1 en el agua de riego (Mancilla-Villa et al. 2014, Maas 1990), por medio de manchas amarillas en el borde y ápice de las hojas. Por otro lado, cuando el agua contiene concentraciones de Cl- mayores de 4 meq L-1, se tienen restricciones de uso, ya que puede acumularse en las hojas y producir clorosis afectando la fotosíntesis (Ayers y Westcot 1987). Por lo anterior, el objetivo fue determinar la concentración de nitrato, fosfato, boro y cloruro en el agua del río Lerma, y estimar el riesgo de toxicidad por iones específicos (B3+ y Cl-) que pueden afectar el desarrollo de los cultivos.
Materiales y métodos
Muestreo, análisis de agua y análisis estadístico
Se colectaron y analizaron muestras de agua de 39 estaciones de muestreo distribuidas en el cauce del río Lerma (Figura 1). Las muestras se colectaron en abril de 2015 de acuerdo con la metodología de muestreo propuesta por la SECOFI (1980), teniendo en cuenta la accesibilidad a los sitios. La concentración de NO3-, PO4 3- y B3+ se determinó por espectrofotometría (JENWAY® 7305 Spectrophotometer), con longitudes de onda de 410, 880 y 420 nm, respectivamente. El Cl- se determinó por titulación volumétrica (Richards et al. 1982) con nitrato de plata (0.01 N); el NO3- por el método de nitración del ácido salicílico (Robarge et al. 1983), el PO4 3- mediante el método de ácido ascórbico (Eaton et al. 1998), y el B3+ por el método de la H-Azometina (Rodier 1978). Se utilizaron soluciones estándar de concentración conocida preparadas en el laboratorio para establecer las rectas de calibración con valor en la ordenada al origen de cero. La ecuación de regresión utilizada para estimar la concentración de nitrato (NO3-) fue NO3- = (205.69 xA) con R2 = 0.98. Para determinar la concentración de 0 a 3 mg L-1 de fosfato (PO4 3-) se utilizó la ecuación PO;|- = (4.9147x A) con R2 = 0.99, para la concentración de 3 a 15 mg L-1 de fosfato (PO4 3-) la ecuación fue PO4 3-- = (13.17 x A) - 5.286 con R2 = 0.99, y la ecuación para estimar la concentración de boro (B3+) fue B3+ = (6.744 xA) con R2 = 0.99.
El enfoque de la investigación fue de tipo cuantitativo con alcance descriptivo, la superficie irrigada con el agua del río Lerma se destina al cultivo de sorgo, cebada, maíz, frijol, trigo, alfalfa, espárrago y brócoli, por lo que la concentración iónica del agua puede afectar los cultivos (Maas 1990). Se determinaron los valores: mínimos, máximos, promedios, medianas, desviaciones estándar, amplitud, coeficientes de variación (CV), cuartiles y valores extremos (Montgomery y Runger 2015). Los análisis se realizaron con el software SAS® versión 9.0 y las gráficas con el programa SigmaPlot® versión 10.0.
Resultados y discusión
La cuenca del río Lerma recibe aguas residuales provenientes del uso doméstico, industrial y agrícola, por lo que contiene concentraciones de nitrógeno, fosforo, potasio, cobre, hierro y zinc. Al respecto, Duncan y Cairncross (1990) indican que estas aguas sirven para el uso agrícola, debido a que pueden reducir la necesidad de fertilizantes. Aunque la alta concentración de nitrato (Figura 2) y fosfato (Figura 3) es un indicador del estado de eutrofización del agua del río Lerma, los valores de 0.768 mg L-1 de P (2.35 mg L-1 de PO4 3-) indican estado hipereutrófico. Al respecto, Moreno-Franco et al. (2010) y Zarazúa et al. (2013) reportan que concentraciones entre 0.384 mg L-1 (1.177 mg L-1 de PO4 3-) y 0.096 mg L-1 de P (0.294 mg L-1 de PO4 3-) lo que indican condiciones eutróficas, por lo que valores mayores de 2.35 mg L-1 de PO4 3- del 69% de las estaciones de muestreo, indican condición hipereutrófica en la mayor parte del curso alto del río Lerma de Almoloya a la presa Tepuxtepec. Mientras que el estado hipereutrófico se detectó desde Salamanca hasta La Calle y de la vía Rivera a la Barca-Ibarra; en tanto que el 31% de las estaciones de muestreo en el curso medio y bajo tuvieron condiciones eutróficas, por lo que el agua del río Lerma puede considerarse en mayor proporción hipereutrófico y en menor grado eutrófico. Al respecto Velázquez-Machuca et al. (2010) reportan que el río Duero, cuerpo receptor de agua residual y drenaje agrícola, tiene agua mixta-bicarbonatada y bicarbonatada-sódica clasificada como eutrófica. Además de la adición de boro por el vertido de aguas residuales (Velázquez et al. 2011). Lo cual puede influir en la concentración y composición iónica, debido a que el río Duero es un afluente del río Lerma. Al respecto Chavez-Alcantar et al. (2011) concluyen que los drenajes agrícolas y las aguas residuales son la principal fuente de contaminantes en la zona de la ciénega del Chapala. Debido a que las aguas residuales transportadas por el río Lerma desembocan en el Lago de Chapala, lo que influye en la concentración de contaminantes encontrados en este cuerpo de agua. En la zona del alto relieve (Toluca-Temascalcingo) son escasas las corrientes tributarias del río Lerma, por lo que la alta concentración a su paso por las principales ciudades, se debe al vertido de agua residual; en el curso medio (Acámbaro-Salvatierra-Jaral del Progreso), con tendencia a disminuir la concentración de nitrato. Pero en la vía Salamanca-Pueblo Nuevo- Labor de Peralta se incrementó, en el curso bajo del río Lerma (Pastor Ortiz-La Piedad-La Barca) la ten dencia fue a disminuir la concentración de nitrato. La aplicación excesiva y pérdida de fertilizantes nitrogenados puede contribuir en la concentración de nitrato en los cuerpos de agua (Velázquez-Machuca et al. 2010).
En el curso medio y bajo del río Lerma, el agua se diluye por el aporte de diversas corrientes tributarias con baja concentración iónica, lo que contribuye con la depuración del río, con variación de 9.87 a 39.70 mg L-1 para la concentración de nitrato, y de 1.73 a 5.26 mg L-1 para el fosfato, en el 50% de las estaciones de muestreo del río Lerma. Lo que puede deberse a que el río Lerma se encuentra en una zona de alta actividad agrícola e industrial, de bido a la descarga de aguas residuales y al gradiente altitudinal de 2 588 a 1 530 msnm, lo que favorece su evacuación por medio de la corriente principal de la cuenca.
La principal fuente de fósforo en el agua residual puede deberse a los detergentes provenientes de actividades antrópicas que forman las aguas residuales domésticas e industriales, ya que algunos detergentes contienen fosfato de sodio. Así como el drenaje agrícola, por el lavado de fertilizantes fosfatados en áreas agrícolas (Velázquez-Machuca et al. 2010). A este respecto, Ayers y Westcot (1987) indican que el agua de riego con calidad aceptable generalmente debe contener menos de 2 mg L-1 de fosfato (0.652 mg L-1 de P), mientras que Hem (1985) indica que la concentración en exceso es una fuente de nutrientes que contribuye con el desarrollo de algas y vegetación acuática, lo que puede oca sionar su acumulación y obstrucción de los sistemas de riego.
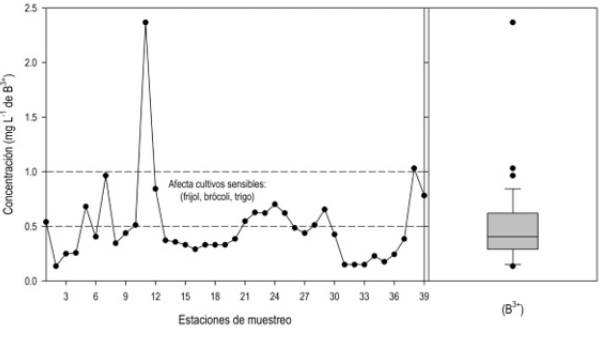
En las aguas naturales, el contenido de boro (B3+) proviene del intemperismo químico de las rocas, del agua de regiones volcánicas y de fuentes hidrotermales. Además de que el tetraborato de sodio (Na2B4O7 • 10H2O), se utiliza como agente limpiador, también tiene usos industriales, por lo que el boro puede estar presente en el agua de origen residual doméstica e industrial (Hem 1985, Velázquez et al. 2011). Aunque este ión es importante en la producción agrícola, en cantidades mayores de 1 mg L-1 es tóxico para cultivos como los cítricos, frutales, frijol, brócoli y trigo (Page etal. 1990, Mancilla-Villa et al. 2014), mientras que los cultivos tolerantes como el sorgo y esparrago, no muestran síntomas en concentraciones de 4 mg L-1 de B3+ en la solución del suelo (Pratt y Suarez 1990). Para una misma concentración de B3+ en el agua de riego, se tiene diferente concentración de B3+ en la zona de raíz, lo que depende de la fracción de lixiviación, si la fracción de lixiviación es mayor de 0.45 se mantiene un bajo el nivel de salinidad en la solución del suelo (Hoffman 1990). A medida que la fracción de lixiviación disminuye, se incrementa la salinidad del agua del suelo debido al efecto de concentración. Lo que representa un riesgo de salinidad y toxicidad para los cultivos sensibles a la salinidad (CE < 1 dS m-1) y al boro (< 1 mg L-1 de B3+) como el frijol, brócoli y trigo (Maas 1990), que son ampliamente cultivados en la zona agrícola estudiada (Figura 4).
La utilización del agua de riego puede restringirse debido al riesgo de toxicidad por cloruro. Cuando la concentración de Cl- es mayor de 10 meq L-1 no se recomienda su uso en la irrigación. Si la concentración de Cl- se encuentra entre 4 y 10 meq L-1 la restricción de uso es moderada (Ayers y Westcot 1987). En este estudio el 95 % de las muestras de agua tuvieron valores bajos de concentración de Cl-, por lo cual, no presentaron ninguna restricción de uso para este ión (Figura 5).
La concentración de nitrato y fosfato en el agua del río Lerma es elevada, posiblemente tienen origen en las descargas de aguas residuales de tipo doméstico, industrial o agrícola. La elevada concentración de iones representa un riesgo por la posible eutrofización de los cuerpos de agua, además del riesgo de contaminación del agua subterránea por lixiviación de NO3-. El B3+ representa riesgo de toxicidad para los cultivos sensibles, mientras que el contenido de Cl- no presentó restricción de uso agrícola. Por la concentración de nutrientes, en el curso alto del río Lerma el agua puede clasificarse en estado hipereutrófico y en los cursos medio y bajo varía entre hipereutrófico y eutrófico.











 nueva página del texto (beta)
nueva página del texto (beta)