Introducción
El conocimiento sobre las plantas útiles y con interés comercial es de suma importancia para los seres humanos, ya que de este depende el aprovechamiento que se haga de ellas. Conocer la distribución y atributos demográficos como la densidad y la estructura poblacional de estas especies es determinante en este sentido (Godínez-Alvarez et al. 2008, Castañeda-Romero et al. 2016). Al definir el área de distribución de una especie se pueden identificar los factores que la determinan y la cantidad de hábitat disponible (López-Gallego 2015). Mientras que la estructura poblacional permite hacer inferencias con respecto a la viabilidad de una población (Elzinga et al. 2001). En México se han realizado estudios con este enfoque, que han determinado el estado en que se encuentran las poblaciones de Sagittaria macrophylla Zucc. y S. latifolia Willd (Zepeda Gómez y Lot 2005), Stenocereus stellatus (Pfeiffer) Riccob., Prosopis laevigata (Humb. y Bonpl. ex Willd.) M.C. Johnston, Castela tortuosa Liebm. y Agave marmorata Roezl (Godínez-Alvarez et al. 2008), y Echinocactus platyacanthus Link & Otto 1827 (Castañeda-Romero et al. 2016).
Dos de las especies de la familia Fabaceae con alto valor comercial que se encuentran creciendo como plantas silvestres en la Península de Yucatán son Haematoxylum campechianum L. (Niembro 2002) y H. calakmulense Cruz Durán & M. Sousa (Cruz y Sousa 2014). La especie H. campechianum es un taxón distribuido en la región, con valor histórico, patrimonial y anteriormente económico, debido a su comercialización como materia prima para extraer tinturas naturales (Contreras 2010). En tanto que H. calakmulense es una nueva especie descrita en el 2014, a partir de muestras provenientes de la Península de Yucatán, la cual era confundida con H. campechianum. En la Península ambos taxones son conocidos de forma indistinta por los mismos nombres comunes: palo de Campeche o palo de tinte y entre los pobladores mayas como éek, tooso boonche’ o palo negro (De la Garza et al. 1983, Cruz y Sousa 2014).
El palo de tinte fue utilizado por los pueblos nativos de América desde la época prehispánica, pero luego del descubrimiento de América, sufrió una explotación comercial intensiva (Contreras 2010). Actualmente las principales amenazas a las que se enfrentan estas especies se relacionan con las actividades antropogénicas que se realizan en sus hábitats (Vester et al. 2007), así como los diferentes usos que se le atribuyen como extracción de hematoxilina para análisis clínicos, usos médicos, postes para cercas y obtención de carbón (Peng et al. 2014, Plasencia et al. 2017). En la Península de Yucatán y en particular en el estado de Campeche, el conocimiento sobre la situación actual de estas especies, su distribución y densidad es casi nulo. Estudios recientes en H. campechianum abordan sus aplicaciones en restauración ecológica (Zamora-Cornelio et al. 2010), su adaptación a ambientes degradados (Pérez-Hernández et al. 2017) y su distribución basada en registros históricos (Plasencia et al. 2017). Pero para H. calakmulense sólo se han realizado estudios taxonómicos y de distribución, basados en ejemplares de herbario (Cruz y Sousa 2014, Duno y Pérez-Sarabia 2015, Plasencia et al. 2017).
Considerando la relevancia histórica, patrimonial, económica y ecológica de las especies señaladas, es de suma importancia conocer el estado actual de sus poblaciones en vida silvestre (Zamora 2010, Duno y Pérez-Sarabia 2015, Plasencia et al.2017). Además, debe tenerse en cuenta que los suelos inundables donde crece el palo de tinte se utiliza para la agricultura de temporal, lo cual puede haber disminuido sus poblaciones. Por lo anterior el objetivo fue estimar sitios de presencia histórica y actual de H. campechianum y H. calakmulense en el estado de Campeche, además de conocer la densidad de H. campechianum y H. calakmulense en sitios donde se localizan y caracterizar la estructura dasométrica de sus poblaciones.
Materiales y métodos
Área de studio
El estado de Campeche está situado en el suroeste de la Península de Yucatán (Figura 1). Limita al norte con el estado de Yucatán, al sur con el estado de Tabasco y la República de Guatemala, al este con el estado de Quintana Roo y Belice, y al oeste con la Bahía de Campeche en el Golfo de México. En el estado alternan áreas de llanuras en el occidente, suroriente y norte, que pueden inundarse estacionalmente. Al oriente se encuentran elevaciones máximas de 340 msnm, así como depresiones denominadas cenotes. Predomina en el 92% del territorio un clima cálido subhúmedo, mientras que el 7.75% presenta clima cálido húmedo y 0.05% semiseco. Las lluvias son de abundantes a muy abundantes durante el verano, y la precipitación total anual entre 1 200 y 2 000 mm en la región húmeda y alrededor de 800 mm en la región de clima semi-seco (INEGI 2010).
En la Península de Yucatán, H. campechianum se encuentra en tierras bajas, con suelos arcillosos y profundos con escaso drenaje (Niembro 2002), en los que se desarrolla selva baja inundable conocida como Ak’alche en la terminología maya (Duch 1989). Con frecuencia H. campechianum forma agrupaciones densas conocidas como tintales. Pero también crece asociada a selva alta subperennifolia, selva mediana subcaducifolia y subperennifolia, manglares, matorrales, orilla de ríos u otros cuerpos de agua, y en vegetación secundaria (Pennington y Sarukhán 1998). En el caso de H. calakmulense, se desarrolla sobre suelo arcilloso y negro húmedo, asociado con la vegetación de selva baja sabanoide, selva baja subcaducifolia inundable, selva mediana subperennifolia, selva mediana subcaducifolia alterada y selva baja subperennifolia (Cruz y Sousa 2014). Aunque ambas especies son semejantes, hay varios caracteres morfológicos que las diferencian. Al respecto H. calakmulense presenta hojas más cortas, de no más de 6 cm de largo, pero con mayor número de pares de folíolos de cuatro a seis, que no superan 1.5 cm de largo y son generalmente de consistencia crasa, convenación secundaria poco evidente, y aunque son glabros en el haz, en el envés son siempre pilosos en la base, cerca de la unión con el peciólulo. Mientras que las hojas de H. campechianum pueden alcanzar hasta 10.5 cm de largo y en general tienen de dos a cuatro pares de folíolos, aunque ocasionalmente pueden presentar cinco, los cuales alcanzan hasta 3.5 cm de longitud, son glabros y presentan venación secundaria y terciaria evidentes (Cruz y Sousa 2014).
Toma de datos
Los registros históricos de H. campechianum y de H. calakmulense en Campeche se tomaron del estudio de Plasencia et al. (2017). Estos autores revisaron los especímenes de estas especies en las principales colecciones de México y de acuerdo con los criterios propuestos por Cruz y Sousa (2014), clasificaron los ejemplares de H. calakmulense que aun aparecían como H. campechianum. Los registros actuales se tomaron de expediciones de campo realizadas entre el 2014 y 2017 como parte de proyectos de investigación. También se visitaron otros sitios donde existían reportes históricos de ambas especies, para verificar su presencia, y sitios que presentaban condiciones adecuadas de acuerdo a sus preferencias de hábitat (Niembro 2002, Plasencia et al. 2017). La determinación de las especies se realizó in situ cuando fue posible, o se colectó material botánico para su posterior determinación en el herbario UCAM del Centro de Investigaciones Históricas y Sociales de la Universidad Autónoma de Campeche, donde fueron depositados.
Se seleccionaron ocho sitios para realizar mediciones de densidad y estructura dasométrica,cuatro se ubicaron en el poblado Hool, 1) Hool 1 (19◦33’ 4.4" LN, -90◦ 24’ 21.1" LO), 2) Hool 2 (19◦ 33’31.8" LN, -90◦ 25’ 57.6" LO), 3) Hool 3 (19◦ 32’ 41.9" LN, -90◦ 27’ 27.8" LO) y 4) Saguayún (19◦ 27’ 8.7" LN, -90◦ 25’ 1.3" LO); dos en Seybaplaya, 5) Seybaplaya 1 (19◦ 36’ 34.3" LN, -90◦ 40’ 45.8 LO") y 6) Seybaplaya 2 (19◦ 39’ 11.5" LN, -90◦ 39’ 32.9" LO), ambos comunidades del municipio de Champotón; y dos en el municipio Campeche en los sitios: 7) Extensión forestal Lerma (EFL: 19◦ 43’ 47.9" LN, -90◦ 33’ 6.0" LO) y 8) Hampolol (19◦ 55’ 54.7" LN, -90◦ 23’12.9" LO)
Los sitios se seleccionaron en función de que fueran fragmentos de vegetación natural donde alguna de estas dos especies fuera dominante (tintales) o estuviese representada al ser abundante o común. En cada sitio de muestreo se establecieron 20 parcelas, para tener un total de 160 parcelas de 10 x 10 m (100 m2), de acuerdo con Cortés-S. (2003), procurando que fueran representativas de las variaciones en la distribución de H. campechianum y H. calakmulense al interior de los fragmentos. En cada parcela se contabilizaron y midieron todos los individuos de H. campechianum y H. calakmulense con diámetro a altura del pecho (DAP) igual o mayor a 1 cm. A cada individuo se le estimó la altura total mediante apreciación visual (m) y el DAP a 1.30 m de altura con una cinta diamétrica. En árboles con más de una rama por debajo de la altura del pecho se midió el DAP de cada rama y se calculó el valor promedio.
Manejo de datos
Las coordenadas de cada registro de H. campechianum y H. calakmulense se proyectaron sobre un mapa de la Península de Yucatán. Se diferenciaron los registros históricos anteriores al 2010 de los posteriores al 2014. Las coordenadas de los registros históricos se obtuvieron de las bases de datos de los herbarios, y las coordenadas de los registros actuales se tomaron en las visitas de campo. Para realizar estos procedimientos se utilizó el programa ArcView 3.2. La densidad (D) se calculó como el número de individuos (N) en un área (A) determinada: D = N/A (Mostacedo y Fredericksen 2000). Para todas las variables medidas se calculó la media, desviación estándar, mínimo y máximo de cada sitio de muestreo. Para conocer la distribución de frecuencias de los individuos de H. campechianum y H. calakmulense en cada sitio se elaboraron histogramas de altura y DAP. Para la altura se establecieron tres categorías individuos bajos (1 a 2.4 m), medianos (2.5 a 7 m) y altos (7.1 a 15 m); e igualmente para el DAP: individuos delgados (1 a 7.5 cm), medios (7.6 a 16.7 cm) y gruesos (16.8 a 62.4 cm). Para establecer estos intervalos, se ordenaron de menor a mayor los valores de altura y de DAP de todos los individuos encontrados en los ocho sitios muestreados, y se dividieron en tres grupos iguales, determinando los valores mínimos y máximos de cada intervalo (Raventós et al. 2015, García-González et al. 2017, Raventós et al. 2018).
Para comparar las variables densidad, altura, DAP y número de ramas entre sitios de estudio, se empleó la prueba de Kruskal-Wallis. En el caso de la densidad, la unidad de muestreo fue la parcela. Luego se compararon los sitios teniendo la densidad por parcela. Para las variables altura, DAP y número de ramas la unidad de muestreo fueron los individuos. Para comparar las frecuencias absolutas de los individuos por intervalos de tamaño y DAP dentro de cada sitio, se empleó la prueba de Chi Cuadrado. Se utilizaron pruebas no paramétricas debido a que los datos no estaban normalmente distribuidos. Para todos los análisis se utilizó el programa Statistica 8.0.
Resultados
Se obtuvieron 26 registros históricos de presencia de H. calakmulense, de recolectas efectuadas entre 1982 y 2006 (Figura 1B), mientras que para H. campechianum fueron 79 registros, realizados entre 1965 y 2010 (Figura 1A). De los reportes históricos de H. calakmulense, 23 se ubican en el municipio de Calakmul, dos en Hopelchén y uno en Campeche. En el caso de H. campechianum, tiene registros históricos en los 11 municipios del estado de Campeche: Calakmul (17), Campeche (11), Champotón (11), Calkiní (8), Carmen (8), Hopelchén (7), Palizada (4), Candelaria (4), Tenabo (4), Hecelchakán (3) y Escárcega (2). Los registros actuales obtenidos para ambas especies (2014-2017) amplían su distribución a nuevos sitios en el estado y confirman su permanencia en aquellas donde se han reportado (Figura 1A y B). De H. calakmulense se tuvieron 11 registros actuales (Figura 1B), cinco en el municipio de Hopelchén, cuatro en Campeche, uno en Champotón y uno en Calakmul. Para H. campechianum se obtuvieron 170 registros actuales (Figura 1A), de los cuales 69 fueron en el municipio de Palizada, 53 en Carmen, 19 en Champotón, 18 en Calakmul, siete en Campeche, dos en Hecelchakán, uno en Escárcega y uno en Candelaria.
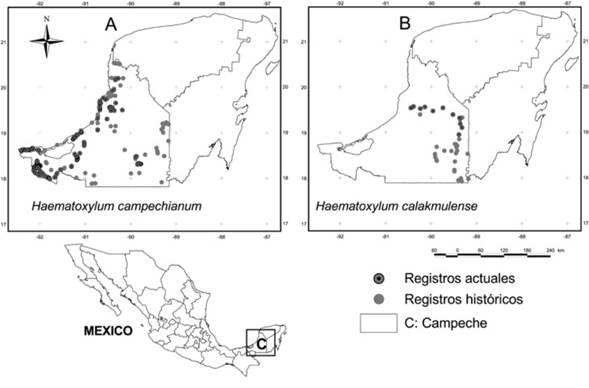
Figura 1: Registros de presencia histórica, anteriores a 2010 (Plasencia et al. 2017) y actuales (2014-2017) de Haematoxylum campechianum L. y Haematoxylum calakmulense Cruz Durán & M. Sousa, en el estado de Campeche, México.
Las densidades variaron entre los ocho sitios en los que se realizaron mediciones, H. calakmulense tuvo valores de densidad bajos (Tabla 1), por lo que solo fue posible realizar el análisis en Saguayún, por ser donde se encontraron suficientes individuos en los muestreos para medir la estructura dasométrica. En los otros sitios solo se encontraron individuos aislados, aunque por los registros de distribución de la especie se conocían sitios en Calakmul con mejor representación a los que no se pudo acceder. Para H. campechianum, la mayor densidad se encontró en los sitios EFL y Seybaplaya 1, mientras que la menor fue en Seybaplaya 2. No obstante, existen diferencias entre los valores de densidad de los ocho sitios (H(N=160) = 39.702, p < 0.0001), específicamente entre Hool 1 y Seybaplaya 1 (Z = 3.368, p = 0.021), Saguayún y EFL (Z = 3.244, p = 0.033), Saguayún y Seybaplaya 1 (Z = 3.686, p = 0.006), Seybaplaya 2 y EFL (Z = 3.518, p = 0.012), Seybaplaya 1 y Seybaplaya 2 (Z = 3.960, p = 0.002), Hool 1 y Hampolol (Z = 3.314, p = 0.026), y Hampolol y Saguayún (Z =3.631, p = 0.008).
Tabla 1: Media ± Desviación Estándar, mínimo y máximo para las variables medidas en ocho sitios del estado de Campeche para las especies Haematoxylum campechianum L. (Hcam) y Haematoxylum calakmulense Cruz Durán & M. Sousa (Hcal).
| Sitios\Variables | Densidad (individuos m²) | Altura (m) | Número de Ramas | DAP (cm) |
| Saguayún (Hcal) | 0.03 ± 0.02 (0.01-0.09) | 8.52 ± 2.45 (1.8-12) | 1.42 ± 0.79 (1-5) | 18.17 ± 11.81 (1-54.6) |
| Hool 1 (Hcam) | 0.04 ± 0.04 (0.01-0.15) | 8.93 ± 3.45 (1.9-15) | 1.18 ± 0.56 (1-5) | 16.02 ± 11.50 (1.3-48.5) |
| Hool 2 (Hcam) | 0.06 ± 0.03 (0.01-0.13) | 5.58 ± 3.07 (1-12) | 1.52 ± 1.19 (1-8) | 9.32 ± 7.71 (1-44.9) |
| Hool 3 (Hcam) | 0.07 ± 0.05 (0.01-0.24) | 7.09 ± 1.61 (3-11) | 1.45 ± 0.90 (1-6) | 14.79 ± 9.24 (1.38-62.4) |
| Seybaplaya 2 (Hcam) | 0.03 ± 0.02 (0.01-0.09) | 7.54 ± 1.21 (4.5-10) | 1.93 ± 1.21 (1-7) | 21.83 ± 8.98 (4.5-49.1) |
| Seybaplaya 1 (Hcam) | 0.13 ± 0.21 (0.02-0.98) | 4.31 ± 1.78 (1.65-10.5) | 1.91 ± 1.39 (1-9) | 7.04 ± 7.96 (1-59) |
| EFL (Hcam) | 0.14 ± 0.14 (0.01-0.45) | 5.87 ± 2.54 (1.5-14) | 1.59 ± 1.06 (1-7) | 8.89 ± 6.56 (1-48.8) |
| Hampolol (Hcam) | 0.09 ± 0.06 (0.01-0.23) | 5.74 ± 1.61 (2-12) | 2.37 ± 1.82 (1-12) | 9.26 ± 7.04 (1-40.2) |
Para H. calakmulense los individuos alcanzaron un máximo de 12 m, mientras que para H. campechianum la altura máxima registrada fue de 15 m (Tabla 1); aunque este parámetro osciló entre 2.5 y 7 m para la mayor parte de los individuos medidos (Figura 2). Para ambas especies, se encontraron diferencias significativas en la distribución de individuos en los diferentes intervalos de altura: Hool 1 (χ2 = 62.3, p < 0.0001), Hool 2 (χ2 = 19.5, p <0.0001), Saguayún (χ2 = 47.7, p < 0.0001), Hool 3 (χ2 = 68.8, p < 0.0001), EFL (χ2 = 142.1, p < 0.0001), Seybaplaya 1 (χ2 = 285.7, p < 0.0001), Seybaplaya 2 (χ2 = 37.6, p < 0.0001) y Hampolol (χ2 = 202.8, p< 0.0001). También, se encontraron diferencias entre los valores de altura obtenidos en los ocho sitios (H(N=1194) = 320.9, p < 0.0001).
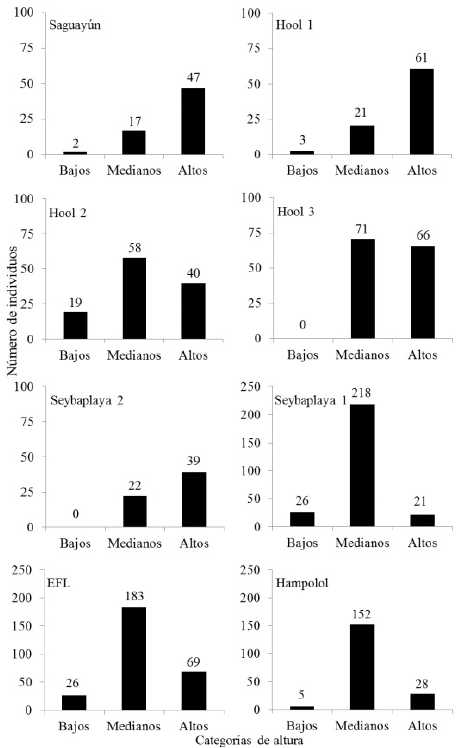
Figura 2 Alturas de los individuos de Haematoxylum calakmulense Cruz Durán & M. Sousa (Saguayún) y Haematoxylum campechianum L., en ocho sitios del estado de Campeche, México. Individuos bajos: 1 a 2.4 m, medianos: 2.41 a 7 m y altos: 7.1 a 15 m.
En promedio, los mayores valores de DAP, considerando los individuos de H. calakmulense y H. campechianum, se obtuvieron en Seybaplaya 2 (Tabla 1), aunque el mayor valor se registró en Hool 3 (Tabla 1). En Hool 1, Saguayún y Seybaplaya 2 la mayoría de los individuos oscilaron entre 16.8 y 62.4 cm de DAP (Figura 3). Por el contrario, en Hool 2, EFL y Seybaplaya los individuos de menores valores de DAP son los que dominaron. En los ocho sitios, considerando ambas especies se encontraron diferencias en el número de individuos en cada intervalo de DAP: Hool 1 (χ2 = 8.566, p = 0.014), Hool 2 (χ2 = 27.744, p < 0.001), Saguayún (χ2 =7.636, p = 0.022), Hool 3 (χ2 = 15.827, p < 0.001), EFL (χ2 = 89.819, p < 0.001), Seybaplaya 1 (χ2 =180.325, p < 0.0001), Seybaplaya 2 (χ2 = 38.793,p < 0.001) y Hampolol (χ2 = 41.165, p < 0.0001). También, se encontraron diferencias entre los DAPs obtenidos en los ocho sitios (H(N=1194) = 262.568, p< 0.0001). Considerando ambas especies, los individuos más ramificados se localizan en Hampolol y los menos ramificados en Hool 1. Para esta variable también se encontraron diferencias entre los ocho sitios (H(N=1194) = 89.244, p < 0.0001).
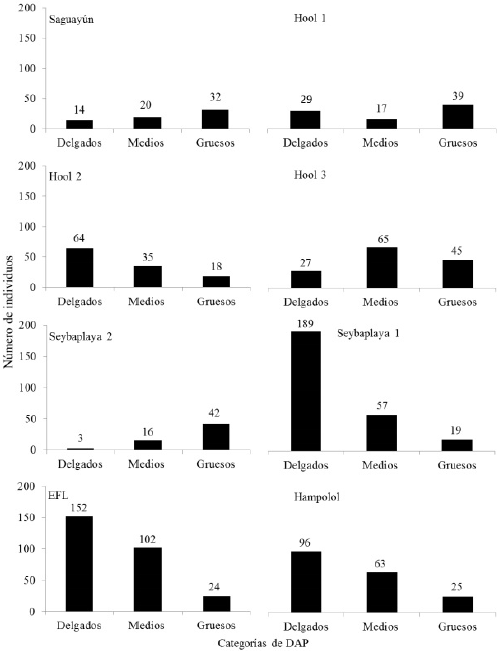
Figura 3 Diámetro a la altura del pecho (DAP, ≈ a 1.30 m de altura) de los individuos de Haematoxylum calakmulense Cruz Durán & M. Sousa (Saguayún) y Haematoxylum campechianum L., en ocho sitios del estado de Campeche, México. Individuos delgados: 1 a 7.57 cm, medios: 7.58 a 16.75 cm y gruesos 16.76 a 62.4 cm.
Discusión
En el estado de Campeche, la distribución de H. campechianum es mayor que la de H. calakmulense, lo que coincide con el comportamiento general de estos taxones en la Península de Yucatán (Cruz y Sousa 2014, Plasencia et al. 2017). Se ha sugerido que la distribución de H. campechianum puede estar asociado con zonas costeras y zonas con menores precipitaciones, generalmente en la parte norte de la Península de Yucatán (Cruz y Sousa 2014). Esta aparente relación no está sustentada por estudios en campo sobre la distribución y las preferencias de hábitat de esta especie, sino que responde a un análisis de la información proveniente de ejemplares de herbario, la cual encubre el sesgo relacionado con las colecciones biológicas. Debido a que el acceso a las áreas costeras es más fácil, se han realizado más colectas en ellas y por tanto hay mayor número de ejemplares. Además, históricamente la especie fue explotada en áreas cercanas al mar o ríos, desde donde era fácil su transportación y más barato los costos de aprovechamiento (Dampier 2004, Arnaiz y Dachary 2009), por lo que existen más registros de su presencia en estos sitios. Pero H. campechianum es un taxón de amplia plasticidad ecológica, que logra adaptarse a diferentes ambientes y crece asociado a numerosas formaciones vegetales en la Península de Yucatán (Pennington y Sarukhán 1998, Niembro 2002).
La especie H. calakmulense se distribuye al interior de Campeche, lo que coincide con los datos de ejemplares de herbario (Cruz y Sousa 2014), que ubican a este taxón en sitios del centro y sur de la Península de Yucatán. Considerando la distribución de ambas especies, es probable que los individuos de palo de tinte que históricamente se han explotado en la Península de Yucatán fueran de la especie H. campechianum. Debido a que H. calakmulense se encuentra en sitios que dificultaron su aprovechamiento, por accesibilidad y distancia al mar o ríos, ya que solo aprovechaban los árboles cercanos a estas fuentes de agua, ya que acarrearlos exigía más trabajo que talarlos, cortarlos y astillarlos (Dampier 2004, Arnaiz y Dachary 2009, Villegas y Torras 2014). Haematoxylum campechianum se encontró como individuos aislados en diferentes formaciones vegetales, como selva baja, selva mediana, manglares, acahuales, o formando tintales, como indican Pennington y Sarukhán (1998). Mientras que los individuos de H. calakmulense se encontraron aislados en potreros, acahuales o en selva baja, pero nunca agrupados formando tintales. La región de Calakmul es históricamente donde se ha reportado la mayor frecuencia de H. calakmulense (Plasencia et al. 2017), lo que se pudo constatar con los registros actuales recopilados. Por cuestiones logísticas y de permisos no se pudieron realizar mediciones de la estructura dasométrica de H. calakmulense dentro de Calakmul, pero en esta área tampoco se observó formando tintales. Esta es una nueva característica que diferencia a H. calakmulense de H. campechianum, que se anexa al conocimiento de la ecología de esta nueva especie. La ausencia de tintales formados por H. calakmulense puede ser otra razón que avale la hipótesis de que este taxón no ha sido utilizado con fines comerciales, ya que normalmente las áreas de palo de tinte que se explotaban eran aquellas donde había densidades altas de árboles.
Con el trabajo de campo, se comprobó que la distribución histórica de ambas especies en los diferentes municipios del estado de Campeche refleja el sesgo de las colecciones biológicas. Pero no se puede minimizar la relevancia de las colecciones de herbario, ya que éstas son importantes y constituyen la base para describir y nombrar especies, para establecer programas de conservación y para brindar información útil a la comunidad científica y público en general (Forero 1975, Peralta 1992). Muchos de los registros actuales e históricos, se encuentran en la región de Calakmul, debido a lo atractivo de la zona para los investigadores (Ortega-Rubio et al.2015). Por otra parte, Candelaria es un municipio que se caracteriza por presentar abundantes cuerpos de agua, lo que lo hace una zona potencialmente idónea para el desarrollo de estos taxones, por ser un factor que determina su presencia. Pero existen pocos registros de herbario para H. campechianum y ninguno de H. calakmulense en esta área (Plasencia et al. 2017), lo que se puede deber a la falta de muestreos o por la ausencia de akalchés en Candelaria. Debido a problemas logísticos, durante los trabajos de campo no fue posible muestrear de forma exhaustiva esta área, por lo que debe tenerse en cuenta como prioritaria para muestreos futuros. Palizada es otro municipio del que se tenía muy poca información en registros de herbario acerca de estas especies, aunque por fuentes históricas se conocía la relevancia del área para el comercio del palo de tinte (Villegas y Torras 2014). Se constató la amplia presencia de H. campechianum y su importancia en la región. Dentro de áreas ganaderas, en muchas ocasiones solo se encuentran fragmentos de tintal, por lo que constituyen el único remanente de vegetación que puede estar sirviendo de hábitat para las especies que logran sobrevivir en estas regiones altamente antropizadas.
Es de importancia conocer las diferencias en la distribución de H. campechianum y H. calakmulense en los diferentes municipios del estado de Campeche, y estudiar las problemáticas que enfrentan cada una en sus sitios de ocurrencia. Aunque los resultados muestran que aún no se cuenta con los elementos necesarios para incluir a estas especies dentro de alguna categoría de amenaza, los procesos de deforestación en los sitios donde se localizan apuntan a un riesgo inminente a mediano y largo plazo. Palizada y Candelaria figuran entre los municipios más afectados por las actividades agropecuarias en el estado de Campeche (Villalobos-Zapata y Mendoza 2010), y donde se ha registrado una mayor pérdida de la cobertura de vegetación natural (Turner II et al. 2004). En tanto que Hopelchén es uno de los municipios más importantes para H. calakmulense, en términos de sitios con presencia de la especie, y al mismo tiempo es de los que presenta a nivel estatal las mayores tasas de deforestación en las últimas décadas (Porter-Bolland et al. 2007, Ellis y Porter-Bolland 2008). También en Champotón, el municipio donde se ubica la mayor parte de los ocho sitios muestreados, los tintales están desapareciendo como consecuencia del desarrollo agrícola. En estos municipios, las principales actividades que provocan el cambio de uso del suelo son la expansión de la agricultura mecanizada y la ganadería, la proliferación de plantaciones de caña de azúcar (Saccharum officinarum L.) y palma de aceite (Elaeis guineensis Jacq.), el establecimiento de caminos, la venta y renta de tierras a menonitas, y los programas de subsidios para el desarrollo agropecuario (Castro 2009, Mata 2014). Solo la caña de azúcar, en el estado de Campeche ocupa el tercer lugar en superficie, después del maíz y el arroz, y el ingenio La Joya se abastece en un 50% de la caña de los ejidos del municipio Champotón (Pimentel y Delgadillo 2015).
En muchos de los sitios donde predomina H. campechianum con DAPs menores de 10 cm (Seybaplaya 1, EFL y Hampolol), es probable que haya ocurrido aprovechamiento mediante tala selectiva, con la extracción de los árboles más altos y de mayor diámetro (Hall et al. 2003). El gran número de individuos jóvenes y la presencia de tocones, sugiere que en estos sitios tienen elevada regeneración producto de la extracción de los individuos más longevos y de mayor talla, lo que puede ser un indicio de un estado de sucesión temprano (Koyoc-Ramírez et al. 2015). En tintales como el de Seybaplaya 2 y Hool 1 se observó que la población está compuesta por individuos adultos, muchos seniles y con escasa regeneración, lo que potencialmente puede ocasionar un decrecimiento y eventualmente la desaparición de la población (Silvertown 1987, Elzinga et al. 2001). Una situación similar se da en el caso de Saguayún, aunque se encontraron evidencias de que hay regeneración por la presencia de plántulas de H. calakmulense. Pero en este sitio se observa una fuerte presión por la tala selectiva de especies y para el establecimiento de apiarios.
A pesar de las amenazas que enfrentan estos taxones en el estado de Campeche, en la Reserva de la Biósfera Calakmul se conservan poblaciones de ambas y en la Reserva de la Biósfera Los Petenes de H. campechianum. Además, en Palizada se están desarrollando iniciativas de propagación en viveros y reforestación de H. campechianum, con el propósito de llevar a cabo, actividades de aprovechamiento comercial. Es importante señalar que a nivel mundial se está renovando el interés por la utilización de colorantes naturales para la industria alimentaria y textil, como sustitutos de los tintes sintéticos (Özkan y Bilek 2014, Shahid-ul-Islam y Mohammad 2017), ámbito en el que H. campechianum tiene potencial.
En el caso de H. calakmulense, es una especie de la que se desconocen muchos aspectos, pero dadas sus semejanzas con H. campechianum, probablemente también tenga alto potencial económico. El desconocimiento sobre las especies dificulta poder determinar los recursos potenciales que pueden ofrecer y pone en riesgo su conservación (Swing et al.2014). Por lo que conocer el estado actual de las poblaciones de H. campechianum y H. calakmulense es de interés. Aparentemente, el estado de Campeche, H. campechianum tiene una situación favorable, debido a qe está mejor representada en el estado y sus poblaciones son más abundantes que las de H. calakmulense. En los ocho sitios muestreados se encontraron evidencias de afectaciones antrópicas, con repercusiones en las poblaciones de ambas especies. Se sabe que H. calakmulense es un taxón menos abundante, debido a que no tiene la capacidad de formar tintales, por lo que se encuentra como árboles aislados, y con distribución más restringida que H. campechianum, por lo que es ncesario realizar estudios que permitan conocer la dinámica poblacional, las preferencias ecológicas y el ciclo reproductivo.
Conclusiones
Haematoxylum campechianum está más distribuido en Campeche que H. calakmulense, la cual se localiza en zonas interiores del estado. H. calakmulense no se localizó formando tintales, mientras que H. campechianum puede crecer en grupos con elevada densidad siendo la especie dominante. Ambas especies alcanzan alturas y DAP semejantes. Algunas de las poblaciones más propensas a desaparecer son las de Seybaplaya 2, Hool 1 y Saguayún. Considerando que el conocimiento sobre la historia natural y la ecología de H. calakmulense es casi nulo, es necesario ampliar los esfuerzos de muestreo dentro del rango de distribución de la especie. También debe tenerse en cuenta que las especies de plantas con elevado valor de uso y potencial económico pueden ser las primeras en verse afectadas por la explotación excesiva y las más propensas a desaparecer. Los resultados constituyen un primer paso para futuros estudios ecológicos, y el punto de partidapara proyectos de conservación y aprovechamiento sustentable de H. campechianum y H. calakmulense en el estado de Campeche.











 nueva página del texto (beta)
nueva página del texto (beta)



