Introducción
El sargo (Archosargus probatocephalus, Walbaum 1792), es un pez marino costero subtropical que ingresa a las aguas salobres, se distribuye en las costas del Océano Atlántico occidental (Bester y Robins 2005), desde Nueva Escocia en Canadá hasta el Golfo de México, con registros en Honduras y Brasil (GSMFC 2006). Es un componente importante de las pesquerías recreativas deportivas y comerciales a lo largo de la costa Atlántica de EUA y Golfo de México (McDonough et al. 2011). El sargo pertenece a la familia Sparidae, una de las más cultivadas en el mundo, con representantes importantes como la brema roja (Pagrus major) en Japón y Taiwan (Okuzawa 2015) y la dorada (Sparus aurata) en el Mediterráneo (APROMAR 2017). El sargo tiene potencial en la acuacultura, debido a su gran adaptabilidad al cautiverio, amplio espectro de alimentación, soporta las condiciones de hacinamiento, se ha logrado el desove y la producción de crías en laboratorio, puede pesar hasta 14 kg, alcanzar una longitud máxima de 80 cm, y su carne es de excelente calidad (Tucker 1998, 2004).
Se tienen reportes de que desova en los arrecifes cercanos a las costas del Atlántico medio y sur de los Estados Unidos y en los estuarios del Golfo de México, a finales del invierno y principios de primavera (GSMFC 2006). Mientras que McDonough et al. (2011) reportaron en Carolina del Sur, con una época de reproducción de enero a abril. La talla de primera madurez para A. probatocephalus es de 35 cm en las costas de los Estados Unidos (Wenner 2004). El promedio del diámetro del ovocito maduro es de 400 µm, tamaño en que se recomienda el uso de 1 000 a 2 000 UI kg-1 de hormona gonadotropina coriónica humana para inducir el desove (Tucker 1998). Esta especie es considerada gonocórica y desovadora parcial, madura generalmente a los dos años de edad (Wenner 2004, Tucker 2004). La frecuencia de desove se estima, desde una vez al día por siete días, hasta una vez cada 20 d (Munyandorero et al. 2006). Al respecto Mc Donough et al. (2011) señalan que la fecundidad parcial promedio es variable, y se correlaciona con la longitud patrón, el peso y la edad. En hembras capturadas en aguas costeras, es de 1 100 a 40 000 ovocitos por desove, mientras que, en hembras capturadas en alta mar, es de 14 000 a 250 000 ovocitos (GSMFC 2006). En cautiverio Tucker y Barbera (1987) obtuvieron 15 000 huevos desovados de forma manual, con individuos con peso promedio de 378 g. Al respecto Tucker y Alshuth (1997) reportan que los huevos son pelágicos de 0.82 mm de diámetro promedio, poseen una gota de aceite que mide 214 ± 27 µm, eclosionan 28 h después de la fecundación, a temperatura de 23 °C. Mientras que Tucker y Barbera (1987) reportan una tasa de fertilización de 59% y eclosión del 86%, en tanto que Tucker (1998, 2004) reportan una sobrevivencia larval al séptimo día después de la eclosión del 62%. La longitud de la larva al eclosionar es de 1.65 ± 0.15 mm (Tucker 2004), a los tres días después de la eclosión los ojos y el sistema digestivo son funcionales y comienza su alimentación exógena, al cuarto día post-eclosión, el vitelo y la gota de aceite se agotan y la larva se alimenta por ella misma (Tucker y Alshuth 1997).
Aunque pareciera que se conocen las técnicas de reproducción de la especie, el manejo de reproductores acondicionados al cautiverio no se ha realizado de manera exitosa (Tucker 1998, 2004), siendo esto esencial para la obtención de larvas de manera eficiente, por lo que el objetivo del presente estudio fue evaluar la reproducción de dos lotes de sargos, uno mantenido en cautiverio por un año y otro silvestre, logrando el desove en ambos lotes.
Materiales y métodos
Lote acondicionado y madurado sexualmente en cautiverio
Se capturaron 45 juveniles de sargo (A. probatocephalus) en el mes de febrero del 2014 en la laguna de Alvarado, Veracruz, México, con peso promedio de 100 ± 50 g, para luego transportarlos en contenedores con aireación al Laboratorio de Acuacultura del Instituto Tecnológico de Boca del Río, donde se les dio un baño profiláctico con peróxido de hidrógeno a 400 ppm por 30 min y agua dulce, para luego colocarlos en un sistemas de recirculación por un año, el sistema de recirculación estuvo conformado por dos tinas de fibra de vidrio con capacidad de 23 m3, ensambladas con un filtro biológico de 7 m3 los peces se colocaron a densidad de un 1 organismo por m3, la calidad del agua del sistema se registró con una sonda multiparamétrica (Hanna Hl 9828), salinidad 10 ± 1 psu, temperatura de 25.5 ± 3 °C, oxígeno disuelto de 4.5 ± 0.3 mg L-1 y amonio total de 0.1 mgL-1. Se registró la supervivencia (%) de los organismos, la longitud furcal (LF) en cm con un ictiómetro y el peso en g con una báscula digital Ohaus® (0.01 g).
Los organismos se aclimataron al cautiverio por medio de la administración inicial al libitum de ostiones y pescado frescos, por cinco días y gradualmente se cambió a alimento balanceado semihúmedo con 45% de proteína y 12% de lípidos, conformado por alimento balanceado de iniciación para tilapia (Purina), filete de pescado fresco, calamar, lecitina de soya, aceite de pescado, alginato de sodio y mezcla de vitaminas y minerales. Al octavo mes de su acondicionamiento, se indujo la madurez sexual por medio del incremento de forma gradual de la salinidad del sistema, incrementando 5 psu cada semana, hasta 35 psu.
Lote de organismos silvestres
En el mes de febrero de 2015 se capturaron en la laguna de Alvarado, Veracruz, México, 15 organismos, 5 hembras y 10 machos con peso promedio de 600 ± 200 g y 26 ± 2 cm de LF, para formar el lote de organismos silvestres. Los cuales se transportaron al Laboratorio de Acuacultura del Instituto Tecnológico de Boca del Río, para su revisión, determinar el grado de madurez sexual por medio de biopsias de la gónada y luego observar las muestras al microscopio compuesto (Carl Zeiss, Primo Star) registrando en el caso de las hembras, la morfología y el diámetro de los ovocitos, y en los machos la movilidad de los espermas, la apariencia y fluidez del semen.
Con los peces maduros sexualmente en ambos lotes; machos con semen fluido y hembras con ovocitos en vitelogénesis avanzada con más de 400 de diámetro, se registró su peso y se indujo el desove con la aplicación intramuscular de 500 UI kg-1 de hormona gonadotropina coriónica y sérica de uso veterinario (PG 600 Intervet). Para después colocar los reproductores en una proporción de dos hembras y cuatro machos por tina, en un sistema cerrado con dos tinas de fibra de vidrio de 1.2 m3, acopladas a un reservorio de sedimentación y filtro biológico, con capacidad de 620 L. Se registró el tiempo en que los organismos desovaron después de la inyección de la hormona, y se evaluó la viabilidad del desove, colocando los huevos en una probeta de cristal de 1000 mL, para luego esperar a que se separaran los huevos viables en la parte superficial y los inviables en el fondo. Los huevos viables de cada desove se colocaron en una incubadora invertida de 100 L hasta su eclosión. Los eleuteroembriones obtenidos se mantuvieron en peceras de vidrio de 60 L a densidad de 100 organismos L-1 con aireación suave, adicionando la microalga Nannochloropsis oculata 100 000 cel mL-1. La alimentación exógena inició a partir del segundo día después de la eclosión (DDE) suministrando el rotífero Brachionus plicatilis morfotipo L (5 rotíferos mL-1). Los parámetros de la calidad del agua se determinaron con una sonda multiparamétrica (Hanna Hl 9828): salinidad 35 ± 1 psu, temperatura de 21.5 ± 0.5 °C, oxígeno disuelto de 4.2 ± 0.3 mg L-1 y amonio total de 0.1 mgL-1.
Para evaluar la calidad de los desoves, se registró el diámetro de la gota de aceite, el volumen del saco vitelino y el tamaño promedio de los huevos y eleuteroembriones, para lo cual se utilizó un microscopio compuesto (Carl Zeiss, Primo Star) con micrómetro ocular con aumento de 4x. Durante los nueve días que sobrevivieron las larvas (DDE), se evaluó el crecimiento en longitud notocordal (LN) (mm) y la tasa de supervivencia (% d-1).
Análisis estadístico
Se verifico la normalidad (Kolmogorov-Smirnov) y homocedasticidad (Levene) del diámetro de la gota de aceite, el volumen del saco vitelino y el tamaño promedio de los huevos y eleuteroembriones recién eclosionados. El análisis paramétrico de comparación entre grupos se determinó con la prueba de t de Student de muestras independientes (p < 0.05), mientras que el porcentaje de eclosión y supervivencia de las larvas entre los grupos se analizó con la prueba de Chi2 a partir de la transformación arcoseno. Todos los análisis estadísticos se realizaron con el programa Statistic v 7.1 .
Resultados
Lote acondicionado y maduración sexual en cautiverio
El pre-acondicionamiento de los organismos duró 21 d, con mortalidad del 20%, sobreviviendo 36 de los 45 organismos capturados. Durante el proceso de adaptación al consumo de alimento, no se presentó mortalidad en los organismos. Transcurridos los 12 meses de cultivo, se registró un peso promedio final de 720 ± 50 g y LF de 31 ± 1 cm (Figura 1), con tasa de crecimiento en longitud de 0.084 ± 0.02 cm d-1 y peso de 1.97 ± 0.4 g d-1.
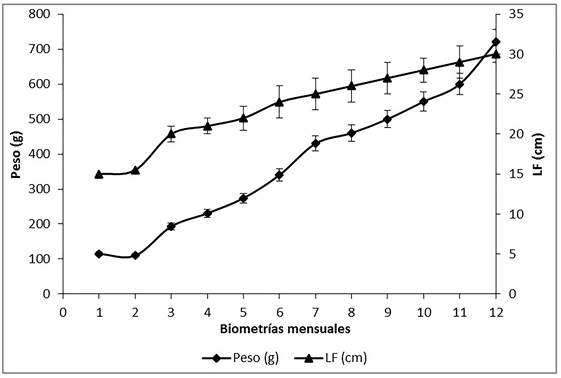
Figura 1: Peso promedio (g) y longitud furcal promedio (cm) registrados en sargos (A. probato-cephalus) acondicionados al cautiverio por un año
En el mes de septiembre los peces se encontraban inmaduros sexualmente, las hembras presentaron ovocitos es estadio de previtelogénesis con diámetro promedio de 190 ± 22 µm, mientras que en el mes de noviembre todos los organismos tuvieron el peso y la talla de primera madurez registrada para la especie, que es de 336 y 28 cm, respectivamente. Los ovocitos presentaron el estadio de vitelogénesis con diámetro promedio de 350 ± 35 µm, en el mes de diciembre (Figura 2). Mientras que en el mes de enero los peces maduraron sexualmente, en la misma temporada en que lo hacen en el medio natural, observándose ocho hembras con ovocitos en vitelogénesis avanzada y en hidratación con diámetro de 420 a 790 µm y 16 machos con semen fluido, mientras que el resto de organismos no presentaron madurez sexual. El peso y talla promedio de los peces inducidos fue de 560 ± 50 g y 30 ± 1.3 cm. A las 48 h post-inyección de la hormona gonadotropina coriónica y sérica los reproductores desovaron, por lo que se registró un total de 60 000 huevos viables kg-1, con tasa de eclosión del 80%, por medio de desoves parciales cada 24 h por cinco ocasiones, obteniéndose 35 000 huevos el primer día, 10 000 el segundo día y 5 000 los siguientes tres días. Los huevos presentaron un diámetro promedio de 797.4 ± 10.3 µm, promedio del volumen del saco vitelino de 232 ± 5 µL, diámetro de gota de aceite promedio de 187 ± 10 µm y LN promedio de los eleuteroembriones al eclosionar de 1.4 ± 0.16 mm, la supervivencia de las larvas al día siete después de la eclosión fue del 50% y al día nueve DDE la mortalidad fue del 100% (Tabla 1).
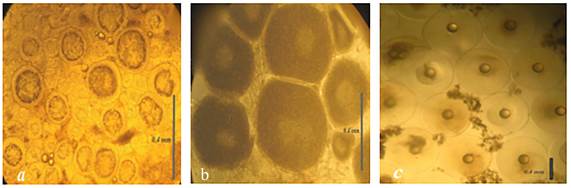
Figura 2: Microfotografías de diferentes estadios de maduración sexual de ovocitos de sargo: (a) estadio previtelogénesis en el mes de septiembre de 2014, con diámetro de 190 ± 22 µm (n = 30) (10x); (b) estadio de vitelogénesis, en el mes de noviembre de 2014, con diámetro de 350 ± 35 µm (n = 28) (10x) y (c) estadio de hidratación con diámetro 790 ± 25 µm, en el mes de enero de 2015, con la evidente gota de grasa (n = 30) (4x)
Tabla 1: Características de los desoves, huevos y larvas de sargo (A. probatocephalus) obtenidos de reproductores madurados sexualmente en cautiverio (MC) y silvestres (RS)
| Característica | Primer desove (MC) | Segundo desove (RS) | Valores promedio |
|---|---|---|---|
| Fecha de desove | 6 enero 2015 | 14 febrero 2015 | - |
| Tiempo de desove post-inyección de la hormona | 48 h | 72 h | 60 ± 12 h |
| Huevos viables | 100 000 | 60 000 | 80 000 ± 20 000 |
| Temperatura y salinidad de desove | 20.5 ± 0.5 C y 35 psu | 21.5 ± 0.5 C y 35 psu | 21 ± 0.5 C y 35 psu |
| Desoves parciales | 5 | 3 | 4 ± 1 |
| Diámetro de los huevos | 796.4 ± 10.3 µma | 838.2 ± 15.3 µmb | 817.3 ± 20.9 µm |
| Tasa de eclosión | 80%a | 60%b | 70% |
| Volumen del saco vitelino | 232 ± 7.8 nL a | 254.2 ± 7.2 nLb | 243 ± 11 nL |
| Diámetro de la gota de aceite | 187 ± 15.4 µma | 220 ± 7.1 µmb | 203.5 ± 16.5 µm |
| Longitud notocordal de eleuteroembriones | 1.4 ± 0.16 mma | 1.9 ± 0.1 mmb | 1.65 ± 0.25 mm |
| Supervivencia de larvas al séptimo DDE | 50%a | 50%a | 50% |
Los subíndices diferentes en cada renglón señalan diferencia significativa (p < 0.05) con la prueba t Student de muestras independientes
Desove de organismos silvestres
Del total de los reproductores silvestres colectados en el mes de febrero, se detectaron dos hembras con peso y LF promedio de 1200 ± 100 g y 35 ± 1.2 cm, respectivamente; con ovocitos en vitelogénesis avanzada de 450 ± 25 µm y cuatro machos con semen fluido, con peso y LF promedio de 1000 ± 89 g y 30 ± 1 cm, respectivamente. Estos peces fueron inducidos con la hormona gonadotropina coriónica y sérica logrando el desove a las 72 h. A partir del desove se obtuvo un total de 40 000 huevos kg-1, con desoves parciales cada 24 h por tres ocasiones, obteniendo 20 000 huevos el primer día, y 10 000 el segundo y tercer día. Los huevos midieron 838.2 ± 15.4 µm, el volumen del saco vitelino fue de 252 ± 4 nL, el diámetro de la gota de aceite de 220 ± 7 µm y la tasa de eclosión del 60%. En tanto que la LN promedio de los eleuteroembriones fue de 1.9 ± 0.16 mm, en tanto que la supervivencia de las larvas al día siete después de la eclosión fue del 50% y al noveno día la mortalidad fue 100% (Tabla 1).
Descripción de eleuteroembriones y larvas
El análisis de comparación entre grupos con la prueba de t de Student, mostró diferencias significativas (p < 0.05), de igual manera el porcentaje de eclosión entre grupos con la prueba de Chi2, registró diferencias significativas. Mientras que el análisis del porcentaje de supervivencia de las larvas entre los grupos, no fue diferente, debido a que se tuvo la misma supervivencia del 50% al séptimo día después de la eclosión en ambos grupos de larvas (Tabla 1).
Los principales cambios morfológicos registrados durante la ontogenia inicial del sargo fueron: el primer DDE los embriones con LN promedio de 1 650 ± 25 µm, tuvieron saco vitelino con volumen promedio de 243.1 ± 16.5 nL y gota de aceite con diámetro de 203.5 ± 16.5 µm, al día dos DDE se observó en la mayoría de los eleuteroembriones el inicio de la reabsorción del saco vitelino, con LN de 2 162.5 ± 43.3 µm, al tercer DDE la pigmentación de los ojos se completó, las larvas presentan una LN de 2 443.8 ± 51.5 µm, al cuarto DDE se tuvo la abertura de la boca y ano, comenzando la mayoría de las larvas la alimentación exógena, con LN de 2475 ± 20.4 µm, al quinto DDE se agotó el saco vitelino y la gota de aceite, se observó el desarrollo de aletas pectorales sin radios, las larvas presentan una LN de 2 471.9 ± 41.3 µm , al sexto DDE se observó el inicio del patrón de pigmentación característico de la especie con la presencia de melanóforos dendríticos en cabeza, ano y línea ventral, LN de 2 568.8 ± 65.7 µm, en el séptimo y octavo DDE no se observaron cambios aparentes, solo incremento en longitud, al noveno DDE, algunas larvas inician el estadio de preflexión, con la aparición de aletas pectorales con radios, y LN de 2 741.3 ± 23.9 µm (Tabla 2 y Figura 3).
Tabla 2: Longitud de la notocorda (LN) registrada durante la ontogenia inicial de sargo (A. probatocephalus), día después de la eclosión (DEE), N (tamaño de la muestra)
| Día | N | LN (µm) | Evento |
|---|---|---|---|
| 0 | 30 | 817.3 ± 20.9 | Desove |
| 1 | 30 | 1 650 ± 25 | Eclosión |
| 2 | 20 | 2 162.5 ± 43.3 | Inicia reabsorción de saco vitelino |
| 3 | 20 | 2 443.8 ± 51.5 | Se completa la pigmentación de los ojos |
| 4 | 20 | 2 475.0 ± 20.4 | Abertura de boca y ano, comienza alimentación exógena |
| 5 | 15 | 2 471.9 ± 41.3 | Agotamiento de saco vitelino y gota de aceite, desarrollo de aletas pectorales sin radios |
| 6 | 15 | 2 568.8 ± 65.7 | Melanóforos dendríticos visibles en cabeza, ano y línea ventral, que marcan la pigmentación específica |
| 9 | 15 | 2 741.3 ± 23.9 | Inicia preflexión, aletas pectorales con radios |
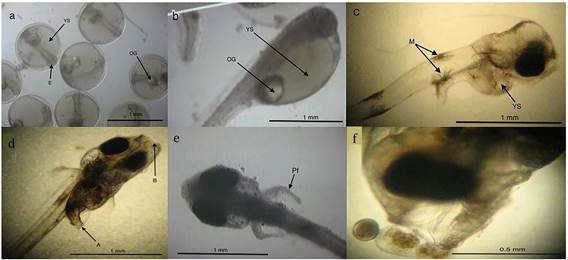
Figura 3: Principales cambios morfológicos registrados en la ontogenia inicial de larvas de sargo (A. probatocephalus): (a) Huevos antes de la eclosión, se observa el embrión (E), el saco vitelino (YS) y la única gota de aceite (OG); (b) eleuteroembrión recién eclosionado (1 DDE), se señala el prominente saco vitelino (YS) y la gota de aceite (OG); (c) larva de 3 DDE, se observa la reabsorción parcial de saco vitelino (YS) y melanóforos dendríticos visibles (M); (d) larva de 4 DDE con boca (M) y ano (A) abiertos; (e) larva en preflexión a los 9 DDE, se observan las aletas pélvicas con radios (Pf); (f) parte anterior de larva y rotífero (R), microfotografías 4x.
Discusión
El lote de peces acondicionados en cautiverio tuvo a los 12 meses un peso promedio de 720 ± 50 g, peso mayor al registrado por Tucker (1998, 2004), quien reportó un peso promedio de 480 g en 12 meses de cultivo. Se tuvo un incremento en peso de 1.97 ± 0.4 g d-1, que es similar a lo reportado por Tucker (2004), cuando alimentó un lote de sargos con alimento comercial de trucha. Hay registros de que la tasa de crecimiento de los peces se modifica por factores como la temperatura, la densidad de organismos, el porcentaje de alimentación y el tipo de alimento (Lahti y Lower 2000, Wang et al. 2000). El sargo alcanzó mayor tamaño en el mismo periodo de tiempo, debido probablemente a la naturaleza de la dieta suministrada, así como al efecto de la temperatura promedio anual de la zona de estudio, la cual es mayor que la registrada por Tucker (1998).
La maduración sexual y desove de los organismos en cautiverio ocurre en el mes de enero, y en el lote de organismos silvestres en el mes de febrero, lo que coincide con lo reportado por Mc Donough et al. (2011) quienes señalan que esta especie se reproduce de enero a abril. La mayoría de los organismos maduraron sexualmente al año de su aclimatación en cautiverio, a diferencia de lo reportado por Tucker (1998, 2004) y Wenner (2004), quienes señalan que lo hacen a los dos años. Mientras que Tucker y Barbera (1987), obtuvieron la madurez sexual, de algunos machos de un lote de sargos en cautiverio por un año, en condiciones de cultivo similares a las del presente estudio. Lo que se puede deber a que la dieta suministrada, cubrió los requerimientos nutricionales de los reproductores, lo que permitió la maduración sexual y desove, debido a que contiene ingredientes, reconocidos como componentes importantes en dietas de maduración empleadas en varias especies de peces marinos (Watanabe y Vassallo-Agius 2003). Por lo que se considera que estos ingredientes influyeron en la fecundidad de los peces, en la cantidad de huevos viables, en la reducción de anormalidades en huevos y embriones, así como en la tasa de eclosión, por los beneficios de su composición en ácidos grasos, nivel proteico, buena digestibilidad y a su contenido de fosfolípidos y colesterol (Fernández-Palacios et al. 1997, Watanabe y Vassallo-Agius 2003).
Al comparar las dosis empleadas de la hormona gonadotropina coriónica humana (HGCH), por otros autores para inducir al desove de otras especies de peces de la familia Sparidae, la hormona homologa de la gonadotropina coriónica y sérica empleada en el presente estudio, varía de 100 a 250 UI kg-1 en la dorada Sparus aurata (Colombo et al. 1989), hasta 1 000 a 2 000 UI kg-1 en el sargo (Tucker y Barbera 1987, Tucker 1998), quienes sugieren dos aplicaciones vía intramuscular de 1 000 UI kg-1, separadas de 24 a 36 h, entre cada aplicación, logrando la ovulación de 24 a 76 h después de la inyección de la hormona. La inducción al desove en ambos lotes de sargos en el presente estudio, con 500 UI kg-1 de la hormona gonadotropina coriónica y sérica a dosis menor que la recomendada, indujo dos desoves. Mientras que los peces acondicionados al cautiverio desovaron a las 48 h posteriores a la inyección y los peces silvestres a las 76 h, diferencias que se pueden deber al estrés provocado en la captura, traslado y manejo en los organismos silvestres.
El promedio del diámetro del ovocito maduro fue de 420 µm ± 35, valores que son ligeramente mayores a lo reportado por Tucker y Barbera (1987). Lo que indujo al desove y producción de huevos viables, con mayor frecuencia de desoves parciales (de cuatro a cinco) post-inyección, que los reportados por Tucker (1998, 2004). Pero con menor cantidad de huevos viables y de desoves parciales en el desove de los organismos silvestres, que en el lote de organismos acondicionados al cautiverio, lo que se puede deber al estrés de captura y traslado, ya que se tienen registros que señalan, que dicha condición puede provocar en las hembras un retardo en la maduración del ovocito, vitelogénesis incompleta, inhibición de la ovulación y puesta, lo que causa atresia folicular acelerada y en los machos inhibe la producción de esperma y disminuye la fluidez del semen (Goos y Casten 2002, Castranova et al. 2005). Estos efectos e intensidad pueden variar con la especie, el estado de maduración y el grado de tolerancia al estrés (Schreck et al. 2001).
La calidad de los huevos en el desove es la habilidad del huevo para fertilizarse y desarrollar un embrión normal (Bobe y Labbé 2010). Aunque las tasas de fertilización y eclosión son los indicadores más utilizados en la evaluación de los desoves, otros parámetros como la morfología del huevo, diámetro, distribución de sus gotas de aceite, anormalidad de los blastómeros, tamaño de las larvas, volumen del saco vitelino y deformidad larval, también pueden considerarse indicadores confiables de la evaluación (Lahnsteiner y Patarnello 2005, Rideout et al. 2005). En ambos desoves del presente estudio se consideran de buena calidad, en base a los criterios descritos con anterioridad. Los huevos y larvas obtenidos del desove de los reproductores silvestres tuvieron mayor tamaño que los de los peces acondicionados en cautiverio; con tallas promedio registradas son similares a las reportado por Tucker y Alshuth (1997). Esta diferencia puede deberse a que, en los peces acondicionados a cautiverio, era su primer desove, y para los peces silvestres por las tallas y pesos que presentaron posiblemente fuera su segunda o tercera época de reproducción, al respecto se reporta relación positiva entre el tamaño y la edad de las hembras y sus huevos, así como con la calidad del desove (Faulk y Holt 2008, Quintero et al. 2009). Las mejores tasas de fecundación, eclosión y tamaño de huevos, se tiene con hembras de mediana edad (Trippel 1998, Lame y Rajasilta 1999). En algunas especies se ha demostrado que el diámetro del huevo aumenta con la edad de los reproductores, por lo que, huevos más grandes, producen por lo general larvas más grandes, con mayor cantidad de nutrientes de reserva (Kennedy et al. 2007), como lo observado en el desove de los organismos silvestres.
La mayor mortalidad en las larvas de peces marinos se presenta durante los primeros días de vida (Tucker 1998, Álvarez-Lajonchére y Hernández 1991), lo que tiene que ver con el tamaño del alimento vivo suministrado y con el valor nutricional del mismo. La eficiencia alimenticia de las larvas es afectada por factores bióticos como la densidad de la presa y su distribución, el tamaño, la movilidad, el color, el tamaño del depredador, el tamaño de la boca, así como el grado de desarrollo del sistema visual y del tubo digestivo (Seiffer et al. 2001, Zavala-Leal et al. 2013). El efecto de estos factores en la sobrevivencia, indica que el tamaño de la presa y el tamaño de la boca de las larvas, fueron los que más influyeron, ya que aunque, tradicionalmente las larvas de peces marinos son alimentadas inicialmente con el rotífero Brachionus plicatilis morfotipo S o pequeño (Prieto et al. 2006), en el presente estudio, fueron alimentadas con el morfotipo L (232-300 µm), que es más grande que la boca de las larvas de sargo, lo que provocó que su supervivencia al séptimo DDE fuera del 50%, y al día nueve DDE las larvas de ambos desoves, presentaron una mortalidad del 100%, por inanición. Se desconocía al momento de administrar el primer alimento vivo el tamaño de la boca de las larvas, por lo que se dio por sentado que podrían alimentarse de forma adecuada con el rotífero suministrado, lo que no ocurrió. Al respecto Tucker y Barbera (1987) reportaron una supervivencia al séptimo DDE del 62% y Tucker y Alshuth (1997) del 40% a los 10 DDE, alimentando larvas de sargo con B. plicatilis morfotipo S, por lo que se tiene que revisar el esquema de alimentación para la obtención de mejores resultados en la supervivencia de las larvas.
Conclusiones
El lote de juveniles se acondicionó al cautiverio, maduró sexualmente y se reprodujo, tanto el lote de organismos acondicionados como silvestres respondieron de forma satisfactoria a la inducción al desove con la hormona gonadotropina coriónica y sérica; con dos desoves con buenos resultados. Los huevos y larvas de los reproductores silvestres pre-sentaron mayor talla; pero las tasas de sobrevivencia fueron iguales para ambos lotes de larvas. Fue posible la reproducción en cautiverio de esta especie, lo que permitirá la producción de crías para su futuro aprovechamiento.











 nueva página del texto (beta)
nueva página del texto (beta)


