INTRODUCCIÓN
Macrobrachium tenellum (Smith 1971) es un langostino que desde hace décadas ha sido objeto de pesca artesanal y de subsistencia en poblaciones cercanas a ríos y zonas costeras de México, El Salvador, Guatemala y otros países donde se desarrolla (Cabrera 1983). En la naturaleza se encuentra en altas densidades, no es agresivo y puede tolerar las variaciones ambientales (Ponce-Palafox et al. 2013). Siendo una de esas variables la temperatura, factor que afecta a los sistemas biológicos en distintos niveles de organización (Johnston y Bennett 1996), factor que dentro de ciertos valores favorece la producción, pero en valores por arriba del óptimo térmico, afecta la salud de los organismos, la demanda de oxígeno y favorece la proliferación, invasión y virulencia de patógenos (Wedemeyer et al. 1999). Desde otra perspectiva, la temperatura juega un papel importante en el establecimiento de los límites de distribución y la supervivencia (Chown 2001). El intervalo de temperaturas preferencia les es una respuesta específica de cada especie, la cual puede variar con la etapa del ciclo de vida, la disponibilidad de alimento, la estacionalidad, la condición patológica, la competencia ecológica, la calidad del agua y la intensidad lumínica (Healy y Schulte 2003). La vulnerabilidad a la temperatura depende de los límites térmicos de los organismos y de su capacidad de aclimatación, la cual se desconoce para la mayoría de las especies (Vinagre et al. 2016). La descripción de las condiciones óptimas de los organismos, es indispensables para su mantenimiento en cautiverio, sobre todo si los requerimientos cambian con la edad (Lagerspetz y Vainio 2006).
La tolerancia térmica se puede determinar estableciendo los límites térmicos críticos máximos (TC max ) y mínimos (TC min ), aumentando o disminuyendo la temperatura de forma gradual hasta llegar a la temperatura en donde se expresen fallas fisiológicas, como la pérdida del equilibrio y espasmos musculares (Terblanche et al. 2007, Díaz et al. 2007). Este método requiere pocos animales, es rápido y sus resultados son comparables en condiciones naturales (Mora y Maya 2006). En este tipo de bioensayos, también se observa la aparición de metabolismo anaerobio, el cual es consecuencia del desequilibrio en la demanda de oxígeno y la capacidad para tomarlo (Frederich y Pörtner 2000). La termotolerancia pude representarse por medio de un polígono térmico, que es una representación gráfica que delimita el nicho térmico de los organismos (Eme y Bennett 2009). Provee ideas importantes de la ecología y la distribución de los organismos y sirve para identificar las tácticas de supervivencia relacionadas con la temperatura, cuantifica el nicho térmico de especies en peligro y ayuda a determinar los óptimos térmicos para su cultivo (Reyes et al. 2011, Madeira et al. 2012).
El consumo de oxígeno es una respuesta fisiológica que se puede correlacionar con las variaciones de los factores ambientales, por lo que la tasa respiratoria, medida en términos de consumo de oxígeno es un indicador de la estimación de la tasa metabólica de crustáceos (Valdez et al. 2008). Uno de los criterios más importantes para determinar el potencial acuícola de una especie es que debe tener una amplia tolerancia a los cambios de temperatura. Por lo anterior, el objetivo del presente trabajo fue determinar la termorregulación, la tolerancia térmica y la respuesta metabólica de adultos de Macrobrachium tenellum aclimatados a diferentes temperaturas.
MATERIALES Y MÉTODOS
Se colectaron con atarrayas y redes cónicas de mano, 200 organismos de Macrobrachium tenellum en canales de riego para agricultura del municipio de Guasave, Sinaloa (25° 24' 12.50" LN y 108° 27' 28.07" LO). Los cuales se trasladaron al laboratorio de acuicultura de la Universidad de Occidente, Unidad Los Mochis, para su aclimatación se mantuvieron a temperatura ambiente por 15 d en un tanque de 5000 L. Todos los días se les proporcionó alimento para camarón (Rangen, 35% PC) y filete de tilapia fresca (Oreochromis aureus) ad libitum a las 10 y 16 h; las heces, exhuvias y el alimento no consumido se removieron por las mañanas mediante sifoneo, se recuperó los niveles de agua y se proporcionó aireación de forma constante. Cada tercer día se realizó el recambio del 25% del volumen total de agua, después de la pre-aclimatación se efectuó una biometría preliminar para seleccionar 60 organismos con peso promedio de 21.3 ± 1.23 g.
Se utilizó un diseño completamente al azar, colocando tres especímenes por acuario de 60 L, a los que se aplicaron las temperaturas de 20, 23, 26, 29 y 32 oC, las cuales se encuentran dentro del intervalo natural de variación anual en la región. La aireación se proporcionó de forma constante (>5 mg02L-1), y se midió con un oxímetro YSI 55. Como alimento se administró filete de tilapia (O. aureus) todos los días a las 10 y 16 h, proporcionando el 10% de su biomasa. Todos los días se recuperaron los niveles de agua y cada tercer día se realizó el recambio del 25% del volumen total de agua. Para mantener la temperatura estable se utilizaron calentadores automáticos de 300 W (Biopro ± 1 °C), con excepción de la temperatura de 20 oC, la cual se mantuvo con clima ambiental artificial, la temperatura en cada acuario se midió con un termómetro de mercurio convencional, cada tratamiento se realizó por duplicado, las condiciones de aclimatación se mantuvieron durante 30 d (Manush et al. 2004).
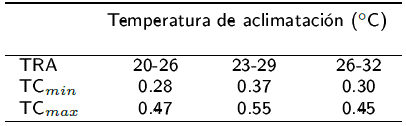
El preferendum térmico de los langostinos se calculó por el método agudo, descrito por Reynolds y Casterlin (1979), se utilizó un gradiente térmico horizontal como el descrito por Díaz et al. (2006), que consta de un tubo de PVC hidráulico de 300 cm de longitud y 20 cm de diámetro con 20 segmentos de 15 cm de longitud cada uno. La profundidad de la columna de agua fue de 12 cm y el gradiente se formó al colocar dos calentadores de 300 W en uno de los extremos del gradiente, mientras que en el extremo opuesto se introdujo hielo en recipientes herméticos. El gradiente tuvo un intervalo de temperatura de 11 a 37 °C (±1.5 °C). En cada segmento se colocó una piedra aireadora para mantener una concentración de oxígeno disuelto de 5 a 9 mg02L-1 (YSI-55 ±0.1 °C) y evitar la estratificación térmica de la columna de agua, la temperatura se midió en cada segmento con termómetros de mercurio (-20 a 100 oC). Se utilizaron tres organismos en cada condición experimental, los cuales fueron colocados de forma individual en el segmento con la temperatura similar a la de aclimatación. La ubicación de cada organismo y temperatura de cada cámara se registraron cada 10 min durante 2 h, cada organismo se consideró como una réplica (N = 15). El preferendum final se determinó gráficamente (Reynolds y Casterling 1979), por medio de la intersección de las temperaturas preferidas por los organismos provenientes de cada temperatura de aclimatación (y = a + bx).
Para el cálculo de las temperaturas criticas máximas (TC max ), se utilizaron tres organismos (N = 15) provenientes de cada temperatura de aclimatación (20, 23, 26, 29 y 32 oC), los cuales se colocaron de uno a la vez en acuarios de 24 x 12 x 12" (45 L), que tenían una resistencia eléctrica de 900 W (Steren®, WL-1300) y una bomba sumergible (MagiDeal Ac 110v-5w) para recircular el agua y mantener la temperatura homogénea, los langostinos se colocaron 30 min antes de dar inicio al experimento para disminuir el estrés por manejo (Díaz et al. 2002, Pérez et al. 2003). Para luego incrementar la temperatura del agua a una tasa de 1 °C m-1 hasta observar la perdida de equilibrio (PE) (Re et al. 2005), e inmediatamente tomar nota de la temperatura a la cual se observó la respuesta. Los langostinos se depositaron de nuevo en la temperatura de aclimatación. De la misma forma, para la temperatura critica mínima (TC min ) se colocaron los langostinos en un cilindro de malla rígida de 15 cm de largo y 10 cm de diámetro, en el gradiente térmico horizontal en el segmento similar a la temperatura de aclimatación y se disminuyó 1 oC m-1, hasta observar la PE, tomando nota de la temperatura, para luego devolver al langostino a la temperatura de aclimatación. El polígono de tolerancia térmica se elaboró a partir de la unión de las medias de los límites críticos térmicos máximos y mínimos (TC max y TC min ). La tasa de respuesta de aclimatación (TRA) se obtuvo con los datos obtenidos de TC max y TC min divididos entre la temperatura de aclimatación (Claussen 1977).
Se tomaron tres organismos de cada condición experimental (N = 15), y se colocaron de forma individual en matraces kitazato de 1L que funcionaron como cámaras respirométricas, en un sistema respirométrico semiabierto (Figura 1). Una cámara vacía se utilizó como control para corregir el consumo de oxígeno ocasionado por microorganismos presentes en el sistema. Los langostinos no se alimentaron 24 h antes de iniciar la determinación. El flujo del agua permaneció abierto por 2 h en la cámara respirométrica (Pérez et al. 2003), para determinar la concentración de oxígeno inicial, luego se cerró el flujo por 1 h para evitar que la concentración disminuyera al 30%, y se convirtiera en un factor de estrés (Stern et al. 1984). Para luego tomar una muestra de agua a la que se le determinó la concentración final de oxígeno disuelto. Las mediciones se realizaron a intervalos de una hora entre las 9 y 13 h, realizando las mediciones por duplicado.

Figura 1 Sistema respirométrico semiabierto. A) Piedras aireadoras, B) Calentadores automáticos (Biopro ± 0.5 oC , 300 W), C) Cámaras respirométricas 1 L, D) Globo, E) Válvula de desahogo, F) Reservorio de agua, G) Bomba periférica (0.5 HP-Truper® y H) Bomba sumergible (Evans 30 W®).
La concentración inicial y final de oxígeno disuelto se realizó con un oxímetro YSI 52 (Yellow Spring Instruments) provisto de un sensor polarográfico con precisión de ±0.03 mL-1. El consumo de oxígeno se calculó como la diferencia entre la concentración inicial y final de cada cámara en cada temperatura de aclimatación, expresándose como mg O2kg-1h-1, con la formula siguiente (Cerezo et al. 2006, Zheng et al. 2008): TCO = (C t - C 0)V/(W x T). Donde: C t es el cambio en la concentración de oxígeno en la cámara antes y después de la prueba, C 0 es la diferencia en oxígeno en la cámara blanco (control), V es el volumen de la cámara, W es el peso del langostino en kg, T es el tiempo en horas, y TCO es la tasa de consumo de oxígeno.
Se aplicaron pruebas de normalidad (Shapiro-Wilk, p > 0.05) y homogeneidad de varianza (p > 0.05) a los de datos, mientras que a las variables no paramétricos se les aplicó la prueba Kruskal-Wallis (p < 0.05), a los resultados con diferencias estadísticas significativas se realizó un análisis de comparaciones múltiples post hoc de Student Newman Keuls (p < 0.05, van-Emden 2008), los datos se graficaron en cajas en paralelo, los análisis se realizaron con el software Sigma plot v.12.5.
RESULTADOS Y DISCUSIÓN
Se calculó un intervalo de temperaturas preferidas de 26.03 a 28.05 oC (Tabla 1), con preferendum térmico final de los adultos de M. tenellum de 26.5 oC (Figura 2), el cual es menor a 28.5 oC y 32.2 oC reportados por Hernández et al. (1995) para juveniles y Flores et al. (2012) para postlarvas de la misma especie. Lo que concuerda con la tercera hipótesis de Giattina y Garton (1982) quienes indican que la temperatura preferida puede reflejar el óptimo térmico para que se realicen de forma adecuada los procesos fisiológicos. Al respecto, Wedemeyer et al. (1999) mencionan que la preferencia térmica es una respuesta especie-específica que puede variar con el tiempo de aclimatación, la edad, el peso, la alimentación, la calidad del agua, la intensidad luminosa y por factores como la competencia y la presencia de patógenos. De acuerdo con Díaz et al. (2015) la temperatura preferida optimiza los procesos fisiológicos y bioquímicos para su máxima eficiencia. Las diferencias con otros trabajos se deben posiblemente a los requerimientos fisiológicos específicos de la edad. Sobre la preferencia térmica González et al. (2010) encontraron que adultos de Litopenaeus vannamei tienen una preferencia térmica de 26.2 oC, valor que es menor que la encontrada reportada en postlarvas y juveniles de 29 a 30 oC por Díaz y Bückle (1993). Posiblemente la mayor temperatura afecte la salud de los gametos, ocasionando malformaciones de espermatozoides y menor supervivencia. No se encontró relación entre la aclimatación y las preferencias térmicas, pero el efecto de las temperaturas de aclimatación sobre las preferencias térmicas varía entre ectotermos acuáticos (Reiser et al. 2014). Al respecto, Flores et al. (2012) reportan diferencias significativa entre la temperatura de aclimatación y las preferencias térmicas, de postlarvas y juveniles de M. tenellum.
Tabla 1 Temperatura Crítica Mínima, Máxima y temperatura preferida en adultos de Macrobrachium tenellum aclimatados a diferentes temperatura (letras distintas indican diferencias estadísticas significativas; Media ± E.S.; Student Newman Keuls, p < 0.05).

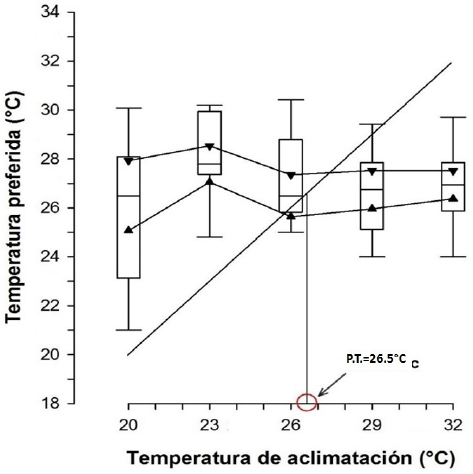
Figura 2 Preferencia térmica en adultos de Macrobrachium tenellum aclimatados a diferentes temperaturas. La zona bordeada por los triángulos representa el 95% del intervalo de confianza de la mediana. Las líneas y barras verticales representan los cuartiles (Kruskall Wallis, p> 0.05).
La temperatura máxima se incrementó con la temperatura de aclimatación de 20 a 32 oC, con diferencias estadísticas entre las temperaturas (SNK, p < 0.05). En la Temperatura mínima se observó un incremento a partir de la temperatura de aclimatación, con diferencias estadísticas (p < 0.05). El polígono de tolerancia térmica alcanzó un área de 331 oC (Figura 3). Los valores de TRA para los organismos expuestos a la TC max y TC min tuvieron un intervalo de 0.28 a 0.37 y de 0.45 a 0.55, con promedio de 0.32 y 0.49, respectivamente (Tabla 2). La amplitud de la zona de tolerancia térmica de una especie puede variar con la etapa de desarrollo, edad o dentro de la misma etapa de desarrollo debido a la plasticidad fenotípica (Bowler y Terblanche 2008). Los polígonos de termotolerancia ayudan en la identificación de estos intervalos, su utilidad radica en que se puede usar como índice, para comparar la termotolerancia para la misma especie en diferentes lugares, o en distintas etapas de su ciclo de vida, lo que resulta en amplitud del rango de distribución, valores óptimos para la misma especie en diferentes lugares, o en distintas etapas de su ciclo de vida, lo que resulta en amplitud del rango de distribución, valores óptimos para su cultivo ( Pörtner y Knust 2007, Pörtner y Farrell 2008). Se encontró un valor de 331 oC2, al respecto mientras Manush et al. (2004) en adultos y juveniles de M. rosenbergii reportaron áreas de 334 oC2 y 318 oC2, respectivamente, mientras que Díaz et al. (2002) reportan 286 oC2 para M. acanthurus. Mientras que Kumlu et al. (2010) obtuvieron para postlarvas de Litopenaeus vannamei un polígono de termotolerancia de 435 oC2.

Figura 3 Polígono de termotolerancia de adultos de Macrobrachium tenellum; área total 331 oC2. En TC max y TC min letras distintas indican diferencias estadísticas significativas (Media ± E.S.; Student Newman Keuls, p < 0.05), también se muestra el modelo de regresión lineal simple de la TC max y TC min en función de la temperatura de aclimatación.
La TRA se utiliza como índice de la magnitud de aclimatación térmica (Claussen 1977), en adultos de M. tenellum se encontraron valores de 0.28 a 0.37, al respecto Díaz et al. (1998) indican que el valor TRA depende del gradiente de temperatura geográfica. La TRA de los crustáceos sugiere que las especies que normalmente habitan en las regiones tropicales y subtropicales, tienen mayores valores de TRA (Hernández et al. 2006, Kir y Kumlu 2008, Noyola et al. 2016). En diversos trabajos se ha encontrado que las especies que viven en regiones frías y templadas que experimentan cambios graduales de temperatura a largo plazo tienen el tiempo para hacer los ajustes metabólicos sin cambios sustanciales en sus rangos de tolerancia (Díaz et al. 2002). Por el contrario, especies tropicales y subtropicales como los langostinos experimentan mayores fluctuaciones de temperatura durante cortos periodos de tiempo y deben tener amplios intervalos de tolerancia para sobrevivir a los cambios relativamente rápidos de la temperatura del agua. Esta respuesta es típica de ectotermos acuáticos como lo mencionaron Díaz et al. (2002, 2004) y Re et al. (2005, 2006). El papel de la temperatura en los procesos biológicos responde en los indicadores de bienestar como la locomoción, crecimiento y reproducción (Angilletta et al. 2002), y efecto en la distribución y abundancia de las especies (Schulte 2015).
La tasa de consumo de oxígeno presentó diferencias estadísticas (SNK, p < 0.05) entre las distintas temperaturas de aclimatación, pero no se encontraron diferencia entre las temperaturas de 26 y 29 oC (Figura 4). Un estudio sobre el consumo de oxígeno puede proporcionar información valiosa de los verdaderos requisitos de los langostinos (Niu et al. 2003). El consumo de oxígeno y su difusión por medio de la ventilación y la circulación es una habilidad cuya eficiencia depende de la especie, la identificación de las necesidades dentro de los intervalos de termotolerancia y óptimos, proporcionaran los valores ideales para su desarrollo (Pörtner 2002). Dentro de la gama de temperaturas en que esto ocurre, la respiración y la asimilación de nutrientes son las ideales para el crecimiento y supervivencia (Giomi y Pörtner 2013). El aumento de consumo de oxígeno en función de la temperatura indica la necesidad de oxígeno (Schulte 2015). No se observó disminución en el consumo de oxígeno en función de la temperatura, lo que se pudo deber a que las TC max son mayores que la mayor de aclimatación. La tasa de consumo de oxígeno de 123.5688 mgO2kg-1h-1 en la temperatura cercana a la preferida (26.5 oC) es importante para proporcionar la concentración adecuada de oxígeno de los langostinos. Las temperaturas de aclimatación no tuvieron efecto sobre las preferencias térmicas.
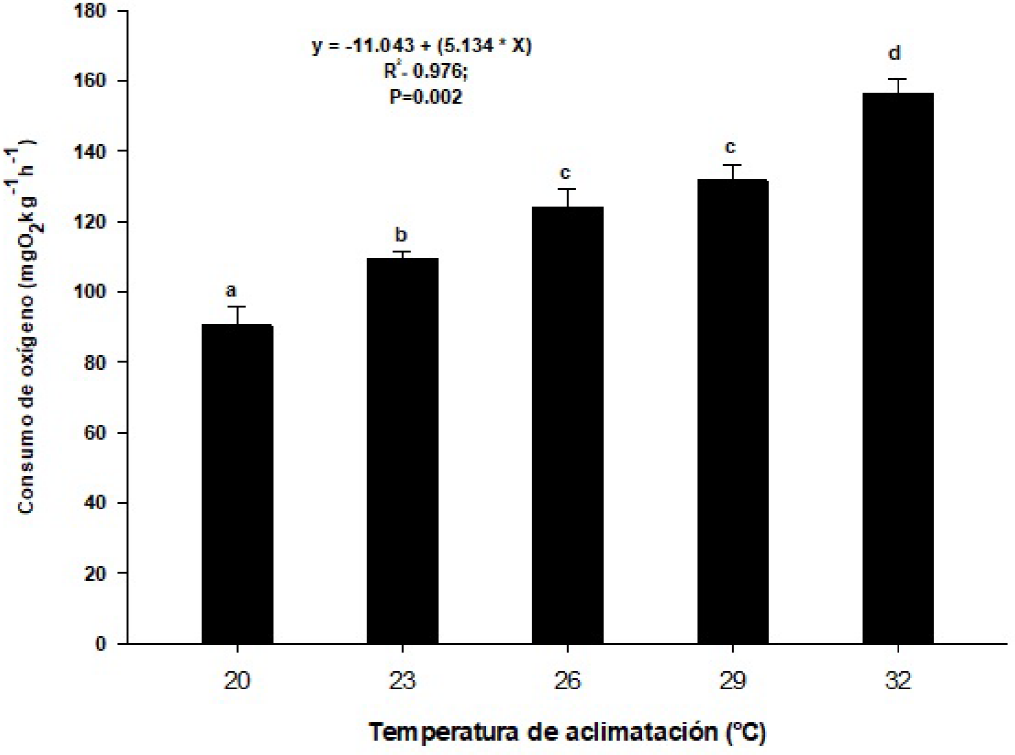
Figura 4 Tasa de consumo de oxígeno (mgO2kg-1h-1) de adultos de Macrobrachium tenellum aclimatados a cinco temperaturas. Letras distintas indican diferencias estadísticas significativas (Media ± E.S.; Student Newman Keuls, p < 0.05).
La temperatura preferida de los adultos de M. tenellum fue de 26.5 oC y el área del polígono de termotolerancia fue de 331 oC2, lo que indica que es una especie euriterma.











 nueva página del texto (beta)
nueva página del texto (beta)