INTRODUCCIÓN
En las últimas décadas se ha presentado un crecimiento acelerado de la acuicultura, debido a que se reconoce como actividad productora de proteína de origen animal (Tacón et al. 2011). La FAO reporta que hay alrededor de 580 especies acuícolas cultivadas de forma controlada a nivel mundial. Entre ellas se encuentran 362 peces de escama, 104 moluscos, 62 crustáceos, seis ranas y reptiles, nueve invertebrados acuáticos y 37 plantas acuáticas. La gran mayoría de las especies utilizadas con fines de acuicultura son exóticas o introducidas, que presentan facilidad en su manejo, adaptabilidad y buenos índices de crecimiento (FAO 2016). Pero no se contempla que estas especies pueden ocasionar alteraciones en los ecosistemas, y provocar desplazamiento de especies nativas (Okolodkov et al. 2007).
En México se realizan estudios para determinar los requerimientos nutricionales óptimos de distintas especies nativas, para desarrollar su potencial de cultivo, entre estas se encuentran el abulón rojo (Haliotis rufescens), atún rojo del Atlántico, (Thunnus thynnus), ostra de Cortéz (Crassostrea corteziensis), totoaba (Totoaba macdonaldi), lenguado de California (Paralichthys californicus), lenguado del mar de Cortéz (Paralichthys aestuarius) y la corvina del Golfo (Cynoscion othonopterus), todos de origen marino (González-Félix et al. 2014, Pérez-Velázquez et al. 2015). Pero el estudio de la nutrición de peces nativos es relativamente nuevo en términos del conocimiento acumulado con otras especies. Actualmente parte de los estudios nutricionales en peces nativos se dirigen a la evaluación de la proteína y los lípidos contenidos en la dieta, y su relación con el crecimiento, reproducción y mantenimiento, para mejorar la producción económica (González-Félix et al. 2014).
El dormilón gordo del Pacífico, chopopo, chame, puyeque o popoyote (Dormitator latifrons Richardson, 1844) es un pez originario de climas tropicales y subtropicales, con preferencia por aguas con temperaturas entre 21 y 30 °C, tiene la capacidad de tolerar aguas salobres y concentraciones de oxígeno bajas de hasta 0.4 mg L-1 (Castro-Rivera et al. 2005, López-López et al. 2015). Su distribución abarca desde el sur de California (EUA) hasta Perú, siendo las ciénegas uno de sus principales hábitats (FAO 2010). Este pez tiene importancia comercial en la región sur y sureste de México, principalmente en las costas de Guerrero y Oaxaca donde se utiliza para consumo humano, mientras que en el centro del país se comercializa su filete (Larumbe 2002). En Ecuador es de gran importancia económica para las comunidades costeras, donde se cultiva de forma artesanal para consumo y exportación (Freire-Lascano 2013). Debido a la falta de información sobre los requerimientos nutricionales de esta especie, el objetivo fue determinar los requerimientos de proteína y lípidos de juveniles de D. latifrons mantenidos bajo condiciones controladas.
MATERIALES Y MÉTODOS
El estudio se realizó en la Universidad de Guadalajara en el Centro Universitario de la Costa en las instalaciones del laboratorio de Calidad de Agua y Acuicultura Experimental en Puerto Vallarta, Jalisco, México. Para lo que se colectaron 200 juveniles de D. latifrons, de la laguna el Quelele en Nayarit, México. Los peces se trasladaron al laboratorio en donde se pusieron en tratamiento químico preventivo con triclorfón (Neguvon, Bayer®) a concentración de 0.3 ppm, para eliminar la posible presencia de parásitos internos y externos (Vega-Villasante et al. 2017). Los peces se mantuvieron en cuarentena por 15 d, en los que se suministró alimento formulado con 30% de proteína y 8% de lípidos (Purina®), a las 9:00 y 17:00 h.
Se elaboraron cuatro dietas experimentales a base de harina y aceite de pescado con 30 y 40% de proteína cruda y, 8 y 16% de lípidos, respectivamente (Tabla 1). Los insumos se pesaron en una báscula analítica (Nimbus®), con precisión de ± 0.1 g, posteriormente se mezclaron con una maquina mezcladora (Blazer®, modelo 810), para tener una pasta homogénea, luego la pasta se pasó a un molino de carne (Torrey® modelo M-12-F5) para obtener pellets de un diámetro aproximado de 3 mm. El material resultante se secó una estufa de convección (NOVATECH®) a o80 C por 24 h, para luego almacenarlo a -20 oC, hasta su uso.
Tabla 1 Ingredientes, composición próxima, coeficiente de digestibilidad de las cuatro dietas experimentales que contienen diferentes niveles de proteína cruda y grasa cruda utilizada para alimentar a juveniles D. latifrons.
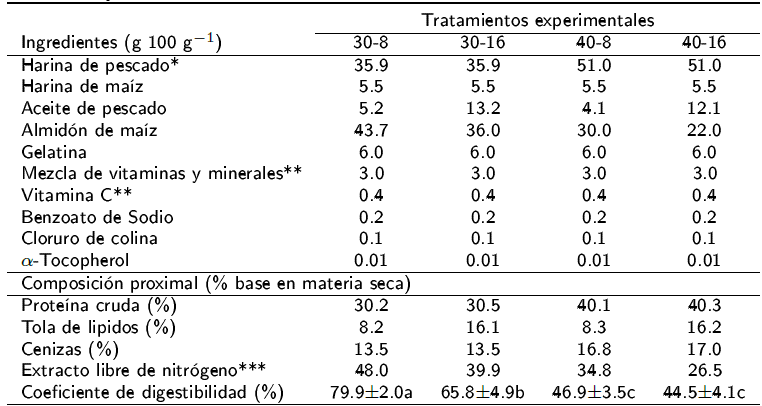
Los valores se expresan como media y (±) SD, (n = 3), los valores dentro de la misma fila con diferentes letras sobrescritas significan diferencias significativas (p < 0.05).
El sistema experimental consistió de 12 reservorios de 350 L de capacidad, conectados con un sistema de recirculación (sistema de biofiltración y lámpara de luz UV), para mantener la calidad del agua. El experimento tuvo una duración de 60 d, cada uno de los tratamientos experimentales se realizó por triplicado y se colocaron 10 organismos por unidad experimental. La temperatura se mantuvo a 29.02 ±1.0 oC con ayuda de calentadores con termostato. Se tomaron muestras de agua una vez por semana para determinar la concentración de amoniaco, nitritos, nitratos y pH (fotómetro YSI 9500®). El oxígeno disuelto y la temperatura se registró con un oxímetro (YSI 550A®). Al inicio del experimento los peces se alimentaron con una ración equivalente al 8% de su biomasa inicial. Cada 15 d los peces se pesaron en (g) y medieron en mm. Los reservónos se limpiaron todos los días y se registró la supervivencia durante los 60 d del experimento. Los peces se alimentaron a las 9:00, 14:00 y 18:00 todos los días hasta saciedad.
Para evaluar el crecimiento se calculó la ganancia en peso (GP%):
Tasa especifica de crecimiento (TEC):
El Coeficiente termal de crecimiento (CTC) se calculó con la formula:
donde T oC = 29 y D días = 60.
Se realizó el análisis proximal de las cuatro dietas experimentales y de la zona dorsal (músculo) de los organismos al inicio y al final del experimento. Para los análisis proximales se capturaron tres peces por unidad experimental de forma aleatoria y se sacrificaron mediante un shock térmico (descenso de temperatura con agua y hielo ) para evitar el estrés (Diaz-Villanueva y Robotham 2015). Todos los análisis se realizaron por triplicado.
La determinación de humedad, proteína total, grasa total y cenizas de los alimentos y del músculo se realizaron siguiendo los protocolos de la AOAC (1995). Los músculos de tres peces de cada unidad experimental se mezclaron para los análisis. La determinación de humedad se realizó por diferencia gravimétrica, pesando 1.0 g de muestra, para luego secarlo en una estufa a 100 oC, hasta peso constante. La determinación del contenido de proteína cruda se realizó con el método de micro Kjeldahl y se multiplico por el factor de 6.25. El contenido de lípidos se determinó con el método de extracción de Soxhlet con la ayuda de hexano como solución extractora. Las cenizas se determinaron por calcinación de una muestra en una mufla a 550 oC por 6 h. La determinación del extracto libre de nitrógeno se calculó por la diferencia de la materia seca con la formula ELN = 100 - (% proteína cruda + % lípidos totales + % de cenizas.
Para determinar la digestibilidad de las dietas, se colectaron heces de las unidades experimentales por 10 d, con ayuda de un colector de heces. Una vez colectadas las heces se mantuvieron en recipientes plásticos en congelación a -20 oC, para su posterior análisis. La determinación del coeficiente de digestibilidad aparente (CDA) de los nutrientes del alimento, se realizó con la determinación de cenizas insolubles en ácido del alimento y de las heces, con el método propuesto por Tejada-de Hernández (1992) modificado por Montaño-Varga s et al. (2002).
Las cenizas insolubles en ácidos (CIA) se determinaron con la siguiente fórmula.
La digestibilidad aparente (DA) se determinó con la fórmula.
Para determinar las diferencias estadísticas entre los tratamientos, se realizó una prueba de homogeneidad entre las repeticiones de los datos y después se realizó un análisis de varianza de una vía (ANOVA). El nivel de significación se estableció con una p < 0.05. Cuando se detectaron diferencias estadísticas, se utilizó una prueba post hoc de Tukey para identificar las diferencias estadísticas entre los tratamientos. Los análisis se realizaron con el programa estadístico Statistica versión 6.1.
RESULTADOS Y DISCUSIÓN
No se encontraron diferencias estadísticas para la ganancia de peso de juveniles de D. latifrons en los distintos niveles de proteína y lípidos en la dieta (Tabla 2). Lo indica que con 30% de proteína y 8% de lípidos es suficiente para producir un adecuado crecimiento, lo que demuestra que los peces alimentados con dietas bajas en proteínas utilizaron con mayor eficiencia la proteína dietética, en comparación con aquellos alimentados con dietas altas de proteínas y lípidos. Estos resultados permiten el diseño de dietas para esta especie con menores niveles de inclusión de insumos con alto precio en el mercado, en particular la proteína, o el uso de alimentos comerciales de menor costo. En la nutrición acuícola la alimentación es uno de los factores de mayor atención, debido a que llega a representar más del 50% de los costos de producción, debido a la falta de insumos y el encarecimiento de los ingredientes utilizados (Tacón et al. 2011, NRC 2011).
Tabla 2 Índices biológicos de juveniles de D. latifrons alimentados con cuatro dietas experimentales con diferentes niveles de proteínas y lípidos.
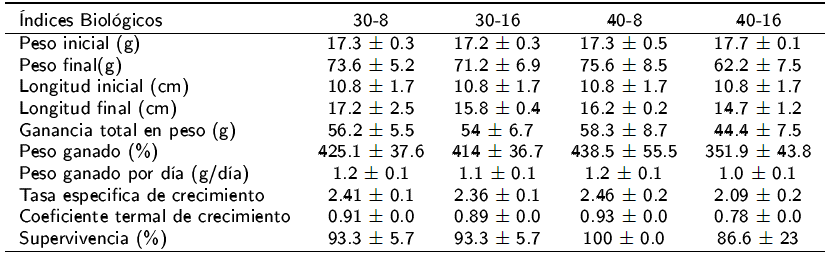
Los índices biológicos se calcularon a partir de 60 d de experimentación.
Se sabe que el alimento tiene efecto en el crecimiento de los peces, pero depende de la especie, hábitos alimenticios, talla, edad, condición fiiologica y de las condiciones físicas y químicas del agua de mantenimiento (Phillips et al. 1998). Pero para D. latifrons no hay estudios publicados sobre nutrición que permitan ser utilizados para establecer condiciones básicas para su mantenimiento en confinamiento, ni estudios sobre su fisiología. Al respecto Yañez-Arencibia y Díaz González (1977) mencionan que esta especie es consumidora de detritos y restos de plantas. Mientras que Castro-Rivera et al. (2005) abordan la conversión alimenticia por medio del crecimiento de cultivos puros de machos, hembras y mixtos, con alimentos comerciales con porcentajes de proteían y lípidos de 30 y 5%, respectivamente.
Estudios en juveniles de tilapia roja híbrida (Oreochromis mossambicus y O. niloticus) alimentados con 15, 20 y 30% de proteína y 6, 12, 18, 24% de lípidos, indican que los mejores resultados de crecimiento lo tuvieron las dietas que contenían la mayor inclusión de lípidos (18%), sin importar el nivel de proteína (De Silva et al. 1991). Mientras que para Carassius auratus (Cyprinidae) se reporta un mejor crecimiento con dietas que contenían 40 y 45% de proteína y 8% lípidos, mientras que dietas con menor cantidad de proteína y lípidos tuvieron un bajo crecimiento (Castillo et al. 2014). Para especies carnívoras marinas se reporta que juveniles de Totoaba (Totoaba macdonaldi) se tuvo el mejor crecimiento con la dieta que contenía 52% de proteína y 8% de lípidos (Rueda-López et al. 2011). Para la corvina Golfina (Cynoscion othonopterus) se encontró que el mejor tratamiento fue con la dieta que contenía 40% de proteína y 8% de lípidos (Pérez-Velázquez et al. 2015). Los resultados demuestran que no es posible adaptar a cualquier especie las dietas diseñadas para una especie en particular, debido a que los requerimientos de los nutrientes pueden diferir de manera importante. Las altas concentraciones de proteínas y lípidos en una dieta, no necesariamente resultan en mayor crecimiento y estado de salud de los peces, ya que se ha demostrado que en algunos casos los altos niveles de proteína y lípidos pueden limitar la regeneración muscular (Rueda-López et al. 2011), piel, células sanguíneas y enzimas, lo que ocasiona obesidad o infiltración grasa del hígado (Wang et al. 2013). Lo que incrementa la susceptibilidad a enfermedades, pérdida de pigmentación y erosión en las aletas (Riaño-Castillo et al. 2014).
La composición proximal del músculo inicial y final, después de 60 d, fue similar en los cuatro tratamientos (Tabla 3), lo que indica que a pesar de las mayores concentraciones de nutrientes, estos no llegan a metabolizarse para favorecer el desarrollo tisular, lo que prueba que hay un rango óptimo para la utilización de proteínas y lípidos. La digestibilidad aparente tuvo diferencias estadísticas con valores del 44.4 al 77.9%, presentando la mayor digestibilidad la dieta con 30 y 8% de proteína y lípidos, respectivamente (Tabla 1). Al respecto Pezzato et al. (2002), mencionan que variaciones en la composición lipídica de la dieta, pueden originar diferencias en la digestibilidad.
Tabla 3 Análisis proximal de tejido muscular de juveniles de D. latifrons alimentados con cuatro dietas experimentales que contienen diferentes niveles de proteínas y lípidos.
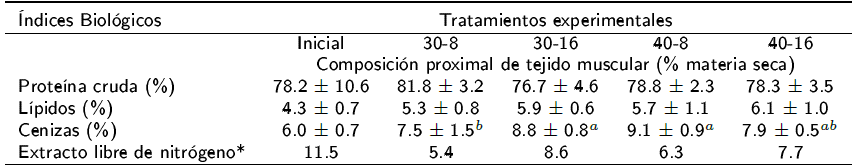
Los valores se dan como media y (±) SD, n = 3, los valores dentro de la misma fila con diferentes letras significan diferencias significativas (p < 0.05), *Extracto libre de nitrógeno = 100 - (% de proteína cruda + lípido total + % de ceniza).
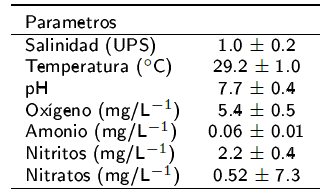
En el periodo de cuarentena se observó que los peces tuvieron una rápida adaptación al alimento comercial, consumiendo alimento extruido flotante y peletizado. Con relación a los parámetros fisicoquímicos del agua (Tabla 4), se registraron valores de temperatura que concuerdan con las temperaturas preferentes de la especie, de entre 21 y 30 oC (FAO 2010). D. latifrons, no mostró diferencias estadísticas en crecimiento, ni supervivencia con dietas que contiene inclusiones del 30 y 40% de proteína y del 8 al 16% de grasa. De acuerdo con los resultados obtenidos una dieta con 30% de proteína y 8% de lípidos puede ser suficiente para promover un adecuado crecimiento. Estos resultados son los primeros obtenidos para esta especie con interés potencial para su cultivo.











 nueva página del texto (beta)
nueva página del texto (beta)