INTRODUCCIÓN
El ácaro rojo de las palmas Raoiella indica Hirst fue reportado por primera vez en el continente americano en el 2004, en la isla Martinica (Flechtmann y Etienne 2004). A pesar de las medidas cuarentenarias establecidas, se dispersó en las otras islas del Caribe y América Latina (Rodrigues et al. 2007, Kane et al. 2012). El ácaro causa daños en cultivos de importancia económica, como el cocotero (Cocos nucífera L.), bananos y plátanos (Musa spp.), palma de aceite (Elaeis guineensis Jacq.) y varias especies de palmas ornamentales y heliconias (Carrillo et al. 2012). En México se detectó por primera vez en el 2009 en los municipios de Benito Juárez e Isla Mujeres, Quintana Roo (NAPPO 2009), por lo que el Servicio Nacional de Sanidad, Inocuidad y Calidad Agroalimentaria, a partir de abril de 2010, implemento la campaña contra el ácaro rojo, cuyo objetivo fue evitar que la plaga ocasione daños de importancia económica en unidades de producción agrícola (SENASICA 2017). En el 2016, el gobierno federal aplicó un presupuesto de 19.06 millones de pesos para la campaña contra el ácaro rojo en los estados de Campeche, Chiapas, Colima, Guerrero, Jalisco, Michoacán, Nayarit, Oaxaca, Quintana Roo, Sinaloa, Tabasco, Veracruz y Yucatán. Esta campaña fitosanitaria se enfoca en la detección y manejo de brotes poblacionales de R. indica, mediante la aplicación periódica de acaricidas y podas sanitarias del material vegetativo infestado. Recomendando los acaricidas abamectina, spirodiclofen y azufre elemental, autorizados de forma temporal por la Comisión Federal para la Protección contra Riesgos Sanitarios (COFEPRIS) (SENASICA 2015).
El control químico de los ácaros es crucial en los programas de manejo integrado de plagas a nivel mundial y es poco probable que se elimine (Van Leeuwen et al. 2015); debido a que sirve para controlar brotes poblacionales (Fountain et al. 2010) o mitigar su dispersión (De Assis et al. 2013). Los ácaros incluyen especies con altas tasas de reproducción y ciclos de vida cortos (Van Leeuwen et al. 2010), lo que incrementa su potencial para desarrollar resistencia a los acaricidas (Whalon et al. 2008). La recomendación para manejar la resistencia contempla acciones como alternancia, secuenciación, rotación y uso de mezclas de compuestos con mecanismos de acción diferentes (Marcic 2012). Por lo que el desafío principal que enfrenta el control químico efectivo es reconocer la efectividad biológica de los acaricidas bajo condiciones locales para diversificar el mecanismo de mortalidad de la plaga (Whalon et al. 2008). Debido a que el uso de un ingrediente activo único para el control de plagas propicia la resistencia acelerada (Whalon et al. 2008). Por lo anterior el objetivo del presente trabajo fue comparar la efectividad biológica de 19 acaricidas para el control de R. indica en plantas de cocotero híbrido (Alto del Pacífico x Enano Malayo) en Tabasco, México.
MATERIALES Y MÉTODOS
Sitio experimental
El experimento se realizó en la ranchería Chipilinar 2 da Sección, municipio de Jalapa, Tabasco (17° 47.614' LN y 92° 47.764' LO) durante la época de secas que abarca de marzo a mayo, que se caracteriza por temperaturas altas y lluvias escasas (Larios-Romero y Hernández 1987). Estas condiciones ambientales favorecen el incremento poblacional de R. indica en sus plantas hospederas (Polanco-Arjona et al. 2017).
Infestación del material vegetal
Se adquirieron 80 plantas de cocotero híbrido (Alto del Pacífico x Enano Malayo) de 18 meses de edad, en el vivero Hacienda Campo Real del municipio de Comalcalco, Tabasco. Las plantas se trasladaron al sitio experimental, donde por seis meses se les proporcionó riegos y fertilización química a dosis de 50 g de superfosfato triple por planta. La infestación experimental de R. indica en cada planta, se realizó de forma dirigida a los foliolos de la parte media de cuatro frondas, localizadas en la parte media del estrato arbóreo. En cada planta, se realizaron cuatro infestaciones a intervalos de dos semanas, del 16 de marzo al 27 de abril de 2016. En cada infestación, se colocaron 10 secciones de foliolo infestados por colonias de R. indica, sujetándolos a la superficie abaxial de los foliolos a infestar con clips, para permitir el establecimiento y colonización de los ácaros. La longitud de cada sección foliar infestante varió de 5 a 10 cm, dependiendo de la densidad de colonias de ácaros, con la finalidad de uniformizar la cantidad de ácaros colocados por fronda. El material biológico se obtuvo de plantas de cocotero híbrido infestadas de forma natural por R. indica y sin antecedentes de tratamiento químico, localizadas en las inmediaciones del sitio experimental.
Diseño experimental
El experimento se estructuró bajo un diseño de bloques completos al azar con cuatro repeticiones. La unidad experimental consistió de una planta de cocotero infestada previamente por R. indica. Un día antes de la aplicación de los tratamientos, se realizó el muestreo del número de ácaros adultos de R. indica por foliolo por planta, tomando una muestra aleatoria de cuatro foliolos por planta, localizados en la parte media de las frondas del estrato arbóreo medio. De acuerdo con Roda et al. (2012), este tipo de muestreo aleatorio estratificado proporciona buena estimación de la densidad poblacional de R. indica en plantas de cocotero. El conteo de ácaros se realizó con una lupa de 20X dirigida a la superficie abaxial de los foliolos seleccionados. Estos foliolos se etiquetaron para evaluaciones subsecuentes después de la aplicación de los tratamientos. De acuerdo con el número promedio de ácaros adultos encontrados por foliolo por planta, se formaron cuatro bloques de 20 plantas: el primer bloque de 69 a 113 ácaros adultos, el segundo de 124 a 162, el tercero de 179 a 239 y el cuarto de 254 a 739.
Evaluación de tratamientos
Se evaluaron 19 tratamientos (Tabla 1) correspondientes a los acaricidas comerciales, los cuales se agrupan en 15 grupos toxicológicos diferentes de acuerdo con la clasificación del Comité de Acción de Resistencia a los Insecticidas (IRAC) (Sparks y Nauen 2015). Son productos químicos para uso agrícola y control de diferentes especies de ácaros fitófagos de frutales, hortalizas y ornamentales; todos con registro vigente en la Comisión Federal para la Protección contra Riesgos Sanitarios (COFEPRIS 2015). Las dosis y frecuencias de aplicación se manejaron de acuerdo con las instrucciones de uso del producto. La aplicación de los acaricidas se realizó por aspersión manual con un atomizador con capacidad de 2 L (Marca Flo Master®), con una presión de salida de 1.1 Kg cm2 y un gasto de 50 ml de solución por planta. Para evitar la contaminación por deriva, cada planta se asperjó por separado dentro de una estructura de plástico de 3 x 4 x 4 m de alto, largo y ancho. Luego de la aplicación, las plantas se colocaron a distancia de 3 x 3 m entre sí. En el tratamiento testigo se aplicó agua con pH de 6.5, misma que se empleó para preparar las soluciones acaricidas.
Tabla 1 Características de los acaricidas comerciales evaluados contra Raoiella indica en Tabasco, México.
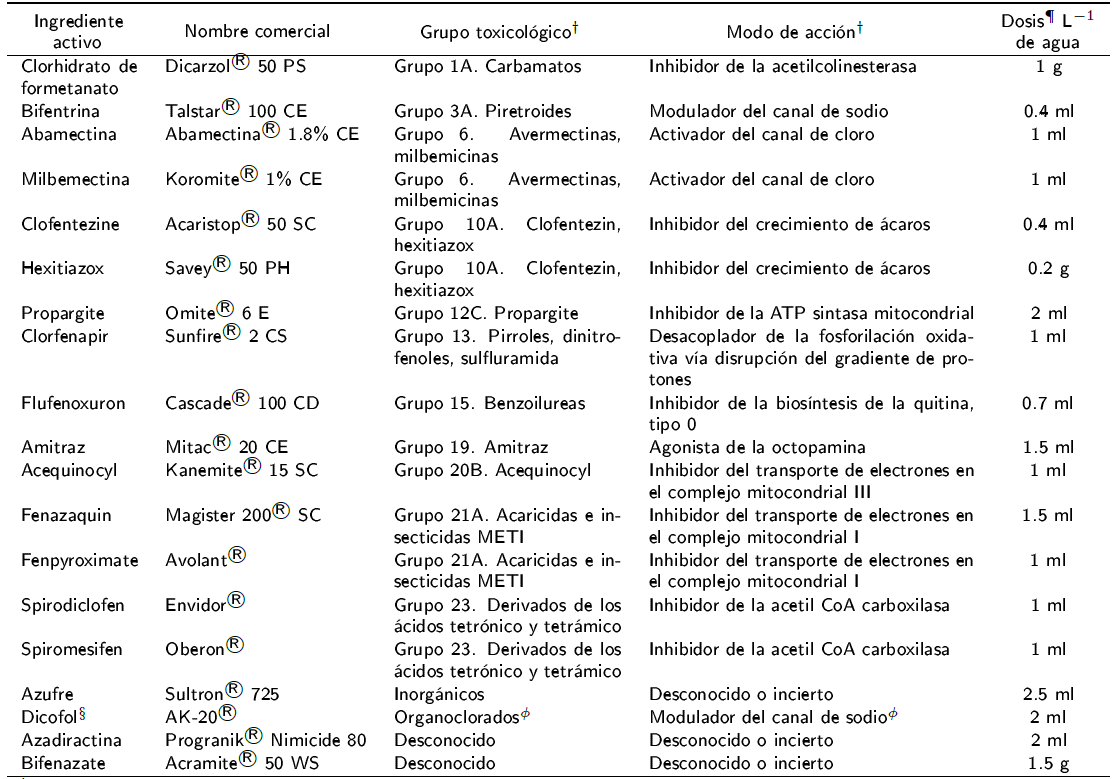
† Comité de Acción de Resistencia a los Insecticidas (IRAC) (Sparks y Nauen 2015).
¶ Dosis de aplicación recomendado por el fabricante. De acuerdo con las instrucciones de uso, el tratamiento con azadiractina se repitió a los 7 y 14 días después de la primera aplicación, y el tratamiento con fenazaquin se repitió a los 10 y 20 días después.
§ Uso restringido (COFEPRIS 2015).
La efectividad biológica de los acaricidas se valoró mediante el conteo de los ácaros adultos que permanecieron vivos a los 2, 7, 14 y 21 d después de la aplicación de los tratamientos. Los datos de evaluación se obtuvieron de cuatro foliolos por planta, provenientes de cuatro plantas por tratamiento, mismos que se evaluaron y etiquetaron antes de la aplicación del acaricida. Se consideraron como ácaros vivos aquellos ejemplares que mostraron movimientos al perturbarse por 5 s con un pincel No. 000 (Helle y Overmeer 1985).
Análisis estadístico
Se realizó un análisis de varianza por fecha de evaluación. El número de ácaros adultos vivos
encontrados a los 2, 7, 14 y 21 d después de la aplicación de los tratamientos,
se transformó a porcentajes con respecto al valor inicial de ácaros registrados
antes de la aplicación. Previo al análisis de varianza, los porcentajes se
convirtieron a valores arcoseno
RESULTADOS Y DISCUSIÓN
Previo a la aplicación de los acaricidas, la densidad promedio de ácaros vivos encontrados en las unidades experimentales fueron estadísticamente iguales entre sí (p = 0.18) (Tabla 2). Se observaron diferencias estadísticas entre acaricidas (p < 0.05), indicando la prueba de Tukey que cinco acaricidas proporcionaron los mejores porcentajes de control a los dos días de la aplicación, los cuales fueron bifentrina con 95.2% de efectividad, bifenazate con 87.5%, acequinocyl con 86.6%, spiromesifen con 83.7% y amitraz con 81.8%. Además de estos productos químicos, los acaricidas fenpyroximate, clorfenapir, azufre, clohidrato de formetanato, milbemectina, propargite y fenazaquin tuvieron una efectividad de control del ácaro entre el 95 y 100% a los siete días después de la aplicación. Mientras que los productos de menor efectividad fueron spiridiclofen y hexitiazox. Cabe mencionar, que la sola aplicación de agua corriente (tratamiento testigo) afectó de forma negativa la presencia de R. indica.
Tabla 2 Efectividad biológica de acaricidas en poblaciones de Raoiella indica en plantas de cocotero híbrido (Alto del Pacífico x Enano Malayo) en Tabasco, México.
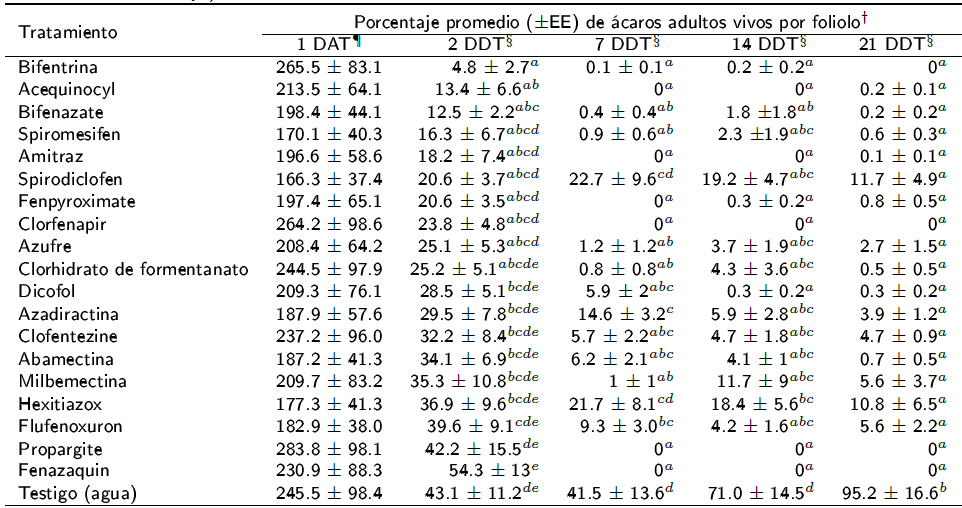
† Basado en un área foliar de 70 cm2. DAT días antes del tratamiento. DDT días después del tratamiento. ¶ Promedios estadísticamente iguales con respecto al testigo (p = 0.18). § Promedios seguidos por letras diferentes son significativamente diferentes (Tukey, p ≤ 0.05). Los datos originales fueron transformados a
En general, a los 21 d después de la aplicación, todos los productos acaricidas evaluados mostraron potencial para utilizarse en el control de R. indica, proporcionando opciones para un programa de control químico en plantaciones de cocotero. Los estudios previos sobre este tema son escasos, pero de acuerdo con Rodrigues y Peña (2012), los acaricidas acequinocyl, milbemectina y spiromesifen también son efectivos para reducir poblaciones de R. indica en plantaciones de cocotero; mientras que las aspersiones de abamectina, milbemectina y azufre fueron efectivos en plantaciones de cocotero y bananas. En bioensayos de laboratorio, con adultos de R. indica a la concentración letal al 90% (CL90) los acaricidas milbemectina, abamectina y fenpyroximate fueron más tóxicos que spiromesifen, clorfenapir y hexitiaxox (De Asiss et al. 2013). Bajo la misma metodología de evaluación, con adultos de R. indica en Tabasco, México, los acaricidas fenazaquim, milbemectina, abamectina y dicofol fueron más tóxicos que propargite, clorhidrato de formetanato, azufre y bifentrina (Sánchez-Vázquez et al. 2017). En general, los acaricidas que comparativamente fueron más tóxicos para los adultos de R. indica en condiciones de laboratorio (CL90) (Sánchez-Vázquez et al. 2017), no fueron los más efectivos en campo. Lo anterior, se puede deber a que la efectividad biológica en condiciones de campo no corresponde al comportamiento toxicológico observado bajo condiciones de laboratorio, ya que la determinación de laboratorio no considera las pérdidas por arrastre, fotodescomposición, termorregulación, escape del organismo, entre otros factores (Lagunes-Tejeda et al. 2009). En México, el uso de los acaricidas abamectina, azufre y spiridiclofen están autorizados de forma temporal para su uso en la campaña fitosanitaria contra R. indica (SENASICA 2015), los cuales mostraron una efectividad del 94, 99 y 77%, respectivamente, a los 7 d después del tratamiento.
El control químico de ácaros fitófagos es problemático, debido al alto potencial de desarrollo de resistencia (Whalon et al. 2008). En particular, el ácaro rojo R. indica tiene un ciclo de desarrollo corto y fecundidad alta con reproducción sexual y asexual por partenogénesis arrenotóquica (Nageshachandra y Channabasavanna 1984, González y Ramos 2010); características biológicas que pueden acelerar el desarrollo de la resistencia en un corto plazo (Whalon et al. 2008). De acuerdo a Sawicki y Denholm (1987), el manejo de la resistencia a los plaguicidas es un conjunto de estrategias con la premisa básica de conservar la susceptibilidad a los plaguicidas, mediante uso racional y la restricción de tratamientos para prevenir la selección de individuos resistentes y, de este modo, prolongar la vida útil de los productos químicos. Por lo tanto, considerando los 12 productos acaricidas con mejor desempeño para el control químico de R. indica y de acuerdo con el orden de los grupos toxicológicos establecido por el IRAC (Sparks y Nauen 2015), se propone utilizar la secuencia siguiente: 1) clorhidrato de formetanato, 2) bifentrina, 3) milbemectina, 4) propargite, 5) clorfenapir, 6) amitraz, 7) acequinocyl, 8) bifenazate, 9) fenazaquin o fenpyroximate, 10) spiromesifen y 11) azufre elemental. En todo caso, es importante realizar una rotación o alternancia del uso de estos acaricidas para el control químico de R. indica que permitirá prolongar la vida útil de estos productos (Whalon et al. 2008). En conclusión, los acaricidas bifentrina, acequinocyl, bifenazate, spiromesifen, amitraz, fenpyroximate, clorfenapir, azufre, clorhidrato de formetanato, milbemectina, propargite y fenazaquin fueron los más efectivos, al reducir más de 95% de las poblaciones de R. indica a los siete días después de la aplicación.











 nueva página del texto (beta)
nueva página del texto (beta)


