Introducción
Un nutracéutico es cualquier sustancia alimenticia, que provea beneficios a la salud (Patil et al. 2016). Estos efectos ocurren por medio de la regulación de funciones corporales que protegen o retardan las enfermedades (Bigliardi y Galati 2013). Por el contenido de ácidos grasos y vitaminas en un alimento, que proporciona beneficios médicos o fisiológicos, se cataloga como nutracéutico (Ali et al. 2009). En años recientes, es común emplear como sinónimo de nutracéutico, el término alimento funcional (Ghosh et al. 2015).
Durante el procesamiento de los alimentos, sus componentes bioactivos son afectados. Por lo que los productos no procesados o con mínimo de procesamiento, pueden tener mejores beneficios para la salud que los procesados (Shahidi 2009). Sin embargo, la biodisponibilidad de algunos nutracéuticos lipofílicos, como los carotenoides, es baja en los alimentos crudos, debido a que se encuentran atrapados en las estructuras vegetales. Pudiendo aumentar la biodisponibilidad al procesarlos para romper de forma parcial las estructuras y facilitar la liberación de los compuestos nutracéuticos (Mc Clements et al. 2015).
Los estudios sobre sustancias nutracéuticas en microorganismos eucariontes se han realizado casi de manera exclusiva en algas y microalgas. Lo cual se debe a que éstas constituyen una fuente de compuestos con actividad biológica que se pueden utilizar como ingredientes funcionales (Barba et al. 2015). Se tienen reportes de varias algas comestibles, en los que se indican que tienen cantidades significativas de proteínas, vitaminas y minerales esenciales para la nutrición humana (Domínguez 2013). En el caso de las microalgas, su contenido de compuestos antioxidantes son los de mayor interés (Kelman et al. 2012, Gad et al. 2011). Las microalgas también se utilizan para aumentar el contenido nutricional de los alimentos (Kovac et al. 2013), como Chlorella y Tetraselmis que contienen ω-3 y ω-6 (Spolaore et al. 2006). La ingesta de ácidos grasos monoinsaturados, como el oleico, previene arritmias, reduce la presión arterial y el tiempo de coagulación. Las especies reactivas de oxígeno y los radicales libres juegan un papel importante en la arterioesclerosis, que puede ser prevenida con el consumo de antioxidantes, como las vitaminas A, C, E, ácido fólico, β-caroteno, selenio y zinc (Badimon et al. 2010). Del mismo modo, los ácidos grasos y los polifenoles tiene influencia favorable sobre los factores de riesgo de enfermedades cardiovasculares (Massaro et al. 2010).
Aunque se cuenta con fuentes alternativas para la obtención de nutracéuticos, se deben buscar nuevas opciones, como los ciliados que pueden contener compuestos antioxidantes. Los Paramecium son de las especies más dispersas en el mundo y las más fáciles de cultivar en el laboratorio, con tamaño relativamente grande, que facilita su identificación (DeLong y Vasseur 2012). A la fecha, se tienen reportadas 15 especies del complejo Paramecium aurelia, de las cuales P. primaurelia, P. biaurelia, P. tetraurelia y P. sexaurelia, como las de mayor distribución (Przybos y Surmacz 2010). Las cuales son morfológicamente idénticas, por lo que sólo pueden diferenciarse vía genética (Catania et al. 2009). En la naturaleza el protozoo se alimenta de microorganismos como las bacterias, algas y levaduras, además de materia vegetal en descomposición (Luna-Pabello 2006). Su temperatura óptima de crecimiento es de 27 a 29 oC, pero puede crecer en temperaturas de entre 5 y 40 oC, con pH entre 5.8 y 7.4, en aguas poco profundas (Przybos y Surmacz 2010, Luna-Pabello 2006), tamaño entre 125 y 150 µm de largo y de 35 a 50 µm de ancho, un macronúcleo, dos micronúcleos vesiculares e infraciliatura de 91 a 97 cinetias (Luna-Pabello 2006). Por lo anterior, el presente trabajo tuvo el objetivo de determinar el contenido de proteínas, ácidos grasos insaturados y vitaminas presentes en la biomasa de una cepa silvestre de P. aurelia.
Materiales y métodos
Identificación de la cepa de Paramecium sp.
Se aisló una cepa de Paramecium sp. procedente de agua dulce estancada en un parque de la zona sur de la Ciudad de México. Para determinar la especie se emplearon técnicas de medición y reconocimiento morfológico e infraciliatura, tinciones con azul de metileno, impregnaciones argénticas de Klein y carbonato de plata. Además de la técnica de reacción en cadena de la polimerasa (PCR), para amplificar y secuenciar el gen que codifica para el RNAr 18S. Con la información obtenida, se procedió a realizar la comparación con las secuencias de DNA disponibles en la base de datos Genbank®.
Cultivo de P. Aurelia
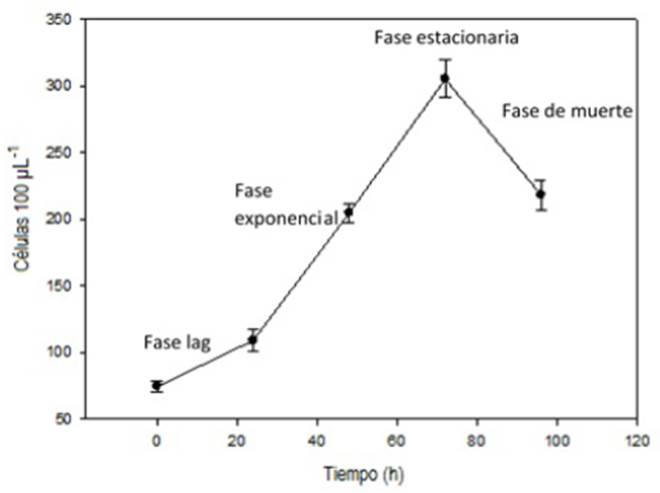
Considerando el tipo de alimento y la temperatura de crecimiento del ciliado, la cepa aislada de P. aurelia se cultivó en un bio-reactor automatizado de 3 L, marca Applikon Biotechnology modelo ADI 1010. Para lo cual se emplearon 700 mL de medio de cultivo formado por una mezcla 1:1 de infusión lechuga: trigo (Pon 1996), pH de 7.0, velocidad de agitación de 70 rpm, temperatura de 28 °C, oxígeno disuelto en concentración de 5.0 a 5.5 mg L-1 por 72 h; para alcanzar la fase estacionaria o de máxima densidad del microorganismo. De forma preliminar se realizó una curva de crecimiento del organismo para detectar la fase lag de aclimatación al medio de cultivo, la fase de crecimiento exponencial, la etapa de crecimiento continuo y la fase de muerte o decaimiento del cultivo. El crecimiento se determinó por cuenta directa de los paramecios presentes en una muestra de 0.1 mL del cultivo, que se realizó cada 24 h, con un microscopio estereoscópico (Motic SMZ-168).
Separación de la biomasa del medio de cultivo
Después del tiempo de cultivo, se centrifugó el medio de cultivo a 3 500 rpm por 7 min en una centrífuga Labnet Hermile Z400. Posteriormente, se filtró la biomasa con una membrana Millipore de 0.45 µm para eliminar el líquido del medio de cultivo. Para determinar el peso seco de la biomasa, se secó la biomasa en una estufa a 70 oC hasta alcanzar peso constante (Chinnasamy et al. 2010).
Determinación del contenido de proteína, ácidos grasos y vitaminas liposolubles
El contenido de nitrógeno total de la muestra, se determinó con el método de Kjeldahl (APHA 2012), usando el factor de 6.25 para calcular el contenido de proteína. Mientras que la determinación del contenido de los ácidos grasos de interés, se realizó con el método 34.1.08 de la AOAC (2012), para ello se pesaron 0.25 g de muestra, para luego agregar 25 mL de la mezcla de cloroformo: etanol (1:1), filtrar y evaporar el disolvente.
La preparación y determinación de los ésteres metílicos de los ácidos grasos, se realizó con el método 41.1.28 de la AOAC (2012). Agregando 2 mL de NaOH en metanol al 2 %, llevar a ebullición por 10 min y agregar 1 mL de la disolución de trifluoruro de boro en metanol 1.3 M, para llevar a ebullición por 2 min y agregar 2 mL de la disolución saturada de NaCl, y separar las fases con un embudo de separación. Al sólido que quedó, se le agregó 1 mL de hexano grado HPLC y se inyectó la muestra en un cromatógrafo de gases marca Varian modelo 3 800, con detector de ionización de flama (FID), nitrógeno como gas acarreador y una columna J&W DB-23 de 30 m de largo y 25 mm de diámetro interno, con temperatura del inyector de 250 °C y del detector de 300 °C, mientras que en el horno la temperatura varió de 140 a 230 °C, con incrementos de 10°C min-1.
El contenido de vitamina A (retinol), D3 (colecalciferol) y E (tocoferol) se determinó con los métodos 922.06, 922.04 y 922.03 (AOAC 2012). Pesando 1 g de muestra a la que se le agregaron 4 mL de KOH en etanol y agitar un minuto en un vórtex, incubar por 10 min a 58°C y dejar enfriar para agregar 400 µL de dimetilsulfóxido, para luego adicionar 5 mL de agua desionizada y 5 mL de n-hexano. La fase orgánica se separó por medio de evaporación hasta secar en atmósfera de nitrógeno a temperatura ambiente. Al sólido residual, se le adicionó 1 mL de metanol: acetonitrilo : agua (25:24:1). La muestra se inyectó en un equipo HPLC con un detector UV de 254 nm, acoplado a una columna C8 con precolumna C-8.
Análisis de datos
La identificación del microorganismo se realizó comparando las las secuencias de DNA obtenidas con las disponibles en la base de datos Genbank®, las características morfológicas se obtuvieron midiendo 30 microorganismos. Todas las determinaciones se realizaron por triplicado, los resultados se presentan como valores medios y desviación estándar.
Resultados
La secuencia amplificada en laboratorio tiene 99 % de compatibilidad con las secuencias del gen que codifica para el RNAr 18S de P. tetraurelia y de P. primaurelia. Con esta información se corrobora que el microorganismo estudiado pertenece al complejo P. aurelia. La especie de Paramecium aislado mostró una forma cilíndrica, con dimensiones de 127.2 ±10.5 µm de largo y de 36.2 ± 5.5 µm de ancho (Figura 1). En la Figura 2, se observa la curva de crecimiento de P. aurelia, donde se muestra que la fase lag ocurre en las primeras 24 h de cultivo. Posteriormente, ocurre la fase exponencial hasta las 72 h, en la cual se encuentra en la fase de crecimiento y duplicación. Al término de esta fase, inicia la fase de muerte.
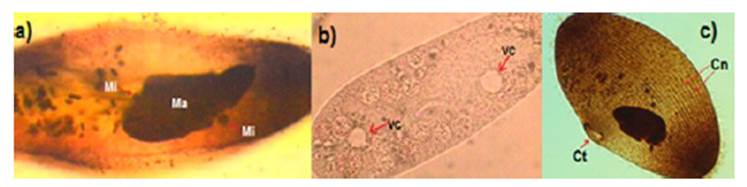
Figura 1 Morfología de P. aurelia. Ma: Macronúcleo, Mi: Micronúcleo, VC: Vacuola contráctil, Ct: Citostoma, Cn: Cinetias.
En la Tabla 1, se observa que la biomasa producida de P. aurelia es baja (74.1 mg L-1), aún y cuando la producción de biomasa se realizó en un bio-reactor controlado. Por lo que es importante efectuar estudios que permitan incrementar su densidad poblacional y la producción de biomasa. Para el contenido de humedad en la biomasa de P. Aurelia se tuvieron valores de 76 %, con contenido proteico promedio del 48.6 %.
Tabla 1 Caracterización de la biomasa de P. aurelia.
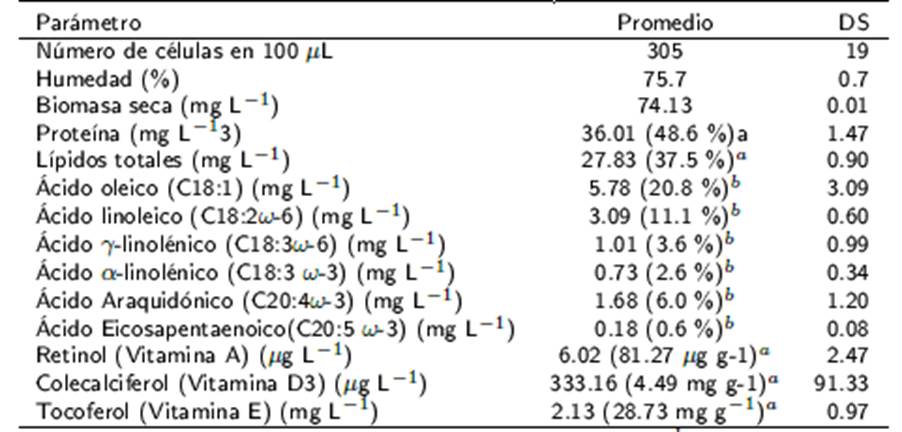
aContenido relativo porcentual (%) respecto a la biomasa seca, bContenido relativo, porcentual (%) respecto a los lípidos totales, DS desviación estándar.
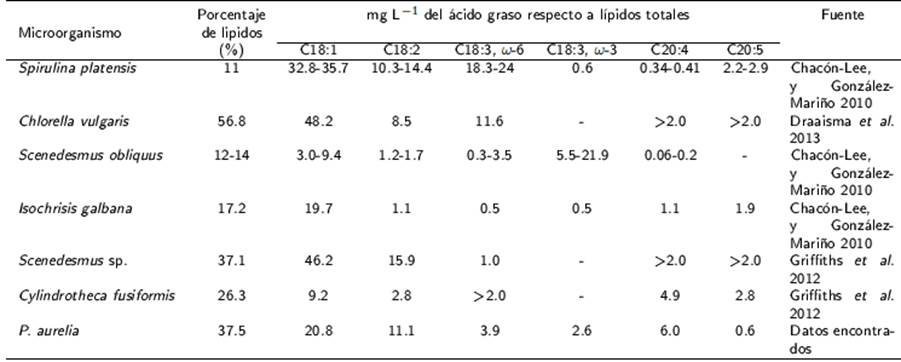
El contenido de ácidos grasos encontrados en la biomasa de P. aurelia son de tipo monoinsaturado (oleico) y poliinsaturado (linoleico, gama-linolénico y araquidónico), lo que le confiere propiedades nutracéuticas (Tabla 2). La variación entre los cultivos, aun cuando estos se realizaron bajo condiciones estandarizadas, puede atribuirse a la oxidación de los ácidos grasos por efecto del periodo de almacenamiento. Se infiere que un efecto similar ocurrió con la vitamina D3 que tiene una gran desviación estándar. Para las vitaminas (A y E) se tiene una baja desviación estándar, lo que indica una mayor capacidad para permanecer estables.
Discusión
El microorganismo estudiado pertenece a la especie P. aurelia, debido a que sus genes tiene un 99 % de compatibilidad con los genes depositados en el Genbank® para la especie, pero también las características morfológicas coinciden con las carácterísticas de P. aurelia (Luna-Pabello 2006, Przybos et al. 2008, Catania et al. 2009). En la figura 2, se observa un crecimiento exponencial típico de los protozoos, con las distintas fases en la curva de crecimiento indicadas por DeLong y Vasseur (2012), que inician con la fase de adaptación al medio de cultivo, seguido de la fase de crecimiento exponencial, finalizando con la fase de muerte.
Aunque algunas algas presentan un contenido de proteína mayor al obtenido de 48.6 %, como Scenedesmus obliquus (50-56 %), Spirulin aplatensis (63 %), Arthrospira maxima (60-71 %) (Chacón-Lee y González-Mariño 2010) y Chlorella vulgaris (55-67 %) (Christaki et al. 2011), otras tienen un contenido similar, como Chlamydomonas reindhartii (48 %) (Chacón-Lee y González-Mariño 2010) y Haematococcus pluvialis (48 %) (Christaki et al.2011), lo cual permite suponer que el contenido proteico de P. aurelia es factible de ser utilizado como suplemento. Siempre y cuando se compruebe la digestibilidad de la proteína y que no tenga toxicidad (AOAC 2012). El contenido de proteína de P. aurelia en base seca, es mayor que el contenido de la leche (26 %), carne (43 %), soya (37 %) y levadura (39 %) (Spolaore et al. 2006).
El contenido total de lípidos de P. aurelia fue de 37.5 %, valor que es menor a los 56.8 % de C. vulagris, pero similar al contenido de 37.1 % de Scenedesmus sp. y mayor al contenido de lípidos de otras algas (Tabla 2). En la biomasa de P. aurelia se encontraron los ácidos grasos oleico (C18:1), linoleico (C18:3ω-3), gama-linolénico (C18:3ω-6) y araquidónico (20:4), así como las vitaminas A, D3 y E, que son sustancias nutracéuticas.
Las algas que tienen una mayor proporción de ácido oleico son C. vulgaris (48.2 %), S. platensis (32.8 - 35.7 %), y Scenedesmus sp. (46.2 %) (Tabla 2). Sin embargo, tanto S. platensis, como Scenedesmus sp. tienen un contenido menor de lípidos que P. aurelia. En consecuencia, esta especie podría utilizarse como fuente de ácido oleico (5.7 mg L-1). Por otra parte, Scenedemus sp. es la única alga que cuenta con una proporción mayor de ácido linoleico (3.1 mg L-1). El contenido de ácido araquidónico (1.7 mg L-1) del ciliado es mayor que el contenido de otras especies de algas. Por lo que P. aurelia podría representar una fuente de ácidos grasos.
Las vitaminas contenidas en la biomasa de P. aurelia, y la proporción de tocoferol (vitamina E) de 28.73 mg g-1 es similar al que presenta Spirulina sp. (29.4 mg g-1) (Mendiola et al. 2008), pero superior al de especies como Caulerpa sertularioides (0.32 mg g-1) (Pires-Cavalcante et al. 2011), Por-phyridium cruentum (0.55 mg g-1) (Lee 2013) y Euglena gracilis (7.35 mg g-1) (Ogbonna 2009). Lo que sugiere que el ciliado es una fuente de esta vitamina. Al respecto se sabe que la ingesta diaria recomendada para hombres y mujeres es de 15 mg día-1 (DRIs 2010), por lo que se requieren 500 mg de biomasa de P. aurelia para cubrir el 100 % de la ingesta diaria de la vitamina E. El porcentaje de retinol (vitamina A) de P. aurelia de 87.21 µg g-1 es superior al contenido de Haematococcus pluvialis (0.09 µg g-1 equivalentes de retinol) y A. gracilis (70 µg g-1 equivalentes de retinol) (Bishop y Zubeck 2012, Chue et al. 2012). El colecalciferol (Vitamina D3) presente en la biomasa de P. Aurelia (4.5 x 105 µg 100 g-1), es superior al contenido encontrado en la tilapia (45.3 µg 100 g-1), el hígado de res (14.1 µg 100 g-1) y la yema de huevo (5.8 µg 100 g-1) (Schmid y Walther 2013).
Conclusiones
El contenido proteico y nutracéutico en la biomasa seca de P. aurelia, es de 48.6 % de proteína y 37.6 % de lípidos formados por los ácidos grasos insaturados oleico (20.8 %), linoleico (11.1 %), gama-linolénico (3.6 %) y araquidónico (6.0 %). Además de las vitaminas A (retinol, 81.27 µg g-1), E (tocoferol, 28.73 mg g-1) y D3 (colecalciferol, 4.49 mg g-1). La biomasa de P. Aurelia es una fuente no convencional de proteinas, ácidos grasos y vitaminas que tienen efectos nutracéuticos.











 nueva página del texto (beta)
nueva página del texto (beta)