Introducción
Los huertos familiares son asociaciones adaptadas de árboles, arbustos, cultivos herbáceos y/o animales, manejados con base en la mano de obra familiar (Galluzzi et al. 2010). Se encuentran en comunidades rurales, alcanzando su mayor biodiversidad y riqueza estructural en climas tropicales (Kumar y Nair 2004). Cumplen con un conjunto de funciones ecológicas, ya que conservan biodiversidad, promueven el reciclaje de nutrientes, evitan la erosión, generan beneficios hidrológicos, proveen nichos de aves, y crean microclimas (Gliessman 1998). Además de proveer múltiples beneficios económicos, al generar productos. Su diversidad de especies vegetales y animales permite obtener productos alimenticios para autoconsumo y venta durante todo el año, además de leña, medicinas, condimentos y ornamentos (Idohou et al. 2014). La composición de las especies en los huertos familiares tiene relación con las condiciones climáticas y edáficas, al cultivarse las especies que mejor se adaptan a ellas (Pitman y Läuchli 2002). Sin embargo, también se adaptan estas condiciones a los requerimientos de las especies, cultivando plantas en recipientes y aplicando riegos (Nakashima 2012).
El cambio climático modifica las condiciones de los suelos y clima en los huertos, particularmente en las costas, y pueden influir en la composición de especies de los huertos. Ya que el incremento del nivel del mar provoca aumento de la salinidad (Caetano et al. 2010). También el cambio climático tiende a incrementar la frecuencia e intensidad de eventos hidrometeorológicos extremos, que afectan los ecosistemas (Ortíz-Pérez et al. 2010). La salinidad del suelo afecta la capacidad de las plan- tas para absorber agua y regular su temperatura; al volver inhóspito al suelo, afecta también la distribución de las raíces, lo que ocasiona de ciencias de nutrimentos y desórdenes fisiológicos en las plantas (Xu et al. 2014).
Elevadas concentraciones de Na+ y Cl- en el suelo disminuyen las actividades de otros iones, conduciendo a desequilibrios nutricionales de Ca2+ , K+, Mg2+ y NO3-, y reducen la disponibilidad y transporte de Ca2+ a las partes en crecimiento de la planta (Kopittke et al. 2011). La salinidad elevada afecta el desarrollo de las hojas y el crecimiento del tallo (Zhu et al. 2012). Las especies toleran distintas concentraciones de sal en el entorno antes de verse afectadas de forma negativa (Chaitanya et al. 2014). La tolerancia a la salinidad se expresa en términos de biomasa relativa, esto es, la relación entre la biomasa generada a determinada concentración de sal y la biomasa generada sin salinidad: Yr = Y/Ym. Donde, Yr es la biomasa relativa, Y la biomasa obtenida con salinidad, e Ym es la biomasa obtenida sin salinidad. Mientras que Correia et al. (2010) ajustaron un modelo exponencial que relaciona la biomasa relativa del algarrobo (Ceratonia siliqua L.) con la CE del agua de riego, obteniendo la ecuación Yr = ae bEC . Donde, ECi es la CEi del agua de riego, y a y b son constantes del modelo. Mientras que Steppuhn et al. (2005a), a partir de la relación entre las concentraciones de sales y la biomasa de las especies, propusieron el índice de tolerancia de estrés (ST-Index): ST − index = ECi50(1 + b). Donde, ECi50 es la CE a la cual Y r (biomasa relativa) es igual a 0.5, y b la constante de la ecuación de Correia et al. (2010).
El objetivo fue analizar el efecto de la salinidad en la composición de especies en huertos familiares de la costa del estado de Tabasco, México, además de determinar si las tres especies más frecuentes en los huertos son tolerantes a los niveles de salinidad que se presentan en el suelo.
Materiales y Métodos
Muestreo en huertos
Se realizó un recorrido por ocho comunidades de la costa de los municipios de Paraíso (18º 16 LN 93º 32 LO), Jalpa de Méndez (18º 04 LN 93º 00 LO) y Comalcalco (18º 09 LN 93º 05 LO) (Figura 1), donde se reportan altas concentraciones de sal en el manto freático y el suelo (Caetano et al. 2010, Ortíz-Pérez et al. 2010). En los que seleccionaron 19 huertos, en los cuales se registraron los árboles y arbustos.
En cada huerto, se tomaron tres submuestras de las capas de 0 a 10,10 a 20 y 20 a 30 cm de profundidad del pedón, distribuidas sobre el área del huerto y mezcladas por cada capa en un recipiente para obtener una muestra compuesta, a finales de la temporada de lluvias (febrero y marzo), nortes (octubre, noviembre y diciembre), secas (marzo, abril y mayo) y lluvias (junio, julio, agosto y septiembre). Para lo cual se perforó el suelo con una barrena manual y se determinó la profundidad a la que se encontraba el manto freático. Las muestras de suelo se secaron en el laboratorio para luego determinar la CE en una submuestra de 12 g con el equipo multiparamétrico Hannah modelo HI 9828.
En cada huerto se registraron las especies por su nombre común; cuando se encontraron especies desconocidas, se tomaron muestras para su identificación en el herbario de la Universidad Juárez Autónoma de Tabasco y El Colegio de la Frontera Sur, Unidad San Cristóbal de las Casas. Con los registros de las especies por huerto se generó una matriz de abundancia a la que se le aplicó el análisis canónico de correspondencia (ACC), con la CE y la profundidad del manto freático como variables ambientales.
Experimento en vivero
En un vivero con cubierta de malla sombra del 50 % y plástico transparente, se realizó un experimento en el cual se aplicaba agua a distintas concentraciones de sal (NaCl) a plantas de las tres especies más frecuentes en los huertos: guanábana (Annona muricata), mango (Mangifera indica) y naranja agria (Citrus aurantium), excluyendo el coco (Cocos nucifera) por presentar alta tolerancia a la salinidad (Remison et al. 1988). Las plantas de estas especies se adquirieron en un vivero comercial, procurando que fueran vigorosas, sanas, de la misma edad (aproximadamente ocho meses), de pie franco, y cultivadas en bolsas de volumen y sustrato similar. Las bolsas con las plantas fueron colocadas sobre estructuras de metal para evitar el contacto directo con el suelo y el enraizamiento. El experimento se realizó en El Colegio de la Frontera Sur, Unidad Villahermosa, del 19 de marzo al 19 de junio del 2012, periodo similar al evaluado por Correia et al. (2010). Durante el experimento la temperatura mínima media fue de 18.1 ºC y la temperatura media máxima de 33.9 ºC (CONAGUA 2012).
Diseño experimental
En el experimento se utilizó un diseño de bloques al azar, siendo los tratamientos el agua de puri cada (testigo, CE 124 μS cm-1), 10 mmol NaCl L-1 (CE 1084 μS cm-1), 20 mmol NaCl L−1 (CE 2143 μS cm−1), 40 mmol NaCl L-1 (CE 4031 μS cm−1) y 80 mmol NaCl L-1 (CE 7631μS cm-1). Se utilizaron 25 plantas por especie en cada tratamiento, en las que se aplicaron cada tres d 300 mL de cada tratamiento.
Evaluación de variables
Se midió el crecimiento por medio de la altura de planta y el número de hojas, y la biomasa de hojas, tallos y raíces, cosechando al azar cinco plantas de cada uno de los tratamientos a los 32 d (fecha1), a los 62 d (fecha2), y a los 93 d (fecha 3) (Tabla 1). En la fecha dos, se midió la CE por duplicado en el agua sobrenadante en dos muestras compuestas del suelo de las cinco macetas cosechadas de cada tratamiento. En la fecha 3, después de secar las muestras hasta peso constante en una estufa a 60 ºC, se realizaron tres mediciones de la CE del suelo en las macetas de cada uno de los tratamientos, realizando una medición en la mitad superior del suelo de la maceta; una en la mitad inferior, y una de la mezcla de las dos partes. La CE se midió utilizando el método de conductimetría (Etchevers 1992), añadiendo agua destilada al suelo en proporción 5 : 1, para luego agitar la mezcla, dejarla reposar por 24 h y medir la CE. También se determinó el peso seco de las hojas, tallo y raíces, después de secar las plantas hasta peso constante en una estufa a 60 ºC. El peso seco total (PST) se calculó con la suma de los pesos hojas, brotes, tallos y raíces. Para luego calcular la relación del peso de las hojas con el peso total de la planta (RPH); la relación peso de los tallos con el peso total de la planta (RPT) y la relación del peso de la raíz con el peso total de la planta (RPR).
Modelo de respuesta a la salinidad y ST-Index
Se utilizó el modelo propuesto por Steppuhn et al. (2005b) para modelar la respuesta de la biomasa total de las plantas en función de la conductividad del agua de riego y determinar la tolerancia a la salinidad de las tres especies.
Análisis estadísticos
Se realizó la prueba de Shapiro-Wilk para el análisis de normalidad. En caso de normalidad, se aplicó un ANOVA de una vía, con los tratamientos de salinidad como factores y las plantas como repeticiones. Cuando el valor de F fue significativo, se aplicó la prueba HSD de Tukey para determinar diferencias significativas entre pares de tratamientos. Cuando las variables no presentaron normalidad se usaron las pruebas no-paramétricas de Kruskal-Wallis y Mann-Whitney. Después del ACC, se utilizó la prueba de permutación para determinar si el eigenvalue era significativo. Todos los análisis se realizaron en el programa PAST (Hammer et al. 2001).
Resultados
Biodiversidad y composición de especies
Las especies frutales son las más frecuentes en los huertos. La palma de coco es la más abundante, posiblemente por ser tolerante a las altas concentraciones de sal. Después de la palma de coco, las plantas más frecuentes fueron la guanábana (A. muricata), el mango (M. indica), la naranja agria (C. aurantium), el macuilis (Tabebuia rosea DC.), la guayaba (Psidium guajava L.), el limón (Citrus limon L. (Osbeck)) y la ciruela (Spondias purpurea L.). También se encuentran especies maderables, como el cedro (Cedrela odorata L.) y forrajeras como el cocoíte (Gliricidia sepium Kunth).
Variables del suelo y agua de los huertos
La CE en la capa superior del suelo mostró variación entre los huertos y las temporadas de muestreo (Figura 2). La profundidad a la cual se encontró el agua freática fue entre 1.50 y 5.83 m (Tabla 2). La mayor profundidad se observó en el mes de mayo, al final de la temporada seca, mientras que la menor profundidad fue al final de la tempo- rada de lluvias en el mes de diciembre (F = 2.922, p = 0.043, Tukey HSD, Q = 4.096, p = 0.028).
Tabla 2: Profundidad del agua freática en nortes, secas y lluvias en huertos familiares de la costa de tabasco, México.

El ACC tuvo un eigenvalue de 0.288 en el eje 1 (Figura 3). Este valor es significativo de acuerdo con la prueba de permutación (p = 0.01). Las coordenadas de los huertos sobre el eje 1 mostraron una correlación significativa con los valores de CE (Spearman rho = 0.83, p < 0.001), mientras que la correlación entre la profundidad del manto freático y las coordenadas en el eje 2 no fue significativa.
Salinidad del suelo en macetas
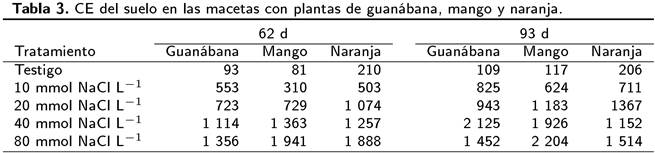
En la fecha 2 (19 de mayo), la CE de las macetas se incrementó al al aumentar la concentración de sal en el agua de riego aplicada. Esto también, se observó en mango a los 93 d después del inicio del experimento, mientras que en guanábana se presentó la mayor conductividad en donde se aplicó la concentración de sal de 40 mmol NaCl L-1. En las macetas con naranja agria se observaron los niveles más altos de CE en el tratamiento con 80 mmol NaCl L-1 y alta CE en el tratamiento con 20 mmol NaCl L-1 (Tabla 3). La CE en el suelo en la mitad superior de las macetas fue menor que en la parte inferior (Tabla 4), observándose acumulación de sal en la parte inferior.
Crecimiento y biomasa de las plantas
Las plantas de guanábana no mostraron diferencias significativas en altura entre tratamientos en la fecha 1 (F = 2.16, p = 0.078) (Tabla 5). Mientras que en la fecha 2, la altura fue mayor en el testigo que en los tratamientos con 40 y 80 mmol NaCl L-1 (F = 6.95, p = 0.000; Tukey HSD 5.70 y 6.48, p = 0.001 y 0.000, y 0.027). En la fecha 3 se tuvieron las mismas diferencias (F = 5.88, p = 0.000; Tukey HSD 4.56 y 6.06, p = 0.02 y 0.000, y 0.018). Mientras que en el mango, no se encontraron diferencias significativas en altura de planta entre tratamientos (Tabla 5).
Tabla 5 Altura y número de hojas en plantas después de iniciar los tratamientos con agua a distintas concentraciones de sal.
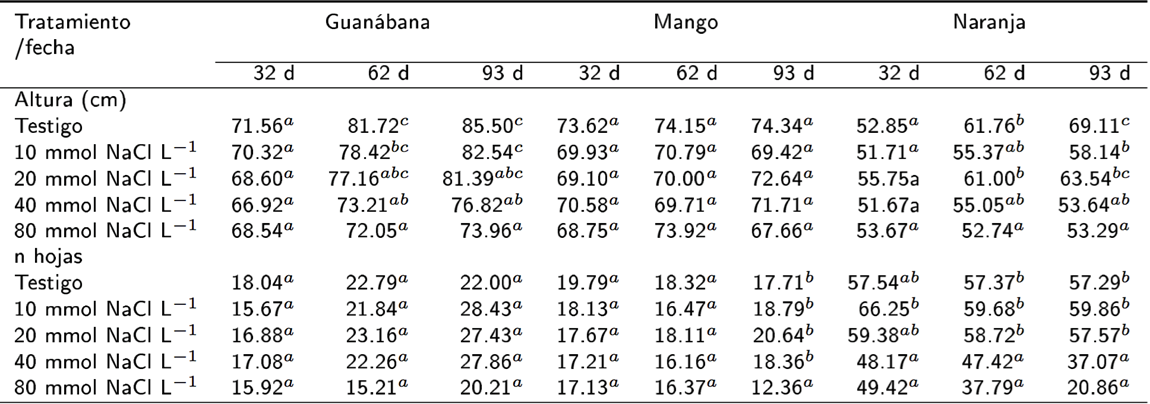
∗Medias con distinta letra difieren significativamente (Tukey HSD, P<0.05)
El número de hojas no mostró diferencias significativas entre fechas. Pero si se detectaron diferencias en la fecha 3 entre el testigo y el tratamiento con 40 mmol NaCl L-1 que tuvo el mayor número de hojas. En naranja agria, la altura de las plantas no tuvo diferencias significativas entre tratamientos en la fecha 1 (F = 1.268, p = 0.287). Mientras que en la fecha 2 las plantas fueron más altas fueron el testigo y el tratamiento con 20 mmol NaCl L-1 (F = 4.557, p = 0.002, Tukey HSD = 4.85 y 4.44, p = 0.008 y 0.019). En la fecha 3 se mantuvieron las diferencias entre el testigo, y los tratamientos con 20 mmol y 80 mmol NaCl L-1 (F = 7.216, p = 0.000, Tukey HSD = 6.28 y 4.07, p = 0.000 y 0.042), mientras que las plantas testigo fueron más altas que las plantas del tratamientos con 10 mmol y 40 mmol NaCl L-1 (Tukey HSD = 4.35 y 6.14, p = 0.025 y 0.001). El número de hojas en la fecha uno fue mayor en el tratamiento con 10 mmol NaCl L-1 que en los tratamientos con 40 mmol y 80 mmol NaCl L-1 (F=5.836,p = 0.000, Tukey HSD = 5.85 y 5.44, p = 0.001 y 0.002). Mientras que en la fecha 2, se encontraron más hojas en el testigo, que en el tratamiento con 80 mmol NaCl L-1 (F = 5.694, p = 0.000; Tukey HSD = 4.95, 5.54 y 5.30, con p = 0.006, 0.002 y 0.003). Estas diferencias estuvieron presentes en la fecha 3 (F = 12.97, p = 0.000; Tukey HSD = 7.69, 8.23 y 7.75; p = 0.000). El testigo y los tratamientos con 10 mmol y 20 mmol NaCl L-1 tuvieron más hojas que el tratamiento con 40 mmol NaCl L-1 (Tukey HSD = 4.27, 4.81 y 4.33; p = 0.029, 0.010 y 0.026) (Tabla 5). En la guanábana se observó un incremento de la fecha 1 a la 3 en el número de hojas en los tratamientos con alta CE, mientras que en naranja agria se observó una pérdida de hojas en la fecha 3 en los tratamientos con 40 y 80 mmol NaCl L-1, y en mango fue el tratamiento con 80 mmol NaCl L-1 (Tabla 5).
Biomasa
No se encontraron diferencias significativas entre los tratamientos para la biomasa de la raíz, hojas, PRH, PRR y el peso seco total en ninguna de las especies evaludas en las primeras 2 fechas. Mientras que en la fecha 3, la biomasa de la raíz de las plantas de naranja agria fue menor en el tratamiento con 80 mmol NaCl L-1 que en el tes- tigo y el tratamiento con 20 mmol NaCl L-1 (F = 5.501, p = 0004; Tukey HSD 4.737 y 6.122, p = 0.02 y 0.003). La biomasa del tallo no varió de forma significativa entre los tratamientos en las especies estudiadas. Para la naranja agria no se encontraron diferencias significativas en el peso de hojas entre tratamientos. En guanábana se observó mayor biomasa de las hojas en el testigo y en el tratamiento con 10 mmol NaCl L-1, que en los otros tratamientos (Kruskal-Wallis K 15.49, p = 0.004; Mann-Whitney, p = 0.012, p = 0.021, y p = 0.037). En mango y naranja agria hubo diferencias significativas entre tratamientos (F = 4.263, con p = 0.029 en mango; F = 3.525, con p = 0.025 en naranja agria). Sin embargo, la comparación entre pares de tratamientos no tuvo valores significativos. La biomasa total no varió entre tratamientos en guanábana y mango en la fecha 3 (F = 2.464, p = 0.078; y F = 2.58, p = 0.069). Aunque en naranja agria se encontraron diferencias significativas (F = 3.525, p = 0.025). No se encontraron diferencias significativas entre tratamientos en el peso de raíces en mango y naranja agria, ni diferencias significativas en el peso de las hojas entre especies.
Modelo
La biomasa total de las plantas en la fecha 3 se relacionó con la CE de los tratamientos mediante las siguientes ecuaciones:
Y r(guanabana)=0.9292e −0.03555*CE
Y r(mango)=1.250e −0.08973*CE
Y r(naranja)=1.0661e −0.07899*CE
Y r es la biomasa de las diferentes especies y CEi es la CE de los tratamientos. Los coeficientes de correlación (r) de los modelos fueron de 0.73, 0.99 y 0.84, para guanábana, mango y naranja agria, respectivamente. A partir de dichos modelos se in ere que la naranja agria reduce su biomasa en 50 % a una CE de 9580 μS cm−1,elmangoa10 220 μS cm-1 y la guanábana a 17 430 μS cm-1. El índice de tolerancia al estrés (ST-Index) fue de 16 810, 9 300 y 8 830 μS cm-1 para guanábana, mango y naranja agria, respectivamente.
Discusión
Salinidad y composición de las especies en los huertos de la costa del estado de Tabasco
Se observó una amplia variación en la CE en los primeros 30 cm del suelo. Los valores más altos se presentaron en un huerto cercano a la laguna Mecoacán, lo que probablemente se deba a las corrientes de agua salada que entran a la laguna. La CE en este huerto fue mayor a los 3 500 μS cm-1 al inicio de la temporada de secas, y de 2 000 μS cm-1 a nales de la época de lluvias. La CE es mayor en el suelo, debido a que la cantidad de agua en el suelo es menor que en la suspensión usada para medir la CE. Al respecto, Oosterbaan (2003) estima que la CE en el agua del suelo saturado (CE) es 10 veces la concentración medida en suspensiones 1 : 5. Por lo que suelos con CE entre 4000 y 8000 μS cm-1 se consideran como ligeramente salinos. En la Figura 2, se observa que los suelos de cuatro huertos tienen valores superiores.
En promedio, la CE fue mayor a principios de la temporada de secas y menor a finales de la época de lluvias. Esto se esperaba, debido a que el agua de lluvia, al percolarse a través del suelo, arrastra las sales al subsuelo. La variación en la CE entre huertos al inicio de la temporada de secas, puede tener relación con la textura del suelo, ya que los suelos arcillosos acumulan mayor cantidad de sal, que los suelos arenosos, al retener mayor cantidad de agua e incrementar su capacidad de intercambio catiónico (Palma y Triano 2007). En los suelos arenosos y sueltos, la capacidad de intercambio catiónico es menor, y en consecuencia el suelo re- tiene menor cantidad de iones de Na+. Aunado a ello, el agua de lluvia se drena en mayor cantidad en estos suelos por la acción de la gravedad, lixiviando las sales disueltas.
El ACC muestra relación entre la composición de especies y la conductividad del suelo. Lo que significa que en algunos huertos las concentraciones de sal alcanzan niveles que no todas las especies toleran. En las condiciones de los huertos, las plantas se exponen a periodos de sequía, lo que ocasiona que la concentración de sal en el agua del suelo aumente a niveles mayores que en suelos saturados de agua, lo que ocasiona desequilibrios nutricionales, debido a los altos potenciales osmóticos en el suelo (Kopittke 2012, Schröder 2013). La ausencia o escasez de elementos esenciales y la mayor presencia de Na+ y Cl− limitan el crecimiento y productividad de las plantas (Ali et al. 2014). Lo que implica, que al aumentar la salinidad en los suelos de los huertos, la composición de especies y la multifuncionalidad sean afectadas.
La profundidad del agua freática no mostró relación con la composición de especies. Las raíces de las plantas, al concentrarse en la capa superior del suelo, absorben en primera instancia el agua de la lluvia, evitando que el agua salina del manto freático influya en el crecimiento de las plantas. La salinidad del agua freática sólo afecta en situaciones donde se encuentra a escasa profundidad, permitiendo que la sal suba a la capa superior del suelo por acción capilar, o bien ocupando los poros del suelo.
Tolerancia a la salinidad de tres especies
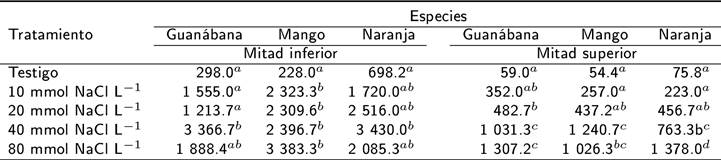
Las mediciones de CE en la fecha 2 muestran una ligera salinidad en los tratamientos con 10 mmol y 20 mmol NaCl L-1, y una moderada salinidad en los tratamientos con 40 y 80 mmol NaCl L-1. En la fecha 3, la salinidad fue moderada en los tratamientos con 10 y 20 mmol NaCl L-1, y alta en los tratamientos con 40 mmol y 80 mmol NaCl L−1 (Tabla 3). Las mediciones produjeron algunos resultados inesperados, donde la CE disminuyó a pesar de haber aplicado agua con mayor CE. Lo anterior, puede deberse a la distribución heterogénea de la sal en el suelo (Bazihizina et al. 2012) o que al tomar la muestra no se homogeneizó lo suficientemente el suelo, lo que pudo afectar la CE. La CE fue 100 % mayor en el suelo de la mitad inferior de las macetas que en el suelo de la mitad superior (Tabla 4). En la mitad inferior de las macetas, las condiciones fueron de alta salinidad en los tratamientos con 10, 20, 40 y 80 mmol NaCl L-1, mientras que en la mitad superior, las condiciones fueron no salinas en el testigo y el tratamiento con 10 mmol NaCl L-1. Lo anterior, implica que las plantas pueden explorar diferencialmente el suelo y aprovechar la variación en la salinidad, absorbiendo los nutrientes de las partes menos salinas. Las raíces expuestas a bajas concentraciones de sal aprovechan los elementos disponibles (K+ y Ca++), lo que le permite a la planta incrementar su biomasa, para evadir el efecto de la salinidad. Este mecanismo puede jugar un papel en guanábana y el mango, cuya biomasa seca total no varió entre tratamientos (Tabla 6). Posiblemente la naranja agria no tiene esta capacidad de compensación. Lo anterior, confirma la flexibilidad y capacidad de algunas especies de regular su exposición a los efectos de la salinidad (Bazihizina et al. 2012).
Tabla 6 Biomasa de hojas, raíces, y total de plantas de guanábana, mango y naranja, a los 93 d con tratamientos de concentraciones de sal.
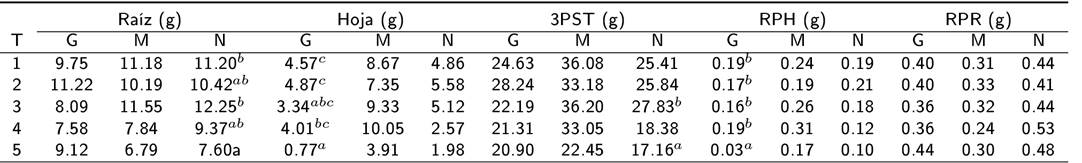
∗Medias con distinta letra difieren sifnificativamente (Kruskal - Wallis, P<0.05). PST = peso seco total, RPH = peso relativo de las hojas, RPR = peso relativo de las raíces, T= tratamiento, T1 =testigo, T2 = 10mmol NaCl L -1 , T3 = 20 mmol NaCl L -1 , T4 = mmol NaCl L -1 , T5 = mmol NaCl L -1
En general, las especies difieren en sus mecanismos de respuesta a la salinidad (Bharti et al. 2013), algunas responden produciendo numerosas hojas y eliminando la sal mediante la defoliación (Carter y Nippert 2012). Otras especies reaccionan de manera diferencial con el pH del suelo (Calvo- Polanco et al. 2014), mientras que el jitomate reduce la salinidad mediante la producción de compuestos de glicina betaína y la trehalosa (Rivero et al. 2014). Los resultados en el número de hojas y su biomasa indican que la eliminación mediante la defoliación puede jugar un papel en la guanábana, mientras que en naranja agria y mango no se observaron indicios de que opere este mecanismo. Posiblemente esto se relaciona con los índices de tolerancia al estrés (ST-Index) encontrados. La naranja agria fue la especie menos tolerante (8.83 dS m-1), seguida del mango (9.30 dS m-1) y la guanábana (16.81 dS m-1). Al incrementarse la salinidad en los huertos en la costa, se reducirá el área de distribución de la naranja agria.
Conclusiones
La salinidad del suelo influyó en la composición de especies arbóreas y arbustivas en los huertos familiares. La mayor salinidad se presentó a principios de la temporada de secas y la menor a principio de los nortes. De las tres especies evaluadas, la naranja agria es la especie menos tolerante a la salinidad; el mango tiene tolerancia intermedia, y la guanábana es la especie más tolerante. Los resultados indican que el incremento de la salinidad impactará en la composición de las especies de los huertos en la costa del estado de Tabasco. Ante la problemática asociada a la salinidad y sus efectos. Se recomienda investigar los mecanismos de adaptación de las plantas a condiciones de mayor salinidad, así como los mecanismos de las prácticas de cultivo.











 nueva página del texto (beta)
nueva página del texto (beta)