Introducción
El parásito helminto de F. hepática causa la enfermedad conocida como fasciolosis, la cual afecta a un amplio rango de mamíferos, particularmente a rumiantes, sin embargo, ha emergido como un importante patógeno para los humanos en África, Asía y en América del sur (Mas-Coma 2005). A nivel mundial, alrededor de 90 millones de personas están en riesgo de adquirir la infección y entre 2.4 y 17 millones ya están infectados (Keiser y Utzinger 2009). Además de que causa importantes pérdidas económicas en el sector agropecuario mundial, estimadas en más de 3 billones de dólares al año (Spithill et al. 1999).
La facciolosis se adquiere con la ingesta de vegetación o agua contaminada con la fase en-quistada o metacercaria, la cual se desenquista en el intestino, para luego atravesar la pared intestinal y migrar al tejido hepático, donde permanece entre 8 y 12 semanas (Mas-Coma et al. 2014). Después de este periodo, el parásito entra en los conductos biliares donde completa su crecimiento y maduración (Molina-Hernández et al. 2015). El adulto perfora la pared de los conductos biliares y se alimenta de sangre, la cual le provee los nutrientes para la producción de un gran número de huevos, que son trasladados al intestino con los fluidos biliares, para luego llegar a las plantas por medio de las heces (Rojo-Vázquez et al 2012). El estado larvario acuático o miracidio, eclosiona del huevo e infecta a los moluscos del género Lymnaea, que actúan como huéspedes intermediarios. Después de algunos estados de desarrollo y multiplicación dentro del caracol, las cercarías emergen y se enquistan en la vegetación para continuar con el ciclo (Mas-Coma et al. 2009). Después de eclosionar el miracidio, no es capaz de infectar, alcanzando su capacidad de invasión óptima entre 1.5 y 2 h después, la cual se pierde entre las 3 y 6 h después de la eclosión (Andrews 1999). Pudiendo vivir en estado libre en el agua hasta 24 h, con temperatura óptima de infección de entre 15 y 26 °C (Rojo-Vázquez et al. 2012).
El analizador de semen asistido por computadora (CASA) es un dispositivo de medición computarizados para la detección de cambios sutiles en el movimiento de esperma (Rijsselaere et al. 2012), con el que pueden analizar en forma individual miles de espermatozoides en un corto período de tiempo, lo que hace que estos sistemas sean prácticos en el uso clínico diario (Amann y Waberski 2014). Por lo anterior, el objetivo del presente trabajo fue investigar el efecto de diferentes temperaturas de incubación sobre la velocidad de movilidad de los miriacidos de Fasciola hepatica.
Materiales y métodos
Obtención de hígados y huevos de F. hepatica
Se extrajeron parásitos adultos de los conductos biliares de bovinos infectados y sacrificados en el rastro, los cuales se lavaron por seis ocasiones con amortiguador de fosfatos salinos (PBS) estéril 0.01 M, pH 7.2, para luego incubarlos por 16 h a 37 °C. Los huevos de F. hepatica de la vesícula biliar se obtuvieron con la técnica de sedimentación, luego se incubaron en agua y oscuridad a 22 y 25°C, para luego examinarlos con un estereomicroscopio (Zeiss Stemi DV4) durante 14 d, en los que se verificó la embrionación (Villa-Mancera y Méndez-Mendoza 2012). Para luego exponer los huevos por 15 min a luz de tungsteno (100 W) para estimular la eclosión (Villa-Mancera et al. 2008, Fairweather et al. 2012).
Evaluación de la motilidad del miracidio
Los parámetros de movimiento del miracidio se determinaron con el CASA (Ultimate Sperm Analyzer, versión 12,21), acoplado al microscopio de contraste de fase (Olympus BX41) con el programa Ultimate® y platina térmica con temperatura de 22 a 37 °C. Los miracidios de F. hepatica se colocaron en un portaobjeto precalentado a 25 °C para luego colocar un cubre objetos y observarlos con el objetivo Olympus 20 x 0.40 PLAN, para luego analizar cada hora por 10 h de post-eclosión, en las que se obtuvieron lecturas de 10 campos visuales diferentes en el microscopio para examinar como mínimo 100 miracidios por muestra. La configuración de los parámetros del programa fue de 45 exposiciones a velocidad de adquisición de 60 Hz, contraste mínimo 25, tamaño de 10 y 12, intensidad 50, velocidad promedio de trayectoria de células estáticas-lentas (V media , punto de corte 20 μm s-1) y velocidad promedio Iineal (V lineal , punto de corte 5 μm s-1). Las características de motilidad estudiadas mediante el CASA fueron: velocidad curvilínea (V curvilinea ) en μm s-1; por medio de la progresión secuencial a lo largo de una trayectoria verdadera; velocidad lineal (V lineal ) en μm s-1; por medio de la trayectoria recta del miracidio por unidad de tiempo; y velocidad media (V media ) en μm s-1 por medio de la trayectoria promedio del miracidio por unidad de tiempo.
Análisis estadístico
Los datos obtenidos se transformaron para agruparse en siete rangos de velocidad o subpoblaciones, con el programa SPSS 20. Con las mediciones repetidas se realizó un un análisis de varianza para conocer el efecto de la temperatura de incubación y el tiempo post-eclosión en las cinética de las subpoblaciones de miracidios de Fasciola hepatica.
Resultados
Velocidad curvilínea del miracidio
La proporción de huevos eclosionados en la temperatura de incubación de 22 y 25 °C fue de 91.7 y 94.2 %, respectivamente. No se observaron diferencias significativas en el porcentaje de huevos que eclosionaron después de la incubación en las dos temperaturas (p > 0.05) de incubación; en total se analizaron 14 783 con el CASA. La distribución de los siete rangos de V curvilinea evaluados durante 10 h post-eclosión en dos temperaturas se muestra en la Tabla 1. El mayor porcentaje de miracidios eclosionados (49.09 %), se observó a las 0 h, en el rango de 1 820 a 2 190 μm s-1; mientras que el menor porcentaje, se presentó en el rango de 0 a 365 μm s-1 a las 0 h post-eclosión en las temperaturas de incubación de 22 y 25 °C. Se encontraron diferencias entre el porcentaje de miracidios en la velocidad V curvilinea y las temperaturas de incubación (p < 0.01).
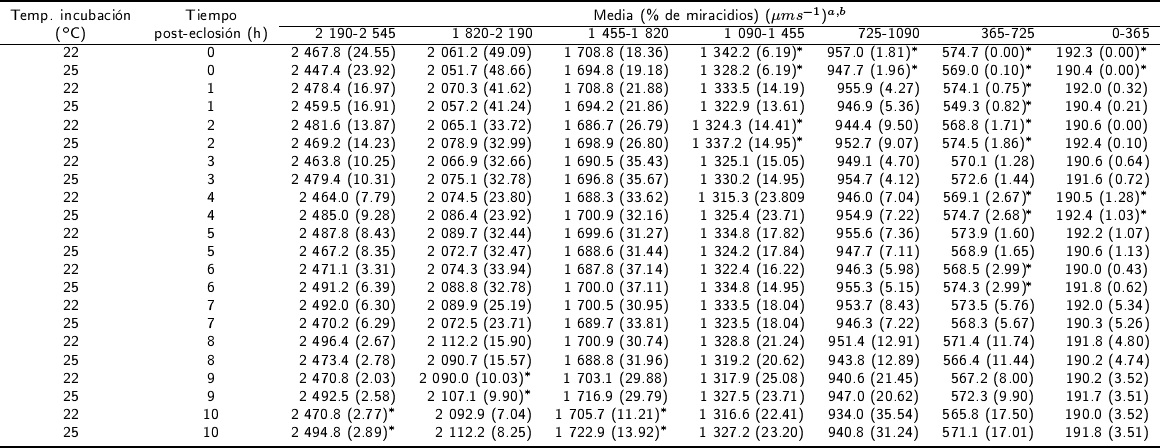
* Indica diferencia estadísticas (p<0.01).
Tabla 1 Distribución del porcentaje de miracidios de Fasciola hepatica en diferentes rangos de V curvilinea de las subpoblaciones analizados con el CASA hasta 10 h post-eclosión.
El porcentaje más alto de miracidios se observó en el rango de velocidad de 1 820 a 2 190 μm s-1 de las 0 a las 4 h post-eclosión; seguido del porcentaje obtenido en el rango de 2 190 a 2 545 μm s-1 de las 0 a las 3 h post-eclosión, en las dos temperaturas de incubación. La velocidad de las 0 h disminuyó de 49.09 al 48.66 % en el rango de 1 820 a 2 190 μm s-1, hasta el rango de 0 a 365 μm s-1 que fue de 0 % de miracidios. Se observaron diferencias significativas entre el porcentaje de miracidios de los rangos de V curvilinea y el tiempo post-eclosión de los huevos de F. hepatica (p < 0.01).
En los huevos incubados a 22 y 25 °C, de las 0 a 4 h post-eclosión, se observó el mayor porcentaje de miracidios en el rango de Vcurvilinea de 1 820 a 2 190 μm s-1, disminuyendo esta proporción hasta el rango de velocidad de 0 a 365 μm s-1. En los miracidios de 6 a 9 h post-eclosión, se obtuvo los mayores porcentajes en el rango de 1 455 a 1 820 μm s-1, disminuyendo hasta 0 % en el rango de 0 a 365 μm s-1. A las 10 h post-eclosión, se observaron los porcentajes más altos de miracidios de 725 a 1 090 μm s-1; ocurriendo una reducción en el porcentaje de miracidios de 365 a 725 μm s-1, en las dos temperaturas de incubación. No se observaron diferencias significativas en los porcentajes de miracidios de los rangos de V curvilinea de las subpoblaciones y las temperaturas de incubación (p > 0.01).
Velocidad lineal del miracidio
En la Tabla 2, se muestran los diferentes rangos de V lineal (μm s-1) de las subpoblaciones de miracidios evaluadas. El mayor porcentaje de miracidios eclosionados (87.62 %) se observó a las 0 h, de 2 190 a 2 545 μm s-1 con temperatura de incubación de 22 °C; mientras que el menor porcentaje (0 %) se tuvo en el rango de 0 a 365 μm s-1, de las 0 a 6 h post-eclosión en las dos temperatura de incubación. Una excepción en el porcentaje de miracidios (0.32 %), dentro de este rango fue a las 3 h a la temperatura de incubación de 22 °C.
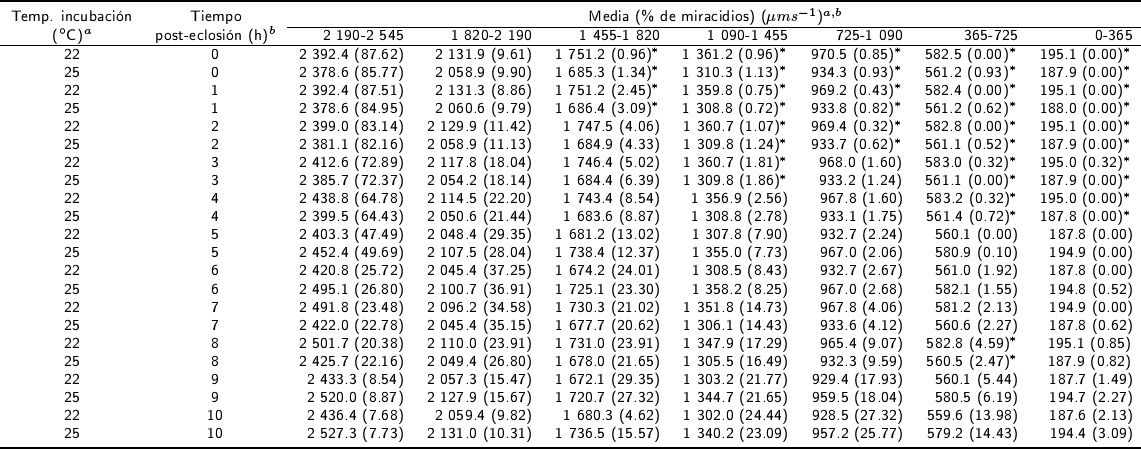
* Indica diferencia estadísticas (p<0.01).
Tabla 2 Distribución del porcentaje de miracidios de Fasciola hepatica en diferentes rangos de Vlineal de las subpoblaciones analizados con el CASA hasta 10 h post-eclosión.
Se observaron diferencias significativas entre el porcentaje de miracidios de los rangos de V lineal y las diferentes temperaturas de incubación (p < 0.01). El segundo porcentaje más alto de miracidios se observó en el rango de velocidad de 1 820 a 2 190 μm s-1 de las 0 a 5 h post-eclosión. En los huevos incubados a 22 °C, las velocidades a las 0 y 1 h disminuyeron en el rango de 2 190 a 2 545 μm s-1 de 87.62 a 87.51 % de miracidios, hasta el rango de 0 a 365 μm s-1. En los huevos incubados a 22 y 25 °C, de las 0 a 4 h post-eclosión, se observ ó el mayor porcentaje de miracidios en el rango de V lineal de 2 190 a 2 545 μm s-1, disminuyendo hasta la velocidad de 0 a 365 μm s-1. La proporción de miracidios de las 6 a 8 h post-eclosión, tuvieron los mayores porcentajes en el rango de 1 820 a 2 190 μm s-1, disminuyendo hasta el 0 % en el rango de 0 a 365 μm s-1. A las 9 h posteclosión, se observaron los porcentajes más altos de miracidios en el rango de 1 455 a 1 820 μm s-1; mientras que a las 10 h se obtuvo el mayor porcentaje de miracidios en el rango de 1 090 a 1 455 μm s-1, en las dos temperaturas de incubación.
Velocidad media del miracidio
Los diferentes rangos de V media (μm s-1) evaluados se muestran en la Tabla 3, en la que se observan diferencias en el porcentaje de miracidios en las diferentes temperaturas de incubación (p < 0.01). El mayor porcentaje de miracidios eclosionados (84,95 %) se observó a las 0 h, en el rango de 2 190 a 2 545 μm s-1; mientras que la menor proporción se tuvo en el rango de 0 a 365 μm s-1. La mayor proporción de miracidios se observó en el rango de velocidad de 2 190 a 2 545 μm s-1 de las 0 a las 3 h post-eclosión, seguida de la proporción de miracidios del rango de 1 820 a 2 190 μm s-1. Se encontraron diferencias significativas entre el porcentaje de miracidios de los rangos de V media y el tiempo post-eclosión (p < 0.01).
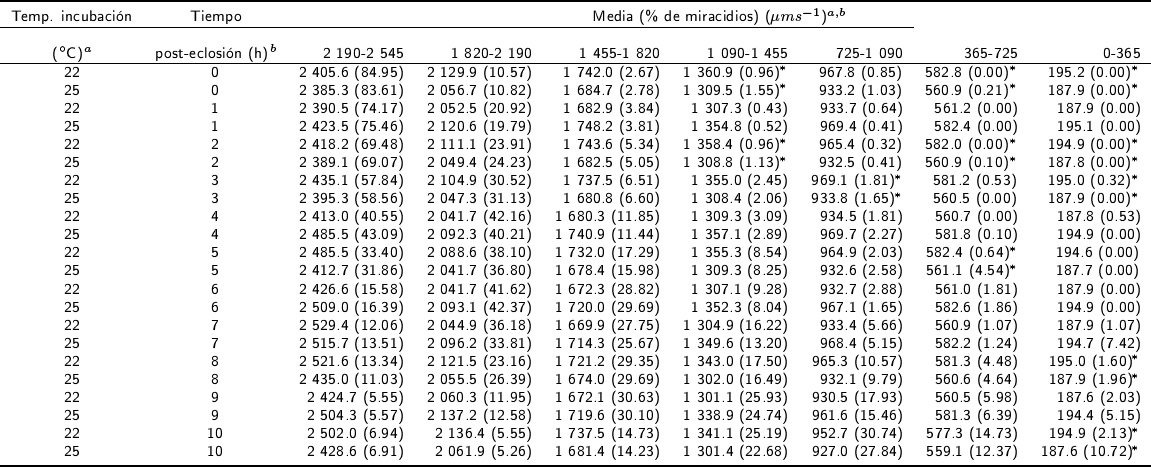
* Indica diferencia estadísticas (p<0.01).
Tabla 3 Distribución del porcentaje de miracidios de Fasciola hepatica en diferentes rangos de Vmedia de las subpoblaciones analizados con el CASA hasta 10 h post-eclosión.
A las 4 h post-incubación, los mayores porcentajes de miracidios se observaron en los rangos de velocidad de 1 820 a 2 190 μm s-1 y de 2 190 a 2 545 μm s-1, respectivamente. En los huevos incubados de las 5 a 7 h post-eclosión, se observó el mayor porcentaje de miracidios en el rango de V media de 1 820 a 2 190 μm s-1, disminuyendo esta proporción hasta el rango de velocidad de 0 a 365 μm s-1. La mayor proporción de miracidios a las 8 y 9 h post-eclosión se obtuvo en los rangos de 1 455 a 1 820 μm s-1, disminuyendo hasta el 0 % en el rango de 0 a 365 μm s-1. A las 10 h posteclosión, se observaron los porcentajes más altos de miracidios en el rango de 725 a 1 090 μm s-1, en ambas temperaturas de incubación (p < 0.01).
Discusión
Los porcentajes de eclosión oscilaron entre 91.7 y 94.2 % en las dos temperaturas de eclosión evaluadas. Al respecto Andrews (1999) reporta que el huevo de F. hepatica a temperaturas de 23 a 26 °C los huevos se desarrollan de 2 a 3 semanas, mientras que a temperatura de 16 °C se requieren de 2 a 3 meses. En condiciones de laboratorio, para el desarrollo del huevo a 10 °C se requieren 6 meses, mientras que a 30 °C se requieren 8 d para su desarrollo (Torgerson y Claxton 1999). Mientras que Canevari et al. (2013) reportan que huevos incubados a 25 °C por 15 d, tuvieron eclosiones de entre 67.0 y 94.8 %.
El miracidio es incapaz de infectar un caracol durante sus primeros minutos de vida, logrando su capacidad óptima de invasión de 1.5 a 2.0 h después de la eclosión para luego disminuir la capacidad de infección de forma lenta (Graczyk y Fried 1999). Esto concuerda con la velocidad encontrada en el presente trabajo que fue de 1 820 a 2 190 μm s-1 y de 2 190 a 2 545 μm s-1 después de la 1 h de post-eclosión en las dos temperaturas de incubación.
El porcentaje de miracidios en los diferentes rangos de velocidad de las subpoblaciones muestran diferencias significativas a través del tiempo post-eclosión, encontrando que después de 10 h post-eclosión a 25 °C se tuvo un bajo porcentaje de miracidios en el rango de 0 a 365 μm s-1. La velocidad de los miracidios esta relaciona con la infectividad, los miracidios que nadan en círculos o que requieren 30 s para moverse 1 cm (333 μm s-1) no infectan a los caracoles, mientras que los que se mueven de 833 a 2 500 μm s-1 son los más infectivos.
En la práctica, los miracidios se limitan a pequeños cuerpos de agua y pocos centímetros de diámetro, la mayoría de los cuales no contienen caracoles (Andrews 1999). Se encontraron diferencias estadísticas entre las dos temperaturas de incubación y la motilidad del miracidio de F. hepatica.
Aunque los miracidios son capaces de recorrer grandes distancias durante su corta vida, esta desciende a las 10 h de edad (Villa-Mancera et al. 2015). El porcentaje de miracidios de los rangos de V lineal y V media de las subpoblaciones mostraron diferencias significativas en las diferentes temperaturas de incubación. El miracidio nada inmediatamente después de eclosionar a gran velocidad en función de la temperatura, que va de 570 μm s-1 a 4.6 oC hasta 1 400 μm s-1 a 20 °C (Wilson y Denison 1970). Mientras que a temperaturas mayores de 22 °C y 25 °C, la velocidad es de 1 553.3 μm s-1 y 1 704.0 μm s-1, respectivamente (Villa-Mancera et al. 2015).
Conclusiones
La temperatura de incubación tiene efecto sobre la velocidad lineal y media del miracidio de Fasciola hepatica. La incubación de los huevos del trematodo y la supervivencia del miracidio está influenciada por la temperatura e intrínsecamente vinculada con el calentamiento global, el cual afecta la dinámica de la enfermedad, con consecuencias potencialmente drásticas para sus huéspedes.











 text new page (beta)
text new page (beta)


