Introducción
La Tripanosomiasis Americana, también conocida como enfermedad de Chagas, es una infección parasitaría endémica del continente americano, la cual se encuentra dentro de las 13 enfermedades tropicales desatendidas en el mundo (1). De acuerdo a la Organización Mundial de la Salud (WHO; por sus siglas en inglés) se estima una prevalencia de alrededor de 6-7 millones de personas infectadas en el mundo y por lo menos 25 millones se encuentran en riesgo de contraer la enfermedad (2). El agente etiológico de este padecimiento es el protozoario hemoflagelado T. cruzi (Kinetoplastida: Trypanosomatidae) (3), parásito que circula en más de 150 especies de mamíferos y es transmitido por las heces de insectos hematófagos de la subfamilia Triatominae (Hemiptera; Reduviidae) conocidos popularmente como chinches, chinche besucona, vinchucas, entre otras (4-5).
Se han descrito alrededor de 136 especies de triatominos y más de la mitad se han encontrado infectados naturalmente con T. cruzi(6). En México, hay reportadas 32 especies (7), dentro de las cuales T. dimidiata es considerado como uno de los transmisores más importantes debido a su amplia distribución, a su capacidad de adaptarse a la vivienda humana y a que es capaz de explotar diferentes fuentes de alimento y refugio (8-9). Varios estudios han demostrado diferencias en la tasa de infección de las diferentes especies de triatominos hacia T. cruzi(10-12). Del mismo modo, se han encontrado diferencias en cuanto al tiempo de defecación posterior a la ingesta de alimento (13-15). Estos parámetros permiten establecer la importancia epidemiológica de las especies de triatominos, dado que aquellas especies que tienen una alta tasa de infección y defecan en un periodo de tiempo más corto, tienen mayores probabilidades de transmitir al parásito (16-17).
Para T. dimidiata, se ha reportado una tasa de infección del 76 % y tiempos de defecación entre los 10-20 minutos posteriores a la alimentación (4,18). No obstante, la mayoría de estos estudios han utilizado ejemplares adultos, obviando de esta manera las diferencias que puedan existir en estos parámetros a lo largo de su ciclo de vida que consta de cinco estadios ninfales antes de llegar a la etapa adulta (Figura 1). El presente trabajo tiene como objetivo establecer y comparar la tasa de infección y el tiempo de defecación de los cinco estadios de T. dimidiata en condiciones de laboratorio. Esto, con el fin de aportar conocimientos que puedan ser de gran utilidad para el diseño e implementación de programas de control de esta especie en las zonas endémicas.
Material y métodos
La colonia original de triatominos y el aislado de T. cruzi se obtuvieron de la localidad Miguel Hidalgo, municipio de Copainalá, Chiapas, México (17º13´16” N y 93º21´08” O), durante una colecta en el 2010 (Figura 2). Los triatominos fueron mantenidos y reproducidos en laboratorio a condiciones controladas de 25º ±2 ᵒC, 75% de humedad y un fotoperiodo de 12:12. Los insectos se mantuvieron en contenedores plásticos de 12 cm de largo por 6 cm de diámetro y alimentados ad libitum con sangre de rata de la cepa Wistar. Por su parte, el parásito fue mantenido en laboratorio mediante pasajes sucesivos en ratones de la cepa BALB/c cada 15 días a través de inoculaciones intraperitoneales (19).

Figura 2 Ubicación de la localidad Miguel Hidalgo, municipio de Copainalá, Chiapas, donde se obtuvieron los insectos usados para pie de cría y el aislado de T. cruzi.
De la colonia original se seleccionaron 30 individuos de cada estadio de T. dimidiata para conformar cinco grupos experimentales. Todos los ejemplares fueron colocados individualmente en frascos de 6 x 6 cm con papel filtro de fondo y mantenidas en las condiciones de luz, humedad y fotoperiodo mencionadas anteriormente.
Cada grupo fue alimentado a repleción con sangre de ratas de la cepa Wistar previamente inoculadas con 1x106de tripanosomas sanguíneos. Los roedores fueron colocados en inmovilizadores y ofrecidos individualmente a los triatominos. La alimentación se realizó en un cuarto oscuro y concluyó hasta que los insectos retiraron su probóscide de la piel del roedor por más de cinco minutos. Una segunda alimentación se ofreció 20 días después siguiendo la misma metodología. La presencia de T. cruzi en los triatominos se confirmó mediante la observación directa de frotis de las heces de todos los ejemplares en microscopio óptico a objetivo 40x. La muestra fecal se obtuvo por defecación espontánea del insecto o en su ausencia por presión abdominal. La observación para determinar el tiempo de defecación fue continua durante la alimentación y hasta por 30 minutos después de que retiraron la probóscide del roedor. A las ninfas que defecaron mientras se alimentaban se les asignó un valor de 0 minutos.
Se utilizó estadística descriptiva para determinar la tasa de infección y el tiempo de defecación por estadio ninfal. La normalidad de los datos del tiempo de defecación fue analizada con la prueba Shapiro-Wilk. Diferencias entre los grupos fueron evaluadas con un análisis de varianza (ANOVA) y la prueba post hoc de Tukey. Se consideraron diferencias significativas cuando p<0.05. Todos los análisis y gráficas de las variables se realizaron con el software estadístico Infostat versión 2016.
Resultados
La población total analizada fue de 150 ejemplares, de las cuales 99 resultaron positivos a la infección con T. cruzi (66 %) por corroboración de tripomastigotes metacíclicos en las heces (Figura 3). De los cinco grupos experimentales correspondientes a cada estadio del insecto, los triatominos del quinto estadio mostraron una tasa de infección del 76 %, la cual fue superior al resto de los grupos evaluados (Cuadro 1). A pesar de las diferencias observadas, cabe mencionar que estas no fueron significativas (p=0.0695). Los individuos que resultaron negativos a la infección fueron analizados por segunda ocasión 10 días posteriores; no obstante, no se presentaron diferencias con respecto al primer análisis.

Figura 3 Tripomastigote metacíclico en heces de un ejemplar del tercer estadio deT. dimidiata. La muestra fue teñida con el Kit Hemocolorante rápido (HYCEL) y observada en microscopio óptico (100x).
Figura 3 Tasa de infección con T: cruzi de los diferentes estadios de T. dimidiata
| Estadio | Individuos | Infectados | % Infección | Valor P |
| I | 30 | 17 | 56 | 0.0695 |
| II | 30 | 17 | 56 | |
| III | 30 | 22 | 73 | |
| IV | 30 | 20 | 66 | |
| V | 30 | 23 | 76 | |
| Total | 150 | 99 | 66 |
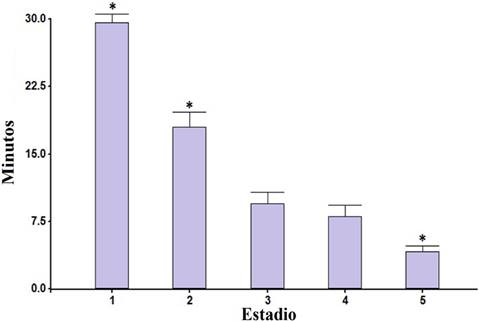
En relación al tiempo de defecación postprandial de los estadios de T. dimidiata, se encontraron diferencias significativas entre los grupos experimentales (p=0.0001). El tiempo de defecación más corto se observó en las ninfas del quinto estadio (4.16 ± 0.61 DE minutos), mientras que el tiempo más largo se registró en las ninfas del primer estadio (Figura 4). De hecho, la mayoría de estos ejemplares defecaron después del periodo de observación establecido (30 minutos), por lo que se les asignó un valor de 30 minutos. Asimismo, cabe señalar que entre los grupos del tercer y cuarto estadio no se presentaron diferencias significativas (p=0.0948).
Discusión
Los resultados de este estudio muestran que todos los estadios ninfales de T. dimidiata son capaces de infectarse con el parásito T. cruzi, sin diferencias significativas entre los estadios (p>0.05). Esto indica que T. dimidiata es un vector potencial del parásito durante todo su ciclo de vida, aunque contrasta con otros trabajos en los que se reportan la nula o baja infección de los dos primeros estadios, lo que ha conducido a su exclusión en algunos estudios epidemiológicos (20-24).
Hasta el momento no se conocen con exactitud las bases que provocan diferencias en la tasa de infección de las diferentes especies de triatominos. Algunos autores sugieren que hay una adaptación mutua entre los transmisores triatominos y T. cruzi de una misma región geográfica (25-26). Además, factores como los componentes de la saliva, del estómago, enzimas digestivas, temperatura y pH, pueden llegar a afectar la diferenciación del parásito en el insecto (27-29). Considerando todos los individuos del experimento, se obtuvo el 66 % de ejemplares infectados, cifra menor comparada con otras especies importantes en México como M. pallidipennis y T. Barberi que presentan tasas de infección del 98.33 % y 89 % en el tercer estadio, respectivamente (10,12). A pesar de presentar una tasa de infección menor que otras especies, es quizá la capacidad de adaptación a la vivienda humana de T. dimidiata la que puede jugar un papel más importante en la transmisión del parásito a humanos y otros animales.
Por otro lado, el tiempo de defecación mostró diferencias significativas entre los diferentes grupos experimentales (p<0.05), presentando los triatominos del quinto estadio tiempos más cortos después de la alimentación (4.16 min). Resultados similares también han sido reportados con R. prolixus(30). El hecho de que se presenten defecaciones en lapsos cortos de tiempo, aumenta las posibilidades de que los triatominos infectados defequen sobre la piel del huésped y de esta forma el parásito penetre en el vertebrado a través de la lesión ocasionada por la probóscide del insecto u otras vías de acceso como laceraciones, mucosas o conjuntiva (31-32). En general, los tiempos obtenidos en todos los estadios fueron más cortos que los reportados para otras especies como T. rubida y T. guasayana(33-34). El tiempo de defecación puede estar influenciado por factores como la temperatura, humedad, frecuencia de alimentación, variación genética, entre otros (6,35). Esto podría explicar las diferencias observadas entre las poblaciones de triatominos de diferentes regiones geográficas.
En este reporte se considera al quinto estadio de T. dimidiata como un transmisor eficaz de T. cruzi. Sin embargo, debido a la infección exhibida en todos los estadios, surge la necesidad de estudiar la capacidad de esta especie de transmitir al parásito durante todo su ciclo de vida; como por ejemplo, la metaciclogénesis por estadio. Un entendimiento sobre las bases de la transmisión vectorial fomentaría la creación de estrategias que permitan reducir la tasa de morbilidad de la enfermedad de Chagas en las zonas endémicas.











 nueva página del texto (beta)
nueva página del texto (beta)