Introducción
El constante crecimiento y desarrollo a nivel mundial, ha aumentado el consumo de recursos naturales, alterando el medio ambiente y provocando contaminación de diversos ecosistemas. Esta contaminación ha generado la acumulación de diversos compuestos que son tóxicos para los seres vivos, siendo este el caso de los metales pesados. Actualmente, hablar sobre metales pesados se ha convertido sin lugar a duda en uno de los temas de mayor importancia tanto a nivel medio ambiental como en salud. Mediante la implementación de normas se ha buscado minimizar el impacto de dichos metales, sin embargo, no hay manera de que exista una calidad de vida, así como desarrollo económico sin la minería y aunque la minería es necesaria para el desarrollo económico, es esencial proteger el medio ambiente para evitar consecuencias irreparables [1].
La industria minera es uno de los ejes económicos más importantes del país, que incluye operaciones de prospección, exploración, extracción, fundición y recuperación de minerales. Según la Secretaría de Economía en el 2021 a nivel mundial, México se ubica en la primera posición en producción de plata y en los diez primeros lugares en la producción de minerales metálicos que contienen bismuto, cadmio, molibdeno, plomo, zinc, oro y cobre. Asimismo, de minerales no metálicos como wollastonita, diatomita, sal, fluorita, celestita, barita, grafito y yeso [7] [8].
A pesar de la importancia económica de la industria minera, la contaminación del agua con metales pesados es un problema para la salud humana y el medio ambiente. El zinc, metal utilizado en diversas industrias, puede contaminar el agua a través de vertidos industriales y residuos mineros y su presencia puede ser perjudicial para la salud y la vida acuática. Para garantizar la calidad del agua y proteger el medio ambiente es crucial eliminar los iones de zinc del agua. La contaminación del agua con zinc se da principalmente de manera antropogénica, incluyendo efluentes municipales e industriales, actividades mineras y geológicas, así como algunas fuentes difusas secundarias. La Norma Oficial Mexicana NOM-001-SEMARNAT-2021 establece un límite máximo permisible de 10 mg/l promedio mensual para la descarga de aguas residuales y bienes nacionales con respecto al zinc en varias actividades, incluyendo uso público urbano, riego agrícola, protección de vida acuática en embalses naturales y artificiales, aguas costeras, explotación pesquera, navegación, recreación y estuarios [4] [6].
La electrodiálisis es una técnica que ha demostrado ser efectiva en el tratamiento de aguas residuales contaminadas con metales pesados, ha sido ampliamente utilizada para eliminar contaminantes específicos como el zinc ya que es un método altamente selectivo. La electrodiálisis es un proceso que puede operar a bajas presiones, lo que reduce el consumo de energía y minimiza los costos operativos. También es una técnica que puede ser aplicada en continuo, lo que aumenta la eficiencia del proceso y reduce los tiempos de tratamiento. Es importante mencionar que la electrodiálisis no es la única técnica disponible para el tratamiento de aguas residuales contaminadas con metales, sino que existen otras opciones como la precipitación química, la adsorción, la oxidación y la reducción, que también han demostrado ser efectivas en la eliminación de metales pesados del agua.
El objetivo de esta investigación es realizar una serie de pruebas con un efluente sintético, el cual tiene características muy similares a la de un efluente real, con la finalidad de evaluar la eficiencia del método y posteriormente, en una segunda etapa, poderlas implementarlas a un efluente real minero.
En una investigación realizada por Babilas y Dydo [3], llevaron a cabo un estudio en el que se evaluó la recuperación de zinc de aguas residuales de galvanoplastia, mediante electrodiálisis con membranas compuestas activadas. En el proceso se analizó la recuperación de zinc y hierro (impureza presente en este tipo de efluentes) mediante agentes quelantes (ácido láctico, málico y cítrico). Se utilizó un módulo de electrodiálisis de cinco compartimentos con un área de membrana de 16 cm2. El experimento se llevó a cabo con una densidad de corriente eléctrica constante de 250 A/m2, la duración de cada experimento fue de una hora. Como resultados, se observó un coeficiente de retención de hierro del 92.36%. Se concluyó que el método permitió una recuperación de zinc del 86.6% con una eficiencia de corriente del 84.95%.
En un estudio, realizado por Noroozi y col. [8], titulado: "Electrodialysis for removal of zinc ions from aqueous solutions: Optimization of operating conditions and electrode materials" se reportó la eficacia de la técnica de electrodiálisis en la remoción de iones de zinc en soluciones acuosas. Evaluaron diferentes condiciones operativas y materiales de electrodo para optimizar el proceso de remoción de zinc en dónde, utilizaron diferentes densidades de corriente (50, 100, 150 y 200 A/m²), como electrolito se preparó una solución sintética que contenía 100 mg/L de iones de zinc y otros iones. Se encontró que la densidad de corriente de 200 A/m² proporcionó la mayor eficiencia de remoción de zinc. El proceso de electrodiálisis fue capaz de eliminar efectivamente el zinc cuando aumentó con la densidad de corriente y la concentración inicial de zinc.
En otro estudio realizado por El-Naas y col. [4], los autores investigaron la separación de iones de zinc mediante la técnica de electrodiálisis usando una celda de dos compartimentos. Con una densidad de corriente constante de 25 A/m² durante todo el experimento y un electrolito sintético de cloruro de zinc con una concentración inicial de 1000 mg/L. Los autores encontraron que la eficiencia fue del 99.4% después de una hora de electrodiálisis y del 99.9% después de dos horas de tratamiento. Los autores también concluyeron que la electrodiálisis es una técnica efectiva para la eliminación de zinc, con el potencial de ser utilizada a escala industrial para el tratamiento de aguas residuales que contienen zinc.
Descripción del método
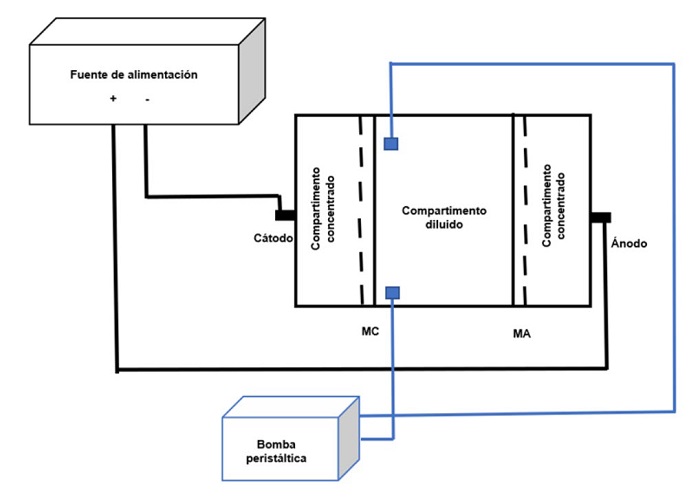
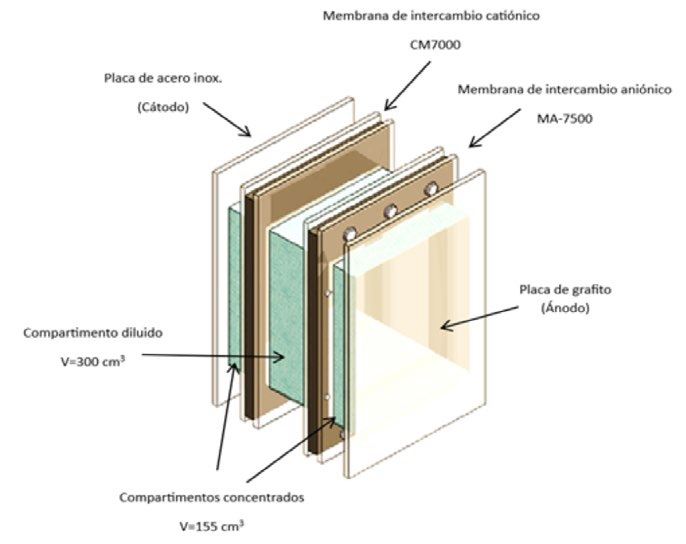
Se evalúa el método de electrodiálisis como una alternativa para remover o disminuir la presencia del zinc en soluciones acuosas, esta técnica está representada por la figura 1. Las variables estudiadas en este proyecto son la densidad de corriente, la velocidad de recirculación y el pH. Las condiciones de operación se establecen en la tabla 1. Las pruebas fueron realizadas en una celda de electrodiálisis que contenía una placa de grafito como ánodo y una placa de acero inoxidable como cátodo, ambas con un área superficial expuesta de 68 cm2. La celda de electrodiálisis está separada por una membrana de intercambio aniónico MA-7500 y una membrana de intercambio catiónico modelo CMI-7000. El suministro de energía eléctrica se realizó con una fuente de poder de corriente directa de la marca Tektronix DC (PWS4305) y la recirculación se llevó a cabo con una bomba peristáltica marca CONTRO1079.
Tabla 1 Condiciones de operación establecidas para las pruebas de electrodiálisis.
| Variable | Rangos de operación |
| Densidad de corriente (A/m2) | 10, 30, 60, 90, 120, 150 |
| Velocidad de recirculación (ml/min) | 10, 30, 50, 78, 107 |
| pH | 4, 5, 6, 7, 8 |
El primer paso para la metodología consistió en elaborar una celda de electrodiálisis de polimetilmetacrilato de tres compartimentos figura 2. La duración de las pruebas de electrodiálisis fue de 60 minutos, con una concentración inicial del efluente sintético de 50 ppm de zinc (ZnSO4) y como solución auxiliar Cloruro de Sodio (NaCl) para los compartimentos concentrados, temperatura inicial de 25±2°C, pH y conductividad eléctrica, de acuerdo con la norma NMX-AA-008-SCFI-2000 Análisis de agua - determinación del pH - método de prueba y NMX-AA-007-SCFI-2013 Análisis de agua - medición de la temperatura en aguas naturales, residuales y residuales tratadas - método de prueba. Se tomaron muestras en los tiempos de 0, 5, 30, 45 y 60 minutos, las cuales se aforaron con agua destilada en un matraz volumétrico y posteriormente se determinó la concentración de zinc mediante análisis químico; el cual, se llevó a cabo por medio de un espectrofotómetro de absorción atómica Marca GBC Modelo AVANTA de acuerdo con la norma NMX-AA-051-SCFI-2016 Análisis de agua - medición de metales por absorción atómica en aguas naturales, potables, residuales y residuales tratadas -método de prueba. Las variables de operación se tomaron con base en el estudio realizado por Arreola y Col. [2].
Con base en los valores obtenidos en el análisis químico, se realizaron los cálculos correspondientes para determinar los porcentajes de remoción alcanzados en cada intervalo de tiempo. Finalmente, se realizaron gráficos de acuerdo con los resultados obtenidos mismos que representan el porcentaje de remoción total y la cinética de remoción para determinar los mejores resultados. La primera variable estudiada fue la densidad de corriente, con una concentración de zinc en el efluente fue de 50 ppm, durante estas primeras pruebas se trabajó con el valor intermedio de pH inicial (pHi) de 6, mismo pH que la solución sintética presentaba inicialmente, por lo que no fue necesario modificarlo, de igual manera se propuso una velocidad de recirculación de 50 mL/min. Cabe mencionar que estos valores se encuentran dentro de los rangos de operación propuestos.
Resultados y discusión
Densidad de corriente en la remoción de zinc.
Los resultados que se alcanzaron en las pruebas de electrodiálisis se muestran en la figura 3, en dónde la cinética de remoción de zinc está función de la densidad de corriente, obteniendo que la eficiencia en la remoción aumenta a medida que aumenta la densidad de corriente. Además, se puede observar que la eficiencia de remoción llega a un punto máximo para cada densidad de corriente; esto quiere decir, que ya no hay una mayor remoción porque la reacción está limitada por la disponibilidad de iones de zinc en la solución. El punto máximo, es aquel en el que la cantidad de iones de zinc que se disuelven en la solución alcanza su límite, debido a que la velocidad de la reacción de disolución de los iones en la superficie del electrodo se iguala a la velocidad de la reacción de precipitación de iones de zinc en la solución. En este punto, no importa cuánto se aumente la densidad de corriente, la cantidad de iones de zinc en la solución permanecerá constante y no habrá un aumento adicional en la eficiencia de remoción de zinc. Por lo que aumentar más allá de 120 A/m2, no sería tan viable, esto de acuerdo con el estudio realizado por Noroozi y col. [8], que explican, que una densidad de corriente demasiado alta podría provocar problemas como la polarización del electrodo y la disminución de la eficiencia de remoción por lo que se sugiere un equilibrio cuidadoso al seleccionar la densidad de corriente óptima.
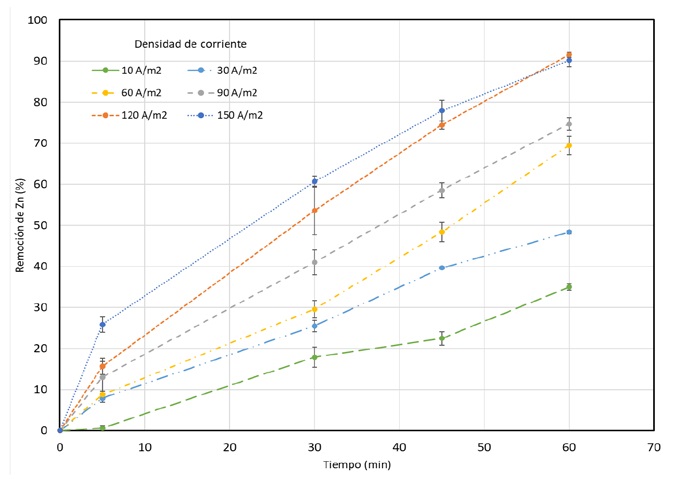
Figura 3 Cinética de Remoción de zinc en función de la densidad de corriente. Velocidad de recirculación: 50 ml/min; pHi=6, t=60 min.
En la figura 4 se muestran las remociones finales en función de la densidad de corriente desde otra perspectiva. La representación gráfica de ésta se realizó con los mismos valores de operación que la figura 3; se puede observar que de igual manera cuando la densidad de corriente es baja no se obtienen buenas remociones y conforme aumenta el valor de operación de esta, aumenta también el porcentaje de remoción llegando a valores de 91.55% con una densidad de 120 A/m2,en un tiempo de 60 minutos; siendo este el máximo alcanzado para estas condiciones de operación.
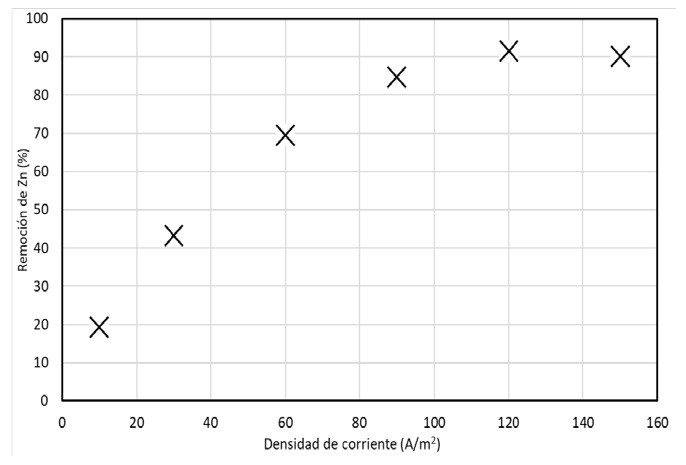
Figura 4 Comparación de la densidad de corriente en el porcentaje de remoción de zinc a pHi=6; velocidad de recirculación 50 ml/min, t=60 min.
Los resultados alcanzados se relacionan con los voltajes de celda obtenidos, como se observa en la figura 5, a mayor densidad de corriente se presentan mayores valores en el voltaje de celda; consecuentemente, a mayor valor de densidad de corriente se prevé que se tenga una mayor fuerza impulsora para la difusión de iones entre los compartimentos. La gráfica muestra que, a medida que aumenta la densidad de corriente, también aumenta el voltaje necesario para mantener la corriente constante. En otras palabras, la relación entre la densidad de corriente y el voltaje no es lineal, sino que muestra una curva ascendente.
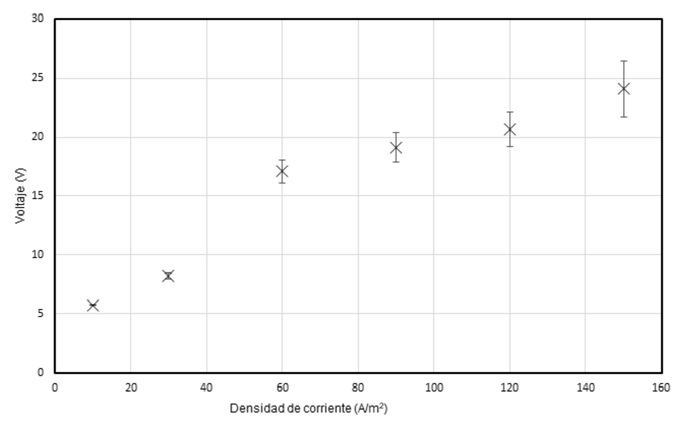
Figura 5 Voltaje de celda en función de la densidad de corriente. velocidad de recirculación: 50 ml/min; phi=6; t=60 min.
Este comportamiento se debe a la resistencia inherente del sistema, que aumenta con la densidad de corriente. A medida que se incrementa dicha densidad , la corriente que fluye a través del sistema también aumenta, lo que produce un aumento en la resistencia y, por lo tanto, en el voltaje necesario para mantener la corriente constante. Es decir, la gráfica muestra que hay una relación no lineal entre la densidad de corriente y el voltaje en un proceso electroquímico, con un aumento significativo en el voltaje necesario a medida que se incrementa la densidad de corriente debido a la resistencia del sistema.
Velocidad de recirculación en la remoción de zinc.
La segunda variable estudiada fue la velocidad de recirculación, durante estas pruebas se trabajó con un pH inicial (pHi) de 6 y una densidad de corriente en un valor de 120 A/m2, ya que representó la mejor condición para la remoción en las cinéticas anteriores. Los resultados obtenidos para esta variable se muestran en la figura 6 en la cual se puede observar que a medida que se aumenta la velocidad de recirculación, también aumenta la remoción de zinc. Las mayores remociones se obtienen a partir de velocidades de recirculación de 10 mL/min, donde se logra una remoción del 85%, y a partir de 30 mL/min, se logran remociones superiores al 90%.
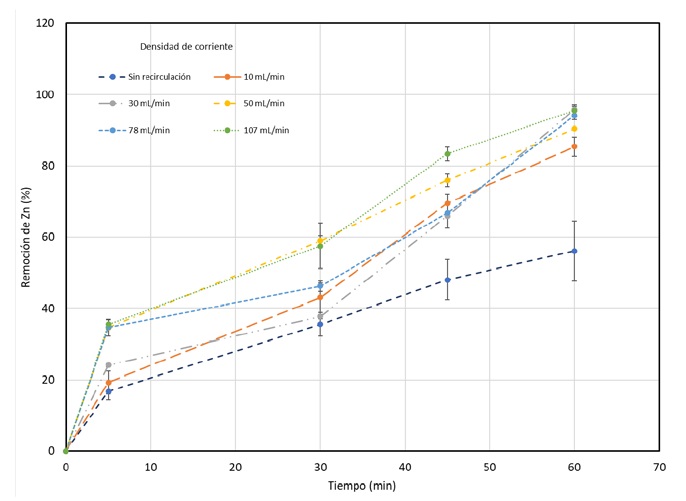
Figura 6 Cinética de Remoción de zinc en función de la velocidad de recirculación. Densidad de corriente:120 A/m2; pHi=6; t=60 min.
La densidad de corriente de 120 A/m2 proporciona una alta eficiencia en la remoción de zinc debido a que se genera una cantidad suficiente de iones metálicos que migran hacia el cátodo, donde se depositan y se pueden retirar del sistema. En segundo lugar, el pH inicial de 6 es un valor adecuado para la remoción de zinc, ya que a este pH el zinc se encuentra mayormente en su forma iónica, lo que favorece su transporte hacia el cátodo. En cuanto a la velocidad de recirculación, se observa que a medida que esta aumenta, también lo hace la eficiencia de remoción de zinc, lo que sugiere que el proceso es dependiente de la velocidad de flujo. Este comportamiento puede ser explicado por la mejora en la transferencia de masa y la disminución de la difusión de concentración en la interfaz líquido-sólido.
En la figura 7 es importante tener en cuenta que, aunque se haya logrado una remoción sin recirculación, esta eficacia es relativamente baja en comparación con las remociones logradas con velocidades de recirculación mayores; ya que la recirculación permite que el agua se someta a un tratamiento continuo y a un mayor tiempo de exposición al proceso de electrodiálisis. Lo que podría explicar la mayor eficacia de remoción observada en las pruebas con velocidades de recirculación mayores.
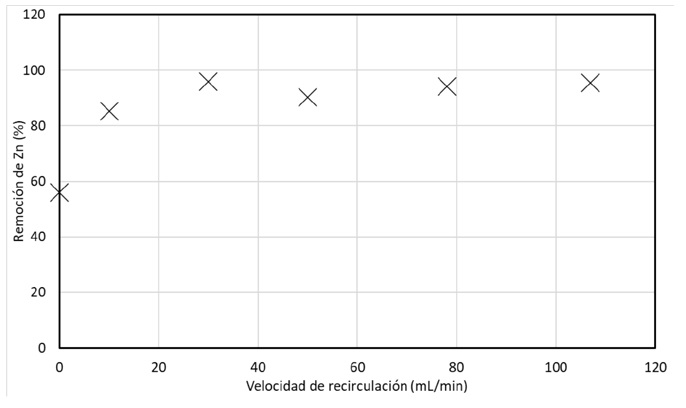
Figura 7 Porcentaje de Remoción Final de zinc en función de la velocidad de recirculación. Densidad de corriente:120 A/m2; pHi=6, t=60 min.
En este caso las densidades de corriente podrían estar permitiendo que los iones de zinc se muevan a través de la solución y se depositen en el electrodo, incluso sin la ayuda de la velocidad de recirculación. En resumen, la combinación de la densidad de corriente, un pH inicial adecuado y una velocidad de recirculación óptima son los factores clave que explican el comportamiento de la cinética de remoción de zinc en este proceso de electrodiálisis.
Es importante tener en cuenta que la velocidad de recirculación también puede tener otros efectos sobre el sistema, como la mezcla de la solución y la eliminación de productos de desecho; por lo que es probable que la combinación de la densidad de corriente y velocidad de recirculación haya producido una mayor remoción de zinc como se observa en las pruebas.
El pH en la remoción de zinc.
Los resultados que se alcanzaron en cada una de las pruebas de electrodiálisis para la variable de pH se muestran en la figura 8, la gráfica muestra la cinética de remoción de zinc en función del pH en el tiempo de 0 a 60 minutos. Se evaluaron cinco valores de pH diferentes para determinar el efecto del mismo en la eficiencia de la remoción de zinc. Se observó que la mayor remoción de zinc se logró a un pH inicial de 6, alcanzando una remoción final del 90.35%.
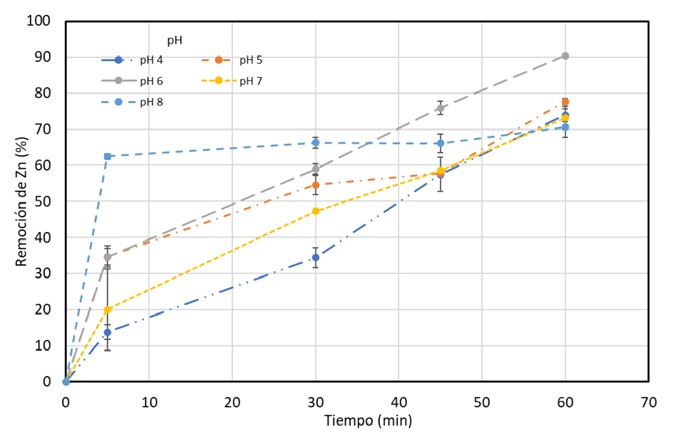
Figura 8 Cinética de Remoción de zinc en función del pH, densidad de corriente:120 A/m2; velocidad de recirculación: 30 ml/min y t=60 min.
+Este comportamiento puede explicarse por la distribución de las especies químicas del zinc en solución en función del pH, en soluciones ácidas, el ion Zn+2 es la especie predominante; mientras que, en soluciones alcalinas, los hidróxidos de zinc (Zn(OH)2 y Zn(OH)-3) son las especies predominantes. En este caso, la mayor remoción de zinc en un pH inicial de 6 se debe a la formación de Zn(OH)2, ya que esta especie es menos soluble que el ion Zn+2. Por otro lado, se observó que el pH inicial de 8 logró una mayor remoción durante los primeros 5 minutos. Esto podría deberse a la formación de Zn(OH)-3, ya que esta especie es más soluble y más fácilmente removible mediante electrodiálisis. En general, los resultados de la gráfica sugieren que el pH es un factor crítico para la eficiencia de la remoción de zinc por electrodiálisis y que el pH óptimo para la remoción de zinc en este efluente sintético es de alrededor de 6. Estos hallazgos pueden ser de gran utilidad para diseñar y optimizar procesos de tratamiento de aguas residuales que contengan zinc y otros metales pesados.
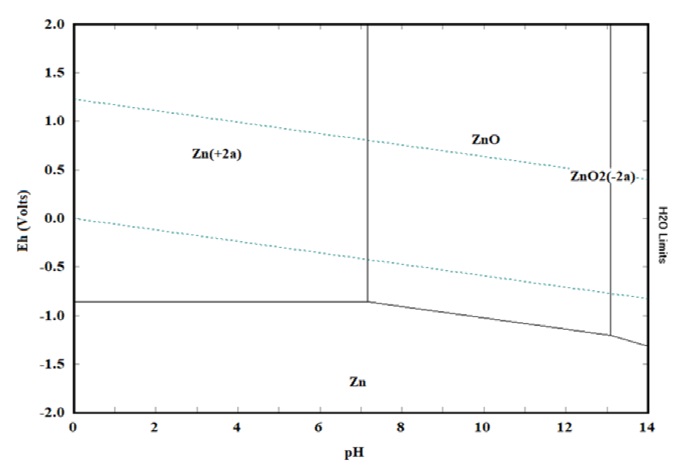
Para poder tener una evaluación más completa y acertada de esta variable fue necesario realizar una simulación de diagrama de Eh-pH (Pourbaix) con ayuda del software HSC Chemistry 6.1. La simulación fue elaborada de acuerdo con las condiciones de la solución y la concentración de esta (50 mg/L de zinc). En la figura 9, se presenta un diagrama de Pourbaix dónde se representan las principales áreas de estabilidad termodinámica de la especie de interés (zinc) en función del potencial y del pH. En dicha figura, se puede observar que la especie predominante en este sistema es el zinc II (Zn+2) para la mayoría de los valores (4 a 7) de pH estudiados y el óxido de zinc (ZnO) el cual comienza a aparecer en el pH de 8, por lo que de acuerdo con estos resultados la variable de pH sí tiene efecto sobre el proceso de electrodiálisis. En el diagrama de Pourbaix del sistema Zn-S-H2O, se puedo observar varias regiones que corresponden a diferentes especies químicas del zinc en función del pH y del potencial redox. En general, el diagrama muestra que el zinc y el sulfuro pueden formar una amplia variedad de especies químicas, dependiendo de las condiciones del medio. Sin embargo, este tipo de diagramas solo nos proporciona una visualización general, por lo que fue necesario realizar un diagrama de distribución de especies.
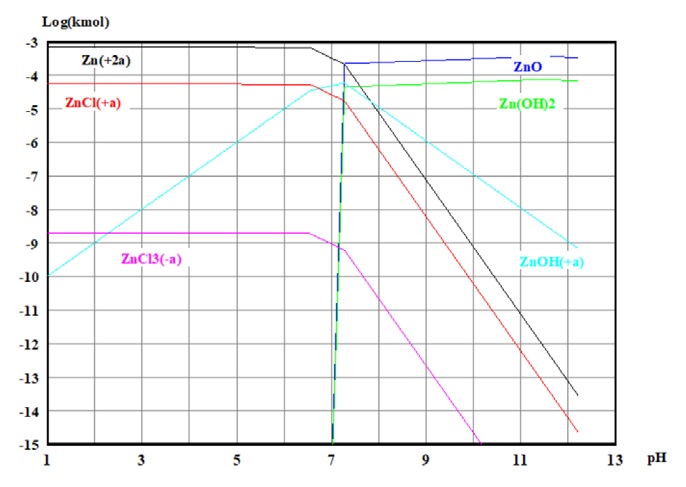
La simulación del diagrama de especiación (distribución de especies) fue realizada con ayuda del mismo software, dicho diagrama se encuentra representado por la figura 10. En este diagrama, se puede observar que se encuentra la presencia de nuevas especies, las cuales no aparecían en el diagrama de Pourbaix, como es el caso de algunos cloruros (ZnCl+1 y ZnCl3-1), así como de hidróxidos (Zn(OH)2 y ZnOH+1). Analizando con más cuidado este diagrama se puede observar que a medida que el valor del pH aumenta (valores mayores a 7), el óxido de zinc (ZnO) aumenta su concentración, por lo que la concentración de los iones de zinc II comienza a disminuir.
Realizando un análisis más profundo sobre los resultados obtenidos en el estudio de la variable del pH en la remoción de zinc, en la figura 7 mostrada anteriormente se puede observar que el pH de 6 fue el que obtuvo mejores porcentajes en la remoción de zinc con un valor de 90.35% y pese a que el pH de 8 durante los primeros cinco minutos alcanza buenas remociones. Esto se debe a que los iones de zinc tienden a precipitarse debido al rango de pH con el que se está trabajando inicialmente, de acuerdo con el análisis termodinámico. Lo anterior quiere decir que, este porcentaje de remoción se debe principalmente al proceso de precipitación y no al proceso de electrodiálisis, por lo que no se recomienda trabajar con este rango de pH para esta técnica. Lo antes mencionado queda respaldado con el diagrama de distribución de especies.
Conclusiones
Densidad de corriente en función de la remoción de zinc:
Como resultados de las pruebas y en base a las cinéticas obtenidas se puede concluir que existe una relación directa entre la densidad de corriente y la remoción de zinc en el proceso de electrodiálisis. Ya que medida que se aumenta la densidad de corriente, se observa un incremento en la remoción de zinc. Esto se debe a que una mayor densidad de corriente produce una mayor velocidad de transferencia de iones, lo que conduce a una mayor remoción de iones de zinc. Sin embargo, es importante destacar que a medida que se aumenta la densidad de corriente, también se incrementa la energía consumida en el proceso, lo que puede resultar en un aumento en los costos operativos.
Velocidad de recirculación en función de la remoción de zinc:
En la segunda variable estudiada se puede concluir que la velocidad de recirculación tiene un efecto directo en la remoción de zinc en el proceso de electrodiálisis. A medida que se aumenta la velocidad de recirculación, se observa un incremento en la remoción de zinc. Esto se debe a que una mayor velocidad de recirculación aumenta el flujo de la solución a través de las membranas, lo que conduce a una mayor remoción de iones de zinc. Además, una velocidad de recirculación más alta permite una mayor eficiencia del proceso en términos de tiempo, lo que puede resultar beneficioso en términos de productividad y rendimiento del proceso.
pH en función de la remoción de zinc:
Se puede concluir que el pH de la solución tiene un efecto significativo en la remoción de zinc en el proceso de electrodiálisis. Ya que se pudo observar que la remoción de zinc es más efectiva en un ambiente alcalino, con un pH alrededor de 8 solo al inicio de las pruebas. Esto se debe a que, a pH más alto, se produce una mayor solubilidad de los iones de zinc, lo que permite una mayor transferencia de iones a través de las membranas. Sin embargo, es importante tener en cuenta que a pH muy alto se puede producir una disminución en la eficiencia del proceso debido a la formación de precipitados o al daño a las membranas. Por lo tanto, se debe buscar un equilibrio entre la remoción de zinc y las condiciones óptimas del proceso en términos de pH.
Como conclusión general, el mayor porcentaje de remoción alcanzado fue de 95.80% y las mejores condiciones de operación están representadas por de densidad de corriente de 120 A/m2, una velocidad de recirculación de 30 mL/min y un pH de 6.
En conclusión, se obtienen en este trabajo de investigación hallazgos similares al estudio realizado por Noroozi y col. [8], en dónde los resultados del estudio mostraron que la electrodiálisis fue efectiva en la eliminación de iones de zinc de soluciones acuosas, logrando una remoción de zinc del orden del 70-90% en diferentes condiciones de operación. Sin embargo, esta investigación resultó en mejores resultados ya que Noroozi obtuvo su mejor eficiencia de remoción de zinc (90%), con una densidad de corriente de 200 A/m2, mientras que en esta investigación se obtuvo un 95.45% de remoción de zinc con una densidad de corriente menor (120 A/m2), lo que indica también un menor consumo de energía. Mientras que el estudio realizado por El-Naas y col. [4], logró una remoción de zinc del orden del 85-95% también diferentes condiciones de operación, sin embargo, en comparación con la esta investigación la duración de las pruebas de este autor (El-Naas) fue de dos horas, por lo que también indica un mayor consumo de energía, es decir, el presenta trabajo obtuvo porcentajes similares en la remoción de zinc, pero usando un menor consumo de energía.











 nueva página del texto (beta)
nueva página del texto (beta)