Introducción
El indio es un elemento metálico situado en el grupo 13, periodo 5 de la tabla periódica y estado de oxidación +3 [1,2]. El nombre tiene su origen en la línea de espectro color índigo, es un metal plateado químicamente estable debido a que no reacciona con el aire y el agua a temperatura y presión estándar.
La extracción del In a partir de minerales es de importancia debido a que se encuentra en pequeñas cantidades (0.05 ppm) en la corteza terrestre y 0.072 ppm en la corteza oceánica [3]. El uso del In se ha incrementado debido a su aplicación en las tecnologías emergentes o estratégicas [4], soldaduras [5], dispositivos fotovoltaicos [6], material de interfaz térmica [7], baterías [8], pantallas de cristal líquido [1], entre otras.
Los minerales de In son extremadamente raros en la naturaleza, donde la roquesita es el mineral más importante; a menudo, el In sustituye a elementos con radios iónicos similares, especialmente aquellos que tienen coordinación tetraédrica con respecto al principal elemento metálico, (Cu+ In3+) = (Zn2+, Fe2+), (Cu+ Fe3+ S2) - (Cu+ In3+ S2) [9]. Generalmente, el In está asociado a algunos minerales sustituyendo elementos de forma acoplada como, esfalerita (ZnS), calcopirita (CuFeS2), estannita (Cu2FeSnS4), tennantita (Cu12As4S13) y casiterita (SnO2) [9,10]. El In sustituye al zinc dentro de la red cristalina de la esfalerita y representa el mineral económico principal [9]; alrededor del 95% de la producción global de In es derivada de la refinación de zinc y el 5% restante proviene de operaciones de refinación de cobre y estaño [11]; en la refinación del zinc parte de In se precipita durante el proceso de eliminación del hierro por medio de la formación de jarosita en medio ácido.
La formación de la jarosita formada en un proceso industrial permite el control de hierro (Fe3+), sulfatos (SO4 2-) y otras impurezas presentes en el sistema de lixiviación [12]; se representa típicamente con la fórmula MFe3(SO4)2(OH)6, donde M corresponde a alguno de los siguientes iones H3O+, Na+, Rb+, Ag+, NH4 +, o Pb2+[13]. Además, se han reportado contenidos de plomo, cobre, galio, arsénico, cadmio, también del In, utilizando espectroscopía de emisión atómica ICP-OES [14,15], por lo que recientemente se han desarrollado procesos para la obtención de estos metales utilizando algunos métodos pirometalúrgicos [14], en unión con los hidrometalúrgicos [16] con el uso de solventes orgánicos [17].
Otra fuente importante para la obtención de este metal es el reciclaje de productos electrónicos [18] como las pantallas de cristal líquido (LCD), donde el contenido de In es recuperado de forma selectiva mediante un proceso de lixiviación con ultrasonido en presencia de pirofosfato (P2O7 4-) y peróxido de hidrógeno (H2O2) [19].
El pirofosfato (PPi) es un ligando de interés por su coordinación versátil, solubilidad, baja toxicidad y biocompatibilidad [20]; puede formar complejos estables con el In (Ec. 1 y 2), hierro (Ec. 3) y cobre (Ec. 4 y 5) [21].
En este artículo se presentan los resultados de la lixiviación de jarositas con contenido de In a diferentes valores de pH y concentraciones de pirofosfato a temperatura ambiente. La experimentación y los resultados fueron evaluados con un análisis de varianza (ANOVA), porque permite disminuir el número de pruebas mediante la experimentación fraccionada sin perder representatividad.
Materiales y métodos
Las jarositas usadas en este trabajo son residuos una planta de electro-refinación del zinc. Para las soluciones de lixiviación se utilizaron reactivos de grado analítico y agua desionizada, pirofosfato de sodio (PPi) y ácido sulfúrico (H2SO4).
El contenido de metales se obtuvo mediante digestión ácida analizada por medio de espectrometría de absorción atómica (Varian SpectrAA 220 FS). La determinación de las especies mineralógicas se realizó por difracción de rayos X (Philips, X-Pert PW3040).
Todas las pruebas fueron realizadas usando agitación magnética a temperatura ambiente con 3 g jarosita en 100 mL de agua desionizada (30 g/L) a diferente pH y concentración de PPi (tabla 1) con la finalidad de evaluar estos parámetros en la lixiviación de In con ayuda de un diseño experimental. El control de pH se realizó con alícuotas de ácido sulfúrico diluido.
Tabla 1 Parámetros para las pruebas de lixiviación con 30 g/L de jarosita a diferente pH, concentración de pirofosfato (PPi) y tiempo de lixiviación a temperatura ambiente.
| Nivel | |||
| 1 | 2 | 3 | |
| pH | 5 | 6 | 7 |
| PPi (M) | 0.051 | 0.1 | 0.15 |
| Tiempo (min) | 30 | 60 | 120 |
Para el análisis termodinámico se utilizó el software Medusa Chemistry® desarrollado por el KTH Royal Institute of Technology [22] de acuerdo con las condiciones presentes en el sistema estudiado.
Durante la lixiviación se midió el potencial oxido reducción (ORP), pH y se tomaron muestras de la solución lixiviada a diferentes tiempos, para el análisis del contenido de In, Cu y Fe, se utilizó el espectrómetro de absorción atómica.
Para el Análisis de Varianza (ANOVA) se realizó un diseño experimental fraccionado 33-1 con los factores que afectan la lixiviación (pH, PPi y tiempo) con la finalidad de obtener una combinación representativa del comportamiento de los factores en la lixiviación del In, el diseño resultante fue de 27 pruebas con 3 factores y 3 niveles (tabla 1).
Resultados y discusión
Caracterización
Mediante difracción de rayos X (figura 1) se determinó la especie de jarosita de sodio (NaFe3(SO4)(OH)6) como especie mayoritaria, además de magnetita ((ZnFe)Fe2O4) presente en el residuo de una planta de refinación de zinc; por absorción atómica se determinó un contenido de 26.8 g/t In, 45.94% Fe, y 0.96% Cu.
Pruebas de lixiviación
Se realizaron 27 pruebas de lixiviación conforme al diseño experimental presentado en la tabla 1, los resultados obtenidos se presentan en la tabla 2 donde se obtienen diferentes porcentajes de lixiviación de In, Cu y Fe de acuerdo con la concentración de PPi, el pH y el tiempo de lixiviación a temperatura ambiente.
Tabla 2 Matriz de valores experimentales, disolución de In (%), hierro (%) y cobre (%) a temperatura ambiente.
| Prueba | PPI (M) | pH | Tiempo (min) | In (%) | Cu (%) | Fe (%) |
| 1 | 0.051 | 5 | 30 | 25.46 | 1.28 | 0.10 |
| 2 | 0.051 | 5 | 60 | 31.67 | 1.11 | 0.13 |
| 3 | 0.051 | 5 | 120 | 26.39 | 0.40 | 0.21 |
| 4 | 0.100 | 5 | 30 | 42.45 | 1.26 | 0.08 |
| 5 | 0.100 | 5 | 60 | 37.57 | 0.60 | 0.13 |
| 6 | 0.100 | 5 | 120 | 62.40 | 1.08 | 0.29 |
| 7 | 0.150 | 5 | 30 | 49.01 | 1.38 | 0.12 |
| 8 | 0.150 | 5 | 60 | 61.80 | 1.81 | 0.19 |
| 9 | 0.150 | 5 | 120 | 58.60 | 1.92 | 0.29 |
| 10 | 0.051 | 6 | 30 | 58.38 | 2.52 | 0.08 |
| 11 | 0.051 | 6 | 60 | 42.85 | 2.69 | 0.11 |
| 12 | 0.051 | 6 | 120 | 36.95 | 2.75 | 0.20 |
| 13 | 0.100 | 6 | 30 | 39.69 | 2.39 | 0.07 |
| 14 | 0.100 | 6 | 60 | 23.35 | 2.73 | 0.10 |
| 15 | 0.100 | 6 | 120 | 74.92 | 1.72 | 0.09 |
| 16 | 0.150 | 6 | 30 | 38.00 | 2.42 | 0.06 |
| 17 | 0.150 | 6 | 60 | 55.40 | 2.38 | 0.08 |
| 18 | 0.150 | 6 | 120 | 44.22 | 1.25 | 0.12 |
| 19 | 0.051 | 7 | 30 | 30.58 | 1.21 | 0.02 |
| 20 | 0.051 | 7 | 60 | 15.07 | 1.22 | 0.03 |
| 21 | 0.051 | 7 | 120 | 25.48 | 0.85 | 0.04 |
| 22 | 0.100 | 7 | 30 | 86.29 | 3.29 | 0.11 |
| 23 | 0.100 | 7 | 60 | 89.52 | 3.29 | 0.13 |
| 24 | 0.100 | 7 | 120 | 84.03 | 3.60 | 0.01 |
| 25 | 0.150 | 7 | 30 | 59.49 | 2.52 | 0.06 |
| 26 | 0.150 | 7 | 60 | 46.70 | 0.03 | 0.08 |
| 27 | 0.150 | 7 | 120 | 46.88 | 1.90 | 0.11 |
Análisis estadístico
Como se puede observar en la figura 2, la distribución de las métricas descriptivas, muestran que el valor mayor en la media es para el In (36.7); mientras que, el Fe y Cu, presentan valores relativamente bajos (0.15% y 8.58%, respectivamente). El In presenta una mayor desviación de los datos (20.39%), es decir, mayor será la variabilidad o dispersión de los datos en relación con su media debido a que los efectos en las pruebas tienen mayor impacto en el porcentaje de recuperación de In. Este comportamiento está relacionado a la concentración de In en el sistema de lixiviación (µ = 0.4 ppm). Para el Cu y Fe se obtienen una desviación de 1.76% y 0.08% respectivamente, existe baja variación respecto a la media debido a la formación de complejos estables con el PPi.
A diferencia del In, el Cu y Fe presentan distribución simétrica, donde se observa una distribución mayor entre los valores del máximo (89.52%) y mínimo (15.07%), los datos se encuentran más dispersos entre sí, además, de tener un porcentaje de lixiviación media 44.21% de In. Para el Cu y Fe se tiene un promedio del 1.80% y 0.10% respectivamente (figura 2, tabla 3).
Análisis de Varianza
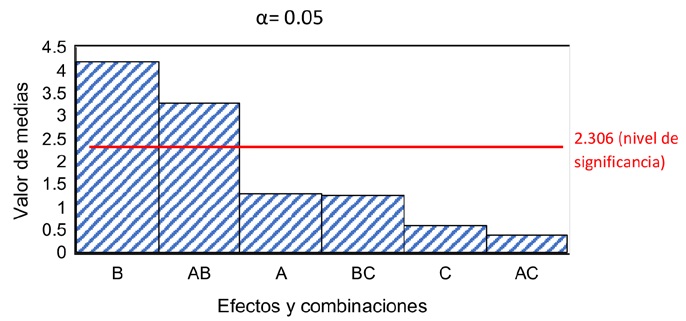
Se consideró usar el efecto de pH (A), concentración de PPi (B) y tiempo (C) así como sus combinaciones (AB, BC, AC) para evaluar el porcentaje de lixiviación de In presente en la jarosita con un análisis de varianza (tabla 1). De acuerdo con el diagrama de pareto con los efectos estandarizados (figura 2) no todas las combinaciones resultaron significativas, solo el efecto de la concentración de PPi (B) y el efecto combinado entre el pH y la concentración de PPi (A y B). Los demás efectos estandarizados individuales y en conjunto no tienen una relación significativa con la recuperación del In presente en la jarosita con un nivel de confianza del 95%.
2.306 (nivel de significancia)
Por lo que para el análisis de varianza solo se tomaron en cuenta los términos de pH (A) y concentración de PPi (B), en la tabla 4 se presentan los grados de libertad (GL), suma ajustada de los cuadrados (SC Ajust.), cuadrados medios ajustados (MC Ajust.), estadístico F (valor F) y valor p. El valor p permite evaluar la relación de igualdad entre todas las medias de la población estudiada, la hipótesis planteada se relaciona con el valor p, al ser valores cercanos a 0 entre las medias de la población se afirma la hipótesis nula, la cual asume que no hay una diferencia significativa entre los grupos en términos de la variable de medición.
Tabla 4 Análisis de varianza con los factores, pH y concentración para In.
| Fuente | GL | SC Ajust. | MC Ajust. | Valor F | Valor p |
| Modelo | 8 | 7742.3 | 967.8 | 6.98 | 0 |
| Lineal | 4 | 4027.1 | 1006.8 | 7.26 | 0.001 |
| pH | 2 | 486.8 | 243.4 | 1.76 | 0.201 |
| Concentración | 2 | 3540.3 | 1770.2 | 12.77 | 0 |
| Interacciones de 2 términos | 4 | 3715.2 | 928.8 | 6.7 | 0.002 |
| pH*Concentración | 4 | 3715.2 | 928.8 | 6.7 | 0.002 |
| Error | 18 | 2495 | 138.6 | ||
| Total | 26 | 10237.3 |
Análisis de efectos
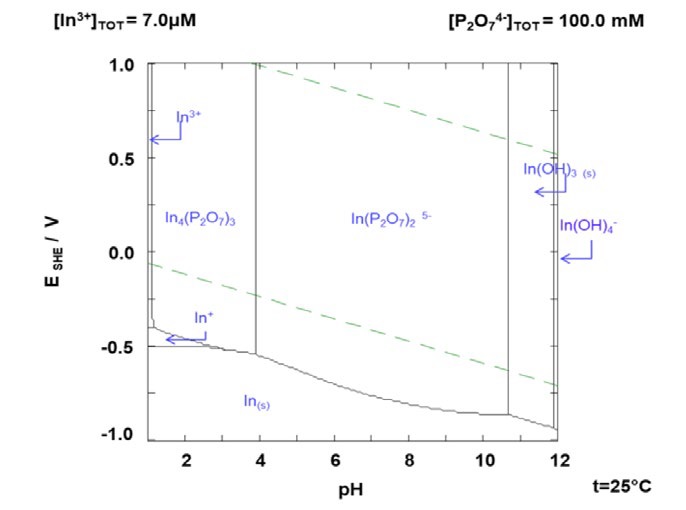
La figura 3, presenta el efecto del pH en la lixiviación de la jarosita, en la medida que el pH se incrementa de 5 a 7 la recuperación de In se favorece de 44 al 53.8% respectivamente, este comportamiento está relacionado a la formación del complejo In(P2O7)2 5- el cual permite que el In pase a solución (figura 4 y 5). Sin embargo, el efecto del pH está relacionado a la presencia del complejo Fe-PPi (FeP2O7 -) el cual limita la presencia de PPi necesario para la lixiviación de In (figura 6).

Figura 5 Diagrama de distribución de especies para el sistema In-P2O7 4-, 0.10 M P2O7 4- y 0.7x10-6 M In a 25°C.
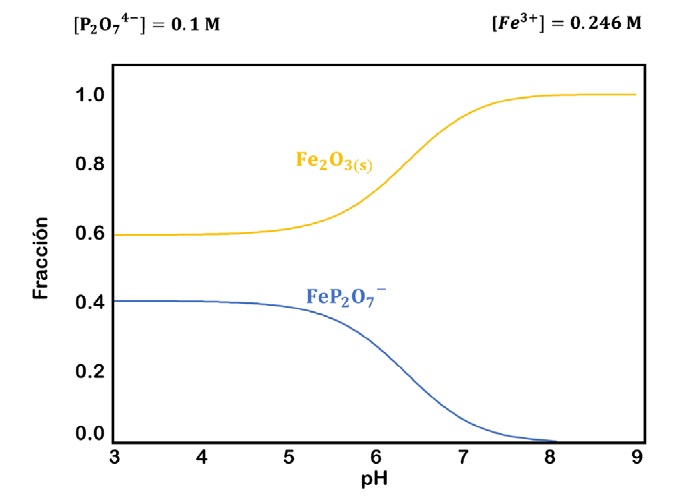
Figura 6 Diagrama de distribución de especies para el sistema Fe-P2O7 4-, 0.246 M Fe y 0.1 M P2O7 4- a 25°C.
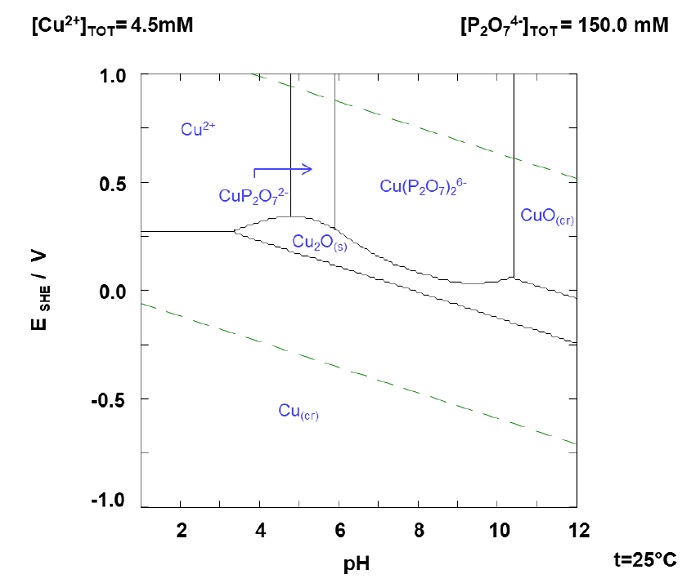
Para el efecto de la concentración del pirofosfato (figura 7), en la medida en que la concentración de PPi se incrementa, el porcentaje de lixiviación de In también se favorece, por ejemplo, a una concentración de 0.05 M se tiene una recuperación de 32.5% y si se incrementa la concentración a 0.1 M se alcanza una recuperación del 60% de In. Finalmente, a una concentración de 0.15 M la recuperación desciende, este comportamiento puede estar relacionado a la formación de un complejo entre el cobre y el hierro que se favorece a mayor concentración de PPi; si se comparan los diagramas a 0.1 M de PPi y 0.15 M de PPi del cobre (figura 8 y 9, respectivamente). Se observa que el área de predominancia del ion Cu(P2O7)2 6- es mayor en la concentración de 0.15 M a pesar de ser una diferencia pequeña podría ser la razón de la caída de recuperación a un pH 7 y 0.15 M de PPi.
El efecto del tiempo en lixiviación se presenta en la figura 10 donde en la medida que se aumenta el tiempo la lixiviación de In se favorece en la solución a partir de la jarosita a las condiciones ensayadas.
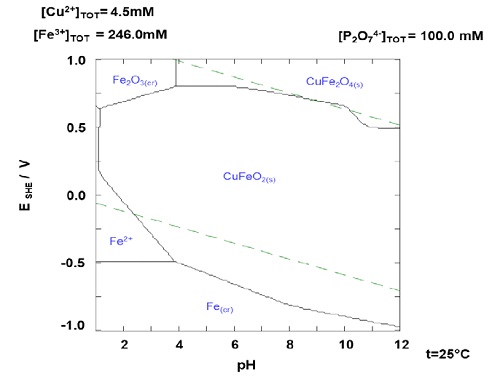
Para el caso del cobre y hierro en las condiciones estudiadas no se tienen disoluciones altas, el cobre tiene una disolución menor que 3.5% y el hierro menor que 0.28%; este comportamiento podría estar relacionado a la posible formación del complejo sólido CuFeO2 y la baja descomposición de la jarosita en las condiciones estudiadas (figura 10) lo que permite que la mayor cantidad de cobre y el hierro permanezcan con el mineral.
Conclusiones
Los resultados presentados demuestran la posibilidad de extracción de In con pirofosfato a partir de la jarosita en un rango de pH de 5 a 7.
De acuerdo con los resultados estadísticos se tiene una correlación entre el pH y la concentración de pirofosfato asociados a la recuperación de In, este proceso permite una lixiviación selectiva del In, debido a la baja disolución de hierro y cobre; se obtiene una lixiviación del 89.52% In, 0.1% Fe, y 3.3% Cu a pH 7 y 0.1 M de pirofosfato a temperatura ambiente.











 nova página do texto(beta)
nova página do texto(beta)