Introducción
La principal propiedad del cobre es la conductividad eléctrica y en el siglo XXI prácticamente se ha garantizado su uso en aplicaciones eléctricas y electrónicas. El cobre tiene mayor fuerza y resistencia a la fatiga y es menos propenso a la corrosión. En aplicaciones no eléctricas, la característica más explotada del cobre es la transferencia de calor, en la infraestructura, el cobre sigue siendo un material idóneo por su compacidad y también su facilidad de unión por soldadura, maleabilidad, conductividad y ductilidad. En forma de aleación, su buena resistencia a la tracción, se combinan para convertirlo en un metal versátil, cuando está aleado con zinc permite la formación del latón, el cuál es lo suficientemente dúctil en caliente y permite forjar formas intrincadas como válvulas y grifos; cuando está frío, exhibe características de mecanizado buenas para que sea utilizado como estándar [1]. En los últimos años, la demanda de cobre ha crecido rápidamente como resultado del aumento de la población mundial, de las economías emergentes y la búsqueda de una sociedad sostenible [2]. En la naturaleza, el cobre se presenta como minerales, malaquita (Cu2(OH)2CO3), cuprita (Cu2O), calcopirita (CuFeS2), calcocita (Cu2S), covelita (CuS) y cobre nativo (Cu) [3]. La calcopirita (CuFeS2) es uno de los minerales de cobre, más abundantes, representando aproximadamente el 70% del cobre en la Tierra [4].
La extracción hidrometalúrgica de cobre a partir de calcopirita se considera más económica y amigable con el medio ambiente que la extracción pirometalúrgica, especialmente cuando los minerales de sulfuro que contienen cobre presente en menas de baja ley [5]. El procesamiento del cobre a partir de este tipo de sulfuros de baja ley es limitado debido a la naturaleza refractaria durante la lixiviación de la calcopirita [6]; por lo que, actualmente se utilizan procesos de tratamiento de minerales con la finalidad de obtener un concentrado de cobre que es tratado por la vía pirometalúrgica hasta la obtención del cobre metálico. El principio químico para la extracción convencional de cobre a partir de CuFeS2 es la oxidación selectiva de los iones sulfuro (S) con oxígeno para la formación de dióxido de azufre (SO2) en forma gaseosa y cobre metálico como producto. Esta ruta requiere del manejo SO2 para la conversión en ácido sulfúrico, además se puede llegar a azufre elemental, pero implica la disociación térmica y reacción de los minerales sulfurados con SO2[7]. Por la complejidad del método, se están trabajando en algunas alternativas donde se reduzca la generación de gases, por lo que el procesamiento hidrometalúrgico de la calcopirita sigue siendo un área atractiva para su procesamiento. Los trabajos de investigación son importantes debido a que los mecanismos presentes en este tipo de sistemas son poco conocidos para cada medio acuoso. Se pueden seguir diferentes rutas para el tratamiento hidrometalúrgico de la calcopirita, estos incluyen el tratamiento térmico previo a la lixiviación, la lixiviación directa y la electrolixiviación química [8], por biolixiviación (BRISA, Biolixiviación Rápida Indirecta con Separación de Acciones), en dos etapas, una etapa química y una biológica [9]. En los últimos años, se ha estudiado a la lixiviación de calcopirita con amoníaco, debido a la mayor selectividad del amoniaco para la disolución de cobre en relación al ácido sulfúrico, especialmente para minerales que contienen carbonatos. En la lixiviación amoniacal se forma complejo Cu(NH3)4 2+ en función del pH, donde la extracción de cobre puede ser baja a pH menor que 9, además el pH de la solución es difícil de controlar debido a la evaporación del amoníaco [10]. Por otro lado, el uso de ácido clorhídrico, puede llegar a ser más efectivo que el sulfúrico en la lixiviación de calcopirita, sin embargo, es muy poco utilizado en la industria debido a su alto costo, corrosividad y alta volatilidad [11]. Además, se han utilizado agentes orgánicos para la formación de complejos con el cobre como el ácido etilendiaminotetraacético (EDTA) en la lixiviación de calcopirita, este agente orgánico puede formar complejos estables con varios elementos como el hierro y cobre, sin embargo, es necesario el uso de dos etapas con la finalidad de obtener una solución de cobre con baja concentración de hierro. En este sentido, en la primera etapa se puede usar ácido oxálico para disolver el hierro y precipitar el cobre en una sal de oxalato; finalmente, en una segunda etapa se promueve la lixiviación del residuo con ácido sulfúrico (H2SO4), peróxido (H2O2), etilenglicol (C2H6O2) y EDTA para obtener el cobre en forma iónica [12].
El diseño factorial se utiliza para estudiar el efecto de la interacción de los factores en la respuesta (% de recuperación de cobre y % de disolución de hierro). La contribución de cada efecto de interacción se demuestra a través del diseño factorial tomando en consideración varios factores (pH, EDTA y H2O2), con este enfoque evaluará no solo el efecto de las variables en la respuesta, sino también la característica de respuesta. El diseño factorial permite la evaluación de los efectos de los factores principales y las interacciones de los diferentes factores [13], a medida que aumenta la cantidad de factores a considerar se expande rápidamente los recursos para los experimentos. Por lo que se han propuesto diseños factoriales fraccionados (FrFD) para detectar el efecto de los factores e identificar que variables tienen un efecto significativo en el proceso [14], se puede reducir la cantidad de experimentos sin pérdida de información sobre los efectos principales [15]. En este trabajo se presentan los resultados obtenidos de la lixiviación de cobre con EDTA a partir de calcopirita con un diseño factorial fraccionado 3(3-1), variando el pH, la concentración del EDTA y peróxido de hidrogeno (H2O2).
Metodología
Caracterización
Durante el desarrollo experimental se utilizaron cristales de calcopirita como mineral de cabeza a un tamaño de partícula entre -45 μm (malla 375) y +53 μm (malla 375). La determinación de las especies mineralógicas se realizó en un analizador portátil XRD-XRF TERRA, Olympus, en un intervalo angular de 5º a 55º con un escaneo de 100 exposiciones de 20 segundos cada una con una fuente de radiación de cobalto. La identificación se llevó a cabo con ayuda del software XPowder Ver. 2010.01.35 PRO y una base de datos PDF2. Los reactivos utilizados son de grado analítico, HNO3 (MEYER®), HCl (MEYER®). Para la caracterización cuantitativa de los elementos presentes en la muestra, se pesó el mineral en una balanza analítica (Ohaus®) y la digestión ácida se realizó en un vaso de precipitados de 250 mL con agua regia, sobre una parrilla eléctrica (Ohaus®) para incrementar la temperatura. La relación de los ácidos HNO3 y HCl fue de 3:1. Durante la cuantificación de metales en solución se empleó el método instrumental de espectroscopía de absorción atómica (SpectrAA 220 Varian).
Sistema de lixiviación
En el sistema de lixiviación se utilizó un agitador mecánico (CAFRAMO BDC-250), una parrilla eléctrica (OHAUS®), un medidor multiparámetro (Hanna S5521), vaso de precipitados de 250 mL (PYREX®), tubos de ensayo (PYREX®) una micropipeta de 5 ml (Omega®) y reactivos de grado analítico, EDTA (MEYER®), H2SO4 (MEYER®), Ca(OH)2 (MEYER®) y H2O2 (MEYER®).
Para las pruebas de lixiviación de la calcopirita en presencia de EDTA, se utilizó el agitador mecánico para favorecer la cinética de reacción, la parrilla eléctrica para el control de temperatura y un medidor multiparámetro para las lecturas de pH, ORP y temperatura. En el vaso de precipitados de 250 mL se llevaron a cabo los procesos de lixiviación con 100 mL de solución y 60 mg de mineral a diferente concentración de peróxido (H2O2) y EDTA. El peróxido se adicionó cada media hora hasta llegar a la concentración propuesta en el desarrollo experimental, el pH del sistema se reguló con alícuotas de H2SO4 diluido y Ca (OH)2 de acuerdo al pH propuesto y se tomaron alícuotas a tiempos determinados. Se utilizo el Ca (OH)2 por su bajo costo industrial.
Diseño experimental
Para evaluar los tres efectos propuestos (EDTA, H2O2, pH) en este sistema de lixiviación, se realizó un diseño factorial de 33-1. El diseño factorial completo (33) se descartó con la finalidad de disminuir la cantidad de pruebas a la mitad sin perder la representatividad. El diseño factorial 3(3-1) plantea realizar 27 pruebas en dos bloques: bloque 1 (pruebas) y bloque 2 (réplicas). Los niveles y factores se presentan en la tabla 1, donde se muestran los niveles bajo, medio y alto con la finalidad de evaluar los efectos de EDTA, H2O2 y pH. Además, se pretende obtener la media, desviación estándar, el mínimo, el máximo y los cuartiles a fin de obtener más información con respecto al comportamiento del sistema.
Tabla 1 Matriz de factores y niveles
| Prueba | |||
| Factor | Bajo (1) | Medio (2) | Alto (3) |
| EDTA (M) | 0.0006 | 0.006 | 0.06 |
| H2O2 (M) | 0.2 | 0.4 | 0.6 |
| pH | 4 | 4.5 | 5 |
Las especies presentes en el sistema propuesto fueron identificadas con ayuda de los diagramas de distribución de especies y predominancia realizados en el Software Medusa, considerando los equilibrios de la base de datos de Hydra [16].
Resultados
Caracterización del mineral
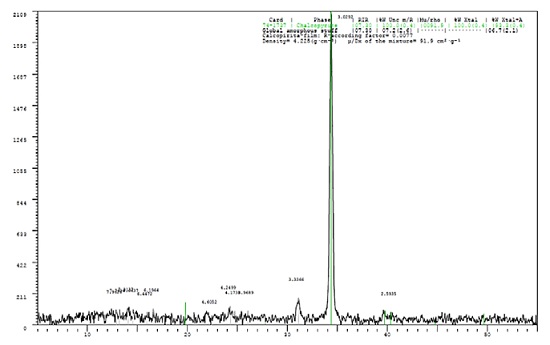
El mineral se caracterizó por difracción de rayos X, donde se identificó a la calcopirita (CuFeS2) como mineral principal (93.3%) con trazas de una fase amorfa - cristalina no identificada (6.7%, figura 1), la determinación del contenido metálico se realizó por espectroscopia de absorción atómica, se tiene 30.3% Cu y 26.75% Fe (tabla 2).
Diseño experimental
El resultado de las pruebas de lixiviación en un tiempo de 10 horas a 25°C (+- 0.5 °C) con una relación sólido/líquido de 0.6 g/L, se presentan en la tabla 3.
Tabla 3 Matriz de concentración en solución de Fe (%) y Cu (%)
| Prueba | Factor | Resultado | |||
| H2O2 | EDTA | pH | Cu (%) | Fe (%) | |
| 1 | 1 | 1 | 1 | 28.40 | 3.59 |
| 2 | 1 | 1 | 2 | 33.09 | 8.86 |
| 3 | 1 | 1 | 3 | 16.89 | 1.40 |
| 4 | 1 | 2 | 1 | 40.46 | 40.91 |
| 5 | 1 | 2 | 2 | 27.16 | 20.23 |
| 6 | 1 | 2 | 3 | 24.27 | 21.63 |
| 7 | 1 | 3 | 1 | 51.66 | 55.47 |
| 8 | 1 | 3 | 2 | 34.12 | 34.24 |
| 9 | 1 | 3 | 3 | 36.74 | 34.40 |
| 10 | 2 | 1 | 1 | 27.30 | 1.06 |
| 11 | 2 | 1 | 2 | 16.84 | 0.29 |
| 12 | 2 | 1 | 3 | 13.13 | 0.15 |
| 13 | 2 | 2 | 1 | 36.96 | 28.69 |
| 14 | 2 | 2 | 2 | 32.44 | 19.71 |
| 15 | 2 | 2 | 3 | 22.34 | 0.68 |
| 16 | 2 | 3 | 1 | 38.98 | 31.90 |
| 17 | 2 | 3 | 2 | 32.92 | 21.13 |
| 18 | 2 | 3 | 3 | 22.90 | 20.60 |
| 19 | 3 | 1 | 1 | 26.96 | 0.88 |
| 20 | 3 | 1 | 2 | 20.04 | 0.20 |
| 21 | 3 | 1 | 3 | 12.83 | 0.15 |
| 22 | 3 | 2 | 1 | 41.14 | 23.44 |
| 23 | 3 | 2 | 2 | 28.66 | 1.22 |
| 24 | 3 | 2 | 3 | 18.55 | 0.33 |
| 25 | 3 | 3 | 1 | 44.45 | 20.58 |
| 26 | 3 | 3 | 2 | 41.29 | 29.00 |
| 27 | 3 | 3 | 3 | 18.18 | 15.22 |
Datos estadísticos
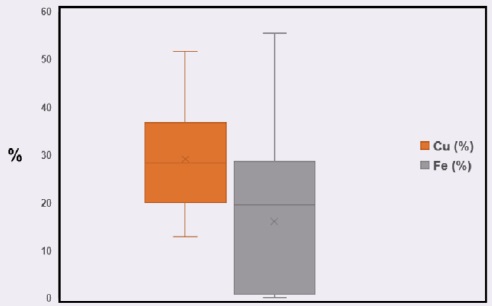
La tabla 4, presenta las medias estadísticas para las pruebas de lixiviación de la calcopirita. El valor mínimo de recuperación en cobre es de 12.83% con una disolución mínima de hierro del 0.15%; mientras que las mayores recuperaciones de cobre son de 51.66% y una disolución de hierro de 55.47%. La desviación estándar de Fe (15.73) es mayor que la de Cu (10.15), esto quiere decir que, las disoluciones de hierro se encuentran más dispersos con respecto a su media en las lixiviaciones y su extensión en la distribución de datos se muestra en el diagrama de la figura 2.
Tabla 4 Medidas estadísticas
| Cu (%) | Fe (%) | |
| Media | 29.64 | 16.18 |
| Desviación estándar | 10.15 | 15.73 |
| Mínimo | 12.83 | 0.15 |
| Q1 - 25% | 22.48 | 0.93 |
| Q2 - 50% | 28.53 | 19.97 |
| Q3 - 75% | 36.91 | 27.38 |
| Máximo | 51.66 | 55.47 |
El primer cuartil indica que el 25% de las pruebas muestran una recuperación igual o menor al 22.48% de cobre con una disolución de hierro del 0.93%, el segundo cuartil indica que el 50% de las pruebas muestran una recuperación igual o menor al 28.53% de cobre con una disolución de hierro del 19.97%, el tercer cuartil indica que el 75% de las pruebas muestran una recuperación igual o menor al 36.91% de cobre con una disolución de hierro del 27.38%.
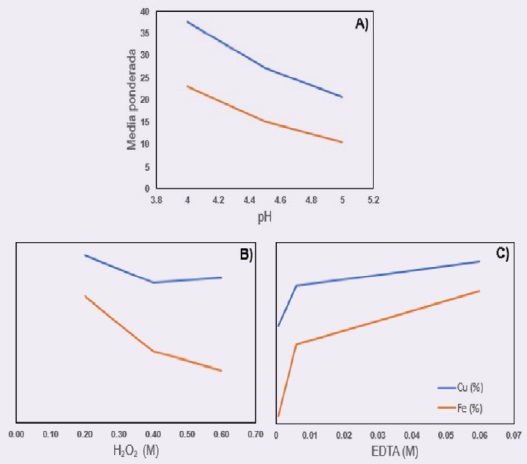
De acuerdo, con los resultados del diseño experimental, el sistema muestra un comportamiento selectivo para la disolución de cobre a una concentración de 0.6 M de H2O2, 0.0006 M de EDTA y pH 4.5 (tabla 5), obteniendo una mayor recuperación de cobre (20.04%) en la solución y una menor disolución de hierro (0.2%).
Tabla 5 Resultado óptimo durante la experimentación
| Factor | Resultado | |||
| H2O2 | EDTA | pH | Cu (%) | Fe (%) |
| 3 | 1 | 2 | 20.04 | 0.2 |
La mayor recuperación de cobre (51.66%) se obtuvo a una concentración de 0.2 M de H2O2, 0.06 M de EDTA y pH 4, sin embargo, con estos parámetros se tiene una baja selectividad en el sistema al tener una mayor disolución de hierro (55.47%, tabla 6).
Tabla 6 Resultados del proceso menos óptimo durante la experimentación
| Factor | Resultado | |||
| H2O2 | EDTA | pH | Cu (%) | Fe (%) |
| 1 | 3 | 1 | 51.66 | 55.47 |
La máxima extracción del cobre del 51.66% sugiere una posible pasivación del mineral causada por una capa protectora no conductora de azufre, como sucede en los procesos hidrometalúrgicos donde están presentes algunas especies relacionadas a este elemento, esta capa impide el transporte de reactivos y productos en la lixiviación [16].
La variable que tiene un mayor efecto en el sistema EDTA-Fe-Cu es la concentración de EDTA, debido a que la concentración de EDTA está relacionado a la liberación de iones de hierro a la solución; es decir, a mayor concentración de EDTA se tiene una mayor liberación de los iones Fe y Cu, sin embargo, si se reduce su concentración, la liberación de los iones de Fe a la solución disminuyen y se promueve una mayor disolución de cobre generando una mayor selectividad del sistema.
Es importante mencionar que el EDTA puede formar complejos con el Ca2+ liberado durante la adición de Ca(OH)2 al regular el pH del sistema disminuyendo la disponibilidad del EDTA para formar complejos con el cobre; sin embargo, a las condiciones estudiadas no se encontraron efectos adversos durante la lixiviación debido a que su uso se restringió al pH 5. Además, se tiene una concentración de EDTA en exceso en relación al cobre presente en el mineral (figura 3C).
Comportamiento del sistema
En la figura 3, se observa la variación en los valores de recuperación porcentual tanto de cobre como de hierro, al finalizar la lixiviación. Donde la relación de recuperación de ambos metales es inversamente proporcional al aumento de pH (figura 3A), es decir que en la medida que se incrementa el pH, el porcentaje de recuperación de hierro y cobre disminuye. Un comportamiento interesante muestra que con el incremento de la concentración de peróxido de hidrógeno (H2O2) (Figura 3B), se incrementa la selectividad del proceso, marcándose una clara diferencia entre la recuperación de cobre y la disolución de hierro. Por otra parte, el incremento de EDTA promueve la disolución de ambos elementos por lo tanto hace que el proceso sea menos selectivo para la recuperación de cobre y la disolución de hierro (figura 3C).
El comportamiento observado en los resultados de las lixiviaciones con relación a la recuperación de cobre y la disolución de hierro presente se puede explicar mediante los diagramas de distribución de especies a altas y bajas concentraciones, teniendo en cuenta el diseño factorial efectuado, en las que se muestran las especies sólidas y liquidas formadas en el proceso.
La figura 4, presenta el efecto de la concentración de EDTA del diseño experimental, en relación con la formación de especies con el cobre y hierro a distintos valores de pH. Por lo que a un pH inferior a 4 y a una concentración de 0.0006 M se tiene una mayor presencia de complejos del hierro en forma sólida (Fe2O3); mientras que, a un pH mayor que 4, los complejos del cobre soluble (Cu(EDTA)2-) se mantienen en el sistema, sin embargo, se promueve la formación del CuFe2O4 responsable de la inestabilidad y baja recuperación de cobre.

Figura 4 Diagrama distribución de especies para el sistema Cu-Fe-EDTA a 0.0006 M EDTA, 2.8 x10-3 M Cu y 2.8 x10-3 M Fe a 25°C [17].
Mientras que a mayores concentraciones de EDTA 0.06 M del diseño experimental realizado (figura 5), se tiene una menor cantidad de especies solidas pero la distribución de especies es homogénea. Este comportamiento provoca que exista una mayor solubilidad de la calcopirita, pero con un sistema menos selectivo a diferentes pH, es decir se tiene tanto el cobre como el hierro en solución.
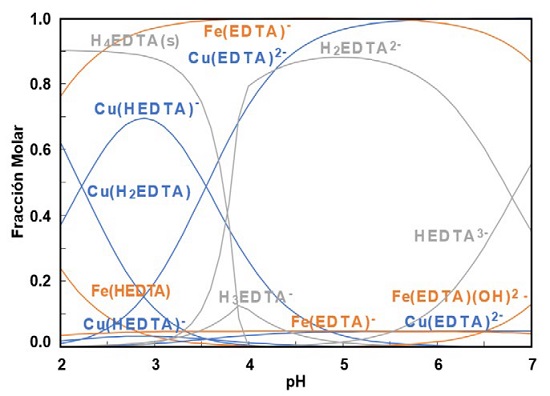
Figura 5 Diagrama distribución de especies para el sistema Cu-Fe-EDTA a 0.06 M EDTA, 2.8 x10-3 M Cu y 2.8 x10-3 M Fe a 25°C [17]
A pesar de que a pH de 3.5 (figura 4) y 3 (figura 5) para las diferentes condiciones es posible la recuperación de cobre debido a posibilidad de formación de los complejos de Cu-EDTA, también se promueve a la formación de los complejos Fe-EDTA, promoviendo una menor selectividad del sistema.
Finalmente, reducir el contenido de hierro en la solución permite proponer un sistema selectivo para la disolución de cobre a partir de calcopirita (CuFeS2) y eliminar procesos de pretratamiento que limiten la presencia de algunos de los elementos presentes en la matriz del mineral o la oxidación del azufre mediante procesos pirometalúrgicos que liberan gases contaminantes, lo que conlleva a la reducción de costos en la etapa de purificación y concentración.
Conclusiones
De acuerdo con el comportamiento del sistema EDTA-Cu-Fe, se encontró que a una concentración de 0.006 M de EDTA, 0.6 M de peróxido de hidrogeno y a pH de 4.5, el sistema permite una recuperación selectiva de cobre del 20.04% con baja disolución de hierro (0.2%), sin embargo, se forman precipitados que limitan la recuperación de cobre; en la medida que se incrementa la concentración del EDTA la recuperación del cobre se incrementa a 51.66% y se promueve una baja selectividad del proceso con una disolución de hierro del 55.47%.
Recomendaciones
Debido a que la concentración del EDTA influye para la recuperación de cobre de forma selectiva, se recomendaría mantener una baja concentración de EDTA a pH 4.5. La mejor relación entre concentración del Cu liberado/EDTA fue de 9:1 a pH 4.5, por lo que se recomienda mantener esta relación si se pretende de variar las relaciones S/L y cuantificar el consumo del EDTA.











 nueva página del texto (beta)
nueva página del texto (beta)