Introducción.
La calcopirita (CuFeS2) representa el 70% de las reservas mundiales del cobre [1]. Este mineral es muy refractario y por ello se procesa principalmente por métodos pirometalúrgicos, los cuales tienen desventajas importantes como: altos costos de producción y generación de gases tóxicos.
Una alternativa a los procesos pirometalúrgicos son los hidrometalúrgicos, ya que éstos, presentan algunas ventajas importantes; tales como, su capacidad para el tratamiento de menas pobres (cada vez más comunes en el caso del cobre) y un control más fácil de los subproductos, lo cual permite disminuir los efectos medioambientales de la obtención del metal.
Alrededor del 80% de los minerales de cobre son procesados mediante fundición y refinación. El otro 20% es obtenido hidrometalúrgicamente. De manera general los procesos hidrometalúrgicos presentan las siguientes etapas [2]:
Lixiviación en medio ácido, para romper la red cristalina, produciéndose una solución impura de cobre.
Extracción por solventes para transferir el cobre a una solución pura (un electrolito altamente concentrado en cobre puro).
Electrodeposición del cobre en un cátodo de cobre a partir del electrolito puro.
Básicamente existen dos tipos de procesos hidrometalúrgicos: los oxidativos y los reductivos. Una de las principales limitantes de los procesos hidrometalúrgicos oxidativos es la pasivación.
Para eliminar esta desventaja se han probado, con limitado éxito, diferentes agentes oxidantes como el ion férrico, peróxido de hidrógeno y oxígeno a elevada presión [3, 4]. Como alternativa, también se han empleado microorganismos como la Acidithiobacilus ferroxidans, para disminuir la pasivación superficial; sin embargo, hasta el momento los procesos biológicos por su lentitud sólo resultan exitosos para minerales con baja concentración de cobre [5].
En 1969 se estableció que la película que rodea la calcopirita durante la lixiviación con Fe3+, forma un sulfuro bimetálico con estructura y propiedades químicas distintas a la materia prima original, pero con las mismas propiedades semiconductoras [6]. Estos productos intermedios son el resultado de las transformaciones del estado sólido que favorecen la solubilización de cationes en los vértices del cristal. Por lo tanto, el modelo implica que la reacción se lleva a cabo preferentemente en la interfaz de la estructura cristalina [7].
Para poder inhibir la pasivación que se presenta al oxidar la calcopirita, la reducción electro-asistida representa una alternativa razonable. Un método alternativo para transformar la calcopirita es la electro-lixiviación, que consiste en reducir la calcopirita (CuFeS2) a calcocita (Cu2S) u otro sulfuro de cobre de fácil extracción o incluso cobre metálico, esto mediante la aplicación de corriente eléctrica.
La reducción electro-asistida de la calcopirita ha sido estudiada en presencia de ácidos fuertes como el HCl, H2SO4[8, 9], al utilizar el ácido sulfúrico como medio lixiviante la cinética de reducción disminuye debido a la formación de una capa pasiva que limita la reacción de reducción. Sin embargo, al utilizar HCl no es posible la formación de azufre elemental, ya que los estudios termodinámicos muestran que la reacción del Cl- con el H2S es poco probable, de esta forma el Cl- no se puede reducir y por lo tanto no promueve la oxidación del H2S a S. El gas cloro (Cl2) o clorato (ClO3 - ) son las únicas especies que pudieran promover la oxidación del H2S y no se presentan en el compartimento catódico del reactor de lixiviación reductiva electro-asistida y por ende la pasivación no se presenta en este sistema, pero, el costo de operación se ve incrementado al tratarse de un ácido muy corrosivo.
En esta investigación se estudia la reducción electro-asistida de la calcopirita utilizando ácido acético como medio lixiviante con el fin de buscar una alternativa para reducir la calcopirita en un medio mucho menos agresivo (comparado con el HCl) y menos oxidante (comprado con el H2SO4) para poder ofrecer una alternativa a los problemas antes mencionados. Al ser un ácido de carácter débil se espera que el ácido acético no oxide al ácido sulfhídrico generado durante la reducción y de esta manera inhibir la pasivación.
Procedimiento experimental
El programa experimental se divide en tres etapas. En la primera etapa se llevó a cabo un estudio termodinámico para conocer los complejos que pueden formarse con el cobre, hierro y el ácido acético.
En la segunda etapa se preparó el mineral de calcopirita, el cual fue maquinado y montado en tubos de teflón para obtener electrodos de disco rotatorio y llevar a cabo el estudio electroquímico. Es importante mencionar que la superficie del electrodo de calcopirita fue preparada adecuadamente y renovada para cada uno de los experimentos realizados. Para determinar las mejores condiciones energéticas para reducir la calcopirita en el ácido acético, se utilizó una celda electroquímica convencional de tres electrodos de 100 mL de capacidad, la cual estaba constituida por: el electrodo de trabajo de calcopirita con un área superficial de 30 mm2; el electrodo de referencia de Ag/AgCl, el cual se sumergió en un capilar de Luggin que contiene una solución saturada de KCl y una punta de platino y finalmente una barra de grafito como contraelectrodo. Estos electrodos se conectaron al potenciostato. Las técnicas electroquímicas que se llevaron a cabo fueron: potencial de circuito abierto (OCP) para todas las concentraciones de ácido acético estudiadas (0.5 a 6 M) y voltametrías lineales partiendo del OCP aplicando diferentes potenciales catódicos (-0.8 y -2.2 V vs SHE) a temperatura ambiente y con una velocidad de barrido de 0.02 V/s. El OCP indica el potencial de reposo, éste fue el punto inicial al llevar a cabo las voltametrías lineales catódicas que permiten estudiar los procesos de reducción a diferentes potenciales.
En la tercera etapa mediante la técnica de Microscopia Electrónica de Barrido de Emisión de Campo (FESEM) se caracterizaron las superficies más relevantes de los electrodos de calcopirita sometidos a los experimentos de voltametría lineal, esto con el fin de realizar un análisis microestructural y con ayuda de Espectroscopía de rayos X de energía dispersiva (EDS) poder conocer la composición química de los productos de reducción formados en la superficie de los electrodos en diferentes condiciones de potencial catódico. Es importante mencionar que la disolución de hierro es una medida la conversión de la calcopirita y por ello, mediante la técnica de espectrofotometría de absorción atómica (AAS) se analizó la cantidad de Fe presente en las soluciones de los experimentos más relevantes con el fin de corroborar que la reducción de la calcopirita es posible al utilizar el ácido acético como medio lixiviante.
Resultados y discusión
Estudio termodinámico
Los diagramas Pourbaix presentados en la figura 1a y 1b (se muestran las zonas de predominio de los diferentes especies sólidas y solubles de Cu y Fe, respectivamente para el sistema CuFeS2-CH3COO-- H2O. La construcción de los diagramas termodinámicos se llevó a cabo empleando el software Medusa.

Figura 1 Diagrama de Pourbaix del sistema CuFeS2-CH3COO-- H2O que muestra las zonas de estabilidad de las especies de a) Cu y b) Fe a una temperatura de 25°C. Las concentraciones usadas para la construcción del diagrama fueron 0.1, 0.1 y 0.2*10-5 M de Cu, Fe y S respectivamente y 2 M de CH3COO-.
En la figura 1a se observa que, la calcopirita puede ser reducida en este medio electrolítico a bornita (Cu5FeS4) y posteriormente a calcocita (Cu2S) u otras especies similares (Cu1.75S o Cu1.934S) y, en potenciales aún más catódicos puede llegar a cobre metálico (Cu0).
En cuanto al hierro contenido en la calcopirita, la figura 1b revela que éste se libera como Fe2+, lo que sugiere que inicialmente el hierro contenido en la calcopirita se encuentra en un estado de oxidación +3, además puede formar complejos con el acetato Fe(CH3COO)+ (esto depende del pH de operación). Asimismo, si el potencial es muy reductor, al igual que el cobre, el hierro puede reducirse hasta su estado elemental (ver figura 1b). Con respecto al azufre proveniente de la calcopirita, se sabe que éste es liberado como ácido sulfhídrico (H2S).
Composición del mineral
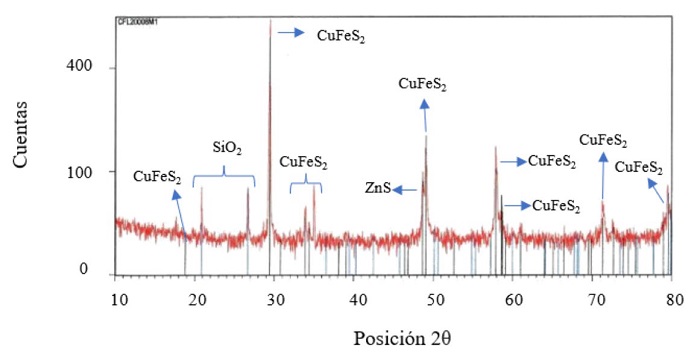
Una muestra del concentrado de calcopirita recolectado en Concepción del Oro, Zacatecas fue analizado químicamente mediante la técnica de difracción de rayos X. En la figura 2 se muestra el patrón de difracción de rayos X correspondiente a este mineral, en donde se puede apreciar la calcopirita (CuFeS2) y otras fases secundarias presentes como lo son el SiO2 (cuarzo) y el ZnS (esfalerita).
Estudio electroquímico de la calcopirita en CH3COOH
El mineral de calcopirita caracterizado en la sección anterior se usó como electrodo de trabajo. En esta sección se discuten los resultados referentes al estudio electroquímico realizado empleando una celda electrolítica de tres electrodos que contenía como electrodo de trabajo al mineral de calcopirita inmerso en distintas soluciones de ácido acético.
Efecto de la concentración de ácido acético en la reducción electro-asistida de la calcopirita
En primera instancia, se realizó la técnica de Potencial de Circuito Abierto (OCP) a temperatura ambiente y para cada concentración de ácido acético utilizada (0.5, 1, 2, 3, 4 y 6 M). El OCP en tiempos iniciales tiende a variar, pero después de 30 segundos (aproximadamente) alcanza un estado pseudo-estacionario. Este potencial se utilizó como inicio para todos los experimentos electroquímicos realizados. Es importante mencionar que el OCP depende en gran medida de la concentración de ácido acético utilizado y por ello, este es distinto al variar la concentración de la solución. A su vez, este parámetro puede variar al realizar esta técnica en otra superficie de calcopirita (en una misma concentración de ácido acético), aun cuando esta superficie sea de la misma roca. Lo mencionado anteriormente se debe a la heterogeneidad en cuanto a fases secundarias presentes (galena, esfalerita, cuarzo, etc.) y su cantidad. Esta es una característica que no se puede controlar en los minerales y por ello, para esta investigación se utilizaron electrodos de calcopirita que presentan valores de OCP similares.
Para evaluar el efecto de la concentración del ácido acético sobre la reducción de la calcopirita, se realizaron voltametrías lineales llevadas a cabo a partir del OCP hacia la dirección catódica (-0.8 y -2.2 V vs SHE), utilizando una velocidad de barrido de 0.02 V/s y variando la concentración de ácido acético en 0.5, 1, 2, 3, 4 y 6 M a temperatura ambiente.
En la tabla 1 se puede observar que, al llevar a cabo las voltametrías lineales partiendo del OCP hacia -0.8 V vs SHE, la corriente de reducción se favorece cuando la concentración de ácido aumenta de 0.5 hasta 4 M. Sin embargo, en términos de la capa de producto formada en la superficie de la calcopirita a este potencial, se puede observar en la figura 3 que al utilizar una solución de ácido acético 0.5 M no se logra distinguir algún cambio en la superficie, caso contrario al aumentar la concentración de ácido acético a 1, 2 y 3 M, en donde es posible observar tonalidades cada vez más intensas en algunas zonas del electrodo de calcopirita (figura 3 b, c y d). Es importante mencionar que estos cambios de color son característicos de la formación de bornita (Cu5FeS4); sin embargo, la caracterización de los productos de reacción se muestra en las secciones posteriores. Al utilizar una solución con 4 o 6 M, la superficie luce muy similar que al usar una solución 3 M. Adicionalmente, es interesante resaltar que, a este potencial, es posible encontrar zonas de calcopirita sin reaccionar, lo que revela que se requeriría más energía para poder reducir una cantidad mayor de calcopirita en el mismo intervalo de tiempo.
Tabla 1 Relación de la concentración de la solución de ácido acético con la densidad de corriente alcanzada para las voltametrías lineales realizadas a un potencial de -0.8 V vs SHE
| Concentración (M) | Densidad de corriente *10-5(A/mm2) |
| 0.5 | -1.32 |
| 1 | -1.76 |
| 2 | -1.86 |
| 3 | -1.93 |
| 4 | -2.47 |
| 6 | -2.23 |

Figura 3 Comparación de la capa de producto formada durante la reducción de la calcopirita en las voltametrías lineales partiendo del OCP a -0.8 V vs SHE con diferente concentración de ácido acético a) 0.5 M, b) 1 M, c) 2 M y d)3 M
Con el propósito de observar si es posible electro-reducir aún más la calcopirita, se decidió intentar con un potencial más catódico i.e., -2.2 V vs SHE. En la tabla 2 se muestra la corriente alcanzada al llevar a cabo las voltametrías lineales partiendo del OCP hacia -2.2 V vs SHE con las diferentes concentraciones de ácido acético. De manera análoga al caso anterior, la corriente de reducción se favorece conforme se incrementa la concentración de ácido acético desde 0.5 hasta 4 M. Mientras que, a concentraciones mayores a 4 M, la corriente de reducción no presenta cambios significativos, lo cual coincide con el comportamiento mostrado con anterioridad al aplicar un potencial de -0.8 V vs SHE.
Tabla 2 Relación de la concentración de la solución de ácido acético con la densidad de corriente alcanzada para las voltametrías lineales realizadas a un potencial de -2.2 V vs SHE.
| Concentración (M) | Densidad de corriente *10-5(A/mm2) |
| 0.5 | -6.77 |
| 1 | -8.22 |
| 2 | -9.76 |
| 3 | -10.00 |
| 4 | -10.80 |
| 6 | -9.42 |
Desde el punto de vista cinético, es interesante resaltar que la densidad de corriente registrada en estos experimentos fue mayor a la obtenida a otros potenciales catódicos menores a -2 V vs SHE (ver tabla 2). Es importante recordar que entre más grande sea la corriente, implica que la reducción de la calcopirita es más rápida. A pesar de esto, en la figura 4 se puede observar que al llevar a cabo las polarizaciones al potencial catódico de -2.2 V vs SHE, con todas las concentraciones de ácido acético estudiadas (0.5-6 M) no se obtienen otras tonalidades diferentes en la superficie de la calcopirita, es decir la bornita continúa predominando como el producto principal de la reducción de la calcopirita.
Caracterización de la capa obtenida en la superficie de la calcopirita mediante Microscopía Electrónica de Barrido de Emisión de Campo
Es importante mencionar que hasta el momento la capa obtenida en la superficie de la calcopirita con la aplicación de los diferentes potenciales catódicos y diferentes concentraciones de ácido acético tiene principalmente tres tonalidades: azul, rosa y morado. Estos colores son característicos de la bornita, la cual, al igual que la calcopirita, está compuesta por Cu, Fe y S, la diferencia radica en la estequiometría distinta, la cual es Cu5FeS4.
En la figura 5 se observa la micrografía de la superficie del electrodo de calcopirita que fue obtenida al llevar a cabo una polarización catódica a -2.2 V vs SHE utilizando una solución 2 M de ácido acético.

Figura 5 Micrografía a 300x tomada en FESEM del electrodo de calcopirita resultante al llevar a cabo una polarización catódica a -2.2 V vs SHE con una solución de ácido acético 3 M en donde se muestran dos zonas con diferente tonalidad.
La micrografía mostrada en la figura 5 fue tomada con electrones retrodispersados, por lo cual, las dos tonalidades mostradas pueden atribuirse a diferentes composiciones. La zona marcada con el número uno corresponde a la capa que se formó durante la polarización catódica, es decir, en donde están presentes las tonalidades rosas, moradas y azules, mientras que la zona 2 corresponde a una zona sin reaccionar de calcopirita.
De acuerdo con los EDS realizados en las zonas marcadas en la figura 5, ambas están compuestas por Cu, Fe y S. La principal diferencia radica en que la zona 2 tiene una mayor cantidad de hierro y azufre comparado con la zona 1 y por las tonalidades se infiere que la zona 1 corresponde a la bornita y la zona 2 a la calcopirita sin reaccionar.
Con base en la caracterización, se infiere que la reducción de la calcopirita a bornita involucra una disminución en la cantidad de Fe contenida en la estructura de la calcopirita (además mediante absorción atómica se comprobó que para una solución 2 M de ácido acético posterior a la polarización catódica a -2.2 V vs SHE se tiene la presencia de 0.032 mg/L) y en la cantidad de azufre, el cual podemos identificar por un ligero olor al H2S al llevar a cabo la reducción.
Efecto de la variación del pH de la solución de ácido acético durante el proceso de reducción
Se evalúo el efecto del pH en una de las soluciones de ácido acético más eficientes (3 M) la cual tiene un pH natural de 2.3 y se utilizó hidróxido de sodio para subir el pH hasta 5.1. Se realizaron voltametrías lineales partiendo del OCP hacia la dirección catódica (-2.2 V vs SHE) utilizando una velocidad de barrido de 0.02 V/s y a temperatura ambiente. La densidad de corriente alcanzada al llevar a cabo la reducción electro-asistida de la calcopirita en la solución de ácido acético con pH de 5.10 fue de 1.5*10-3 A/mm2, lo cual es un incremento significativo a la solución de ácido acético con pH natural que alcanza una corriente de 1*10-4 A/mm2. Si bien es cierto que con el aumento del pH se logra un aumento significativo en la corriente, la capa resultante que se forma en la superficie de la calcopirita corresponde a la bornita, la única diferencia es que los colores son más intensos y se obtiene mayor cantidad de tonalidades azuladas (figura 6) que las obtenidas con una solución 3 M con pH natural.
Conclusiones
El Potencial de Circuito Abierto (OCP) puede presentar variaciones al utilizar una misma concentración de ácido acético si se realiza en distinta superficie (aun si esta superficie pertenece a la misma roca) debido a la heterogeneidad de la superficie, así como a la cantidad y presencia de fases secundarias en la matriz de la calcopirita la cual es una característica natural de los minerales.
Se comprobó mediante técnicas electroquímicas que la calcopirita reacciona al utilizar ácido acético como medio lixiviante; esto debido a los colores de la capa formada (rosa, azul y morado) al llevar a cabo las polarizaciones a diferentes potenciales catódicos y a su vez por los picos de reducción encontrados mediante la técnica de voltametría lineal. Estudios de caracterización por FESEM y EDS permiten inferir que la especie mineral que se forma es la bornita.
Al utilizar concentraciones bajas de ácido acético (0.5 M) se requiere de un potencial catódico mayor (~-2.2 V) para formar la bornita en comparación con el sistema 3 M en donde se requiere un potencial catódico menor. La concentración de ácido acético más eficiente corresponde a 2 o 3 M, en ambos sistemas se presentan las velocidades de reducción más altas obtenidas hasta el momento.
Al aumentar el pH de una solución de ácido acético 3 M de 2.3 a 5.1, la densidad de corriente aumenta significativamente, lo cual indica que la cinética de reducción se aumenta. Lo anterior revela que, al incrementar el pH se favorece la reducción de la calcopirita.











 nova página do texto(beta)
nova página do texto(beta)