Introducción.
En la actualidad, las medidas ambientales impuestas al sector minero se enfocan en el uso eficiente de los recursos hídricos y en la preservación del medio ambiente. Dado que el agua representa el 80-85% del volumen de la pulpa mineral procesada en los circuitos de flotación, se tiene la obligación de buscar una alternativa sustentable del uso del agua. El empleo de aguas recicladas en los circuitos de procesamiento de minerales en operaciones industriales es una solución que se ha comenzado a implementar. Sin embargo, el uso de aguas tratadas afecta el proceso de recuperación de minerales de sulfuros, debido a que los componentes químicos presentes hacen que el proceso se comporte de manera distinta a como lo hacen con el uso de agua fresca [1-3].
El agua de proceso tiene diversos agentes contaminantes que afectan la flotabilidad de algunos minerales de sulfuros. Los contaminantes comúnmente son calcio, magnesio y sulfato. Dichos agentes contaminantes se encuentran en las aguas recicladas debido al empleo de cal (CaO, Ca(OH)2)) como un modificador y regulador de pH, el uso de cal es muy común en los procesos de flotación de minerales de sulfuros y a la oxidación natural del azufre de los sulfuros por parte del oxígeno atmosférico absorbido en las pulpas de flotación [4]. La presencia de magnesio se asocia a la existencia de minerales que lo contienen, tales como la dolomita (CaMg(CO3)2), magnesita (MgCO3) y brucita (Mg(OH)2), los cuales son ligeramente solubles en soluciones acuosas, llegando a alcanzar concentraciones del orden de 30 a 120 ppm en las pulpas de flotación (e.g., Unidades Madero y Naica, respectivamente, del Grupo Peñoles). Los estudios de plantas de procesamiento de minerales de sulfuros muestran que las concentraciones típicas de Mg están alrededor de las 50 ppm [5]. Así mismo, se reportan concentraciones típicas de calcio en el orden de 500 a 650 ppm [6, 7].
El efecto del calcio y el magnesio en el proceso de flotación de minerales de sulfuros ha sido objeto de estudios previos y se ha sugerido que la presencia de estos iones metálicos tiene un efecto negativo; es decir, tienen un efecto depresor en la flotación de minerales. En este sentido, se ha demostrado el efecto depresor de los iones Ca2+ en minerales como la esfalerita (ZnS), este efecto se atribuye a que los iones Ca se adsorben en la superficie del mineral disminuyendo el número de sitios activos durante la etapa de activación con cobre [8, 9]. De igual forma, estudios preliminares han reportado que la precipitación de estos iones con carbonato de sodio (Na2CO3) tiene un efecto benéfico en la cinética de flotación de galena (PbS) y esfalerita (ZnS). Asimismo, se ha sugerido que el carbonato de sodio causa la disolución del yeso que se encuentra adherido en la superficie del mineral y este precipita como carbonato de calcio (CaCO3), lo que reduce el contenido de calcio en solución y el efecto adverso en la flotación de esfalerita [1, 3, 9, 10]. Sin embargo, a la fecha aún no existe una razón fundamental que explique dicho comportamiento. Por lo anterior, el presente estudio tiene como objetivo investigar la remoción de calcio y magnesio mediante la adición de Na2CO3, caracterizar el sólido obtenido (MEB y DRX) y proponer un modelo cinético de la precipitación de calcio. Hasta el momento no se ha propuesto un modelo cinético para la precipitación del magnesio, debido a un comportamiento distinto al del calcio.
Metodología
Materiales y reactivos
En el presente trabajo se prepararon soluciones con una concentración de 50 mg/L de magnesio (0.002 mol/L MgSO4 ●7H2O) y 650 mg/L de calcio (0.016 mol/L CaSO4 ●2H2O). Para preparar las soluciones se utilizó agua desionizada y se adicionó Na2CO3, se utilizaron 3 concentraciones distintas (0.008, 0.016 y 0.024 mol/L); todos los reactivos utilizados fueron grado reactivo. Para filtrar la solución se utilizó papel filtro con un tamaño de retención de partícula de 2.5 μm y una bomba de vacío.
Procedimiento
Para la precipitación de Ca y Mg se prepararon soluciones con las concentraciones antes mencionadas, a temperatura ambiente y atmósfera abierta. Se estudió la precipitación de calcio y magnesio con 3 dosis distintas de Na2CO3 estas concentraciones se establecieron por un análisis termodinámico previo [11, 12]. Las soluciones se mantuvieron en agitación 15 o 60 minutos (véase Tabla 1). La solución fue filtrada con la ayuda de una bomba de vacío y papel filtro. Los sólidos retenidos se secaron a temperatura ambiente y las soluciones filtradas fueron analizadas químicamente para determinar la concentración residual de calcio y magnesio. El método de análisis fue espectrometría de Absorción Atómica (AA) para lo cual se utilizó un equipo marca THERMO SCIENTIFIC modelo ICE 3300.
Tabla 1 Condiciones experimentales para la precipitación de Ca2+ y Mg2+.
| Exp. | Concentración inicial (mol/l) | Condiciones de prueba | Fuerza iónica | |||
| N° | Ca | Mg | Na2CO3 | T(°C) | t(min) | l(mol/L) |
| 1 | 0.016 | - | 0.008 | 25 | 60 | 0.084 |
| 2 | 0.016 | - | 0.016 | 25 | 60 | 0.104 |
| 3 | 0.016 | - | 0.024 | 25 | 60 | 0.124 |
| 4 | - | 0.002 | 0.008 | 25 | 60 | 0.028 |
| 5 | - | 0.002 | 0.016 | 25 | 60 | 0.048 |
| 6 | - | 0.002 | 0.024 | 25 | 60 | 0.068 |
| 7 | 0.016 | 0.002 | 0.008 | 25 | 60 | 0.092 |
| 8 | 0.016 | 0.002 | 0.016 | 25 | 60 | 0.108 |
| 9 | 0.016 | 0.002 | 0.024 | 25 | 60 | 0.128 |
| 10 | 0.016 | 0.002 | 0.008 | 17 | 15 | 0.084 |
| 11 | 0.016 | 0.002 | 0.016 | 17 | 15 | 0.104 |
| 12 | 0.016 | 0.002 | 0.024 | 17 | 15 | 0.124 |
Se realizó una primera serie de pruebas, en la que se estudió la precipitación de calcio solo, magnesio solo y finalmente ambos, con la adición de Na2CO3. Con el objetivo de analizar el efecto de la temperatura se realizó una segunda serie de pruebas donde se estudió la precipitación de calcio solo a una temperatura de 17 °C y un tiempo de reacción de 15 min. En la Tabla 1 se presentan las condiciones experimentales con las que se obtuvieron los sólidos.
Identificación de los sólidos mediante DRX
Los sólidos productos de la reacción de precipitación fueron filtrados, secados a temperatura ambiente y analizados mediante difracción de rayos X (DRX), empleando un difractómetro D8 Advance Bruker. La identificación de fases sólidas de realizó mediante MDI Jade 6.5.
Microscopia electrónica de barrido (MEB)
La preparación de la muestra para analizar mediante MEB (Phillips XL30 ESEM) consistió en dejar secar el sólido obtenido de la reacción de precipitación a temperatura ambiente. Se realizó un análisis de la interacción superficial entre galena-sólidos obtenidos por lo que se utilizaron muestras de un cristal de PbS montado en baquelita. La técnica consistió en pulir la superficie del espécimen mineral y enjuagarlo muy bien con agua desionizada. A continuación, el espécimen mineral se sumergió en un recipiente cuadrado de 200 mL conteniendo 100 mL de una solución de agua desionizada conteniendo 1 g/L del precipitado obtenido a pH 10 con la adición de 0.1 mol/L de NaOH, y se dejó en agitación durante 10 min. Finalmente, los especímenes se analizaron mediante MEB-EDS.
Discusión de resultados
Identificación mediante DRX de los reactivos utilizados.
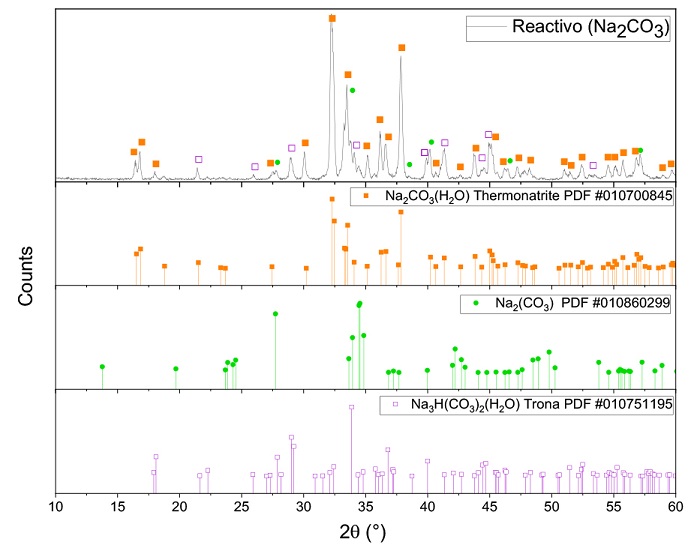
Los reactivos utilizados en la experimentación se analizaron mediante DRX. Los difractogramas correspondientes se presentan en la siguiente sección. En la Figura 1 se observa el espectro de difracción del reactivo de Na2CO3 utilizado. Los picos característicos observados corresponden a termonatrita, Na2CO3 y trona, los cuales fueron identificados con los patrones de difracción 01-070-0845, 01-086-0299 y 01-075-1195 respectivamente.
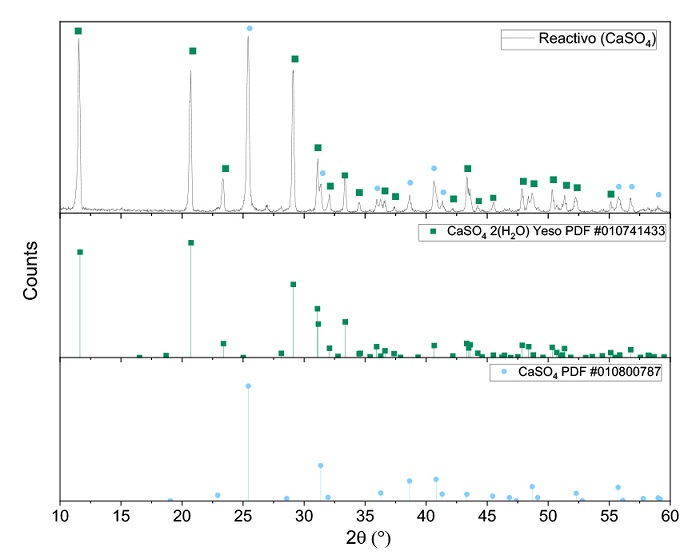
En la Figura 2 se presenta el espectro de difracción del reactivo de CaSO4 .2H2O utilizado. Los picos característicos observados corresponden yeso (CaSO4 .2H2O) y CaSO4, los cuales fueron identificados con los patrones de difracción 01-074-1433 y 01-080-0787, respectivamente.
En la Figura 3 se presenta el espectro de difracción del reactivo de MgSO4 .7H2O utilizado. Los picos característicos observados corresponden a hexadrita (MgSO4 .6H2O) y epsomita (MgSO4 .7H2O) los cuales fueron identificados con los patrones de difracción 00-024-0719 y 01-072-0696.
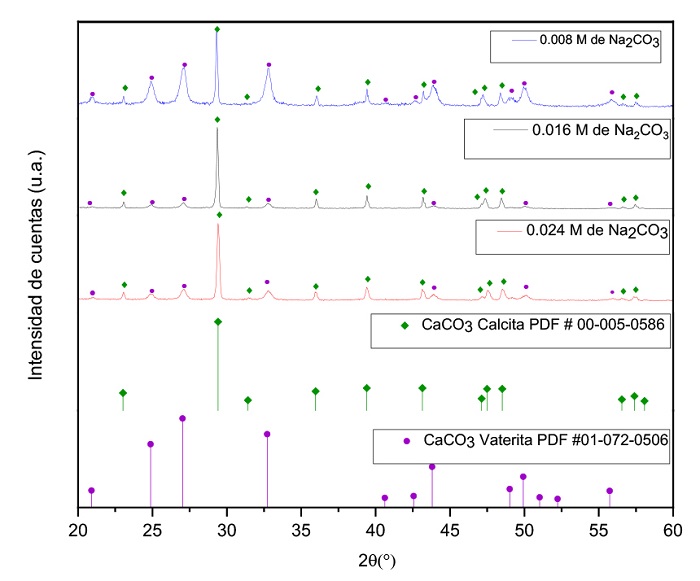
Los sólidos obtenidos de la reacción de precipitación se analizaron mediante DRX. Los difractogramas correspondientes se presentan en la Figura 4. Los picos característicos observados corresponden a calcita y vaterita (poliformo de la calcita), los cuales fueron identificados con los patrones de difracción 00-005-0586 y 01-072-0506, respectivamente. No se observa la presencia de otra fase, lo cual indica que los precipitados obtenidos son prácticamente CaCO3. Se observa que la intensidad de los picos de cada muestra cambia ligeramente, por lo que se sugiere que la concentración de carbonato de sodio es una condición relacionada con la cristalización de las partículas.

Figura 4 Espectros de difracción de rayos X (DRX) de los sólidos obtenidos de la precipitación de CaCO3 en solución mediante la adición de carbonato de sodio (experimentos 10,11 y 12, respectivamente).
Cabe mencionar que en el sistema de estudio con las condiciones establecidas y las distintas adiciones adiciones de carbonato de sodio, el sólido obtenido se identificó como calcita. La fracción de Mg precipitado no dio lugar a fases adicionales. Lo anterior, probablemente debido a la baja concentración de magnesio (50 mg/L) en solución y a su dificultad para precipitarlo.
Caracterización mediante MEB-EDS de los sólidos obtenidos.
La adición de Na2CO3 a una solución saturada de sulfato de calcio (0.016 mol/L CaSO4) promueve la precipitación del calcio como CaCO3, tal como la modelación termodinámica lo sugiere. En la Figura 5 se observa el sólido obtenido en el experimento 11, el cual fue identificado mediante DRX como calcita y/o vaterita, sobre la superficie de galena. El análisis semi-cuantitativo mediante EDS detecta la presencia de Ca, C y O. La composición en porcentaje atómico es: 17.13% At de Ca, 20.15% At de C y 62.07% At de O, lo que sugiere la presencia de un carbonato de calcio. Es interesante observar dos morfologías distintas, una en forma de esfera y la otra de rombos apilados. Esto corrobora la existencia de dos especies en el sólido obtenido, calcita (romboédrica) y vaterita (di-hexagonal). Además, se observó que existe una adhesión de CaCO3 en la superficie mineral. Sin embargo, el tamaño de las partículas del CaCO3 (aprox. 7 µm) es menor al compararlo con las partículas de yeso (aprox. 38 µm) [13].
Remoción de calcio y magnesio en solución mediante la adición de Na2CO3.
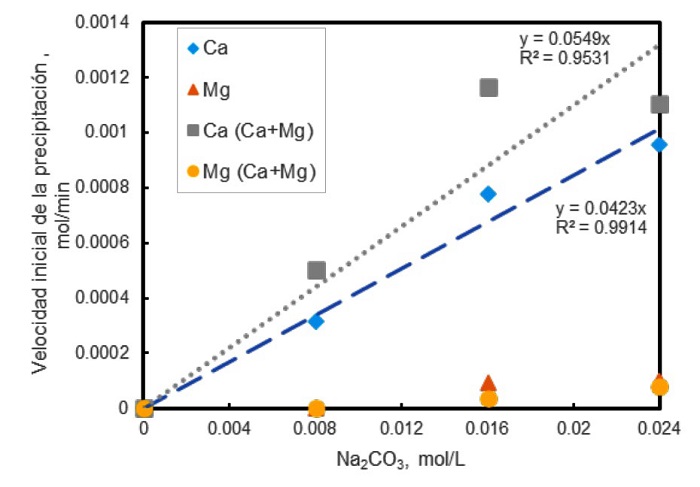
En la Figura 6 se presentan los resultados obtenidos en los experimentos de remoción de Ca y Mg. En el gráfico se observa que, en el caso del calcio, tanto solo como con la presencia del Mg, su velocidad inicial de precipitación (%/min) incrementa conforme la concentración de Na2CO3 aumenta; es decir, se observa que aparentemente la velocidad inicial tiene un comportamiento lineal respecto a la concentración de carbonato de sodio adicionado. También se puede observar que, la remoción de Ca solo y Ca+Mg es muy similar; por lo anterior se puede inferir que la presencia del Mg no tiene algún efecto en la remoción de Ca. En relación con la remoción de Mg, se puede observar que la remoción es mayor con Mg solo y esta aumenta también con una mayor adición de carbonato de sodio; sin embargo, este comportamiento no parece lineal, sino que da inicio una vez adicionada cierta cantidad de Na2CO3 (mayor a 0.008 M). Además, la precipitación de Mg es menor que la de Ca. Los resultados sugieren que la remoción de Mg sí se ve afectada por la presencia de calcio en solución, probablemente debido a que el calcio consume preferencialmente al ion carbonato.
Con los resultados obtenidos de esta serie de pruebas, se pudo establecer un modelo cinético a fin de entender el papel de la concentración de los reactantes y del tiempo de reacción, y estar en posibilidad de predecir la precipitación de Ca. Este modelo cinético se describe a continuación.
Cinética de reacción de Ca 2+ con condiciones estequiométricas
Reacción:
Se propone una cinética de segundo orden para una reacción en fase homogénea (e.g., reactantes en fase acuosa):
Definiendo a R como la fracción de calcita que precipita:
Donde: [Ca]0 es la concentración inicial de calcio y [Ca] la concentración de calcio en cualquier instante.
Dado que la reacción ocurre bajo condiciones estequiométricas, la concentración de calcio en cualquier momento es igual a la del carbonato:
Sustituyendo y escribiéndolo en términos de la concentración de [Ca] tenemos:
Reagrupando e integrando con las condiciones a la frontera: para t=0, [Ca]=[Ca]o y para t=t, [Ca]=[Ca].
Despejando [Ca]:
Cinética de reacción bajo condiciones no estequiométricas.
Agrupando [Ca]:
Integrando por fracciones parciales y despejando [Ca]:
Para un valor supuesto de k, y conocida [Ca], se puede estimar la fracción de calcita precipitada R con la ecuación respectiva.
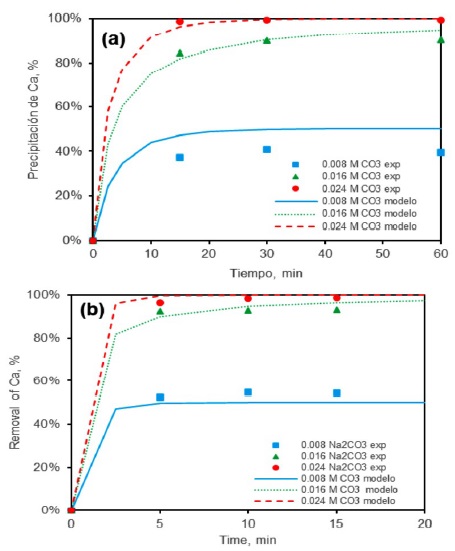
Con la ecuación (10) y (14) y se estimó la concentración y la precipitación de calcio en cualquier tiempo. Esta precipitación se representa con una línea punteada en la Figura 7. Como se mencionó anteriormente, la temperatura tiene un efecto en la remoción de Ca, por lo que se consideraron k distintas. Una k=19.06 (L2/mol2 min) para los datos experimentales de T=17 °C y una k=112.205 (L2/mol2 min) para una T=25°C. Con el objetivo de analizar el efecto de la temperatura en la remoción de calcio se realizaron pruebas con dos temperaturas distintas (17 °C y 25 °C). Los resultados de este análisis se presentan en la Figura 7. En la Figura 7(a) se observa que a una temperatura de 17 °C la precipitación de calcio aumenta con concentraciones mayores de carbonato de sodio. Sin embargo, para un tiempo de reacción de 60 min y adiciones estequiométricas (e.g., 0.0016 M) y superiores (0.0024 M) el incremento no es notable. Por ejemplo, con una concentración de 0.016 mol/L de Na2CO3 la remoción de calcio es del 90%, mientras que con 0.024 mol/L de Na2CO3 es del 99%.
Se observó que la temperatura es un parámetro relevante, por lo que el análisis se realizó a una temperatura de 25° C, los resultados de presentan en la Figura 7 (b). Se observó un incremento en la remoción de calcio cuando la temperatura aumentó. Por ejemplo, cuando T= 17 °C y la concentración de Na2CO3= 0.008 mol/L, la remoción de calcio fue de 40%, mientras que, a una temperatura de 25 °C alcanzó el 54%, lo que permite inferir un efecto positivo de la temperatura en la recuperación de calcio, es decir la mayor posibilidad de que la precipitación se vea gobernada por la reacción química.
Conclusiones
La adición de Na2CO3 a una solución saturada de sulfato de calcio (0.016 mol/L CaSO4) promueve la precipitación del calcio como CaCO3. Se encontró que el calcio precipita como calcita y vaterita (poliformo de la calcita).
Las mediciones de potencial zeta efectuadas a los sólidos obtenidos de la adición de Na2CO3 a una solución de MgSO4 (0.002 M) y CaSO4 (0.016 M), mostraron que su carga es negativa, generada por la disolución incongruente del sólido, el cual disuelve más iones calcio que iones carbonato en un medio alcalino.
Los resultados sugieren que la precipitación de calcio con la adición de carbonato de sodio bajo condiciones estequiométricas y no estequiométricas, está descrita por una cinética de reacción de segundo orden.











 nueva página del texto (beta)
nueva página del texto (beta)