Introducción
La actividad fotosintética que mantiene el flujo energético de la biosfera ha sido motivo de muchos estudios. Algunas se basan en la medición de la eficiencia fotoquímica con la cual los organismos fotosintéticos capturan la energía de la radiación electromagnética y la transforman en energía bioquímica almacenada y utilizada por las células [1]. Dichas mediciones se obtienen con equipos denominados fluorómetros los cuales miden la fluorescencia de la clorofila en hojas individuales o en las plantas enteras [2]. Los fluorómetros son equipos diseñados para la emisión y detección de longitudes de onda de radiación que son absorbidas y reemitidas por los pigmentos de los organismos que llevan a cabo fotosíntesis oxigénica; tales como cianobacterias, algas, y plantas vasculares [3]. Con el análisis de las características de la radiación reemitida por los pigmentos fotosintéticos puede determinarse la Eficiencia en el Uso de la Radiación (EUR); la disminución en la EUR generalmente ocurre por un estado de estrés. El estrés causa daño oxidativo en las membranas de los cloroplastos [4], lo cual causa cambios en las características de la radiación reemitida por los pigmentos fotosintéticos. Estos cambios son detectados por el fluorómetro.
Los ajustes en el aparato fotoquímico son resultado de los cambios ambientales y pueden ser cuantificados con los fluorómetros desde etapas muy tempranas del estrés. Por lo tanto, es posible monitorear el proceso y conocer su tendencia en el tiempo. Se ha demostrado con éxito que mediante la medición de la fluorescencia de la clorofila es posible determinar los niveles de estrés por déficit hídrico en las plantas [5], [6]. por temperaturas extremas [7], por salinidad [8], la toxicidad por metales [9], e incluso afectaciones por factores bióticos [10].
No obstante, siguen siendo escasos los reportes que explican los usos y alcances de las lecturas en los fluorómetros para el estudio e interpretación del estrés en los cultivos agrícolas afectados por el cambio climático. La presente revisión tiene como propósito mostrar los parámetros de fluorescencia que se registran durante el estrés ocasionado por los factores bióticos y abióticos en las plantas cultivadas.
¿Qué es la fluorescencia?
Como sabemos, la fotosíntesis de las plantas terrestres es un proceso que se realiza en los cloroplastos. Las membranas de los cloroplastos contienen clorofilas y carotenoides que son los pigmentos responsables de absorber la radiación electromagnética que llamamos luz. Los pigmentos se asocian con proteínas especializadas y forman estructuras llamadas “antenas” y “centros de reacción”, que se encuentran en complejos supramoleculares denominados fotosistemas I y II (FI y FII en la figura 1). Las antenas son complejos de pigmentos clorofílicos y carotenoides organizados espacialmente por proteínas llamadas Complejos Cosechadores de Luz de los fotosistemas (CCLI y CCLII en la figura 1) que absorben radiación de longitud de onda entre 400 y 700 nm. La actividad fotosintética comienza con la captura de la energía lumínica por las antenas y la transferencia de la energía a los centros de reacción de los fotosistemas I y II. En condiciones de baja luminosidad y en ausencia de estrés, el proceso fotoquímico ocurre con alta eficiencia. Sin embargo, bajo alta intensidad lumínica o bajo condición de estrés el proceso se vuelve menos eficiente.
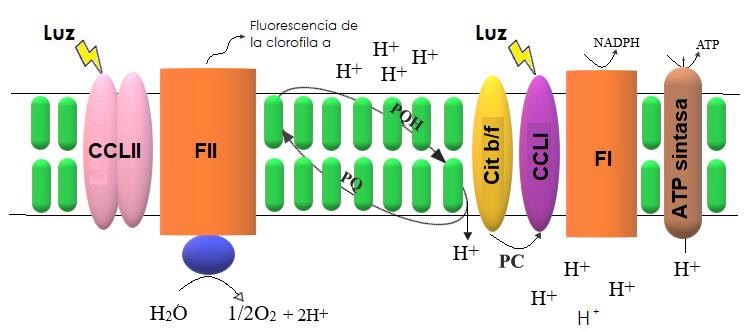
Figura 1 Esquema simplificado del proceso de transporte de electrones que sucede en la membrana tilacoidal de las plantas. FII: Fotosistema II, CCLII: Complejo Cosechador de Luz II, Cit b/f: Citocromo del tipo b y f, FI: Fotosistema I, CCLI: Complejo Cosechador de Luz I, PC: Plastocianina, PQ: Plastoquinona, ATP: Adenosin Trifosfato, NADP: Nicotinamida Adenina Dinucleótido Fosfato (P). La adición del ión H+ simboliza la reducción de las moléculas. Modificado de Baker y Rosenqvist [11].
Cuando los fotones son absorbidos por las antenas de los CCL, cada fotón deja de existir como tal y se transforma en una cuasipartícula denominada excitón. Un excitón ocurre cuando la energía del fotón se transforma en un estado energizado transitorio de los electrones de una molécula. Los excitones son de vida muy corta y deben de ser transferidos rápidamente a los centros de reacción P680 y P700 del FII y FI (figura 2). En los centros de reacción la energía contenida en el excitón es transformada en energía contenida en los enlaces de una molécula reducida; es decir, pasa de ser un fenómeno físico transitorio (excitón) a adoptar una forma bioquímica estable en un compuesto de tipo quinona (PQ en la figura 1). Durante la transferencia de electrones entre los fotosistemas, la quinona reducida transfiere su electrón a través del complejo de citocromos b y f y al fotosistema I para generar la Nicotinamida Adenina Dinucleotido Fosfato reducida (NADPH) utilizado en la reducción de CO2[11]. Como bien sabemos, el ATP (Adenosín Trifosfato) se obtiene de la operación de la ATP sintasa que usa el gradiente de concentración de protones entre el lumen del tilacoide y el estroma del cloroplasto para transformar el ADP (Adenosín Difosfato) en ATP (figura 1).

Figura 2 Flujo de la energía desde el momento en que son captados los fotones provenientes del sol, el paso a través de las antenas, y las posibles vías de desexcitación. La vía bioquímica se refiere a los procesos tales como la reducción del NADP, el ciclo de Calvin, la respiración, entre otros.
¿Pero qué pasa si los excitones no son transferidos rápidamente a los centros de reacción? Esta situación ocurre en condiciones de alta luminosidad o en presencia de estrés. Lo que ocurre en estos casos es que, los excitones se transforman nuevamente en fotones de longitud de onda mayor a la del fotón original y son reemitidos por el aparato fotoquímico. La transformación de los excitones en fotones puede producir radiación térmica (calor) o lo que se llama fluorescencia, que se define como la emisión de radiación visible por parte de una sustancia que ha absorbido previamente radiación electromagnética de longitud de onda menor (figura 2).
Mientras mayor sea la magnitud de emisión de calor o fluorescencia por el aparato fotosintético menor será su eficiencia en transformar la energía de la luz en potencial reductor almacenado en una molécula. Por lo tanto, el uso de un fluorómetro puede indicarnos la eficiencia del proceso fotoquímico y el impacto que las diferentes condiciones ambientales tienen sobre la eficiencia.
Los fluorómetros de reciente generación, son equipos portátiles que cuentan con adaptadores herméticos de un diámetro inferior a 1 pulgada. Estos adaptadores son colocados al aparato foliar para su adaptación a la obscuridad. Cuando células vegetales adaptadas a la obscuridad son irradiadas, la fluorescencia de la clorofila a muestra una compleja cinética de inducción llamada curva de Kautsky. Dicha curva se caracteriza por una serie de inflexiones en la tasa de ascenso en el nivel de fluorescencia llamado la transiente OJIP; cada letra denota una inflexión distinta en la curva de inducción [12]. La inducción de la fluorescencia de la clorofila a es registrada por los fluorómetros al momento en que se aplica radiación electromagnética de excitación mediante pulsos a una frecuencia determinada. Cuando los fluorómetros aplican una densidad de flujo fotónico fotosintético (DFFF) menor a 0.1 μmol de fotones m-2 s-1, se registra un mínimo rendimiento de la fluorescencia de la clorofila (Fo). En este momento todos los centros de reacción se encuentran completamente oxidados. Cuando al mismo tejido se le aplica un corto pulso de luz actínica de muy alta DFFF (>6000 μmol m-2 s-1), se genera un máximo nivel de fluorescencia (Fm) por la reducción completa de los centros de reacción. La diferencia entre Fm y Fo se denomina fluorescencia máxima variable (Fv). De aquí puede estimarse el rendimiento cuántico máximo (Fv/Fm) [13]. Este parámetro representa la eficiencia máxima al cual la radiación absorbida por los pigmentos antena del fotosistema II es convertido a energía química.
Cuando el tejido foliar se adapta a un período de luz, el aparato fotoquímico pasa gradualmente del estado adaptado a la obscuridad, al estado adaptado a la luz. En la cinética de inducción de la fluorescencia podrá observarse que existe un punto de estabilización (Fs) denominado estado estable (figura 3). La aplicación del pulso de radiación saturante permitirá observar el rendimiento máximo de la fluorescencia de la clorofila en el estado adaptado a la luz (Fm'). A la diferencia entre Fm' y Fs se le denomina Fq'. Con este parámetro puede estimarse el rendimiento cuántico efectivo (Fq'/Fm'). La Fq'/Fm' es ampliamente usado para estimar la tasa de transporte de electrones (ETR) [13].

Figura 3 Cinética de inducción de la fluorescencia de la clorofila ‘a’ que se obtiene con los fluorómetros comerciales. Fo: Fluorescencia mínima adaptada a la obscuridad; Fm: Fluorescencia máxima adaptada a la obscuridad; Fv: Fluorescencia variable; Fs: Estado estable adaptado a la luz; Fm': Fluorescencia máxima adaptada a la luz; Fo': Fluorescencia mínima adaptada a la luz; Fv': Fluorescencia variable adaptada a la luz. Modificado de Rohacek, [13].
Los parámetros que se obtienen de ambas condiciones de adaptación se usan ampliamente para estimar otros parámetros de fluorescencia importantes, estos son: la eficiencia máxima del fotosistema II dada una condición de luz (Fv'/Fm') y los declives en el rendimiento cuántico debidas a procesos fotoquímicos (qP) y no fotoquímicos (qN o NPQ). La Fv'/Fm' se obtiene considerando un mínimo nivel de fluorescencia (Fo') cuando los centros del fotosistema II están altamente oxidados dada una condición de luz. La Fo' puede calcularse u obtenerse aplicando luz rojo lejano débil en ausencia de luz actínica [11]. Un resumen de los parámetros que se obtienen mediante el proceso fotoquímico se presenta en la Tabla 1.
Tabla 1 Parámetros de uso común en la detección del estrés biótico y abiótico. Para más detalles puede revisarse Rohacek [13].
| Parámetros de la fluorescencia de la clorofila. | Siglas | Fórmula |
| Rendimiento cuántico máximo del PSII | Fv/Fm | (Fm-Fo)/Fm |
| Rendimiento cuántico efectivo del PSII | Fq'/Fm' | (Fm'-Fs)/Fm' |
| Declive fotoquímico | qP | (Fm'-Fs)/(Fm'-Fo) |
| Declive no fotoquímico | NPQ | (Fm-Fm')/(Fm-Fo) |
Aplicación de los parámetros de fluorescencia en las plantas cultivadas
El estrés hídrico es el factor abiótico limitante más estudiado en la productividad de los cultivos y el cambio climático global está aumentando la frecuencia de las condiciones de estrés hídrico. El estrés hídrico ha sido asociado con una disminución en varios procesos bioquímicos tales como: la tasa fotosintética, absorción iónica, respiración, metabolismo del carbono y disminución en el crecimiento de las plantas [14]; la afectación en el crecimiento de las plantas expuestas al estrés hídrico es continuo y se encuentra estrechamente ligada a futuros rendimientos del cultivo [15]. La medición de los parámetros de fluorescencia en las plantas sometidas a estrés hídrico ha facilitado información valiosa para determinar los límites de resistencia de los cultivos a este factor limitante. Entre los parámetros estudiados, se ha encontrado que el rendimiento cuántico efectivo, el declive fotoquímico (qP), y el coeficiente de declive fotoquímico disminuyen, mientras que los parámetros no fotoquímicos (NPQ) tienden a aumentar; en plántulas de lechuga (Lactuca sativa L.) sometidas a estrés por sequía, el contenido de osmoreguladores como la prolina aumenta significativamente [16]. Yang y colaboradores, encontraron que el incremento en el parámetro NPQ registrado en plantas de tomate (Solanum lycopersicum L.) sometidas a condiciones de estrés hídrico se debe a un mecanismo fotoprotectivo [17], mientras que la disminución en el rendimiento cuántico efectivo ocasionado por este factor ha sido relacionado a un daño en las membranas tilacoidales o los centros de reacción [18]. Como una consecuencia del cambio climático global, la frecuencia, la intensidad y duración de la sequía está en aumento y actualmente se encuentra en niveles alarmantes. Si bien se han logrado avances significativos en el entendimiento de las respuestas de algunas plantas cultivadas a este factor, se requieren más estudios de los parámetros de fluorescencia que den indicios de la adaptación de las plantas al estrés hídrico.
La salinidad es otro de los factores abióticos más limitantes de la productividad. Muchos cultivos son sensibles a la alta concentración de sales en el suelo. Los efectos adversos de la salinidad son el resultado de una compleja interacción entre los procesos morfológicos, fisiológicos y bioquímicos; involucrados en la germinación de las semillas, crecimiento vegetal y la toma de nutrientes [19]. Los ensayos de fluorescencia de la clorofila en las plantas sometidas a la salinidad han mostrado que el transporte de electrones es el parámetro más sensible, lo que indica la inactivación de los centros de reacción del fotosistema II. Una disminución en el rendimiento cuántico máximo (Fv/Fm) del FII en respuesta a la sal fue reportado para Portulaca oleracea, una planta suculenta que se ha usado en la medicina popular [20], y en cultivos que se siembran a campo abierto como el maíz [21]. Los parámetros de fluorescencia han facilitado una rápida y precisa medición del nivel de tolerancia al estrés por salinidad de ocho genotipos de cebada [22]; lo que sin duda favorece la planeación en la plantación de los cultivos en zonas con este problema. El parámetro (Fv'/Fm') también registra sensibilidad en las plantas de trigo afectadas por salinidad [23], sin embargo, son escasos los estudios que analizan el comportamiento de este parámetro. Los parámetros de la fluorescencia de la clorofila se usan actualmente como herramienta base para seleccionar especies ornamentales para paisajes áridos [24]. Más recientemente, con la técnica de la fluorescencia de la clorofila, se ha demostrado que la adición de nitrógeno a las plantas de avena en medio salino alivia los efectos negativos de la salinidad [25]. Lo anterior, muestra las utilidades de la medición de la fluorescencia de la clorofila como medio para determinar las respuestas instantáneas de las plantas para mitigar los efectos adversos de la salinidad; sin embargo, aún es incipiente la cantidad de plantas que se han estudiado con este propósito.
En concordancia con la salinidad, la presencia de metales pesados en los suelos agrícolas es otro de los factores que cada vez más afectan a los cultivos. Los suelos contaminados con metales pesados disminuyen la productividad agrícola, ya que los metales tóxicos entran en los tejidos de las plantas con los nutrientes desde el suelo; ocasionando una reducción en el área foliar y el crecimiento. Estos cambios se acompañan de la reducción en la respiración y la fotosíntesis [26]. Entre las estrategias para disminuir este problema, se ha practicado la fitorremediación; lo anterior se logra mediante el empleo de plantas con alta capacidad de absorción de metales pesados. Mediante la técnica de la fluorescencia de la clorofila se ha progresado en la selección correcta de las especies más resistentes a este factor. Por ejemplo, mediante el registro del rendimiento cuántico máximo en plantas de Festuca arundinacea se determinó que su tolerancia se encuentra en el rango de concentración 4 a 20 mg L-1 de los metales Aluminio y Fluoruro [27], lo cual permite su selección como planta conservadora de suelos. Dezhban y colaboradores, encontraron que la medición de la fluorescencia de la clorofila en la especie Robinia pseudoacacia como indicador a la tolerancia de los metales cadmio (Cd) y plomo (Pb) resulta efectiva en combinación con la medición del contenido de clorofila y prolina [28]. Las evidencias actuales muestran que la técnica de la fluorescencia de la clorofila en los estudios de fitorremediación es acertada y está facilitando la selección de especies más idóneas para la detoxificación de los suelos.
La temperatura es el factor más estudiado como resultado del calentamiento global. El empleo de la técnica de la fluorescencia de la clorofila ha mostrado utilidad en la determinación de la tolerancia de los cultivos a este factor. Se ha reportado que la estabilidad de las membranas celulares es un determinante clave de la tolerancia de las plantas con metabolismo C3 a este factor [29]. El rendimiento cuántico efectivo ha sido el parámetro más útil para determinar la tolerancia a los extremos de temperaturas de cultivares de tomate [7]. En la propagación de plantas ha sido empleado para examinar los niveles de estrés al que se incurre durante la aclimatación, enraizamiento y trasplante de especies de importancia ornamental [30]. La tolerancia al frio de órganos propagativos de fresa con la técnica de la fluorescencia permitió la determinación de cultivares propicios para zonas frías [31]. El rendimiento cuántico efectivo (Fq'/Fm') es el parámetro que ha mostrado la mayor utilidad en los estudios de las respuestas de las plantas hortícolas al estrés por temperaturas [32]. Por su parte, el parámetro NPQ ha mostrado utilidad en la determinación del daño por extremos de temperatura en plantas ornamentales [33]. En la última década, el estudio del impacto de las altas temperaturas en las plantas, como resultado directo del calentamiento global, ha cobrado gran interés. No obstante, para garantizar la seguridad alimentaria, será necesario enfocar más estudios de los mecanismos de adaptación a este factor para el desarrollo de cultivares tolerantes.
El aumento en la concentración de CO2 en el ambiente como detonante del calentamiento global, ha propiciado cambios en la fisiología de las plantas [34]. Varios estudios han sido perfilados para relacionar los parámetros de la fluorescencia de la clorofila con la asimilación de este sustrato. Plantas de pepino (Cucumis sativus L.) sometidas a elevadas concentraciones de CO2 registraron los más altos incrementos en el parámetro Fv/Fm [35]. Así mismo, la tasa de transporte de electrones (ETR) fue correlacionado con la asimilación neta de CO2 en las plantas C4 y las plantas crasuláceas [36]. En ensayo in vitro se ha observado que la aplicación de altas concentraciones de CO2 promueve la fotosíntesis en plantas de vid y mejora los procesos fotoquímicos (Vitis vinífera), lo cual se manifiesta en una disminución del parámetro Fv/Fm [37]. También, se ha reportado que el suministro elevado de CO2 a las plantas, alivia los efectos negativos del estrés hídrico; lo cual se ve reflejado en los parámetros de fluorescencia [38]. La técnica de la fluorescencia de la clorofila contribuirá en gran medida en el entendimiento del comportamiento futuro que presentarán las plantas cultivadas ante el calentamiento global.
Por otro lado, como una consecuencia indirecta del calentamiento global, se han postulado cambios en la interacción planta-microorganismo [39]. Varios estudios se están perfilando para entender dicha interacción con la técnica de la fluorescencia de la clorofila. En el caso de los fitopatógenos, la eficiencia cuántica Fv/Fm ha sido el parámetro más sensible. Plantas de crisantemo afectadas por Fusarium oxysporum y Sclerotinia sclerotiorum mostraron cambios significativos en el parámetro Fv/Fm [40]. La reducción en este parámetro ha sido más notable cuando los síntomas en las plantas afectadas manifiestan clorosis [41]. Aucique-Pérez y colaboradores, mostraron que las plantas de trigo inoculadas con el hongo Pyricularia oryzae reducen hasta en 5% el rendimiento cuántico; el silicio (Si) mejoró dicha respuesta como inductor de tolerancia [42]. Este parámetro, también ha sido útil para determinar el nivel de daño por enfermedades virosas como los Potyvirus [43]; sin embargo, no es sensible para la detección presintomática de la enfermedad ocasionada por los virus del grupo de los Tobamovirus [44]. En plantas de trigo afectadas por roya se encontró que el parámetro (Fo) es un buen indicador en el avance de la enfermedad [45]. En contra parte, las plantas cultivadas inoculadas con microrganismos benéficos, muestran una mejora sustancial en la eficiencia fotoquímica, y por consecuencia una mejora en la eficiencia fotosintética [46]. Estos reportes, dan hincapié al uso de la técnica de la fluorescencia como herramienta para entender la interacción de las plantas con los microorganismos.
Un resumen del comportamiento de los parámetros de fluorescencia ante los factores de estrés más estudiados se presenta en la figura 4.

Figura 4 Tendencias de los parámetros principales de la fluorescencia ante los principales factores de estrés vegetal más estudiados. NPQ: Declive no fotoquímico; qP: Declive fotoquímico; ETR: Tasa de transporte de electrones; Fv/Fm: Rendimiento cuántico máximo; MP: Metales pesados; Moo: Microorganismos; IT: Inductores de tolerancia.
Conclusiones y perspectivas futuras
Si bien se reconoce que los parámetros de la fluorescencia de la clorofila son afectados por casi cualquier factor (figura 3), su utilidad va más allá que la simple cuantificación de los niveles de estrés de las plantas. Actualmente, las mediciones de la fluorescencia son ensayadas con fluorómetros modulados inalámbricos [47], lo que permite el desarrollo de equipos de medición remota. Ello está permitiendo el análisis de la relación de los parámetros de fluorescencia con la productividad de los cultivos, ahora medida desde el espacio [48],[49],[50]. Lo anterior, permitirá predecir el rendimiento de las plantas cultivadas en cualquier estación del año. Además, las técnicas actuales de fenotipificación auxiliadas con la técnica de la fluorescencia de la clorofila, están permitiendo la evolución de la integración de los estudios fotoquímicos con imágenes de fluorescencia multicolor [51]. Esto permitirá adquirir rasgos morfológicos, fisiológicos y patológicos instantáneamente; así como entender su relación con la fotosíntesis y los metabolitos secundarios involucrados [52]. Lo que proporcionará un nuevo medio para promover el progreso en el mejoramiento de cultivos tolerantes a los diversos factores limitantes de su productividad [48]. La técnica de la fluorescencia de la clorofila permitirá entender cómo se adaptarán las plantas cultivadas a los diversos factores de estrés, los cuales se agudizan cada vez más con el cambio climático.











 nueva página del texto (beta)
nueva página del texto (beta)



