Introducción
La contaminación del aire es uno de los parámetros más importantes que afectan la calidad de vida y la salud de la población en comunidades urbanas. Con el objetivo de garantizar una buena calidad del aire, los gobiernos de todo el mundo han adoptado una serie de medidas cada vez más exigentes para frenar su contaminación [1]. En específico, se ha prestado especial atención a las emisiones de los vehículos de motor. Los automóviles funcionan con gasolina, la cual está compuesta por hidrocarburos. Cuando el combustible de hidrocarburo se quema con el oxígeno del aire, se libera una gran cantidad de energía. Sin embargo, debido a que la gasolina contiene alrededor de 150 compuestos químicos diferentes, genera más que solo energía: también produce contaminación (figura 1). Los principales contaminantes son gases como monóxido de carbono (CO), hidrocarburos no quemados (HC) y óxidos de nitrógeno (NOx). En México, la Secretaría de Medio Ambiente y Recursos Naturales (SEMARNAT) ha implementado normas que indican los requisitos de emisiones gaseosas para vehículos y motores, con el fin de mejorar la calidad del aire. Los estándares de emisiones para vehículos livianos se establecieron por primera vez en 1988 y entraron en vigor en 1993 (NOM-042-ECOL-1993 y NOM-042-ECOL-1993). Posteriormente, se actualizaron con la publicación de la NOM-042-SEMARNAT-2003 que brinda una opción de cumplimiento con los estándares basados en el sistema regulatorio de los EE. UU. y el sistema europeo, pasando de los estándares Euro 3 y 4. Esta regulación está en vigor desde 2004 y actualmente establece los límites máximos permisibles de emisión CO, HC y NOx por vehículos de pasajeros (hasta 3,857 kilogramos), que usan gasolina, gas natural, gas licuado de petróleo o diésel (tabla 1) [2]. Se define como vehículo de pasajeros a cualquier automóvil con capacidad de hasta 10 personas. En la tabla 1 se muestra la clasificación en donde A: Vehículos año modelo 2004 y posteriores, B: Vehículos año modelo 2007 y posteriores, C: Vehículos al año calendario en el cual se apliquen los límites máximos permisibles.

Figura 1 Emisión de gases tóxicos por el tubo de escape de un vehículo de pasajeros en una zona urbana. Imagen obtenida de wired.com/story/think-ride-sharing-is-good-for-the-planet-not-so-fast/
Tabla 1: Límites máximos permisibles de emisión para vehículos de pasajeros que funcionan con gasolina o diésel establecidos en la NOM-042-SEMARNAT-2003.
| Vehículo de pasajeros | Ejemplo | CO (g/km) | HC (g/km) | NOx (g/km) | |||
| Gasolina | Diesel | Gasolina | Diesel | Gasolina | Diesel | ||
| A | Nissan Sentra 2004 | 2.11 | 0.156 | 0.25 | 0.62 | ||
| B | Volkswagen Jetta 2009 | 2.11 | 0.099 | 0.249 | |||
| C | SUV Toyota Rav4 2022 | 2.11 | 0.047 | 0.068 | |||
Debido al incremento de la población y la cantidad de vehículos, las regulaciones son cada vez más exigentes. Por tal motivo, se han desarrollado tecnologías avanzadas de tratamiento de emisiones para vehículos de gasolina, lo que puede ayudar a reducir la contaminación asociada a tráfico vehicular a pesar del aumento de los viajes en automóvil. El uso del catalizador de tres vías (CTV) es una estrategia importante para disminuir los gases de escape como CO, HC y NOx[3]. A continuación, se profundiza en la formulación histórica y actual de los CTV y se investiga la química catalítica que tiene lugar a nivel molecular; así como las ventajas ambientales que ofrecen estos dispositivos.
Antecedentes históricos del uso de los catalizadores de tres vías
Los catalizadores se introdujeron a inicios de los 70´s para cumplir con la normativa de control de emisiones de vehículos con motor [4]. Los primeros catalizadores se conocían como convertidores catalíticos de dos vías, ya que oxidaban el CO y los HC transformándolos en CO2 y vapor de agua (H2O). La conversión de estos dos gases se abordó con el uso de platino y paladio, que demostraron ser muy activos y estables para la oxidación. Inicialmente, la reducción de NOx se llevó a cabo de forma no catalítica mediante un sistema mecánico denominado “recirculación de los gases de escape”. Los gases ricos en H2O, CO2 y N2, se reincorporaban a la primera fase del ciclo de combustión (etapa de admisión) para mezclarse con el aire de aspiración. Esto aumentaba la capacidad calorífica y disminuía la temperatura máxima alcanzada. De esta manera la cantidad de NO se reducía, ya que a mayor temperatura se generan más óxidos de nitrógeno [4]. Posteriormente, la investigación sobre materiales catalíticos condujo al descubrimiento del rodio (Rh) como un excelente catalizador reductor de NOx. En 1980, la introducción del Rh proporcionó al convertidor catalítico la capacidad de reducir también los NOx dando lugar al llamado catalizador de tres vías [5]. Estos elementos activos (Pt, Pd y Rh) se esparcieron en un soporte cuidadosamente fabricado con un material altamente capaz de almacenar oxígeno, para moderar los cambios rápidos de las estequiometrías de escape ricas o pobres en oxígeno. El componente de almacenamiento adsorbe el exceso de oxígeno presente y lo libera para la ejecución de las reacciones químicas. El primer material utilizado fue CeO2, que presenta la característica de que cada átomo de O2- libre crea un espacio y produce dos cationes Ce3+ mediante la distribución de electrones a dos cationes Ce4+[6]. Sin embargo, a pesar de sus excelentes propiedades de almacenamiento de oxígeno, el uso de CeO2 puro se descartó porque es poco termoestable y sufre sinterización a altas temperaturas, perdiendo así sus características cruciales de almacenamiento y liberación de este elemento [7]. En consecuencia, la actividad de investigación en los años 90´s se centró en la mejora de la estabilidad de la superficie del soporte de CeO2. Entre los diferentes sistemas estudiados, el ZrO2 parecía ser el estabilizador térmico más eficaz, especialmente cuando forma un óxido mixto con CeO2. Los primeros trabajos incorporaron ZrO2 en la superficie de los CTV de forma descontrolada, principalmente por impregnación, obteniendo resultados poco favorecedores. Posteriormente, se encontró que la forma adecuada de añadir ZrO2 es generando una solución sólida entre el CeO2 y el ZrO2[8]. También, se investigó la estabilidad térmica de los óxidos mixtos CeO2 ± ZrO2 soportados sobre Al2O3 y se demostró que una mayor proporción de ZrO2 puede evitar que el CeO2 disperso reaccione con el Al2O3, mejorando así las estabilidad de los CTV [9]. Como puede observarse, los CTV han evolucionado tras años de investigación hasta su formulación actual para asegurar una mayor eficiencia. A continuación, se describen las características y el funcionamiento de los CTV de uso vigente.
Principios de funcionamiento de los catalizadores de tres vías actuales
El diseño actual de estos dispositivos consiste en una carcasa de acero que protege dos monolitos de cordierita sintética (2MgO-2Al2O3-5SiO2), material que exhibe una baja expansión térmica y resistencia al agrietamiento por choques térmicos durante cambios rápidos de temperatura. La estructura interna de cerámica está organizada en un sistema de canales similar a un panal de abejas, resultando en una mayor superficie de interacción entre los gases tóxicos y la superficie catalítica [10]. La superficie del CTV está recubierta con platinoides (Pt, Pd y Rh) encargados de acelerar las reacciones de conversión (figura 2). Los platinoides ayudan a acelerar una reacción química, sin ser agotados u oxidados. Un catalizador actúa generando un estado de transición diferente y una menor energía de activación para la formación de productos. Por lo tanto, las colisiones moleculares tienen la energía necesaria para alcanzar el estado de transición. En consecuencia, los catalizadores permiten el transcurso de reacciones que de otro modo estarían bloqueadas o desaceleradas por una barrera cinética [11]. Los platinoides son colocados sobre una solución sólida de Al2O3-CeO0.2Zr0.8O2. Este compuesto se caracteriza por poseer la capacidad de liberar y almacenar oxígeno de forma reversible por la fluctuación de los estados de oxidación de los cationes. La alta capacidad de almacenar oxigeno es debido a la facilidad con la que los iones de Ce pueden reducirse de Ce4+ a Ce3+ tras la formación de vacantes de oxígeno. El catión Zr+4 aumenta la capacidad de almacenar oxígeno debido a la distorsión de la red cristalina. Una buena capacidad de almacenamiento de oxígeno es importante, ya que este elemento es esencial para que se lleven a cabo las siguientes reacciones redox de conversión.
2CO + O2 ( 2CO2 (oxidación)
2NOX + CO ( CO2 + N2 (reducción)
C9H20 + 14O2 ( 9CO2 + 10H2O (oxidación)
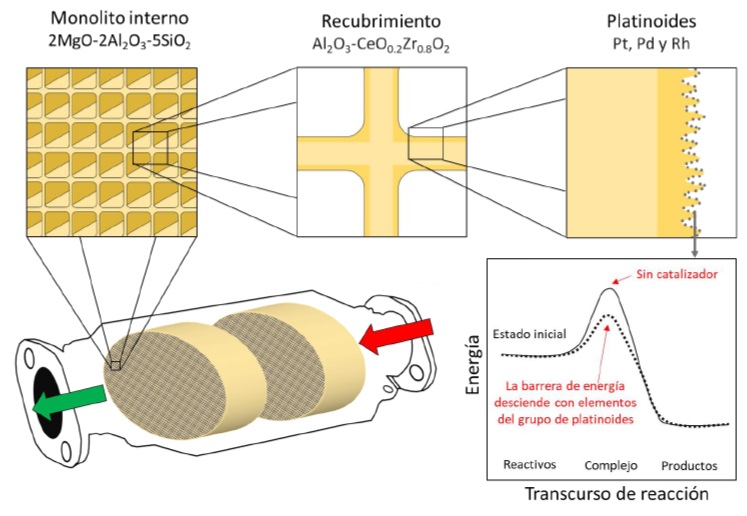
Figura 2 Estructura interna de un catalizador y gráfico de la participación de los platinoides en la disminución de energía de transición para la formación de productos durante el transcurso de una reacción (catálisis).
El oxígeno necesario para formar la mezcla con combustible y que eventualmente alcanza el CTV se toma del aire atmosférico. El CTV es mucho más eficiente convirtiendo CO, HC y NOx cuando la relación de aire/combustible es estequiométrica (14.6/1). Además, esta proporción evita que el CTV se impregne de gasolina no quemada y se dañe. El aire se introduce a través del filtro en el colector de admisión y se dosifica mediante la válvula de mariposa. Por otro lado, llega el combustible, que dentro del colector de admisión se une al aire y esta mezcla es enviada al cilindro. El llenado de los cilindros se produce por aspiración mientras la válvula de admisión está abierta. Para lograr que el motor funcione a una relación aire/combustible de 14.6/1 se utiliza un sensor que detecta la presencia de oxígeno (sonda lambda). De esta manera, si el sensor detecta una alta proporción de O, envía una señal al sistema de inyección para enriquecer la mezcla inyectando más combustible. Contrariamente, si la mezcla contiene mayor cantidad de combustible, el sensor detecta la ausencia de oxígeno y envía una orden al sistema de inyección para que reduzca la cantidad de combustible utilizado. Los gases de escape resultantes de la explosión de la mezcla en las cámaras de combustión se canalizan a través de colectores y pasan por tres fases antes de ser expulsados (figura 3). En la fase 1, ocurre la unión de los gases de cada cilindro en un único colector. La fase 2, consiste en la reorganización molecular de las especies gaseosas a través del CTV. Finalmente, en la fase 3 los gases resultantes pasan a través de un resonador y las ondas sonoras producidas con cada explosión se mitigan en un silenciador. El proceso de conversión por catálisis transcurre en la fase 2, cuando CO, NOx e HC atraviesan los canales del CTV e interactúan con su superficie. El primer bloque del CTV contiene mayor cantidad de Pt y Rh, por lo que las moléculas de NOx son las primeras en reaccionar, generando átomos libres de N que se combinan para formar N2. Las moléculas del gas pasan al segundo bloque con concentraciones mayores de Pt y Pd; así las moléculas de HC y CO se unen con O- para formar CO2 y vapor de agua. Las tres reacciones químicas se llevan a cabo a altas temperaturas, lo que se traduce en una deficiencia importante en el diseño moderno del CTV, pues la conversión de gases es nula durante el arranque en frío (que se presenta en los minutos iniciales del viaje del vehículo) [10]. En ese sentido, los CTVs dependen de las temperaturas elevadas proporcionadas por el motor para cumplir su función de manera óptima. Así, a una temperatura de operación alta (hasta 800oC) y con la cantidad adecuada de oxígeno, el porcentaje de conversión de los gases de escape oscila entre el 90 y el 99.9 % [12].
Beneficios para el medio ambiente y la salud humana
Sin el uso de los catalizadores de tres vías los gases de escape de los vehículos se liberarían directamente a la atmósfera. Como se mencionó previamente, en los motores de gasolina el proceso de combustión genera tres contaminantes principales: CO, HC y NOx. Estos gases tienen un impacto grave e irreversible tanto en la salud humana como en los ecosistemas [12]. El monóxido de carbono, generado por el calor del motor durante el trabajo realizado, es un gas altamente venenoso, insípido, inodoro e incoloro. La exposición a este gas afecta el suministro de oxígeno a órganos y tejidos del cuerpo, lo que puede provocar la muerte. El envenenamiento por CO causa dolor de cabeza, dolor en el pecho, debilidad, náuseas, vómitos, y altera el estado mental [13]. Por otro lado, los hidrocarburos no quemados son residuos de la gasolina y su incorporación a la atmosfera genera nubes dañinas de smog fotoquímico; además, algunos compuestos de HC producen irritación en los ojos, daño pulmonar y asma [14]. Por último, el óxido de nitrógeno se forma al combinar oxígeno y nitrógeno a altas temperaturas. Este gas es responsable de generar smog fotoquímico y lluvia ácida. En humanos, se vincula a una amplia gama de problemas respiratorios, como por ejemplo tos y dolor de garganta [15].
La emisión de estos tres gases se minimiza sustancialmente mediante el uso de convertidores catalíticos [3]. Se ha demostrado que la intensidad de las emisiones de los vehículos ha disminuido en factores de 2 a 100 durante las últimas décadas para cumplir con los estándares regulatorios. Los vehículos con CTV operando con la proporción de aire y combustible cercana a la estequiométrica y a una temperatura adecuada emiten una menor cantidad de estos tres gases, en comparación con los vehículos de gasolina sin convertidor catalítico (tabla 2) [12].
Tabla 2 Emisiones de CO, NOX y HC provenientes de un automóvil sin y con catalizador de tres vías (modificada de [12]).
| Gas de escape | Sin catalizador de tres vías (g/km) | Con catalizador de tres vías (g/km) |
| CO2 | 1.8 | 0.3 |
| NOx | 0.00346 | 0.00068 |
| HC | 1.56 | 0.22 |
Los beneficios del uso del catalizador son claros. Sin embargo, el diseño del proceso de combustión en estos vehículos genera un envejecimiento y, por tanto, una pérdida de eficiencia [16]. Además, su sobreuso produce niveles elevados de emisión de materia particulada como platinoides y óxido de zirconia [16, 17], por lo que se recomienda su reemplazo oportuno.
Importancia de su uso y reemplazo
Un convertidor catalítico es uno de los dispositivos de tratamiento de gases de escape más efectivos. Sin embargo, al igual que cualquier otra pieza automotriz, puede dañarse o volverse menos eficiente. Las razones de la pérdida de eficiencia de conversión pueden incluir mezclas de aire/combustible no adecuadas, bujías y sensores de oxígeno defectuosos, y sincronización incorrecta del motor. Los CTV también pueden obstruirse total o parcialmente debido a fugas de anticongelante y aceite causadas por sellos de válvulas dañados, juntas defectuosas y pistones desgastados. Adicionalmente, algunos elementos químicos presentes en los aditivos de las gasolinas se pueden incorporar a la superficie catalítica [18]. En algunos casos, las unidades convertidoras se sobrecalientan derritiendo la estructura interna de panal [19]. Por otra parte, el empuje a alta presión del flujo de gases y el golpeteo generado por el mal estado de calles y carreteras puede producir su desintegración, liberando la capa catalizadora a la atmósfera [16]. En ese sentido, el sobreuso de un catalizador más allá de su vida útil producirá no solo la emisión de gases tóxicos, sino también de material particulado que igualmente tiene un efecto negativo sobre la salud y el medio ambiente [16, 19]. Los vehículos con un CTV dañado consumen más gasolina, expulsan humo con mal olor por el escape y pueden tener fallas mecánicas en el motor, generando un impacto económico. El motor depende del flujo eficiente de los gases de escape para funcionar a un nivel óptimo. Los bloqueos en el convertidor catalítico pueden restringir el flujo de gases, afectando su rendimiento. Finalmente, la acción más eficaz para solucionar los problemas relacionados con los convertidores catalíticos es reemplazar las unidades más antiguas por otras nuevas. La vida útil de este componente varía entre los diferentes fabricantes y el uso, aunque suele estar entre 100.000 y 120.000 kilómetros. Para alargar la vida útil de los catalizadores al máximo se recomienda mantener en buen estado diversos elementos del motor como las bujías, el filtro de aire y el sensor de oxígeno.
Conclusiones
Los convertidores catalíticos de tres vías son esenciales para reducir la emisión de gases de los vehículos con motor de gasolina a niveles reglamentarios. Su función es importante en términos ambientales ya que disminuyen hasta un 99% las emisiones de CO, HC y NOx. Su formulación y diseño actuales influyen en su rendimiento y eficiencia de conversión de gases. Sin embargo, su uso prolongado genera transformaciones en la composición original, causando la pérdida de sus propiedades catalíticas. Sumado a esto, el sobreuso de los CTVs conlleva al desgaste estructural y la posterior liberación de partículas sólidas. Por lo tanto, se recomienda su reemplazo oportuno para evitar la emisión de gases tóxicos y de material particulado a la atmósfera. Finalmente, este trabajo es una guía útil para obtener una mejor comprensión del funcionamiento de los convertidores catalíticos como dispositivos esenciales para la disminución de la contaminación ambiental.











 nueva página del texto (beta)
nueva página del texto (beta)




