Introducción
Existen distintos organismos capaces de producir sustancias nocivas o tóxicas a la salud que conocemos comúnmente como venenos. Un veneno se define como una mezcla compleja, compuesta en su mayoría por péptidos y proteínas [1], la cual es producida en una glándula especializada. Algunos arácnidos (escorpiones y arañas), ciertos insectos como abejas y avispas, y algunas especies de serpientes son capaces de producir venenos [2].
En México, las serpientes son animales sumamente estigmatizados por múltiples razones, entre ellas religiosas y culturales. De manera similar, un mal manejo de su información y percepción en medios de comunicación ha influido en una percepción negativa hacia ellas [3]. Por otro lado, las serpientes en México también son animales emblemáticos. Forman una parte importante de la mitología mexica y, también del Escudo Nacional y Bandera de México. Adicionalmente, el país ocupa el primer lugar a nivel mundial en diversidad de serpientes, ya que alberga más de 400 especies. Ello representa una cifra muy importante considerando que se han descrito poco menos de 4000 especies en todo el mundo [4].
México es el segundo país con mayor número de especies de serpientes de importancia médica (su mordedura requiere atención médica). Estas se distribuyen en 2 familias, Viperidae con 76 y Elapidae, con 17 especies respectivamente [4]. En ese sentido, dentro de la familia Viperidae encontramos a las serpientes de cascabel con 47 especies descritas en el país, 45 del género Crotalus spp., y 2 Sistrurus spp.
En México y Centroamérica, la familia de serpientes de mayor importancia médica, por la cantidad de accidentes que causan y la pronta acción de su veneno, es la familia Viperidae. En la figura 1 se muestra una adaptación evolutiva sumamente peculiar de especímenes de la familia Viperidae: la foseta loreal, estructura termosensora que les ayuda a identificar a sus presas. Adicionalmente, los vipéridos cuentan con glándulas productoras de veneno y colmillos hipodérmicos conectados a ellas. Por otro lado, las serpientes de cascabel se diferencian fácilmente de otros vipéridos por la presencia de un apéndice queratinoso sonoro localizado el final de la cola, la cual se conoce coloquialmente como un “cascabel” [5].

Figura 1 Imagen de cabeza de serpiente de la familia Viperidae donde se señalan el orificio nasal, foseta loreal y glándula productora de veneno. Fotografías por Jorge Jiménez Canale.
Serpientes en sonora
En Sonora sobresale la presencia de las serpientes de cascabel. De las 75 especies de serpientes reportadas en el estado, solamente 16 especies se consideran de importancia médica, 12 de las cuales son serpientes de cascabel (Crotalus spp, familia Viperidae). Las otras especies son Agkistrodon sp.(familia Viperidae) y Micruroides euryxanthus, Micrurus distans e Hydrophis platurus (familia Elapidae). En la figura 2, se observan algunas especies de serpientes de cascabel que se encuentran en el estado de Sonora [6].

Figura 2 Serpientes de cascabel presentes en el Estado de Sonora: A. Serpiente de cascabel diamante del Oeste (C. atrox) B. Serpiente de cascabel cola negra (C. molossus) C. Serpiente de cascabel de cuernitos (C. cerastes) D. Serpiente de cascabel de Mojave/Altiplano (C. scutulatus) E. Serpiente de cascabel tigre (C. tigris). Fotografías por Jorge Jiménez Canale.
La Organización Mundial de la Salud (OMS) estima que al año ocurren ~5.4 millones de mordeduras de serpientes, las cuales llegan a causar de 80 000 a 137 000 muertes [7]. El panorama en México es un poco distinto, registrándose ~4000 mordeduras, con una taza de fatalidad del 0.5%. Específicamente para el caso del Estado de Sonora suelen reportarse ~100 mordeduras al año [8]. En ese sentido, científicos han buscado desarrollar antivenenos más baratos, eficaces y accesibles. Para ello, es de trascendental importancia conocer la composición y propiedades de los venenos de las serpientes [9], [10].
Estudios recientes han demostrado que los venenos de especies de serpientes, incluyendo las mexicanas, comparten la presencia de familias de toxinas [11]. En la figura 3 se muestra una representación de la abundancia de las familias de toxinas en serpientes de cascabel del género Crotalus spp. Entre estas toxinas destacan como familias dominantes las fosfolipasas A2 (PLA2s), metaloproteasas (SVMPs) y serinoproteasas (SVSPs). Asimismo, proteínas secretoras ricas en cisteína (CRisPs), L-aminoácido oxidasas (LAAOs), lectinas de tipo C (CTLs/snaclecs), disintegrinas (DIS) y péptidos natriurétricos (NPs) [1].
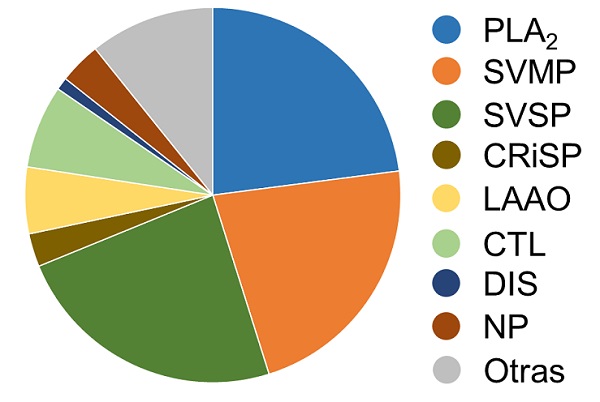
Figura 3 Composición venómica de serpientes de cascabel (Crotalus spp.). Imagen modificada de Tasoulis & Isbister, 2017 [1].
Se presume que esta representación va a cambiar rápidamente conforme se avance en el estudio de los venenos de las distintas especies. Los avances en las investigaciones sobre las propiedades tóxicas de las sustancias que se encuentran en los venenos de serpientes han permitido descubrir que, utilizadas en cantidades y formas definidas, pueden tener usos terapéuticos contra diversas enfermedades, incluidos diversos tipos de cáncer [12]. Dada la abundancia de las serpientes de cascabel en el Estado de Sonora, resulta de especial interés estudiar la composición y propiedades de sus venenos, así como su posible aplicación como agentes terapéuticos. Por tal motivo, en el presente artículo nos enfocaremos en los avances que se han realizado en la caracterización de los venenos de serpientes de cascabel sonorenses, enfatizando los estudios para el desarrollo de fármacos.
Composición de venenos de serpientes de cascabel sonorenses
Como se mencionó anteriormente, en el estado de Sonora, México se han descrito 13 especies de vipéridos, de las cuales 12 de ellas son serpientes de cascabel (Crotalus spp.). En la tabla 1, se enlistan dichas especies y algunas familias de toxinas que se han reportado se encuentran en sus venenos. En la figura 4 se muestra de manera general el proceso habitual de extracción de veneno de una serpiente, el cual es necesario para el estudio de sus venenos. De forma breve, las serpientes se introducen dentro de un tubo de plástico para evitar movimientos bruscos y controlar la zona de la cabeza de donde son sujetadas, esto reduce el riesgo que la serpiente sufra alguna lesión y otorga seguridad al personal. Posteriormente, se permite que la serpiente muerda un contenedor estéril cubierto con Parafilm, para asemejar tejido. Una vez extraído el veneno, se puede realizar un proceso de liofilización con lo cual el veneno se podrá usar para estudios pertinentes.

Figura 4 Imágenes de extracción de veneno a serpiente de cascabel en Sonora, México. Fotografías por Rodolfo Vega Littlewood.
Tabla 1 Lista de especies de serpientes de cascabel (Crotalus spp.) en Sonora, México [6], [11].
| Especie | Familias de toxinas | Referencias |
| Serpiente de cascabel Diamante del Oeste (C. atrox) | BIPs, BPPs, CNP, CRiSP, Dis, Hya, LAAO, CTL, PLA2, SVMP P-I/III, SVSP, VEGF | [11], [13] |
| Serpiente de cascabel del Pacífico (C. basiliscus) | PP, CRISP, CTL, Dis, LAAO, PLA2 (CRTX, non-CRTX), SVMP P-I/II/III, inhibidor de SVMP, SVSP | [11], [14] |
| Serpiente de cascabel de cuernitos (C. cerastes) | 3FTx, 5′NT, BPP, CRiSP, CTL, Dis, Hya, Kun, LAAO, MYO, NGF, PDE, PLA2, SVMP P-II/III, SVSP, VEGF, WAP | [11][15][16] |
| Serpiente de cascabel de Isla San Esteban (C. estebanensis) | N/D | N/A |
| Serpiente de cascabel gris (C. lepidus) | 5′NT, CRiSP, CTL, Dis, LAAO, PDE, PLA2, SVMP-P-I/III, SVSP (TLE) | [11], [17], [18] |
| Serpiente de cascabel cola negra (C. molossus) | Dis, LAAO, MYO, PLA2, SVMP P-I/III, SVSP (TLE) | [11], [19], [20] |
| Serpiente de cascabel de manchas gemelas (C. pricei) | N/D | N/A |
| Serpiente de cascabel moteada (C. pyrrhus) | LAAO, SVSP, PLA2 (CRTX/MTX) | [11], [21] |
| Serpiente de cascabel de Mojave (C. scutulatus) | 5′-NT, APase, BPPs, CRiSP, CTL, Dis, Hya, Kun, LAAO, MYO, NGF, PDE, PLA2 (MTX, no-CRTX), SVMP P-I/II/III, SVSP, VEGF | [11], [22], [23] |
| Serpiente de cascabel tigre (C. tigris) | CRiSP, Dis, PLA2 (MTX), SVMP P-III, SVSP, VEGF | [11], [24] |
| Serpiente de cascabel de praderas (C. viridis) | 5′-NT, APase, BPP, CRiSP, CTL, Dis, GC, LAAO, MYO, OHA, PDE, PLA2 (CRTX, no-CRTX), PLB, SVMP inhibitor, SVMP P-I/II/III, SVSP (TLE) | [11], [25], [26] |
| Serpiente de cascabel de nariz surcada (C. willardi) | CRiSP, CTL, Dis, LAAO, PDE, PLA2, SVMP P-I/III, SVSP (TLE) | [11], [27] |
Notas: Toxinas de 3 dedos (3-FTX), 5’-nucleotidasa (5’-NT), acetilcolinesterasa (achase), péptido natriurétrico tipo A (ANP), péptido natriurétrico tipo B (BNP), péptido natriuretrico tipo C (CNP), adenosina trifosfatasa (ATPase), péptido inhibitor de bradiquinina (BIP), péptido potenciador de bradiquinina (BPP), lectinas de tipo C (CTL), cisteína proteasa (CysProt), proteína secretora rica en cisteína (CRiSP), crotoxina (CRTX), disintegrina (Dis), factor de crecimiento epidermal (EGF), factor de crecimiento de fibroblasto (FGF), guanilil ciclasa (GC), hialuronidasa (Hya), inhibidor tipo kazal (Kazal), inhibidor tipo kunitz (Kun), L-aminoácido oxidasa (LAAO), Mojave toxina (MTX), miotoxina (MYO), factor de crecimiento nervioso (NGF), ohanina (OHA), fosfodiesterasa (PDE), factor de crecimiento derivado de plaqueta (PDGF), fosfolipasa A2 (PLA2), fosfolipasa B (PLB), fosfolipasa D (PLD), metaloproteasa de veneno de serpiente (SVMP), serinoproteasa de veneno de serpiente (SVSP), enzima tipo trombina (TLE), factor de crecimiento endotelial (VEGF), waparina (WAP), N/D (no determinado).
Algunas familias de toxinas como las SVMPs y SVSPs se asocian al desarrollo de coagulopatías en pacientes [12], mientras que otras como la MTX y CRTX se asocian a problemas asociados al funcionamiento neuromuscular y neurotoxicidad [28]. En ese sentido, la gran variedad de familias de toxinas que se han reportado en los venenos de serpientes de cascabel promueve el estudio de los mismos para la búsqueda de posibles agentes farmacológicos [29]. Adicionalmente, una de las ventajas de utilizar componentes proteicos para el desarrollo de medicinas, es la alta afinidad que tienen con receptores celulares, descartando en ocasiones actividades no deseadas en el organismo por interacción en otras zonas [12].
Potencial farmacéutico de familias de toxinas
La utilización de péptidos y/o proteínas provenientes de venenos de serpientes para desarrollo de medicamentos no es un concepto nuevo. Entre algunas de las desventajas encontramos una baja distribución en el cuerpo cuando son administrados vía oral gracias a la digestión en el estómago. De manera similar, estas moléculas son eliminadas rápidamente del torrente sanguíneo si se administran vía intravenosa, y pueden causar reacciones inmunogénicas. Por otro lado, algunas claras ventajas son la alta especificidad que presentan en ciertos tejidos y células, acción en procesos metabólicos, y actividad anticancerígena mediante diferentes mecanismos. Con base en esta idea, nuestro equipo de investigación ha reportado el potencial uso del veneno de serpientes de cascabel (C. molossus), al integrarlo a estructuras nanométricas como nanopartículas contra células de carcinoma mamario (T-47D) [19]. A continuación, describiremos brevemente sobre el potencial uso de toxinas aisladas y familias de toxinas presentes en diferentes venenos de serpientes de cascabel sonorenses, específicamente en enfermedades como cáncer.
Fosfolipasas A2 (PLA2s)
Las fosfolipasas son enzimas de gran interés biotecnológico y farmacológico, esto debido a que están involucradas en diversas enfermedades inflamatorias en humanos, así como en el envenenamiento de venenos de serpientes [30]. Su mecanismo de acción está dirijido al metabolismo de lípidos membranales y, entre sus productos de hidrólisis se genera ácido araquidónico, precursor importante de compuestos como prostaglandinas, tromboxanos, leucotrienos, entre otros [12]. Una de las características de muchas células cancerosas es una biosíntesis y lipogénesis atípica, por lo que estos componentes del veneno pudieran ser utilizadas contra ellas. Se ha reportado que diversas PLA2s tienen actividad antiproliferativa en modelos tanto in vitro como in vivo, mediante mecanismos como inductores de apoptosis, inhibición de migración celular y angiogénesis [12].
Metaloproteasas (SVMPs)
También conocidas como zinc-metaloproteasas, son proteínas de masa molecular variable y multi dominio, las cuales mediante procesos autoproteolíticos pueden generar agentes bioactivos. Se asocia su acción al desarrollo de hemorragias y cambios en el proceso de coagulación. Se ha reportado que su principal mecanismo de acción es sobre componentes de la matriz extracelular (colágeno, laminina, fibronectina, entre otros) [31]. Dependiendo de su estructura se pueden clasificar en P-I, P-II, P-III y P-IV SVMPs, las cuales hacen referencia a solo el dominio de SVMP, SVMP + DIS, SVMP + DIS + dominio rico en cisteína y SVMP heterodiméricas, respectivamente. Se ha reportado algunos de sus mecanismos de acción antiproliferativa se basan en la acción que presentan inhibiendo procesos adhesión celular (al actuar sobre receptores de integrinas), reduciendo la probabilidad de iniciar un proceso metastásico [12].
Serinoproteasas (SVSPs)
Las serinoproteasas son enzimas que se ha reportado se encuentran en diversos organismos, tanto de plantas como en animales. Aunque han sido relativamente menos estudiadas que otros componentes del veneno de serpientes de cascabel, sabemos que afectan diversas etapas de la cascada de coagulación [32]. Específicamente se reporta que algunos de sus mecanismos de acción están involucrados en la inhibición de agregación plaquetaria, coagulación y fibrinólisis. Si bien, la mayoría de los estudios referentes a estas toxinas están enfocados en desórdenes de coagulación, algunos reportes han indicado que pueden inhibir metástasis en líneas cancerosas de pulmón mediante un proceso de defibrinogenación [33].
L-aminoácido oxidasas (LAAOs)
Estas glicoproteínas se encuentran presentes en organismos como bacterias, plantas y animales. Catalizan una deaminación oxidativa de L-aminoácidos dando productos como ácidos alfa-keto, amoniaco y peróxido de hidrógeno (H2O2) [12]. En ese sentido, se ha demostrado que su interacción con receptores de membranas celulares produce altos niveles de H2O2. Lo anterior puede ayudar a inducir un proceso de hipotensión, y curiosamente, se ha observado que esto ocurre de manera específica en células endoteliales de mamíferos. Algunos estudios reportaron que la interacción de estas enzimas en membranas celulares produce un aumento significativo local de H2O2 y de esta manera induce apoptosis, sin embargo, también se reportó que este proceso de apoptosis era diferente al inducido solo por H2O2[34]. Asimismo, se ha reportado que la acción de las LAAOs también está ligada a caspasas (proteasas comunes como marcadores apoptóticos). En este contexto, estas enzimas resultan ser sumamente interesantes, pero hace falta determinar sus mecanismos de acción y seguridad de aplicación.
Lectinas de tipo C de serpientes (CTL)
Las lectinas son proteínas que reconocen y se unen de manera específica a ciertos carbohidratos. Actualmente se han estudiado diversos tipos de lectinas para el desarrollo de agentes antitumorales [35]. Asimismo, se ha reportado que algunas CTLs son capaces de inhibir crecimiento tumoral derivado de las interacciones con las membranas de diversas líneas cancerosas. Estas toxinas pueden adherirse a los receptores de integrinas compitiendo con receptores de la matriz extracelular, los cuales son importantes en el desarrollo celular y tumoral, promoviendo su uso como potenciales agentes antiproliferativos [12], [36].
Desintegrinas (DIS)
Las desintegrinas representan una familia de péptidos no enzimáticos y no tóxicos de relativamente baja masa molecular ( < 10 kDa) [37], [38]. Se ha demostrado que ciertas integrinas como las αβ y subtipos, son receptores sumamente importantes en la adhesión celular de células cancerosas. De manera general, el mecanismo de acción de estas toxinas como inhibidores de crecimiento tumoral y metástasis se basan en el impedimento de la unión de receptores de integrinas tumorales en la matriz extracelular [12]. Algo relevante es que ya se han aprobado medicamentos antiplaquetarios como Tirofibán [39] y Eptifibatida [40], basados en desintegrinas.
En la figura 5 se muestran los componentes que se han caracterizado en los venenos de serpientes de cascabel que ocurren en Sonora. Se anticipa que esta gráfica puede cambiar conforme se profundicen los estudios en especímenes nativos del estado, así como comparándolos con especímenes juveniles y adultos.
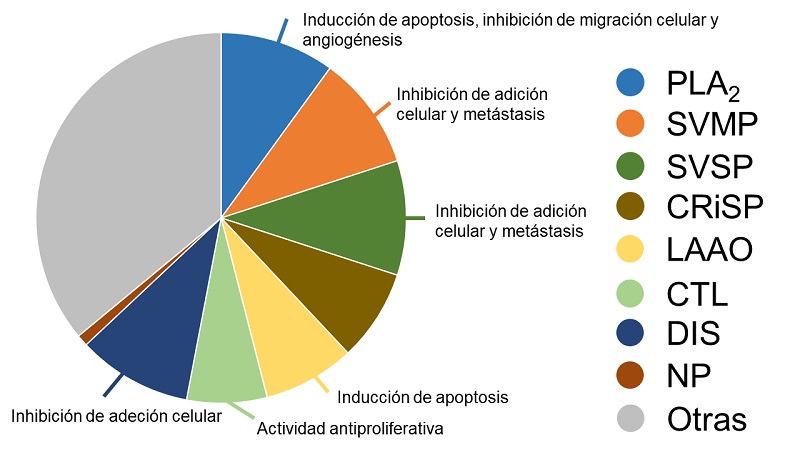
Figura 5 Composición venómica de serpientes de cascabel (Crotalus spp.) que ocurren en Sonora, México. Imagen modificada según datos de Deshwal et al. (2021) [11].
Es importante aclarar que existe una falta de estudios con respecto a venenos de serpientes sonorenses. Hace falta caracterizar de manera más profunda sus contenidos, así como sus funciones en el cuerpo. En ese sentido, se debe considerar que pueden existir cambios interespecíficos derivado de diferencias geográficas, y también ontogenéticos [41], por lo que comparar el veneno de serpientes adultas y juveniles brindará información valiosa.
Las toxinas provenientes de serpientes venenosas representan oportunidades para la investigación y desarrollo de medicamentos, como el cáncer. En la tabla 2 se observa una lista de medicamentos aprobados por la FDA basados en toxinas de serpientes.
Tabla 2 Lista de medicamentos aprobados por la FDA basados en toxinas de serpientes [42].
| Fase | Fármaco | Origen | Indicación |
| Aprobado por la FDA | Captopril | Bothrops jararaca | Hipertensión |
| Tirofibán | Echis carinatus | Ataques al corazón | |
| Eptifibatida | Sistrurus miliarus | Síndrome coronario agudo | |
| Batroxibina | Bothrops moojeni | Infarto cerebral, embolia pulmonar, trombosis venosa profunda, infarto a miocardio | |
| Hemocoagulasa | Bothrops atrox | Cirugía plástica, cirugía abdominal, vitrectomía | |
| Fase clínica | Alfimeprasa | Agkistrodon contortix | Oclusión arterial periférica aguda |
| Viprinex | Agkistrodon rhodostoma | Infarto cerebral isquémico agudo |
El potencial farmacológico que las toxinas provenientes de serpientes venenosas presentan es enorme. En ese sentido, recomendamos aumentar el esfuerzo en los estudios que se les realizan, con la confianza en que lo anterior brindará frutos. Si bien la realidad de poder obtener un producto farmacéutico aprobado por agencias reguladores es difícil, no es imposible y no debemos permitir que eso frene a futuras investigaciones.
Conclusiones
Sonora es un estado sumamente biodiverso donde ocurren distintas serpientes de cascabel. Estas serpientes venenosas también cumplen roles importantes en el ambiente, como controladores de roedores. Adicionalmente, los venenos de estas serpientes son fuentes de compuestos con un gran potencial farmacéutico para diversas enfermedades, tales como diabetes, cardiovasculares y cáncer. En un futuro cercano sus venenos podrán salvar un número mayor de vidas que las muertes que ocasionan. Diversos componentes mayoritarios del veneno de serpientes de cascabel (PLA2s, SVMPs, SVSPs, LAAOs, DISs, CTLs, entre otros) ya se han estudiado previamente, y análisis han reportado actividad anticancerígena. Debido a lo anterior, el estudio de los venenos de serpientes de cascabel sonorenses ofrece amplias oportunidades para el desarrollo de nuevos y mejores medicamentos. En la Universidad de Sonora, recientemente un grupo multidisciplinario de investigadores inició una línea de investigación en este tema, cuyos resultados iniciales son muy prometedores.











 nueva página del texto (beta)
nueva página del texto (beta)



