Introducción
A lo largo de la historia evolutiva de los organismos, se han observado cambios graduales entre la gran diversidad de especies que existen en la actualidad y aquellas que existieron en el pasado [1]. Múltiples estudios de tipo bioquímicos, biogeográficos y geológicos sustentan que la biología de los organismos se ve alterada dependiendo de la severidad de las condiciones ambientales a la cual se exponen; lo que genera la gran diversidad de especies que se han desarrollado dentro del reino animal. Esto hace necesario establecer relaciones filogenéticas entre las especies y los cambios fisiológicos que promueve la variabilidad del ambiente en ellos [2].
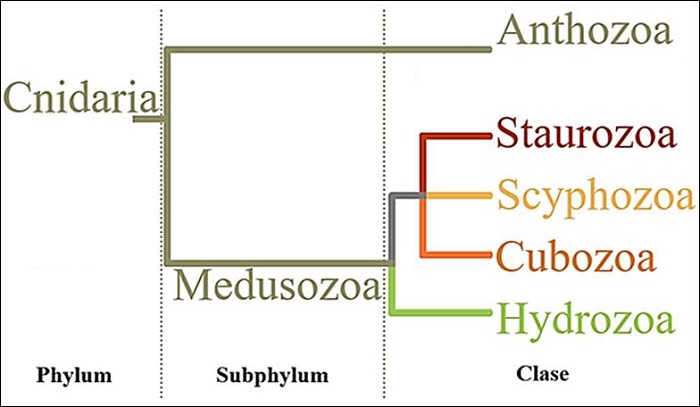
Las especies que habitan este planeta se adaptan gradualmente a las condiciones ambientales y se acoplan a los cambios morfológicos adecuados para lograr su sobrevivencia [3]. En contraste, existen especies ancestrales como los Cnidarios (medusas, corales y anémonas de mar), los cuales desde su aparición en la tierra presentan una forma bastante similar a la de los Cnidarios actuales, experimentando pocos cambios en su morfología a lo largo del tiempo. El filo Cnidaria es un grupo de organismos que aparecieron muy tempranamente después de las primeras formas multicelulares animales. No obstante, estos organismos han conservado su morfología ancestral, lo que sugiere que han sufrido muy pocos cambios desde su origen [4]. Dentro del filo de los Cnidarios se encuentra el subfilo Medusozoa; el cual incluye a las clases Cubozoa, Hydrozoa, Staurozoa y Scyphozoa (figura 1) [5]. El subfilo de los Medusozoos se ha diversificado a tal punto, que se han reportado especies de medusas principalmente de vida marina [6], pero también dulceacuícola y de ambientes costeros [7].
Las medusas de la clase Scyphozoa (comúnmente llamadas escifozoos) se pueden alimentar de larvas, huevos de peces, cladóceros, hidromedusas, ctenóforos, copépodos, crustáceos pequeños y algunos tipos de microplancton; de tal modo que la capacidad de depredación está fuertemente asociada al tamaño de la presa. Por otro lado, las medusas son presas de sifonóforos, ctenóforos, peces, tortugas marinas, aves y focas [8]. Dentro de la clase de los escifozoos se encuentran las medusas del orden Rhizostomae, las cuales no tienen tentáculos en el borde de la campana como comúnmente ocurre con las medusas. Además, carecen de una boca central, la cual es sustituida por pequeñas “bocas” denominadas ostiolos, los cuales comunican al exterior con un sistema de canales que llevan hacia ocho apéndices en el interior con forma de brazos [9]. Dentro de este orden se ubica el género Stomolophus, cuya especie Stomolophus meleagris es conocida comúnmente como la medusa “bola de cañón” [10], especie de interés en la presente revisión. El presente artículo de revisión pretende ofrecer a los futuros investigadores una amplia visión de la información acerca de la medusa bola de cañón de manera cronológica y con ello optimizar el tiempo de búsqueda de la información, misma que se ha dispersado bastante a través del tiempo.
El género Stomolophus
Actualmente, dentro del orden Rhizostomae se incluyen a los géneros Cassiopea, Cephea, Eupilema, Mastigias, Rhizostoma y Stomolophus, estos últimos dos estuvieron estrechamente relacionados, a tal punto, que la especie entonces conocida como Cephea rhizostoma[11], se identificó posteriormente como Stomolophus meleagris[12]; y a partir de sus características particulares como en la terminación de los brazos orales, se reconoció como especie tipo del género Stomolophus[13]. Los estudios de Agassiz [12] [14] lograron describir a la especie Stomolophus meleagris dentro de la familia Stomolophidae (tabla 1), de tal modo que con el tiempo a Stomolophus meleagris se le conoció comúnmente como la medusa bola de cañón debido a su particular forma casi esférica.
Tabla 1 Clasificación taxonómica completa de Stomolophus meleagris (Agassiz, 1862) [10]
| Reino | Animalia |
| Phylum | Cnidaria |
| Subphylum | Medusozoa |
| Clase | Scyphozoa |
| Orden | Rhizostomae |
| Familia | Stomolophidae |
| Género | Stomolophus |
| Especie | Stomolophus meleagris |
La medusa S. meleagris es capaz de nadar activamente utilizando la musculatura de la región sub-umbrelar (debajo de la campana), posee simetría radial y dos tipos de tejidos diferenciados y organizados; mismos que están dispuestos hacia el exterior e interior del individuo (ectodermo y endodermo, respectivamente), característica por la cual se define como un organismo diblástico [9]. Dentro de sus características morfológicas, se puede destacar que la parte superior se compone principalmente por una campana (umbrela) de aproximadamente 18 cm de diámetro, en forma de medio huevo con una consistencia gelatinosa y rígida.
Asimismo, la parte inferior está formada por ocho brazos orales fusionados de aproximadamente 5 cm de longitud, los cuales llevan a una boca central que está conectada hacía la cavidad gástrica en el interior del organismo en donde se asimila el alimento (figura 2) [13] [15]. Adicionalmente, se ha reportado que las condiciones ambientales óptimas para el desarrollo de la medusa S. meleagris es una temperatura de 22.5 °C, salinidad del agua de 36 ppm, concentraciones de oxígeno disuelto de 4.9 mg/L y un pH de 8.3 [16].
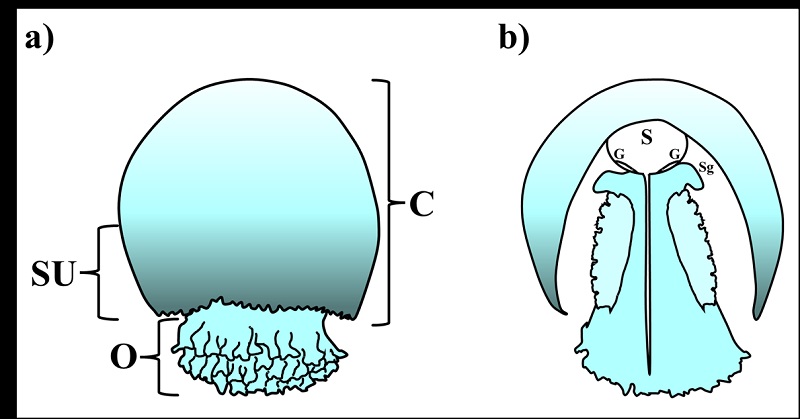
Figura 2 Morfología de Stomolophus meleagris. a) Morfología externa, C: campana o umbrela; SU: región sub-umbrelar; O: brazos orales. b) Corte longitudinal, S: cavidad gástrica; G: gónadas; Sg: Fosa subgenital [13] [18].
Cabe señalar, que la medusa bola de cañón tiene una amplia distribución en México, encontrándose en diez de los 17 estados costeros del país, de los cuales siete pertenecen al Golfo de México y diez al Pacífico Mexicano [8]. La alta presencia de S. meleagris en estos sistemas lagunares puede deberse a distintos factores, entre ellos la penetración de masas de aguas marinas a los cuerpos lagunares por mareas o corrientes, así como la alta disponibilidad de alimento [17].
Ciclo de vida
La figura 3, muestra el ciclo de vida de S. meleagris que inicia desde la fase de medusa adulta, en la cual se lleva a cabo la reproducción sexual por medio de la liberación de gametos (figura 3a) al medio marino, tanto del macho como de la hembra, presentándose una fecundación de tipo externa. El gameto fertilizado desarrollará una larva ciliada de vida libre conocida como “plánula” (figura 3b). Las plánulas son alargadas las cuales van desde 120 hasta los 390 µm de longitud y aplanadas con aproximadamente 130 µm de ancho. Esta fase es diblástica, el endodermo sólido en el interior y envuelto por un ectodermo con cilios a su alrededor, con los cuales nada para adherirse a los bentos y posteriormente transformarse en un “escifostoma” o comúnmente llamado “pólipo”.
La fijación de la plánula en el fondo marino es el punto de partida de la fase sésil del ciclo de vida de esta especie. La plánula, se une a los bentos por su extremo anterior formando una especie de tallo, modificando su forma a medida que el tallo se estrecha; mientras que la parte posterior de la plánula queda dispuesta hacía arriba y se expande hasta que se desarrolla un pólipo juvenil (figura 3c). La altura de este pólipo varía entre 200 y 430 µm, desde la base del tallo hasta la boca ubicada en el ápice. Posteriormente, aparecen los tentáculos alrededor de la boca, generalmente en números de cuatro, aunque en algunos casos pueden ser tan escasos como dos, o tan abundantes como ocho [18].
Una vez que se alcanza la etapa de pólipo maduro (figura 3d) este puede poseer hasta 16 tentáculos y hasta 2 mm de altura desde su base hasta el extremo de los tentáculos. Si las condiciones del ambiente no son propicias, este puede reproducirse por vía asexual formando podocistos (figura 3e), mismos que darán origen a un nuevo escifostoma con la misma información genética, pero con mayor capacidad de resistir eficientemente a las presiones ambientales [18].
Por otro lado, cuando las condiciones ambientales son favorables para el pólipo maduro, inicia el proceso de “estrobilación”, por lo que el organismo ahora se denomina “estróbilo”. La primera indicación externa de que el proceso de estrobilación ha comenzado, es la formación de pequeños lóbulos en la base de los tentáculos, seguido de la elongación del ápice del ahora estróbilo juvenil. Aproximadamente seis horas después se puede apreciar un proceso de segmentación en el estróbilo juvenil (figura 3f) en dónde cuenta con una incisión circular alrededor del anillo de tentáculos, misma que se va haciendo cada vez más profunda. Con el paso del tiempo, más incisiones aparecen justo debajo de la primera, llegando a observarse un estróbilo con bastantes segmentos en columna, cada uno de estos darán origen una “éfira” (siguiente forma del ciclo de vida) [18] [19].
Alrededor de 36 horas después de iniciado el proceso de estrobilación, los tentáculos comienzan a sufrir una regresión hasta el punto de que éstos son absorbidos. Simultáneamente con la regresión de los tentáculos, cada segmento comienza a alargar ocho protuberancias las cuales son conocidos como “ropalios”, cada uno de éstos se divide en sus extremos hasta contar con dos puntas finas. En este punto, cada segmento comenzará a diferenciarse del pólipo en la base del estróbilo maduro (ubicado en el tallo, debajo de todos los segmentos en desarrollo, figura 3g); de modo que cada segmento que se separa da origen a una éfira (figura 3h), a esta estructura del ciclo de vida se le conoce como “medusa juvenil” [19]. Las éfiras se liberan entre tres y cinco días después de que inició la estrobilación y presentan un tamaño de 1.5 a 2 mm de diámetro, volviéndose capaces de nadar activamente por medio de contracciones sobre sí misma, comenzando la fase móvil del ciclo de vida de S. meleagris.
El estróbilo que se quedó en el bento puede volver a formar un pólipo maduro que continuará con su propia sobrevivencia y que seguirá siendo capaz de volver a pasar por el proceso de estrobilación. Finalmente, es la éfira quien se desarrollará en una medusa adulta (figura 3i) de vida libre; lo anterior, al unir sus ropalios dando origen a lo que será la campana y con la posterior aparición de los brazos orales desde el centro. Esto permitirá la formación de la cavidad gástrica en dónde se desarrollarán las gónadas, estructuras sexuales las cuales definen a una medusa adulta, capaz de liberar gametos al medio marino para que el ciclo continúe [18].
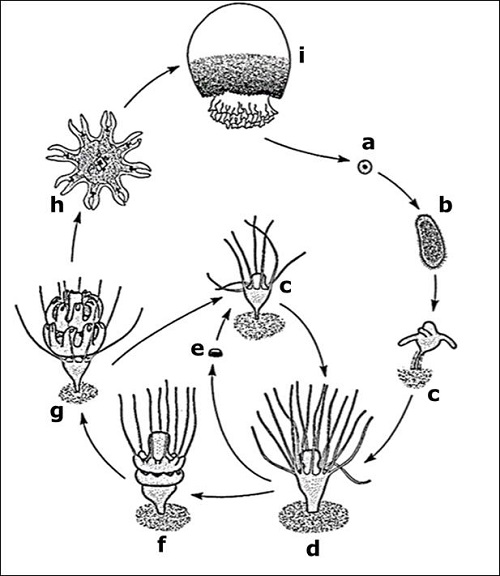
Figura 3 Ciclo de vida de Stomolophus meleagris. a) gameto, b) plánula, c) pólipo juvenil, d) pólipo maduro, e) podocisto, f) estróbilo juvenil, g) estróbilo maduro, h) éfira y i) medusa [18].
Plasticidad fenotípica
La medusa bola de cañón es fácil de reconocer debido a su forma, aunque cabe mencionar que la coloración es un tema que siempre genera dudas entre los investigadores. Lo anterior, debido a que esta medusa muestra variaciones de color, presentando fenotipos marrón, blanco, púrpura y azul; además de diferentes patrones de pigmentación caracterizados por ser lisas o con puntos. La pregunta recurrente es: ¿Son todas estas coloraciones la misma especie de Stomolophus? Un estudio reciente evaluó la estructura genética de S. meleagris dentro del Golfo de California para medusas con los fenotipos azul, blanco y purpura. A partir de estas coloraciones, se definieron nueve fenotipos diferentes: 1. Purpura sin puntos, 2. Purpura con puntos grandes, 3. Púrpura con puntos pequeños, 4. Blancas con puntos, 5. Blancas sin puntos, 6. Blancas con brazos orales pronunciados y alargados, 7. Azules con puntos, 8. Azules sin puntos y 9. Azules con brazos orales cortos. De todos ellos, predomina el fenotipo azul, seguido del blanco y por último el purpura [20]. A partir de análisis moleculares con el gen de la citocromo oxidasa 1 y el de la subunidad 12S del ARN ribosomal, no se encontraron patrones definidos sobre alguna agrupación independiente que estuvieran relacionadas con el color para todas las localidades muestreadas dentro del Golfo de California. Además, mediante un análisis de regresión, encontraron que las medusas de coloración blanca se ubicaron en localidades más frías, con una temperatura del agua entre 20 y 24 °C; mientras que las medusas de coloración azul se encontraron en cuerpos de agua por encima de los 24 °C. De esta manera, la medusa S. meleagris en el Golfo de California existe como un único stock genético y los distintos patrones de pigmentación observados para esta especie pueden resultar de condiciones ambientales específicas no definidas hasta el momento [20].
Madurez sexual
Como se mencionó anteriormente, el ciclo de vida de S. meleagris pasa por varias fases, de las cuales la fase medusa adulta se destaca por tener función sexual. Los organismos son considerados como “adultos” una vez que alcanzan la madurez sexual; sin embargo, esta especie no presenta dimorfismo sexual, por lo cual se tiene que hacer una revisión exhaustiva del tejido que comprende a las gónadas para poder determinar el sexo de algún individuo. En un esfuerzo por comprender mejor la etapa reproductiva y el sexo de S. meleagris, se identificaron cinco estados de madurez sexual, los cuales se denominaron: indeterminados, hembras inmaduras, machos inmaduros, hembras maduras y machos maduros (figura 4) [8]. Se determinó el sexo de 777 ejemplares cuyo estado de madures sexual se distribuyó para 687 individuos como indeterminados, 7 hembras inmaduras, 16 machos inmaduros, 31 hembras maduras y 36 machos maduros.
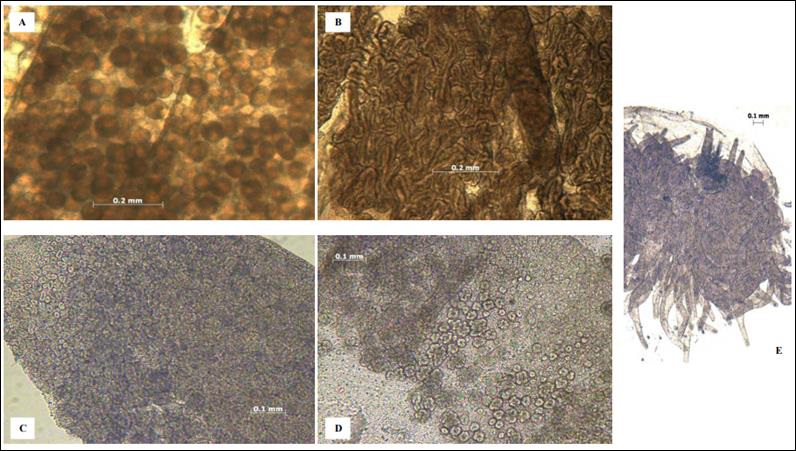
Figura 4 Estados de madurez sexual según el tejido gonádico de Stomolophus meleagris. A) hembra madura, B) macho maduro, C) hembra inmadura, D) macho inmaduro y E) organismo indeterminado [8].
Por otro lado, la talla mínima de madurez sexual para el caso de las hembras fue de 4.49 cm mientras que para machos fue de 3.49 cm. Además, en el mismo estudio se menciona que para todas las localidades los machos maduraron antes que las hembras. Sin embargo, el tamaño de las medusas no está relacionado con la madurez sexual, esto debido a que se obtuvieron organismos de un tamaño superior al promedio de madurez sexual; los cuales fueron identificados como sexualmente inmaduros, teniendo una gran variabilidad de madurez sexual según los tamaños para diferentes poblaciones de la misma especie [8] [21].
Entre los factores que pueden influir a la talla mínima de madurez sexual, el que mayormente afecta es el balance entre la energía destinada al crecimiento somático y al reproductivo. Esto debido a que, cuando el alimento es limitado, la tasa de crecimiento disminuye provocando cambios en la energía destinada para la reproducción, por lo que la talla mínima de maduración sexual se presenta en tallas chicas. Por el contrario, cuando una medusa se desarrolla en presencia de abundante alimento, crece a mayor velocidad a expensas del desarrollo gonádico. Por lo que la maduración sexual depende de la talla de crecimiento corporal, la cual está relacionada con el alimento presente en el ambiente [22] [23] [24].
Importancia económica
En países asiáticos como China, Japón, Malasia, Corea del Sur, Taiwán y Singapur, las medusas se han utilizado como un recurso comestible durante miles de años. Se han reportado más de 3,800 especies de medusas, de las cuales son 22 las que cuentan con un potencial culinario. Estas especies se caracterizan por pertenecer a la clase Scyphozoa, cuyas características sensoriales son apropiadas para servir como alimento, tales como cuerpos más rígidos y grandes en comparación con las medusas de otras clases, además de que los scyphozoos comestibles suelen carecer de toxicidad. Entre los países que actualmente consumen esta medusa como alimento se mencionan a: Argentina, Australia, Baréin, Birmania, Canadá, China, Corea del Sur, Ecuador, Estados Unidos, Filipinas, Honduras, India, Indonesia, Irán, Japón, Malasia, Nicaragua, Pakistán, Perú, Rusia, Sri Lanka, Tailandia, Turquía, Vietnam y claro, México (figura 5) [25].
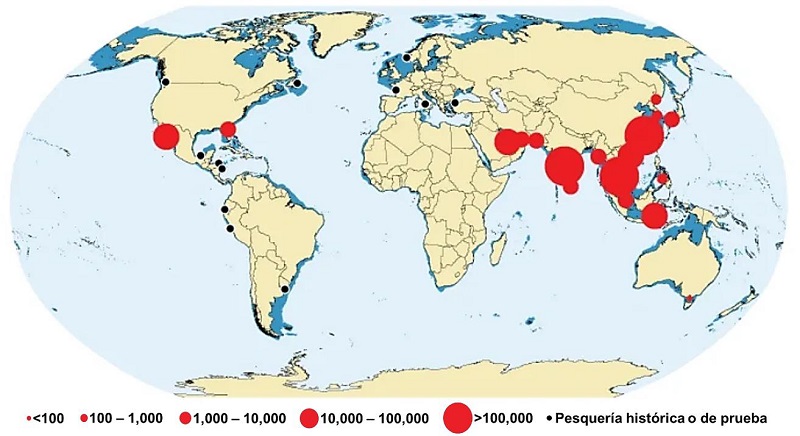
Figura 5 Pesca de medusas en todo el mundo. Los círculos negros y rojos representan la magnitud de captura en toneladas [25].
La medusa bola de cañón S. meleagris, es la única que se pesca y se comercializa en las costas mexicanas, presentándose de manera abundante en las costas del Golfo de México, Golfo de California y el Océano Pacífico. Existen registros de S. meleagris en aguas mexicanas desde finales de la década de los setenta [26]; sin embargo, su pesquería se desarrolló en el año 2000 en el Golfo de México en la costa de Tabasco, con un primer permiso de pesca, lo que permitió la construcción de la primera planta mexicana de procesamiento de medusas. No obstante, la pesquería se reubicó hacia el Golfo de California un año después en las aguas costeras del estado de Sonora. Como resultado de acuerdos científicos entre el Centro de Investigaciones Biológicas del Noroeste S.C. (CIBNOR) y compañías pesqueras [27], para el año 2004 se tenían resultados interesantes y descubrimientos biológicos sobre S. meleagris.
El arte o método de pesca utilizado para la medusa bola de cañón en México, se lleva a cabo en embarcaciones menores con un máximo de tres pescadores, mismos que utilizan redes tipo cuchara. Estas tienen un mango de 1.5 a 2 m de longitud y una malla de 8 a 12 cm de tamaño de poro, con las cuales se pueden atrapar medusas de un tamaño mínimo requerido, reduciendo la pesca de otros tamaños no comerciales, o incluso de otras especies más pequeñas. Este arte de pesca es de los más sencillos, ya que las medusas se localizan en grupos abundantes cerca de la superficie; pues, nadan a baja velocidad y se logra capturar más de un individuo por cada redada. Una embarcación tiene la capacidad de pescar hasta 5 toneladas de medusas, lo cual en mayor escala ha generado ganancias de 300 millones de pesos además de generar hasta 5,000 empleos, por lo que su aprovechamiento en las costas mexicanas es imprescindible [28] [29].
Una vez que se realiza el desembarque, las medusas capturadas se transportan a una planta procesadora en donde tratan a los individuos con mucho cuidado, debido a que pueden ser dañados fácilmente y no ser aptos para su comercialización. El tratamiento que se les da dentro de una planta de procesamiento consiste en exponerlas con abundante sal para lograr su deshidratación y prevenir la descomposición. Una vez deshidratadas, se empacan para su exportación, siendo China el principal país al cual México exporta este recurso. Se han logrado capturar entre 10,000 y 15,000 toneladas de medusas por año, con picos de hasta más de 30,000 toneladas como sucedió en 2015. A la fecha, México tiene alrededor de 20 plantas procesadoras de medusas las cuales se ubican en las costas de Sonora, específicamente en Bahía de Kino, el Golfo de Santa Clara, Puerto Peñasco y San Luis Río Colorado. Asimismo, en las costas de Baja California en Ensenada y San Felipe [30].
Clasificación actual
Tomando en cuenta la relevancia económica que la medusa bola de cañón tiene sobre el país, en los últimos años se han sumado esfuerzos por comprender su estructura poblacional con el objetivo de aprovechar correctamente a la medusa como recurso natural. En el año 2017, se realizaron estudios los cuales determinaron que la medusa identificada como Stomolophus meleagris que se pesca en el Golfo de California, aparentemente está comprendida por diferentes especies. Lo anterior, se determinó a partir de dos marcadores mitocondriales: citocromo c oxidasa I (COI) y ADNr 16s y dos marcadores nucleares: ADNr 18s y 28s [31]. De tal modo, que los datos obtenidos proponen que la especie identificada como Stomolophus meleagris, difiere en estos marcadores genéticos con las medusas Stomolophus muestreadas dentro del Golfo de California, además de otras medusas Stomolophus muestreadas en las costas de América Central (figura 6). Por lo tanto, la medusa bola de cañón que vive en el Golfo de California pasa de ser especie meleagris a una especie no definida aún, denominada como Stomolophus sp. 1 (ubicada en el Golfo de Santa Clara, en el Alto Golfo de California) y Stomolophus sp. 2 (ubicada en toda la zona sur del Golfo de california). Asimismo, se identificó un organismo del género Stomolophus sp. 6 en las costas de Bahía de Kino, Sonora y a pesar de tener suficientes datos moleculares para poder afirmar que se trata de una especie distinta a las que se encuentran en el Golfo de California, no es posible confirmar la presencia de una nueva especie o población basado en la observación de un solo individuo. Por otro lado, se identificaron a las medusas Stomolophus sp. 3, sp. 4 y sp. 5 en las costas de América Central, siendo la primera de la costa Oeste y las últimas dos al este.
El estudio anterior sirve para conocer la distribución genotípica de las poblaciones con las cuales se cuenta, así como poder proponer mejores estrategias para la conservación de estos acervos genéticos. Estos hallazgos se han reforzado debido a que en el 2019 se describió la estructura genética de las poblaciones de Stomolophus spp., dentro del Golfo de California a partir del análisis de ADN mitocondrial y microsatélites de las Stomolophus sp. 1 y sp. 2 [32] [33]. La distribución reportada en 2017 coincidió con los resultados reportados en el estudio del 2019, donde se ubicó a Stomolophus sp. 1 al norte de la región de las grandes islas del Golfo de California y Stomolophus sp. 2 al sur. Cabe destacar que los autores proponen que el intercambio genético puede estar restringido por la presencia de las grandes islas, debido a que las condiciones oceanográficas de la región aíslan la zona norte del Golfo de California, disminuyendo la dispersión de organismos. De esta manera, se sentaron las bases para futuros análisis de dinámicas poblacionales de las medusas Stomolophus spp. promoviendo que futuros estudios se enfoquen a la preservación de la diversidad genética en el norte del Golfo.
Conclusiones
Las medusas son un recurso natural poco explotado en México, pero de gran riqueza biológica por sus características específicas. En los últimos años se ha reportado un aumento abrupto en la abundancia y distribución de las medusas bola de cañón que se localizan en las costas del noroeste de México; el cual se ha propuesto que se relaciona mayormente con el incremento de la temperatura de la masa oceánica. Si bien, tenemos una especie con potencial culinario y de importancia económica para México, hasta el día de hoy se desconoce mucho sobre su biología, por lo que se destaca la importancia por esclarecer cuáles son los mecanismos etológicos, ecológicos, fisiológicos, bioquímicos, moleculares y demás, los cuales les permiten enfrentar los grandes cambios ambientales que hoy día se están presentando.
Una perspectiva futura para S. meleagris en México es continuar con los planes de pesca y exportación, para lograr un aprovechamiento óptimo de este recurso en el país. Además, generar conocimiento que sirva para encontrar tanto las condiciones de cultivo, como los niveles fisicoquímicos y cantidad de nutrientes por volumen de agua, planes alimenticios adecuados, patrones de conducta, entre otros. Esto con la finalidad de dejar de extraer este recurso del medio silvestre de manera oportuna; teniendo que esperar a que las condiciones ambientales permitan la aparición de la fase medusa y su maduración hasta la etapa adulta. Así, existe la perspectiva futura de producir la medusa de manera deliberada y controlada, sin comprometer a las poblaciones silvestres de la medusa bola de cañón. En esta revisión se otorga la información mínima requerida para continuar con la investigación para la generación de ciencia básica y aplicada que contribuya en la conservación de la especie.











 nueva página del texto (beta)
nueva página del texto (beta)