Introducción
Datos recientes indican que aproximadamente un tercio de la población mundial padece sobrepeso u obesidad [1], la cual se estima incrementará hasta un 18% en hombres y 21% en mujeres, para el año de 2050 [2]. En la última década, México ha tenido un aumento significativo en la prevalencia de obesidad en sus diferentes grupos etarios. La Encuesta Nacional de Salud y Nutrición (ENSANUT) 2020 [3], reportó un incremento en la prevalencia de obesidad en adultos en comparación con los datos del 2012, pasando del 32.4% al 36% [3].
Particularmente la obesidad abdominal, predispone al desarrollo de múltiples enfermedades crónicas no transmisibles, entre las que se encuentran la enfermedad por hígado graso no alcohólico (EHGNA), el síndrome metabólico (SM), la diabetes mellitus tipo 2 (DMII), hipertensión arterial sistémica, enfermedad renal crónica, enfermedades cardiovasculares, cáncer entre otras [4]. Estas enfermedades originan alrededor del 70 % de las defunciones a nivel mundial [4], además de conducir a una disminución en la calidad de vida y años de vida productiva de la población.
El origen de la obesidad es multifactorial e incluye factores modificables (la inactividad física, hábitos nutricionales inadecuados, estrés crónico y el estilo de vida) y factores no modificables (factores hormonales, genéticos, edad, entre otros). Sin embargo, la evidencia científica demuestra claramente que el desequilibrio entre el consumo y gasto de energía son los factores mas predominantes para el desarrollo de obesidad de la población mundial y de los mexicanos [5].
En el presente trabajo se aborda el desarrollo de EHGNA y su asociación con la obesidad, enfocado en la importancia de un abordaje preventivo y de intervención en etapas tempranas de la enfermedad, así como los potenciales efectos benéficos de algunos compuestos bioactivos para prevenir la enfermedad y sus complicaciones.
LA EHGNA
La obesidad induce un estado inflamatorio crónico de bajo grado, el cual inicia en el tejido adiposo y puede llegar a afectar a todos los tejidos y órganos. En el caso del hígado, este estado promueve el desarrollo de la EHGNA.
La EHGNA se define por la presencia de una infiltración y acumulación excesiva de lípidos en el hígado (esteatosis hepática) en individuos sin antecedente de abuso de alcohol. EHGNA es evidenciada mediante métodos de imagen o por estudios histopatológicos, en pacientes sin presencia de alguna otra enfermedad hepática, uso de fármacos o trastornos hereditarios causantes de la acumulación de grasa hepática y con consumo de alcohol <30 g/día en hombres y <20 g/día en mujeres [6].
La EHGNA comprende un espectro de presentaciones variables, las cuales se pueden clasificar en 2 principales entidades con base en hallazgos histológicos: hígado graso no alcohólico y esteatohepatitis no alcohólica [7].
La EHGNA se ha convertido en la enfermedad hepática más común en adultos a nivel mundial, asociándose directamente con la prevalencia de obesidad y el desarrollo prematuro de SM, denominándose incluso como “la manifestación hepática del SM” [7]. Es la enfermedad hepática más común en niños en países desarrollados [8], es relativamente común en adolescentes [9] y está asociada a complicaciones durante el embarazo [10]. La EHGNA afecta particularmente a la población de la tercera edad, en quienes se pueden acumular otros factores de riesgo para su desarrollo [11].
FISIOPATOLOGÍA
El reconocimiento de la participación de vías moleculares adicionales, cambios en la estructura de organelos celulares y el desarrollo paralelo de componentes del SM, son algunos de los factores que se han reconocido como importantes mecanismos iniciadores y de progresión en la EHGNA. Lo anterior ha dado mayor aprobación a la nueva “hipótesis de ataques múltiples y paralelos” [12], que intenta explicar la fuerte asociación que hay entre la EHGNA y la obesidad, el aumento de tejido adiposo y una mayor liberación de ácidos grasos y triacilgliceroles. Esto, acoplado a un consumo excesivo de grasas y azúcares en la dieta, lleva a una alteración hepática y sistémica en el metabolismo de lípidos y carbohidratos y en la tasa de ingreso/egreso de ácidos grasos, dando como resultado una acumulación de lípidos en el hígado y al desarrollo de la esteatosis característica de la EHGNA [13].
Paralelo a esto, los avances de la última década en el estudio de la microbiota intestinal, han mostrado que como parte de su metabolismo y del proceso de fermentación dependiente de la dieta, los microorganismos producen moléculas como los ácidos grasos de cadena corta (AGCC), que pueden llegar a modificar a los ácidos biliares primarios, para modular la señalización celular y respuesta inmune. Cuando la persona padece obesidad y su dieta es alta en carbohidratos, grasa y alimentos procesados, ocurre un desequilibrio en la microbiota o disbiosis que da como resultado que el perfil de AGCC generado, tenga un efecto proinflamatorio, tanto local como sistémico. Al absorberse y llegar al hígado por circulación portal, estos metabolitos potencializan el efecto inflamatorio e inducen la expresión de genes de proteínas que participan en el proceso de lipogénesis. Lo anterior contribuye a promover la esteatosis, la esteatohepatitis y la progresión a fibrosis y cirrosis, cuando el estado nutricional no es el adecuado [14].
A pesar de que las hipótesis mencionadas intentan explicar la complejidad de la enfermedad, es claro que la progresión de la EHGNA está fundamentada en la presencia de esteatosis, estrés oxidativo (EO) e inflamación, los cuales se refuerzan entre sí en un ciclo vicioso [12].
El EO se refiere a una situación de desequilibrio en la cual la producción de especies reactivas de oxígeno (EROs) supera los mecanismos de defensa antioxidante del organismo. El EO puede inducir cambios a nivel fisiológico, por ejemplo, en la sensibilidad a la insulina, la actividad de enzimas principales del metabolismo lipídico y señalización del sistema inmune [15]. Además, algunos lípidos y/o sus derivados son considerados tóxicos por su capacidad de promover la generación de EROs, fenómeno denominado como “lipotoxicidad” [16].
TRATAMIENTO ACTUAL
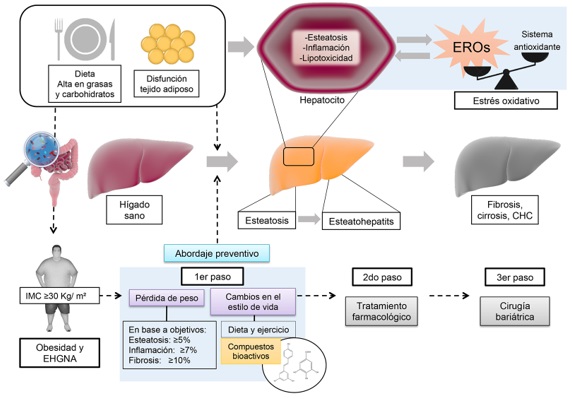
Debido a que la etiología de la EHGNA es multifactorial, resulta clave promover la pérdida de peso corporal ya que esto se asocia con mejoras en biomarcadores de resistencia a la insulina y dislipidemia, cambios en el perfil de adipocinas y mejoría de biomarcadores inflamatorios, aunado de manera importante a la resolución de la esteatohepatitis y lesiones histológicas. En las guías de práctica clínica para manejo de obesidad, centradas en complicaciones de la Asociación Americana de Endocrinólogos Clínicos y del Colegio Americano de Endocrinología, se recomiendan una meta de pérdida de peso ≥5 % para pacientes con obesidad que cursan con esteatosis y de 10 - 40% en aquellos con esteatohepatitis [17]. La Figura 1 resume la fisiopatología y posible abordaje de la EHGNA.
Como tratamiento de primera línea, se recomiendan los cambios en la dieta y en el estilo de vida mediante programas estructurados [17]. En este sentido, se ha recomendado la dieta mediterránea, la cual es alta en el uso de aceite de oliva, vegetales, frutas, nueces, granos enteros, pescados y mariscos, así como alta en antioxidantes, fibra, grasas mono- y poliinsaturadas y baja en su contenido de carnes rojas y alimentos procesados [18]. El consumo regular de este patrón dietario ha mostrado mejorías significativas en el perfil metabólico y lipídico de pacientes con EHGNA, en parte debido a los efectos lipolíticos, antiinflamatorios y antilipogénicos de los lípidos al regular la expresión de genes [19].
Si el tratamiento inicial no muestra resultados satisfactorios, se suelen incluir también tratamientos farmacológicos en individuos con índice de masa corporal (IMC) ≥30 kg/m² y en aquellos con IMC ≥27 kg/m² con comorbilidades [17], [20].
La cirugía bariátrica se recomienda en casos en los que las primeras dos intervenciones no sean exitosas, y en individuos con un IMC ≥40 kg/m² o en aquellos con ≥35 kg/m² que presenten comorbilidades. Sin embargo, este procedimiento no se ha establecido con seguridad en pacientes con EHGNA [17].
COMPUESTOS BIOACTIVOS
Los compuestos bioactivos son moléculas encontradas en algunos alimentos, particularmente los de origen vegetal, y pueden originar beneficios en células y tejidos [21]. Se consideran compuestos bioactivos a múltiples familias de moléculas, entre los que destacan los oligosacáridos, alcaloides, vitaminas, polifenoles, entre otros.
Los alimentos que son una fuente rica de compuestos bioactivos han mostrado propiedades antioxidantes y antiinflamatorias que ejercen efectos positivos a la salud. Por ejemplo, la ingesta de dietas con altos contenidos de polifenoles se ha asociado con mejorías en marcadores séricos de enfermedades como DMII, SM, enfermedades cardiovasculares y cáncer [22]. Entre los mecanismos reportados para tales efectos, se destaca su capacidad de prevenir o disminuir la formación de EROs que a su vez mitiga procesos inflamatorios [23]. Estas acciones resultan potencialmente benéficas en enfermedades como la EHGNA, en donde la alta tasa de formación de EROs y procesos inflamatorios crónicos favorecen la progresión de la enfermedad.
Existen múltiples estudios observacionales y de intervención que demuestran los efectos benéficos de los compuestos bioactivos. La Tabla 1, resume algunas investigaciones sobre compuestos bioactivos con efectos benéficos que podrían impactar positivamente en pacientes con EHGNA.
Tabla 1 Algunos compuestos bioactivos y efectos benéficos reportados en afectaciones hepáticas no alcohólicas.
| Compuesto | Modelo | Dosis/ Vía de administración | Efectos | Referencia |
| Quercetina | Línea celular de hepatocitos (AML12) | Incubación, 10 μM/12 h | Inducción de lipofagia; activación de la señalización de AMPK | [24] |
| Ácido gálico | Células estrelladas hepáticas (HSCs) | GA (0–300 μg/mL) | Actividades antifibróticas | [25] |
| Ácido ferúlico | Ratón inducido con DAG | 30 mg/kg/ día, v.o. | ↓peso corporal ↓CT, TG, C-LDL y AST en suero ↓depósito de TG y CT hepáticos ↓ inflamación lobular, esteatosis y balonización hepatocelular ↓ expresión de mRNA de FASN y SREBP-1c | [19] |
| Epigalocatequina galato (EGG) | Ratones C57BL/6J | DAG adicionada con 0.3% de EGG, v.o. | ↓peso corporal y tejido graso ↓esteatosis, balonización hepatocelular, infiltrados y actividad de esteatohepatitis no alcohólica ↓ translocación de endotoxinas derivadas del intestino y la respuesta inflamatorias hepáticas vía TLR4/NFκB ↓ MDA y TG hepáticos ↓resistencia a la insulina, ALT y endotoxina sérica | [26] |
| Extracto de té verde (30% catequina) | Ratones inducidos con DAG | 2% extracto de té verde v.o. / 8 semanas | ↓masa corporal y adiposidad ↓fosforilación de la subunidad p65 de NFκB, genes proinflamatorios (TNFα, iNOS, MCP-1, MPO) | [27] |
| Ácido cafeico | Ratones C57BL / 6J inducidos con DAG | 0.08% o 0.16% de ácido cafeico en la dieta | Actividad antiinflamatoria y prebiotica ↓acumulación de lípidos en higado, endotoxemia y la inflamación Atenua la disbiosis de la microbiota intestinal Revirtió el desequilibrio en la microbiota intestinal inducido por la DAG | [28] |
| Vitaminas E y C | Estudio trasversal (789 personas) | Vit E <5.45 y >5.45 mg/1000 kcal; vit C <91 y >91.4 mg/1000 Kcal | Vit E: ↓ probabilidad de EHNA, sin asociación con EHGNA o fibrosis ↓ TG, ALT, AST, glucosa, HbA1C (%) y diabetes tipo 2 (%) Vit E y C: ↓GGT, PCR, y puntaje en la prueba de esteatosis | [29] |
| Catequina | Pacientes con esteatohepatitis no alcohólica (n=38) | 600 mg de catequinas de té verde /día/ 6 meses v.o. | ↓IMC, lípidos séricos, glucosa en suero, ALT, AST y hs-PCR Mejoría en la relación grasa visceral/grasa subcutánea y la relación hígado/ bazo | [30] |
Estudios epidemiológicos y sistemáticos han reportado que el consumo de café, el cual es una mezcla de múltiples compuestos bioactivos, se ha asociado con un efecto hepatoprotector en pacientes con EHGNA lo cual parece llevarse a cabo mediante un efecto antioxidante [31]. Del mismo modo, la suplementación con resveratrol, compuesto polifenólico contenido principalmente en uvas rojas, moras, cacahuates, cocoa, ha demostrado que en pacientes con EHGNA induce mejoras vía la reducción de biomarcadores de inflamación [32].
Por otra parte, en un estudio multiétnico con 17685 participantes, se reportó una asociación inversa significativa entre el consumo de flavonoides provenientes de la dieta (frutas y verduras) y el riesgo de presentar EHGNA, destacando el efecto protector de los flavonoides en procesos inflamatorios y de estrés oxidativo [33]. Particularmente, el consumo de catequinas del té verde en conjunto con actividad física han mostrado un efecto protector en pacientes con esteatohepatitis, vía la reducción del IMC, enzimas hepáticas y lípidos en suero, así como la reducción de biomarcadores de inflamación y tejido adiposo visceral [30]. Lo anterior evidencia que el efecto antioxidante, antiinflamatorio, prebiótico y obstaculizador del metabolismo de lípidos mostrado por los compuestos bioactivos podrían ejercer un efecto benéfico en el tratamiento preventivo de EHGNA.
CONCLUSIÓN
La fuerte asociación entre la EHGNA y la obesidad, invita a un abordaje de carácter preventivo y de intervención en las etapas tempranas de la enfermedad. El tratamiento podría centrarse en mejorar el IMC, reforzando cambios en la actividad física y en los patrones dietéticos como tratamiento primario, a través de educación nutricional y de salud. Es recomendable que los patrones dietéticos incluyan alimentos ricos en compuestos bioactivos, como los compuestos fenólicos, fibra y vitaminas que provean de un efecto antioxidante, antiinflamatorio y potencialmente anti-obesogénico. Las modificaciones a la dieta suelen ser un tratamiento seguro, por lo que representan una estrategia factible para prevenir el desarrollo de EHGNA en la población mexicana.
Factores dietarios y metabólicos, entre otros, permiten el desarrollo de EHGNA. La sobrecarga lipídica induce lipotoxicidad que afecta organelos productores de especies reactivas de oxígeno (ERO), que a su vez producen más ERO en un ciclo vicioso. Niveles altos de ERO promueven un estado de estrés oxidativo. Se muestran los pasos recomendados en el manejo de la obesidad y EHGNA, enfatizando el uso de compuestos bioactivos.
Dieta alta en grasa (DAG); vía oral (v.o.); colesterol total (CT); triacilgliceroles (TG); aspartato aminotransferasa (AST); alanina aminotrasferasa (ALT); Gamma-glutamil-transferasa (GGT); lipoproteína de baja densidad (C-LDL); ácido graso sintasa (FASN); proteína de unión al elemento regulador de esteroles 1c (SREBP-1c); malondialdehído (MDA); proteína quinasa activada por AMP (AMPK); Proteina C reactiva (PCR); hemoglobina glicosilada (HbA1c); factor nuclear kappa-B (NF-kB); esteatohepatitis no alcohólica (EHNA); PCR de alta sensibilidad (hs-PCR); receptor 4 tipo Toll (TLR4); ARN mensajero (mARN); Factor de necrosis tumoral-α (TNFα); óxido nítrico inducible sintasa (iNOS); proteína quimioatrayente monocito-1 (MCP-1); mieloperoxidasa (MPO).











 nueva página del texto (beta)
nueva página del texto (beta)