Introducción
El litio, es un elemento químico que pertenece al grupo de los metales alcalinos que cuenta con propiedades electroquímicas únicas en su alto potencial redox y su mayor especificación de calor que lo categoriza dentro del uso de energías verdes por su gran aplicación de baterías recargables y recursos de energía [1]. Sin embargo, varios estudios que muestran que la oferta de litio no podrá satisfacer la demanda en el 2023, debido al incremento de uso de baterías para autos eléctricos. Por lo tanto, viendo la complejidad de recuperar el ion litio, se requiere el desarrollo de un proceso eficiente hidrometalúrgico que se emplee comúnmente en la recuperación de él [2, 3].
Teniendo en cuenta la alta eficiencia de purificación y concentración de gran variedad de metales, sin mencionar su fácil operación, la técnica de extracción con solvente se considera comúnmente como un método favorable para la recuperación del ion Li. Esta técnica se basa principalmente en solubilidad de los materiales y la tasa de trasferencia de masa. La consiste en el contacto de una fase acuosa (solución de alimentación con el metal de interés) y una fase orgánica (solvente orgánico; extractante), donde posteriormente se mezclan ambas fases a cierta temperatura y agitación, permitiendo el intercambio iónico hasta lograr el equilibrio [4, 5].
El extractante CYANEX® 272 es un ácido fosfínico, el cual permite la recuperación de los metales como el cobalto de las baterías de iones de litio gastadas por medio de un mecanismo de intercambio catiónico [7].
El extractante CYANEX® 936P es a base de fósforo, elaborado específicamente para recuperar Li de soluciones gastadas del proceso convencional litio, además se puede aplicar a las salmueras después de eliminar Mg2++ y Ca2++ por medio de una filtración o precipitación [8].
No obstante, no se ha encontrado suficiente información sobre la extracción por solvente de Li (I) con extractante prometedores [6]. Por ello, el objetivo de esta investigación es determinar la eficiencia del extractante CYANEX 272 y CYANEX 936P para la separación selectiva de ion litio a partir de soluciones sintéticas.
2. METODOLOGÍA
2.1. Preparación de Soluciones:
Las soluciones que se realizaron constan de dos fases: Orgánica y Acuosa, las cuales se prepararon individualmente bajo los siguientes parámetros:
Fase Orgánica:
Para la fase orgánica se adquirieron los extractantes Cyanex 272 y Cyanex 936P, y se diluyeron con queroseno, hasta obtener concentraciones de 5% (5% de extractante + 95% Keroseno), 8% (8% de extractante + 92% Keroseno), y 10% de solución (10% de extractante + 90% Keroseno).
Fase Acuosa:
Las soluciones sintéticas (madre) se prepararon disolviendo una cantidad requerida de Li, Al y K (Tabla 1) en una solución de 0.2% de H2SO4, donde se prepararon 3 diferentes soluciones sintéticas, ajustando su pH en 1, 1.5, 2, 2.5 y 3 usando el mismo H2SO4.
2.2. Procedimiento:
Los experimentos de extracción se realizaron en una relación 1:1 de fase acuosa (solución madre) y orgánica (soluciones de extractantes), donde se vertió 50 mL de cada solución en un embudo de separación de vidrio de 100 mL. Posteriormente se agitó durante 3 minutos, a temperatura ambiente (25°C) para después dejar separar las dos fases. Las muestras de la fase acuosa (pobre) se tomaron de la parte inferior del embudo y se analizaron mediante un Espectrómetro de Absorción Atómica Perkin Elmer, Modelo AANALYST 400, mientras que las soluciones de la fase orgánica (cargada) se determinaron su concentración por método de balance de masas.
3. RESULTADOS
En base a la concentración inicial de la fase acuosa [Mi ] y de acuerdo con su concentración después de la extracción [MFa ] y así mismo asumiendo que no hubo cambio de volumen en ambas fases, se calculó como se puede ver en la ecuación 1.
Una vez calculados los resultados de porcentaje de extracción de cada uno de los extractantes a sus diferentes concentraciones, se graficó pH contra % de extracción, para así obtener los isotermas de extracción y permitir ver las mejores condiciones de extracción de Li, las cuales fueron al utilizar un 10% (v/v) de extractante tanto en Cyanex 272 y Cyanex 936P como se muestra más adelante en las Figura 1 y 2.
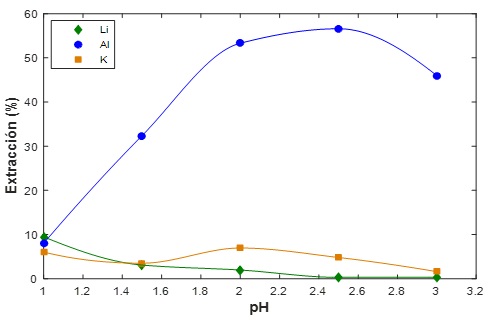
Figura 1 Isotermas de extracción con el extractante Cyanex 272 al 10% (v/v) y una relación ORG/AQ = 1/1
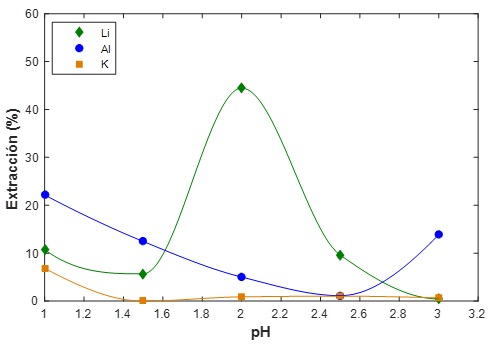
Figura 2 Isotermas de extracción con el extractante Cyanex 936P al 10% (v/v) y una relación ORG/AQ = 1/1
Cuando se realizan las pruebas con el extractante Cyanex 272 al 5%, 8% y 10% (v/v) se observó que al incrementar el pH (1 a 3) de la solución, disminuía el % de extracción. Donde en una solución acusa a un pH de 1, se obtuvo el 9.16% de extracción de Li, 4.89% de K y 8.42% de Al.
Al realizar las pruebas con 8% (v/v) del extractante se obtienen extracciones de 7.80% Li, 7.93% K y 9.49% de Al, a un pH de 1. Mientras que una solución acuosa a pH 1.5 a 3 se obtuvieron extracciones de Li de 0.43%, 0.46%, 0.15% y 0.12%. Por lo tanto, analizando las concentraciones se puede determinar que el extractante Cyanex 272 a 5% y 8% v/v no es muy selectivo con el ion Li.
Cuando se realizan las pruebas ahora con una concentración del 10% (v/v), se obtienen extracciones 9.47 % de Li, 6.03 % de K y 3.07 % de Al, a un pH de 1, como se muestra en la Figura 1.
Como se muestra en la figura, se puede observar como el extractante tiene mayor afinidad con el Al, además se visualiza que al incrementando el pH de la solución acuosa, el extractante no cuenta con afinidad con el ión Li.
Sin embargo, al realizar las corridas con el extractante Cyanex 936P a concentraciones de 5%, 8% y 10% se obtuvo % de extracciones de; 43% de Li, 0.94% de K y 13.81% de Al (5% v/v), a un pH de 3, 43.62% de Li, 0.46% de K y 4.6 % de Al (8% v/v), a un pH de 2, y extracciones de 44.46 % de Li, 0.88% de K y 5.01% de Al (10% v/v), a un pH igual de 2 en solución. Y así mismo, se puede determinar que las mejores condiciones de extracción para este extractante fueron realizando las corridas con el 10 % de exctractante, tal como se muestra en la Figura 2.
4. CONCLUSIONES
Considerando los resultados analizados, se concluye:
El extractante Cyanex 936P, es más selectivo para el ion Li que el extractante Cyanex 272, analizados ambos extractante en las siguientes condiciones: 5%, 8% y 10% de concentración del extractante y en soluciones de 1, 1.5, 2, 2.5 y 3 pH.
Las mejores condiciones para la etapa de extracción de Li en la cual se obtuvo la mayor extracción del 44 % de Li, fueron las siguientes: extractante = Cyanex 936P, concentración del extractante = 10 %, pH de solución acuosa = 2 y relación ORG/AQ = 1:1.
Con base a los resultados se propone realizar pruebas solamente con el exctractante Cyanex 936P, pero incrementando su concentración.











 nueva página del texto (beta)
nueva página del texto (beta)



