Introducción
El cianuro se conforma de un grupo de sustancias químicas de carbono y nitrógeno, que pueden ser naturales o artificiales [1]. En cuanto a la química del cianuro la disolución y disociación de cianuro molecular o iónico en solución acuosa forma cianuros libres. Además, dependiendo del pH de la solución este se puede encontrar como cianuro libre (CN‾) o ácido cianhídrico (HCN) [2].
Este compuesto es el más utilizado en la industria química por su composición, debido a que ambos elementos (carbono y nitrógeno) son elementos comunes y tienden a reaccionar fácilmente con otras sustancias. El 80% de cianuro se utiliza en la producción de productos químicos orgánicos como el nitrilo, nailon y plásticos acrílicos, entre otras aplicaciones industriales como procesamiento de metales, endurecimiento del acero entre otros. En cuanto al porcentaje restante de su producción se utiliza para fabricar cianuro de sodio en forma sólida, y el resto (18%) se utiliza en la minería, principalmente para la recuperación de oro [1].
Este método para la recuperación de oro se ha utilizado durante décadas y hasta la fecha, debido a que es un proceso económico y eficiente, sin embargo, si su manejo no es el adecuado tiene el riesgo de contaminar al medio ambiente y causar efectos negativos en la salud de los seres vivos [3]. Por lo que es de suma importancia dar seguimiento a los efluentes del proceso, ya que estos presentan cianuro libre, tiocianato y cianatos [4].
Algunos de los métodos más utilizados para su descomposición son la degradación natural, precipitación, biodegradación y oxidación química los cuales presentan distintos niveles de efectividad [5], sin embargo, estos procesos pueden resultar lentos y poco sustentables.
Debido a lo anterior, investigadores como Forero, Ortiz y Ríos [6]; Albdraba, Al-Obaidi, Hashim y Zangana [7], denominan procesos de oxidación avanzada cuando los procesos convencionales se combinan, resultando reacciones más eficientes para la remoción de compuestos orgánicos en los efluentes, ya que incrementan la generación de radicales hidroxilos (•OH).
Uno de los procesos más estudiados y utilizados es la ozonización, investigadores como Jiménez-Prieto, Esperanza-Pérez y Ramírez-González [8], realizaron una evaluación de los procesos de oxidación con gas ozono y cloración alcalina para eliminar cianuros de las soluciones provenientes de un procesamiento de minerales auríferos, encontrando que la ozonización simplifica y mejora la rentabilidad eliminando el cianuro a un 98% a comparación del proceso de la cloración alcalina.
Por otro lado, Pueyo, Miguel, Ovelleiro y Ormad [9], realizaron un estudio para la eliminación de cianuro contenido en residuos de solución provenientes del proceso de coquización, a partir del proceso de ozonización y la oxidación de ozono combinado con peróxido de hidrógeno obteniendo una eliminación del 90% de cianuros con ozono y un 95% con el ozono y H2O2.
Además, otra tecnología eficiente de los procesos de oxidación avanzada son los catalizadores, ya que diversos investigadores mencionan que la velocidad de las reacciones se incrementa, dando como resultados una remoción eficiente de cianuro en las soluciones. Los catalizadores más utilizados son el dióxido de titanio, nano materiales, carbón activado, zeolita, hematita, goetita y magnetita además de algunos óxidos metálicos [10].
Investigadores como Lin, Gu, Cui y Liu [11], estudiaron la degradación de cianuro en aguas residuales provenientes de un proceso de extracción de oro, utilizando ozono sin y con diatomita para producir una oxidación catalítica encontrando que la oxidación catalítica con ozono fue la más favorable obteniendo una contribución del 65.7%. Por otro lado, Hanela, Durán y Jacobo [12], realizaron un estudio comparando la efectividad del proceso de oxidación de ozono-UV seguido de zeolita tratada la cual utilizaron como catalizador para acelerar la reacción y así determinar la descomposición del cianuro complejado con hierro proveniente de un proceso de galvanizado, obteniendo un 82% de eliminación de cianuro.
Por otro lado, el uso de óxidos de hierro como catalizadores, ha sido reportado por diversos investigadores para el tratamiento de aguas residuales de algunas industrias farmacéuticas para la remoción de sus contaminantes, no obstante para el tratamiento de efluentes cianurados no hay mucha información al respecto, por lo que en el presente trabajo se llevó a cabo un estudio referente a la descomposición de cianuro contenido en una solución sintética, empleando la oxidación con ozono y ozono con óxidos de hierro bajo condiciones controladas a nivel laboratorio, con la finalidad de conocer el efecto de su catálisis.
Metodología
Etapa 1: Pruebas de descomposición de cianuro con ozono
Para las pruebas de descomposición de cianuro con ozono se utilizó un reactor cilíndrico de vidrio transparente de 2 L de capacidad, al cual se le adecuó un burbujeador de piedra cilíndrico de 4 cm de altura y 25 mm de diámetro, a través del cual se inyecto ozono, generado mediante un reactor de ozono marca Pacific Ozone Technology, modelo G11, alimentado con oxigeno grado industrial.
Para las soluciones sintéticas se empleó una concentración de 250 ppm de cianuro de potasio marca Fermont, pureza 99.4%, en 1.3 L en un medio alcalino (pH 11, ajustado con hidróxido de sodio, marca Jalmek, pureza 97.0%), las pruebas se mantuvieron en agitación con un agitador mecánico marca Arrow Engineering modelo Agitator, y se llevaron a cabo a temperatura ambiente, tomando muestras a diferentes tiempos.
Etapa 2: Pruebas de descomposición de cianuro con ozono y óxidos de hierro
Dado que, diversos investigadores han mencionado, que la combinación de dos o más oxidantes, han obtenido resultados muy positivos en los procesos de oxidación para la eliminación de efluentes, se consideró esta etapa en donde se llevara a cabo la combinación de O3 y óxidos de hierro.
Caracterización de óxidos de hierro
Para el presente trabajo se utilizaron dos tipos de óxidos de hierro los cuales provenían de residuos industriales, dichos óxidos fueron analizados por Fluorescencia de Rayos X (FRX), marca PANalytical, modelo Epsilon 1. En la Tabla 1 se puede observar una jarosita la cual se compone principalmente de hierro y calcio.
Tabla 1 Análisis químico. Elementos principales que componen la jarosita
| Composición (% peso) | ||||||||
| Jarosita | Al | Si | S | Ca | Mn | Fe | Cu | Zn |
| 0.338 | 1.295 | 7.199 | 21.558 | 0.516 | 23.401 | 0.458 | 8.640 | |
En cuanto al segundo óxido de hierro se trata de un polvo de colector el cual podemos apreciar en la Tabla 2 que este se compone en su mayoría por hierro.
Tabla 2 Análisis químico. Elementos principales que componen el polvo de colector
| Composición (% peso) | |||||||
| PC | Al | Si | S | Ca | Mn | Fe | Zn |
| 1.803 | 4.579 | 2.416 | 3.501 | 0.157 | 29.095 | 0.263 | |
Previamente a dichos óxidos de hierro se les realizó un tratamiento el cual consistió en someterlos a una temperatura de 500 °C por una hora, ya que autores como Ristić, Musić y Orehovec [13] mencionan que este proceso térmico produce una descomposición en los óxidos de hierro demostrando que las sales se descomponen a temperaturas de 500 a 600 °C, resultando como productos una mezcla de hematita y sulfato de sodio. En la Tabla 3 se muestra la jarosita tratada la cual presentó un incremento de hierro a 30.926 %, en cuanto al polvo del colector tratado el hierro disminuyo de forma significativa a 22.747 % tal y como se observa en la Tabla 4.
Tabla 3 Análisis químico. Elementos principales que componen la jarosita tratada
| Composición (% peso) | ||||||||
| Jarosita T. | Al | Si | S | Ca | Mn | Fe | Cu | Zn |
| 0.376 | 1.319 | 8.970 | 18.426 | 0.501 | 30.926 | 0.586 | 8.502 | |
Tabla 4 Análisis químico. Elementos principales que componen el polvo de colector tratado
| Composición (% peso) | ||||||||
| PC. T. | Al | Si | S | Ca | Mn | Fe | Cu | Zn |
| 2.377 | 4.810 | 2.604 | 3.812 | 0.141 | 22.747 | 0.143 | 0.162 | |
Previo a la caracterización, las pruebas se llevaron a cabo de igual forma que la Etapa 1 con la diferencia de que en esta etapa se le agregó a la solución 1 g/L de óxidos de hierro.
Métodos de análisis de cianuro
Una vez que se tomaron las muestras en cada etapa y a los diferentes tiempos, se llevó a cabo la determinación de cianuro libre por el método de volumetría reportado por Nava-Alonso, Elorza-Rodríguez, Pérez-Garibay y Uribe-Salas [14].
Cabe mencionar que antes de realizar la determinación de cianuro libre en las pruebas donde se agregaron los óxidos de hierro (Etapa 2), se realizó una separación de sólido-líquido, por filtrado, en cada muestra.
Discusión y resultados
Ozono
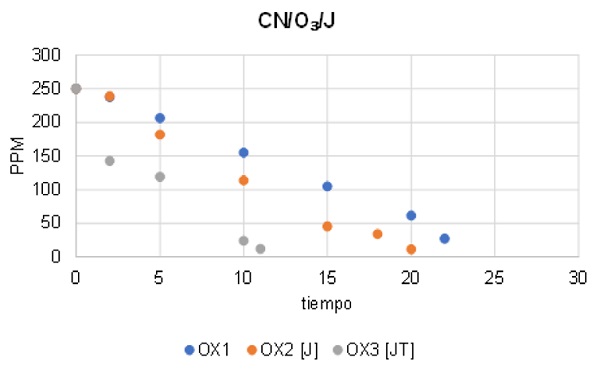
La Figura 1 muestra el efecto del ozono en la descomposición de cianuro de la prueba OX1, donde se puede observar que a los 22 minutos el cianuro no se elimina en su totalidad y la solución aún cuenta con 27.1 ppm.
De acuerdo con Nyamunda [15], la ozonización consta con dos mecanismos de oxidación, una primera posible propuesta es que cuando el cianuro es oxidado este pasa a convertirse a cianato lo anterior se puede observar en la Ecuación (1):
Mientras que la segunda podría tratarse de un mecanismo catalítico (Ecuación 2), sin embargo, Nyamunda menciona que esto solo tiende a ocurrir en condiciones ácidas.
Sin embargo, como ya se había mencionado este proceso resulta lento impactando en la optimización del proceso de oxidación de cianuro.
Ozono y óxidos de hierro
Jarosita
En las pruebas donde se utilizó este óxido de hierro se pudo observar que el cianuro se elimina en un promedio de 15 minutos, lo anterior se expone en la Figura 2, en donde la prueba OX2 con jarosita presento 11.36 ppm en la solución en un tiempo de 20 minutos. Por otro lado, la prueba OX3 en donde se utilizó la jarosita tratada mostró un mejor efecto presentando las mismas ppm en menor tiempo (11 minutos).
Los resultados obtenidos en la prueba OX3 se podrían aludir al cambio de fases de la jarosita, ya que esta se encuentra como sulfato de hierro y al ser sometido al tratamiento térmico, esta pasa a convertirse en especies tales como magnetita o hematita, las cuales favorecen a la catálisis de la reacción.
Polvo de colector
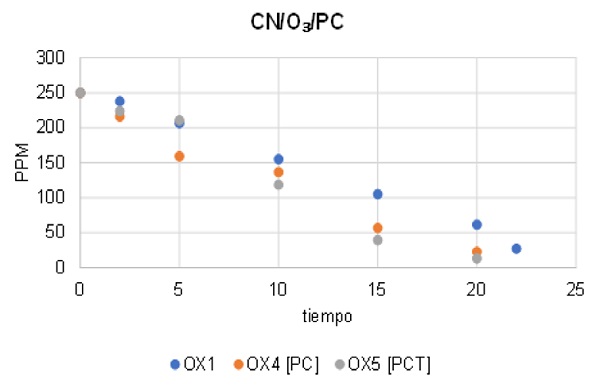
Las pruebas en donde se agregó este óxido de hierro no se vieron tan favorables como las pruebas en donde se utilizó la jarosita, sin embargo, si presentaron mejores resultados a comparación de la prueba en donde se utilizó solo ozono. Lo anterior se puede observar en la Figura 3 en donde la prueba OX4, la cual contenía polvo de colector la solución presentaba 22.72 ppm y la OX5 con polvo de colector tratado presentó 13.16 ppm ambas a los 20 minutos. Si bien los tiempos para la remoción de cianuro fueron similares a las pruebas donde solo se utilizó ozono, el polvo de colector logró oxidar mayor cantidad de cianuro a los mismos minutos.
Yan, Bing, y Wu [16], mencionan que cuando el ozono se encuentra en contacto con óxidos de hierro en especial especies como hematita, magnetita y óxido férrico, ocurre una descomposición en la molécula del O3, la cual se convierte en O2 y contribuyen a la formación de radicales hidroxilos.
Wang, Zhang, Wang, Xiong y Tian [17], realizaron una comparación de diversos óxidos de hierro entre los cuales destacan el óxido férrico atribuyéndole una alta actividad catalítica en procesos para eliminación de otros contaminantes, sin embargo, describió el mecanismo de los ciclos de reducción que ocurren con el Fe2+ y Fe3+, los cuales se observan en la Ecuación (3-5), estos son responsables de la generación de radicales hidroxilos.
Así mismo los radicales hidroxilo (•OH) generados comienzan a actuar con el cianuro de la solución oxidándolo y convirtiéndolo a tiocianato esta reacción se puede observar en la Ecuación 6 [18].
Conclusiones
El ozono puede oxidar al cianuro, no obstante, esta toma más de 22 minutos para eliminarlo en su totalidad.
En general los resultados nos indican que el ozono con y sin óxidos de hierro si logra oxidar al cianuro, sin embargo, los tiempos de oxidación de este son más cortos cuando se agregan los óxidos de hierro al medio, reduciendo en un 50% los tiempos de oxidación, siendo la jarosita tratada la más eficiente.
A pesar de que el polvo de colector no tuvo el mismo efecto que la jarosita con y sin tratamiento, este se muestra más favorable un 9% en comparación a la oxidación con ozono.











 nueva página del texto (beta)
nueva página del texto (beta)