Introducción
En los últimos años ha aumentado el interés por los estudios enfocados en la obtención de manganeso metálico, debido al amplio abanico de usos que tiene, como resultado de esto; se ha presentado un incremento en la producción mundial anual de manganeso, pasando de 180,000.000 a 1,700,000.000 toneladas entre el año 2000 y 2012. Además, aún se prevé un crecimiento en la demanda de este metal hasta en un 83% para el año 2021. Con relación a estos datos; países como Sudáfrica, Australia, Gabón, México, entre otros; encabezan la mayor producción minera en todo el mundo en cuanto a manganeso se refiere [1].
En el caso particular de México, se cuenta con importantes yacimientos de pirolusita (MnO2), tanto de alta ley como de baja ley. En la actualidad, este país solo emplea estos minerales como materia prima en el alto horno de la industria siderúrgica, sin que se aproveche de manera significativa su valor; por lo que es atractivo para el país desarrollar conocimiento sobre las técnicas que se emplean para la recuperación de productos de valor agregado que impacten en la economía. Es común recuperar los productos a partir de minerales de alta ley, sin embargo, el aumento en la demanda de este metal (cuarto más consumido del mundo) ha hecho necesaria la recuperación desde fuentes secundarias como minerales de baja ley.
El proceso final para la obtención de este producto en forma metálica es la electrodeposición (posterior a una serie de procesos hidrometalúrgicos) [2]; esta técnica consiste en la descarga de un metal (presente en solución) sobre un electrodo llamado cátodo como respuesta al paso de una corriente eléctrica continua. El principal problema de este proceso es; que la reducción de manganeso se lleva a cabo un potencial muy negativo (E°Mn2+/Mn0= -1.18 VSHE) lo que da como resultado la generación de gas hidrógeno a cualquier valor de pH por la reducción del agua (E°H2O/H2= -0.82 VSHE) [3]. Esto propicia la obtención de depósitos inconsistentes de baja cobertura, bajas eficiencias de corriente y altos consumos de energía.
El dióxido de selenio es el principal aditivo utilizado para solucionar esta problemática gracias a que el selenio es adsorbido sobre el electrodo, resultando en un aumento en el sobrepotencial de la reacción de reducción del agua haciendo posible la deposición del metal sobre el electrodo. Sin embargo, el uso del selenio presenta inconvenientes, ya que es un elemento altamente tóxico para los ecosistemas naturales tanto atmosféricos como acuáticos y son causadas por diversas actividades industriales como operaciones relacionadas con la minería [4].
El presente trabajo, se enfoca en encontrar aditivos alternos que sustituyan al SeO2 sin que parámetros como la eficiencia de corriente, consumo de energía y calidad del depósito se vean afectados de forma considerable. Durante el desarrollo experimental se evaluaron algunos aditivos tanto orgánicos como inorgánicos tales como la dextrina, glicerina, dióxido de teluro y tiosulfato de sodio.
Además, se evalúa el efecto que tienen variables de densidad de corriente, la concentración sulfato de amonio y la agitación del electrolito en la electrodeposición de manganeso con la finalidad de encontrar una alternativa para mitigar la contaminación de este proceso.
Objetivo
Evaluar la factibilidad del uso de diferentes aditivos orgánicos e inorgánicos en la electrodeposición de manganeso como una alternativa al dióxido de selenio.
Planteamiento del problema
Es común hacer uso de aditivos como el SeO2 en el proceso de electrodeposición de manganeso, este aditivo es tóxico para el medio ambiente; por lo que este trabajo se enfocó en evaluar el uso de otros aditivos más amigables para el medio ambiente, tales como: glicerina, dextrina, dióxido de teluro y tiosulfato de sodio, para este proceso. Esto con la finalidad de eliminar o reducir el uso del SeO2 sin que parámetros como eficiencia de corriente y consumo de energía se vean afectados significativamente.
Método de trabajo
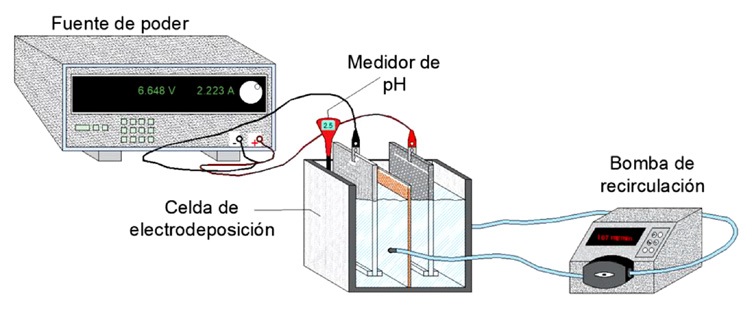
Las pruebas de electrodeposición se realizaron en una celda de polimetilmetacrilato, dividida en dos compartimentos por una membrana de intercambio aniónico AMI-7001. Se utilizó una placa de acero inoxidable 304 como cátodo y una placa de una aleación plomo-plata (1% Ag) como ánodo, la energía fue suministrada por una fuente de poder Tektronik PWS-4305 y la recirculación se realizó con una bomba peristáltica. La Figura 1 muestra el sistema electroquímico montado para la realización de las pruebas.
Las pruebas se realizaron bajo las siguientes condiciones de operación: densidad de corriente de 600 A/m2, concentración de sulfato de amonio de 0.9 M, concentración inicial de manganeso de 0.27 M y un caudal de recirculación de 107 ml/min. La Tabla 1 detalla los aditivos que se utilizaron, así como los valores de operación estudiados para realizar la electrodeposición de manganeso.
Tabla 1 Valores de concentración de aditivos utilizados para la electrodeposición.
| Aditivo | Concentración molar | |||
| Dextrina | 5x10-5 | 5x10-4 | 5x10-3 | 5x10-2 |
| Glicerina | 1x10-4 | 1x10-3 | 1x10-2 | 1x10-1 |
| Dióxido de teluro | 1x10-5 | 1x10-4 | 1x10-3 | 1x10-2 |
| Tiosulfato de sodio | 1x10-2 | 5x10-2 | 1x10-1 | 4x10-4 |
Para el cálculo de la eficiencia de corriente (ŋ) y el consumo de energía (WMn) se utilizaron las ecuaciones establecidas por Faraday [5]. Los análisis químicos se realizaron calculando la diferencia de concentración (inicial y final) de manganeso en el católito, determinada mediante un espectrofotómetro de adsorción atómica modelo Avanta marca GBC (EAA).
Resultados
La finalidad del proyecto es encontrar un aditivo que sustituya al SeO2 tomando en cuenta la recuperación de manganeso metálico y sin que la eficiencia de corriente y consumo de energía se vean afectados de manera significativa. Los resultados se presentan en las siguientes tablas (Tabla 2-5).
Tabla 2 Porcentajes de recuperación de manganeso, eficiencia de corriente y consumo de energía utilizando TeO2 como aditivo.
| Conc. TeO2 (M) | %R | ŋ | WMn |
| 1x10-6 | 34.57 | 52.83 | 13175 |
| 1x10-5 | 36.37 | 57.85 | 12077 |
| 1x10-4 | 19.11 | 29.51 | 23904 |
| 1x10-3 | 8.82 | 19.20 | 38009 |
Tabla 3 Porcentajes de recuperación de manganeso, eficiencia de corriente y consumo de energía utilizando Na2S2O3 como aditivo.
| Conc. Na2S2O3 (M) | %R | ŋ | Wmn |
| 1x10-2 | 23.24 | 31.77 | 36459 |
| 5x10-2 | 17.01 | 23.39 | 45174 |
| 1x10-1 | 20.72 | 23.96 | 43240 |
| 4x10-1 | 16.05 | 31.23 | 54363 |
Tabla 4 Porcentajes de recuperación de manganeso, eficiencia de corriente y consumo de energía utilizando (C6H10O5)n como aditivo.
| Conc. C6H10O5 (M) | %R | ŋ | Wmn |
| 5x10-5 | 39.39 | 43.58 | 22708 |
| 5x10-4 | 30.78 | 48.54 | 16475 |
| 5x10-3 | 18.47 | 26.44 | 28612 |
| 5x10-2 | 9.59 | 13.41 | 59255 |
Discusión
Porcentaje de recuperación de manganeso metálico, porcentaje de eficiencia de corriente y consumo de energía utilizando TeO2 como aditivo
En la Figura 2 se observa que las menores concentraciones benefician la cinética de la prueba, dando como resultado las mayores recuperaciones (34 y 36%); caso contrario a las concentraciones más altas donde se obtuvieron recuperaciones de 8 y 19% aproximadamente, perjudicando la recuperación en comparación con las concentraciones más bajas. Esto se atribuye a que el TeO2 y el Mn estarían formando complejos aniónicos, complejos que son atraídos al compartimento anódico, reduciendo la cantidad de iones de Mn sujetos a ser depositados en el electrodo a medida que la cantidad de este aditivo aumenta.

Figura 2 Recuperación de Mn, eficiencia de corriente y consumo de energía en función de la concentración de TeO2. Densidad de corriente=600 A/m2, [Mn+2]=0.27, [(NH4)2SO4]=0.9.
Por otro lado, la eficiencia de corriente que presentó este aditivo con las concentraciones bajas en el proceso fue muy prometedora (52-60%), ya que se acerca a valores reportados por otros autores utilizando SeO2 (60-70%), al igual que en la recuperación de Mn; la eficiencia de corriente iba en descenso a medida que aumentaba la concentración de TeO2. En cuanto al consumo de energía, se tiene un aumento a medida que la concentración de TeO2 aumenta, por otro lado; cuando las concentraciones disminuyen se tienen valores similares a los encontrados cuando es utilizando SeO2 (9000-12000 kWh/t). Por lo que es claro que el uso de concentraciones bajas de TeO2 benefician el proceso de electrodeposición de Mn metálico, además de que los resultados son similares a los encontrados con el SeO2, lo cual es bastante benéfico para el medio ambiente.
Porcentaje de recuperación de manganeso metálico, porcentaje de eficiencia de corriente y consumo de energía utilizando Na2S2O3 como aditivo
Los resultados en la Figura 3 muestran que, existe una tendencia ascendente en la recuperación de manganeso a lo largo de la prueba, manteniéndose posteriormente constante entre el minuto 20 y el minuto 30, después de este tiempo, se tiene nuevamente un crecimiento hasta el final de la prueba, brindando recuperaciones del 20-24% en bajas concentraciones durante la primera hora, y recuperaciones de 16-18% utilizando concentraciones más altas, muy por debajo de los resultados que se tienen utilizando SeO2 (45%), esto se asocia al comportamiento que se tiene en el pH, cuyos valores fueron de 7 en el uso de concentraciones bajas mientras que las concentraciones altas alcanzaron valores de 8.8.
Estos resultados se deben a que el aditivo en concentraciones bajas logra inhibir la generación de gas hidrógeno de mejor manera que utilizando las concentraciones más altas. Ya que, si bien está comprobado que un pH ácido es idóneo para un proceso de recuperación de Mn; existen trabajos como el de Gong and Zangari [6] y Griskonis, et al. [7] donde se documenta que puede existir una diferencia de pH entre la interfase electrodo-electrolito.
Por otro lado, utilizando Na2S2O3 como aditivo, se observa que tanto la menor como la mayor concentración dieron paso a mejores eficiencias de corriente, destacando que ambas tienen valores similares (32%), sin embargo; la mayor concentración tuvo un consumo de energía por arriba de los 50000 kWh/t, mientras que el uso de la menor concentración tuvo un consumo menor a 40000 kWh/t, lo que indica que nuevamente; la menor concentración muestra los mejores resultados.
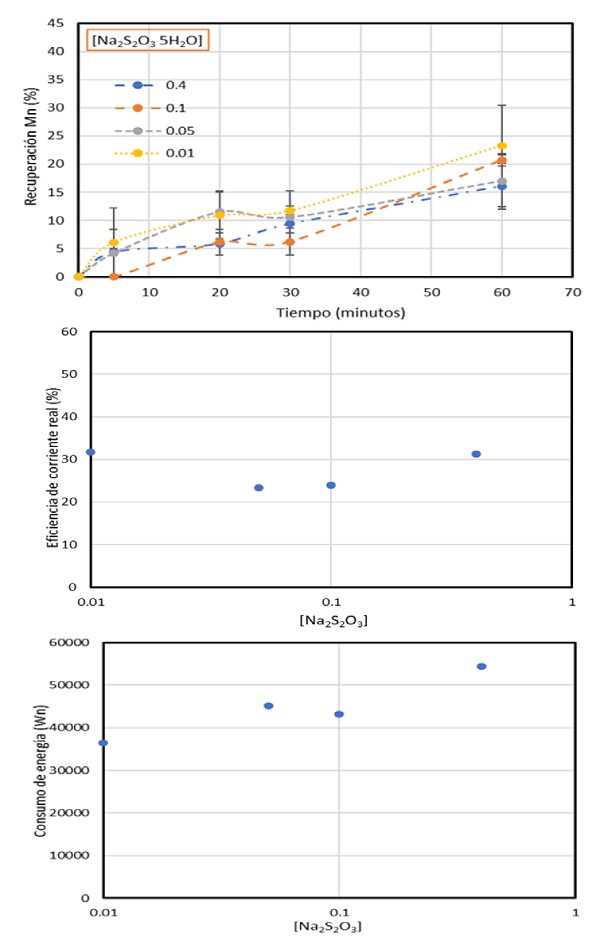
Figura 3 Recuperación de Mn, eficiencia de corriente y consumo de energía, en función de la concentración de Na2S2O3. Densidad de corriente=600 A/m2, [Mn+2]=0.27 M, [(NH4)2SO4]=0.9 M.
Porcentaje de recuperación de manganeso metálico, porcentaje de eficiencia de corriente y consumo de energía utilizando [(C6H10O5)n] como aditivo
Utilizando [(C6H10O5)n], los resultados mostraron una cinética similar a las de los aditivos inorgánicos, ya que el uso de concentraciones bajas dio lugar a las mayores recuperaciones (30-40%), mientras que el uso de concentraciones más altas resultaron en una disminución notable de recuperación, cuyos valores fueron 10-19%, esto puede verse reflejado en la Figura 4.
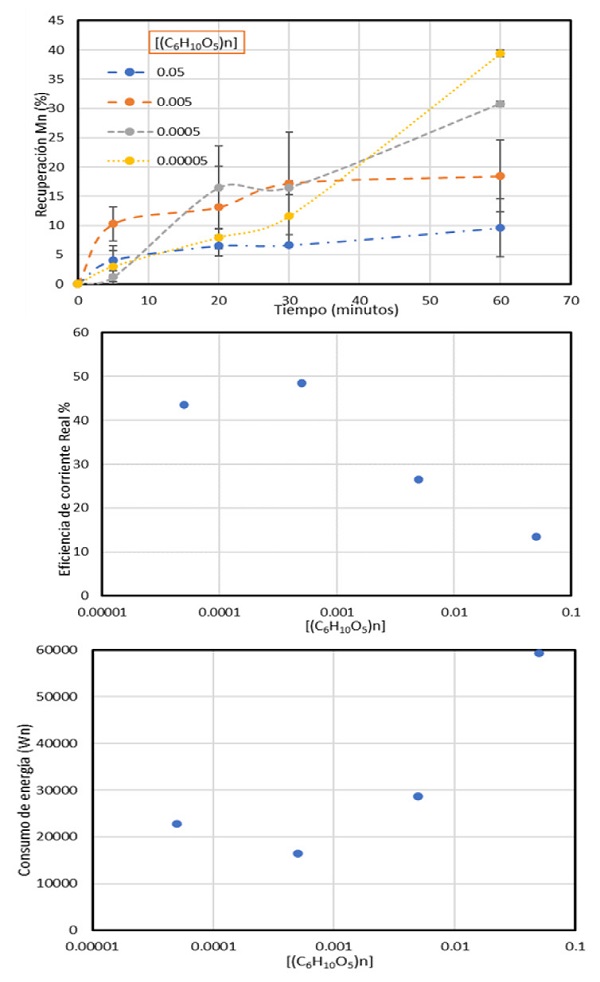
Figura 4 Recuperación de Mn, eficiencia de corriente y consumo de energía, en función de la concentración de (C6H10O5)n. Densidad de corriente=600 A/m2, [Mn+2]=0.27 M, [(NH4)2SO4]=0.9 M.
Lo anterior puede deberse al mecanismo de reacción que se tiene utilizando aditivos orgánicos, ya que la aparición de iones hidroxilo (OH-) reaccionarían con los iones hidrógeno resultado de la reacción electroquímica de la reducción del agua, dando lugar a la aparición de moléculas de H2O. Por otro lado, las eficiencias de corriente fueron prometedoras, ya que las menores concentraciones oscilan en valores similares a las obtenidas utilizando TeO2 alcanzando porcentajes de aproximadamente 43 y 48%. Esto se atribuye a que el uso de cantidades altas propicia una mayor generación de iones hidroxilo que afectan este parámetro, y un menor uso significa un agotamiento de aditivo en un menor tiempo, lo que provocaría del mismo modo, aparición de estas especies que afectan el proceso.
Porcentaje de recuperación de manganeso metálico, porcentaje de eficiencia de corriente y consumo de energía utilizando C3H8O3 como aditivo
La Figura 5 muestra una recuperación de Mn con un crecimiento casi lineal utilizando concentraciones altas (0.1 y 0.01 M) prácticamente en toda la prueba, pero utilizando concentraciones bajas (0.001 y 0.0001 M) el crecimiento deja de ser tan notorio después del minuto 30. Esto se asocia al aumento en el pH que se presenta utilizando la glicerina. Después se tiene la eficiencia de corriente utilizando glicerina en este proceso, donde se observan cifras parecidas a las que se consiguieron utilizando otros aditivos (50-52%) a los 60 minutos de prueba.

Figura 5 Recuperación de Mn, eficiencia de corriente y consumo de energía a diferentes concentraciones de C3H8O5. Densidad de corriente [600 A/m2], [Mn+2]=0.27 M, [(NH4)2SO4]=0.9 M.
En general este aditivo mostró eficiencias altas en comparación con aditivos anteriores, prácticamente permanecieron constantes (52%) a excepción de la concentración más alta, donde tuvo un descenso significativo, esto se puede asociar a la viscosidad que tiene este aditivo, ya que cantidades altas propician un aumento en la resistencia de la celda, aumentando el consumo de energía a medida que aumenta la cantidad de glicerina, siendo el mínimo consumo el valor aproximado de 15000 kWh/t (valor por arriba del consumo de energía determinado utilizando TeO2 y SeO2).
Conclusiones
Se observaron recuperaciones de manganeso en todas las pruebas; teniendo mayor estabilidad electroquímica en los aditivos inorgánicos.
Las bajas concentraciones de TeO2 favorecen la recuperación de manganeso a comparación de las altas concentraciones utilizadas.
El TeO2 mostró las mejores eficiencias y los mejores consumos de energía en relación a la cantidad de metal recuperado, además de estar dentro de los rangos más usuales a lo reportado por [8] utilizando SeO2.
De acuerdo con los resultados obtenidos el TeO2 fue el aditivo más apto para la sustitución del dióxido de selenio (SeO2).











 nueva página del texto (beta)
nueva página del texto (beta)