Introducción
En la mayoría de los sistemas de flotación, la hidrofobicidad que adquieren las partículas se debe a la adsorción selectiva del colector, siendo este uno de los reactivos químicos más importantes involucrados en el proceso. Desafortunadamente, muchos de los colectores actualmente utilizados tienen importantes implicaciones para la salud y el medioambiente, lo cual ha motivado la búsqueda de colectores más sustentables, que ofrezcan un rendimiento similar o superior, al obtenido con los reactivos convencionales más tóxicos [1].
Es bien conocido que los xantatos son los colectores más comúnmente empleados en la flotación de minerales sulfurosos y algunos minerales oxidados [2]. No obstante, diversas investigaciones han demostrado que no son compuestos estables [3-8]. Su oxidación e hidrólisis genera distintas especies: perxantato, monotiocarbonato y dixantógeno, las cuales proporcionan propiedades diferentes a la superficie mineral y afectan la acción del colector.
Los agentes quelantes han recibido especial atención en la búsqueda de reactivos para mejorar la separación por flotación de minerales sulfurosos, minerales oxidados y algunas tierras raras. La estructura química de estos colectores se caracteriza por la presencia de grupos iónicos y grupos de coordinación [9]. Entre estos reactivos destacan los ácidos hidroxámicos, los cuales al no hidrolizarse, oxidarse o descomponerse en otras especies químicas, podrían considerarse reactivos amigables con el medio ambiente, en comparación con los xantatos [8].
En las últimas décadas, los ácidos hidroxámicos y sus sales han mostrado buenos resultados en la flotación de minerales oxidados de cobre, minerales oxidados de plomo y algunas tierras raras. No obstante, la interacción entre las superficies minerales y los ácidos hidroxámicos en solución aún no queda del todo esclarecida. En la presente investigación se propusieron los mecanismos de interacción entre la anglesita con los aniones hidroxamato en solución acuosa, los cuales explican satisfactoriamente los resultados obtenidos haciendo uso de las técnicas experimentales de microflotación, adsorción de colector (espectroscopia infrarroja) y potencial zeta.
Materiales y métodos
La composición química de la muestra de anglesita fue determinada mediante análisis elemental de metales con espectroscopia de absorción atómica (AA) e ICP, mientras que la cuantificación de azufre se llevó a cabo mediante análisis químico por combustión (LECO). En la Tabla 1 se presentan los resultados del análisis químico elemental, donde se puede observar que el mineral es relativamente puro.
Tabla 1 Composición química del mineral empleado en la investigación.
| Mineral | Elementos químicos presentes (% en peso) | |||||||
| Pb | S | Cu | Fe | Zn | C | Si | Insolubles | |
| Anglesita | 68.5 | 11 | 0.0005 | --- | --- | 0.14 | --- | --- |
Además, la muestra se caracterizó mediante difracción de rayos X (DRX). La Figura 1 muestra el espectro de difracción obtenido, en los que se observan solamente los picos característicos de la anglesita; ninguna otra fase mineral fue identificada.
Microflotación de anglesita
Los experimentos de microflotación se efectuaron en una celda Partridge-Smith de 80 mL de capacidad empleando una muestra de 1 g de anglesita en la fracción de tamaños -106+75 µm, la cual se acondicionó durante 5 minutos en 100 mL de solución de colector (ABH o AOH), a la concentración de interés. El mineral y 80 mL de la solución fueron transferidos a la celda Partridge-Smith, donde el mineral se flotó durante 1 min, utilizando un flujo volumétrico de 23 mL/min de nitrógeno de alta pureza. Los 20 mL de solución de acondicionamiento restantes se adicionaron progresivamente a la celda para remplazar el agua que acompaña a los sólidos flotados. Al finalizar la prueba, los flotados y hundidos se filtraron, secaron y pesaron, para estimar la recuperación de sólidos.
Espectroscopia Infrarroja
La adsorción de colectores ABH y AOH sobre la superficie de anglesita fue investigada mediante espectroscopía infrarroja. La metodología experimental consistió en el empleo de anglesita pura de un tamaño inferior a 25µm. El mineral fue acondicionado durante 24 horas en 200 mg/L de ABH o AOH, según el caso de interés. Después del acondicionamiento, el mineral fue decantado y sometido a nueve etapas de lavado empleando agua desionizada al mismo pH, con la intención eliminar cualquier traza de colector residual. Por último, las muestras se analizaron cualitativamente mediante espectroscopia infrarroja por ATR, utilizando un espectrómetro Varian 3000 Excalibur Series.
Mediciones de Potencial Zeta
Las mediciones de potencial zeta se llevaron a cabo empleando un zetámetro Pen Kem Lazer Zee Meter modelo 501, el cual permite la lectura directa del potencial zeta de partículas coloidales, que se calcula con la ecuación de Smoluchowski [10], a partir de la movilidad electroforética de las partículas en la suspensión, en un campo eléctrico conocido. El rango de pH investigado fue de pH 4 a 10, y en todos los casos se empleó un tamaño de partícula menor a 20 µm. 0.15 g de mineral fueron acondicionados durante 10 minutos en una solución de 5x10-4 mol/L de ABH o AOH, según el caso de interés, abierta a la atmósfera. Al finalizar la etapa de acondicionamiento químico, se tomó una muestra de la suspensión y se procedió a medir el potencial zeta de las partículas.
Resultados Y Discusión
Efecto del pH en la flotación de anglesita
La microflotación de anglesita se realizó empelando dosis crecientes de colectores ABH y AOH, los resultados obtenidos se presentan en la Figura 2. La figura muestra que un incremento en la dosificación del AOH conduce a un aumento en la recuperación bajo condiciones ligeramente ácidas (ver Figura 2b). Sin embargo, este comportamiento no se observa cuando la anglesita se flota utilizando ABH (ver Figura 2a). Obsérvese que la recuperación se mantiene alrededor de 20%, incluso cuando la dosis de ABH se incrementa de 5x10-4 a 10-3 mol/L. Esta diferencia probablemente se debe a una menor densidad de adsorción del ABH sobre los sitios de plomo, en comparación con la desarrollada por el AOH.
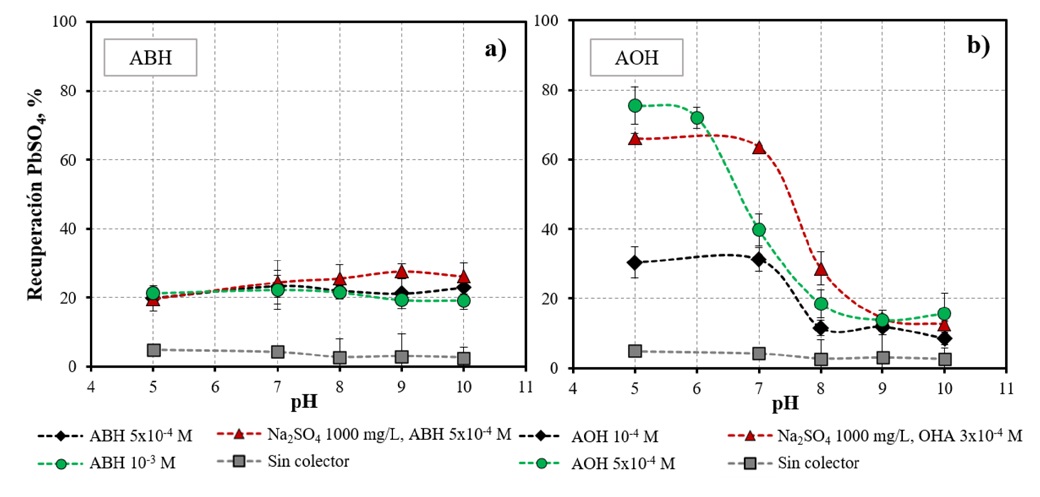
Figura 2 Efecto del pH y la presencia de sulfato (1000 mg/L) en la recuperación de anglesita (-106+75 µm) usando: (a). ABH y (b). AOH. Las mediciones se llevaron a cabo a 25ºC. La anglesita se flotó durante 1 minuto.
Por otro lado, la recuperación de anglesita se ve afectada adversamente cuando el pH se incrementa de 7 a 10, incluso cuando la dosis de AOH se incrementa de 10-4 a 5x10-4 mol/L. Esta disminución en la recuperación seguramente se deba a la presencia de leadhillita (Pb4(CO3)2(SO4)(OH)2) e hidrocerusita (Pb3(CO3)2(OH)2) en su superficie, especies que tienen propiedades hidrofílicas y predominan en esta región de pH.
Caracterización de las especies adsorbidas sobre la anglesita mediante ATR-FTIR
El espectro individual de cada uno de los colectores, de la anglesita sin colector (blanco) y de la anglesita acondicionada con ABH y AOH, a tres diferentes valores de pH (5, 8 y 10), son presentados para su comparación en la Figura 3.

Figura 3 Espectros IR de la anglesita no acondicionada (blanco) y acondicionada a pH 5, 8 y 10 con: (a) y (b) ABH; (c) y (d) AOH.
El espectro de la anglesita sin tratar (blanco) es consistente con el reportado por Yao, Li [11]. De acuerdo con la literatura, los enlaces S=O dan lugar a bandas vibracionales intensas [12]. En este contexto, las bandas S=O del compuesto aparecen en la región de número de onda esperada, 1019 cm-1 y 964 cm-1, para vibraciones de tensión y, en 627 cm-1 y 591 cm-1, para vibraciones de flexión.
Cuando la anglesita es acondicionada con ABH y AOH se observan diferencias con respecto al blanco únicamente a pH 8 y 10; a pH 5 no se observa desplazamientos o presencia de nuevas bandas, lo cual sugiere que a pH 5 no existe adsorción química del colector. Sin embargo, se encontró que la mayor recuperación de anglesita se obtiene usando AOH a valores de pH 5 y 7. Las razones de este último comportamiento serán discutidas más adelante.
En el caso de la anglesita acondicionada con ABH a pH 8 y 10 (ver Figura 3a y 3b), se observa la presencia de cuatro bandas: dos de baja intensidad en 1520 cm-1 y 1325 cm-1, una de mediana intensidad en 682 cm-1 y una de alta amplitud e intensidad en 1400 cm-1. A diferencia de las bandas del ión carbonato de la cerusita, las bandas características del ión sulfato de la anglesita no desaparecen ni pierden intensidad, lo cual indica una baja densidad de adsorción del colector, de modo que no alcanza a cubrirlas. En cuanto al AOH, al acondicionar la anglesita con este colector a pH 8 y 10 (ver Figura 3c y 3d), se observa la aparición de una nueva banda en 3198 cm-1. Asimismo, las bandas C-H del colector, ubicadas en 2916 cm1 y en 2847 cm-1, son observadas en ambos casos. Además, se observan bandas de alta amplitud e intensidad en 1602 cm-1 y l395 cm-1. Cabe señalar que la intensidad de estas bandas es más alta a pH 8.
La detección de grupos funcionales del ABH y AOH sobre las superficies de la anglesita, manifiesta la adsorción química (i.e., quimisorción) de los colectores [13]. Aparentemente, para la anglesita la quimisorción únicamente ocurre a pH 8 y 10.
Formación de complejos metálicos monodentados y bidentados con los aniones benzohidroxamato y octanohidroxamato
Con el propósito de determinar si el enlace que se forma entre los sitios de plomo con ABH y AOH consiste en una estructura de anillo, se extrajeron los valores de las frecuencias C=O y C-N de los espectros mostrados anteriormente, los cuales se presentan en la Tabla 2 para su comparación.
Tabla 2 Frecuencias de los enlaces C=O y C-N de los colectores ABH y AOH y de la anglesita acondicionada en su presencia.
| Condiciones | Anglesita (PbSO4) | |
| Frecuencia (cm-1) | ||
| C=O | C-N | |
| Colector ABH | 1646 | 1551 |
| Mineral con ABH (pH 5) | ||
| Mineral con ABH (pH 8) | 1520 | 1400 |
| Mineral con ABH (pH 10) | 1520 | 1400 |
| Colector AOH | 1657 | 1559 |
| Mineral con AOH (pH 5) | ||
| Mineral con AOH (pH 8) | 1602 | 1581 |
| Mineral con AOH (pH 10) | 1602 | 1580 |
Resulta importante mencionar que Zhang, Honaker [13] señalan que el oxígeno del grupo carbonilo sirve como centro donante en los quelatos metálicos, por lo que habrá una pérdida de electrones de este grupo funcional que, a su vez, aumentará la densidad de electrones en el enlace C-N. De modo que la extracción de electrones hará que la frecuencia a la que absorbe el enlace C=O disminuya y que la frecuencia del enlace C-N aumente [14], formándose una estructura de anillo, es decir, un ligando bidentado.
En la Tabla 2 se observa que esta condición se cumple para la anglesita acondicionada con AOH pH 8 y 10, lo cual sugiere que en estas condiciones los aniones benzohidroxamato y octanohidroxamato se encuentran adsorbidos químicamente formando un quelato bidentado, es decir, una estructura de anillo. Por el contrario, la condición no se cumple para la anglesita es acondicionada con ABH a pH 8 y 10, lo anterior aparentemente se debe a que, bajo estas condiciones, los aniones benzohidroxamato y octanohidroxamato no se encuentran formando un anillo con el plomo, y que muy probablemente el quelato formado es monodentado. Cabe señalar que la formación de quelatos bidentados da como resultado un complejo más estable, que el que se forma cuando el metal se une con un solo ligante (monodentado).
Potencial Zeta de la anglesita con y sin colector
Se efectuaron mediciones de potencial zeta con el fin de determinar los cambios de carga superficial de las partículas de anglesita, antes y después del acondicionamiento con los colectores ABH y AOH. La Figura 4 presenta los resultados obtenidos.
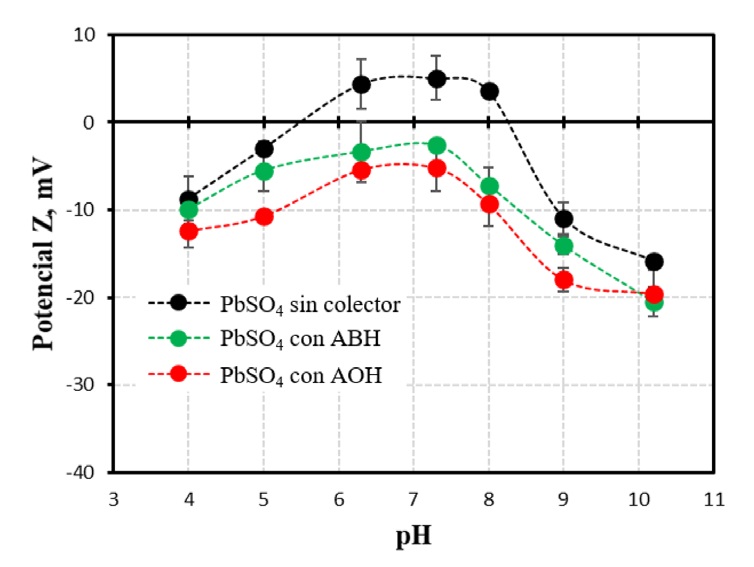
Figura 4 Potencial zeta de la anglesita en agua y en 5x10-4 mol/L de ABH y AOH, en función del pH. Las barras de error que se muestran corresponden a intervalos de confianza del 95%.
En la figura claramente se observa que en ausencia de colector la anglesita adquiere carga positiva o negativa dependiendo del pH en el que se encuentre. De acuerdo con la modelación termodinámica del sistema, reportada por Elizondo-Álvarez, Uribe-Salas [15], por debajo de pH 6 únicamente se tiene anglesita, con carga negativa de acuerdo a los resultados de potencial z obtenidos. En el rango de pH de 6 a 8, las especies Pb(OH)4 2+, PbOH+ y Pb4(CO3)2(SO4)(OH)2 son las responsables de darle la carga positiva a la superficie de la anglesita en esta región de pH. Finalmente, para valores de pH por encima de 8.5, la hidrocerusita (Pb3(CO3)2(OH)2) es la especie predominante [15]. Además, a estos valores de pH también puede haber Pb(OH)2. Aparentemente, ambas especies son las responsables de cambiar la carga de las partículas de anglesita, de positiva a negativa, en la región de pH de 8.5 a 10.
Cuando la anglesita es acondicionada con ABH y AOH, el potencial zeta se vuelve más negativo en todo el rango de pH estudiado, indicando que ambos colectores aniónicos son adsorbidos. La adición de AOH presenta mayor efecto sobre el potencial zeta de la anglesita, que el ABH, indicando que existe una mayor adsorción de este colector sobre el mineral, como lo demuestran los resultados de caracterización superficial mediante reflectancia infrarroja.
Con base en estos resultados, se puede decir que existe colector adsorbido sobre la anglesita a pH 5. No obstante, las mediciones de caracterización superficial mediante ATR-FTIR no detectaron colector adsorbido. A este respecto, cabe comentar que es posible que el lavado al que se someten las partículas minerales posterior a la adsorción (9 etapas de lavado), con el objeto de eliminar residuos “entrampados” del colector, haya eliminado prácticamente el total del colector fisisorbido en las mediciones de caracterización superficial mediante ATR-FTIR.
Mecanismos de interacción entre la anglesita y los aniones benzohidroxamato y octanohidroxamato en solución acuosa
Anglesita-benzohidroxamato
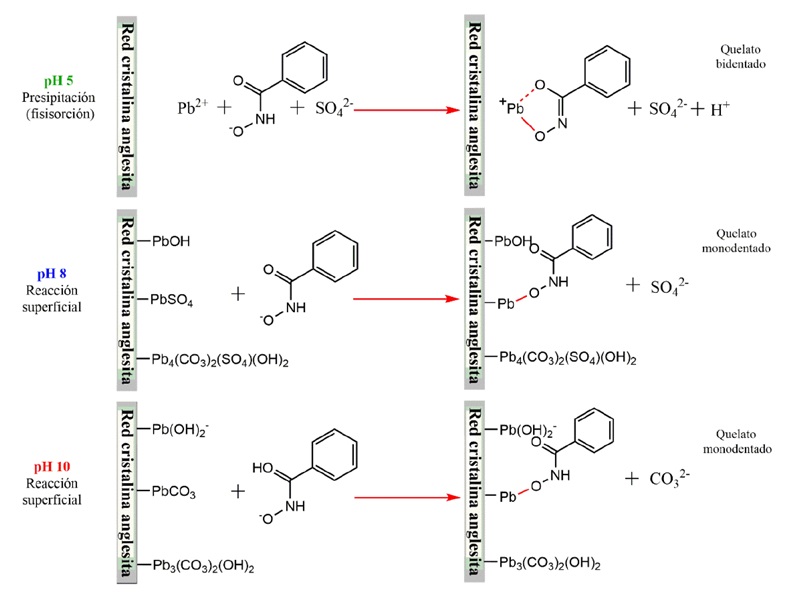
De acuerdo con los resultados mostrados y discutidos anteriormente, el presente trabajo propone que el anión benzohidroxamato reacciona químicamente con los sitios activos de su superficie únicamente a pH 8 y 10 (ver Figura 5). El Pb2+ se disuelve de la red cristalina a pH 5 y reacciona con el anión benzohidroxamato para formar el precipitado Pb-benzohidroxamato, el cual es readsorbido físcamente en las vecindades de la superficie, dando como resultado una superficie hidrofóbica. A pH 8, -PbOH+, -PbSO4 y -Pb(CO3)2(SO4)(OH)2 son los sitios activos predominantes, de los cuales -PbSO4 puede reaccionar químicamente con los aniones benzohidroxamato para formar quelatos monodentados. Finalmente, a pH 10 el anión benzohidroxamato reacciona con el sitio -PbCO3 que no ha sido convertido a hidrocerusita (Pb(CO3)2(OH)2), produciendo quelatos bidentados. Cabe mencionar que a pH 10 también puede haber -Pb(OH)2 sobre la superficie de la anglesita, especie que inhibe la adsorción de colector.
Anglesita-octanohidroxamato
Los mecanismos de interacción anglesita-octanohidroxamato propuestos en este trabajo se ilustran en la Figura 6. A pH 5, el anión octanohidroxamato reacciona con el Pb2+ disuelto de la red cristalina, formando un precipitado Pb-octanohidroxamato, el cual es fisisorbido en las vecindades de la superficie, como lo demuestran las mediciones de caracterización superficial mediante ATR-FTIR y mediciones de potencial zeta. A pH 8, el anión octanohidroxamato reacciona con los sitios -PbOH y -PbSO4 formando quelatos bidentados. Finalmente, a pH 10, el anión octanohidroxamato reacciona con el sitio -PbCO3 que no ha sido convertido a hidrocerusita (Pb3(CO3)2(OH)2), produciendo quelatos bidentados. Obsérvese que existe una menor concentración de enlaces con los sitios de plomo desarrollados por el benzohidroxamato (ver Figura 5), en comparación con los desarrollados por el octanohidroxamato (ver Figura 6). Lo cual se debe a las limitaciones estereológicas impuestas por la estructura morfológica del ABH.
Conclusiones y perspectivas
Con base en las mediciones efectuadas con las diferentes técnicas experimentales empleadas se propusieron los mecanismos de interacción, los cuales presentan reacciones globales y ayudan a entender la manera en que reaccionan el ABH y AOH con los minerales de plomo.
Se sugiere que los aniones benzohidroxamato y octanohidroxamato se adsorben químicamente formando quelatos bidentados con la anglesita acondicionada con AOH pH 8 y 10. Asimismo, dichos colectores forman quelatos monodentados en el caso de la anglesita con ABH a pH 8 y 10. Por último, ambos colectores se fisisorben sobre la anglesita a pH 5.
Se encontró una menor densidad de adsorción del ABH sobre los sitios de plomo, en comparación con la densidad de adsorción desarrollada por el AOH. Lo cual probablemente se debe a que el ABH contiene un anillo bencénico en su estructura mientras que el AOH tiene una sola cadena octílica, de modo que el anión benzohidroxamato probablemente tenga mayores limitaciones estereológicas, comparado con el anión octanohidroxamato, para unirse con los sitios de plomo de la superficie mineral.
Estos resultados dan la pauta para investigar el uso del ácido octanohidroxámico (colector más reactivo) en la flotación de minerales reales de baja ley de plomo. Se espera que su empleo como colector proporcione buenos resultados en la recuperación simultánea de galena, cerusita y anglesita, sin la necesidad de una etapa de sulfuración previa de los minerales oxidados. Además, el uso del AOH mitigaría los efectos negativos a la salud y al medio ambiente ocasionados por los xantatos.











 nueva página del texto (beta)
nueva página del texto (beta)