Introducción
El oro y el teluro se pueden combinar en la naturaleza formando telururos de oro dando origen a un mineral refractario, lo cual significa que durante la cianuración convencional se obtienen recuperaciones menores al del 80%. Sin embargo, la creciente necesidad de extracción de los telururos de oro, ha creado la necesidad de buscar nuevas alternativas para el tratamiento de este tipo de minerales; se han propuesto tratamientos para la recuperación de oro y plata de sus telururos, incluyendo tostado, preoxidación, cianuración con plomo y nitrato y el uso de agentes de lixiviación distintos del cianuro.
Debido a que el ácido de Caro (H2SO5) es un conocido oxidante fuerte, ha sido empleado con anterioridad para la oxidación de minerales de uranio, zinc y cobre, obteniendo resultados favorables.
Con el objetivo de estudiar la capacidad del ácido de Caro como agente pre oxidante de los minerales refractarios a la cianuración, específicamente los telururos de oro, se realizó este estudio experimental, con el propósito de encontrar las condiciones de preoxidación aptas para utilizarse y obtener una mayor recuperación del mineral.
Antecedentes
Caracterización mineralógica
El mineral que se utilizó en este estudio proviene del Noroeste de México, del estado de Sonora, el cual contiene telururo de oro (AuTe2). La caracterización de la muestra se llevó a cabo en trabajos previos realizados por el Centro de Investigación y Estudios Avanzados, Unidad Saltillo y el laboratorio Petrochemin LABS de S.L.P.
Según los resultados obtenidos en este estudio previo, la muestra caracterizada se compone de sulfuros y de óxidos minerales de ganga y de mena: cuarzo (SiO2), feldespatos, hematita (Fe2O3), goethita (FeO)OH, pirita (FeS), esfalerita (ZnS), magnetita (Fe3O4), ilmenita (FeTiO3), oro nativo (Au), calaverita (AuTe2) y trazas de calcopirita (CuFeS).
Las especies de oro identificada son oro nativo y calaverita (AuTe2) como el mineral de teluro y que se presenta liberado y ocluido. (Tabla I)
Tabla I Distribución de especies oro de la muestra del mineral proveniente de una mina del noroeste del país con mineral refractario de telururo de oro.
| Especie de Oro | % | Tamaño de partícula (µm) | Tamaño promedio (µm) | |
| Oro Nativo (40%) | Oro nativo libre | 30% | 3 – 30 | 20 |
| Oro nativo ocluido en Cuarzo | 70% | 4 – 10 | 8 | |
| Calaverita (60%) | Calaverita Libre | 25% | 6 – 18 | 9 |
| Calaverita ocluida en cuarzo | 65% | 4 – 20 | 16 | |
| Calaverita ocluida en hematita | 10% | 20 | 20 | |
| 100% | ||||
Consideraciones termodinámicas
El potencial estándar de oxidación del H2SO5 se estima en aproximadamente 1.5 V a pH 0 y varía con el pH según la siguiente ecuación [3]:
La Figura 1 presenta el diagrama Eh - pH del Au - Te - H2O en donde se traza una línea punteada que representa el potencial estándar del H2SO5, el cual es más que suficiente para la oxidación requerida en la calaverita, (0.3 V). Por lo tanto, se establece que termodinámicamente es posible realizar la disolución del AuTe2 mediante la adición de ácido de Caro, y debido al efecto oxidante de este compuesto, se obtendría la formación de Au+ y una especie de Te (IV) (TeO3 2-, HTeO3 -, H2TeO3, dependiendo del pH).
Metodología experimental
Este estudio se llevó a cabo en 3 etapas experimentales, comenzando por la síntesis el ácido de Caro, el tratamiento pre-oxidativo, y la cianuración al mineral, con el fin de evaluar el grado de refractariedad de los minerales de metales preciosos contenidos en cada muestra y establecer una relación con la presencia de teluro en el mineral.
Síntesis del ácido de Caro
El ácido de Caro fue preparado de acuerdo con el método descrito por [2] mediante la adición lenta de H₂O₂ a H₂SO₄, manteniendo agitación constante y enfriando por medio de baño de agua para mantener la temperatura por debajo de 20° C, con un sistema de enfriamiento para remover el calor de dilución del ácido (Figura 2) y el calor de reacción y, de esta manera, evitar la pérdida de H₂SO₅ activo por auto-descomposición [1]. El ácido de Caro preparado con H₂SO₄:H₂O₂ = 3:1, con H₂SO₄ al 98% (w/w) y H₂O₂ al 50% (w/w) presenta un contenido de 25% (w/w) de H₂SO₅, el cual será diluido con agua desionizada hasta obtener una concentración de H₂SO₅ al 10% (w/w), ideal para ser utilizado en los experimentos.
Procedimiento pre-oxidativo (H2SO5-AuTe2)
La prueba se realizó en un reactor de vidrio de 500 mL de capacidad, el cual esta enchaquetado para mantener la temperatura constante. Se añadió el ácido de Caro a la pulpa del mineral (Figura 3) manteniendo una agitación magnética constante, así como el control de la temperatura y el pH.
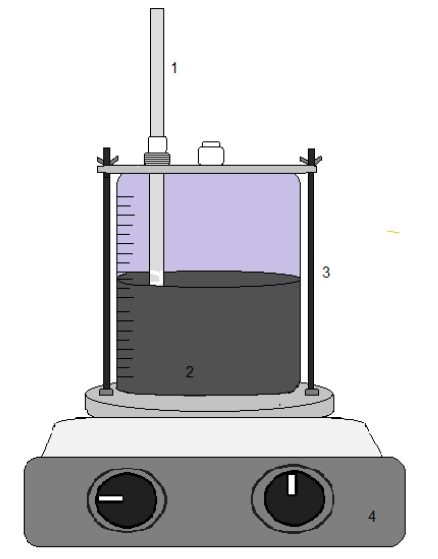
Figura 3 Representación del equipo experimental. 1. Termómetro; 2. Agitador; 3. Reactor; 4. Parrilla de agitación.
La pre-oxidación se realizó empleando diferente concentración del ácido de Caro, tomando muestras a intervalos predeterminados, las cuales fueron filtradas para realizar la medición de Au en solución mediante espectroscopía de absorción atómica. Las condiciones de cada una de estas pruebas se muestran en la Tabla II. Posteriormente, se realizó un lavado de este mineral oxidado con agua desionizada para eliminar el ácido de Caro físicamente adsorbido en el mineral y que pudiera reaccionar con el cianuro que se agregará en la etapa posterior.
Tabla II Condiciones de pre-oxidación a la muestra del noroeste de México con presencia de telururo de oro.
| Condición | Valor |
| Tiempo de agitación (minutos) | 30, 60, 120, 180 |
| Masa del mineral (g) | 50 |
| Acidez (pH) | <2 |
| Volumen (mL) | 300 |
| Velocidad de agitación (rpm) | 500 |
| Concentración del ácido de Caro (w/w) | 2, 5, 10% |
| Temperatura (˚C) | 25 |
Cianuración estándar
Las pruebas de cianuración se realizaron empleando mineral con pretratamiento oxidativo y con el mineral sin pretratamiento. Las condiciones de estas pruebas se muestran en la Tabla III.
Tabla I Condiciones de cianuración estándar al mineral refractario de calaverita.
| Condición | Valor |
| Masa Mineral concentrado (g) | 50 g |
| Volumen de pulpa | 310 |
| Acidez (pH) controlado con NaOH | 11-11.5 |
| Velocidad de agitación (rpm) | 400 |
Para realizar la cianuración, se preparó una solución lixiviante de cianuro de sodio, la cual se agregó al reactor, seguido de esto, se agregaron los 50 g del mineral, el reactor se mantuvo en agitación constante. Por último, se midió la recuperación de oro y se tomó una muestra a los 30 minutos, después cada hora hasta que se consideró necesario.
Resultados
Los resultados de la evaluación del efecto de la variación de la concentración del ácido de Caro se presentan en la Figura 4. Comenzando por el ácido de Caro al 2% en una solución de 300 mL y 50 g de mineral con contenido de calaverita. La disolución de oro máxima en esta prueba fue de 0.41 ppm en 3 horas (Figura 4). A continuación, se evaluó la recuperación de oro al aumentar la concentración del ácido de Caro al 5%. Se puede apreciar un aumento en la disolución de oro de 0.24 ppm en 3 horas, significando un aumento considerable respecto a la prueba en que se empleó el ácido de Caro al 2%.
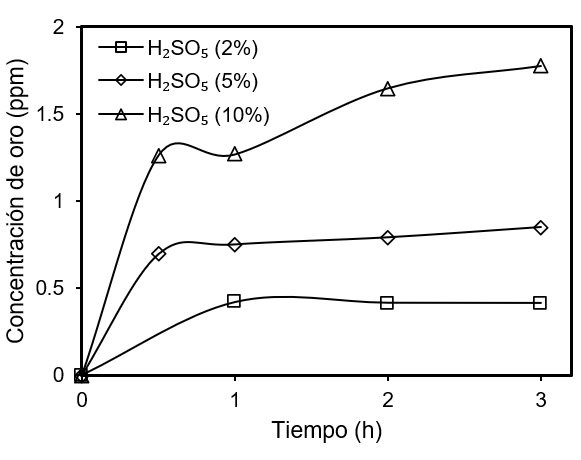
Figura 4 Disolución de oro contenido en un mineral refractario de calaverita empleando H2SO5 (25 ˚C; 1 atm).
Al aumentar la concentración del ácido de Caro al 10%, se observa que a las 3 horas se observa que la recuperación de oro alcanzó 1.77 ppm de oro.
Se encontró que la presencia de ácido de Caro provoca una sobreestimación del contenido de oro en las mediciones de absorción atómica. Para estimar el efecto de esta interferencia, se midió el ácido de Caro a diferente concentración mediante AA y posteriormente se realizó el cálculo para conocer la concentración de oro real disuelto en la solución.
Al medir el ácido de Caro en AA se obtuvieron los siguientes resultados (Figura 5)., los cuales muestran que a mayor concentración del ácido de Caro se presenta una interferencia mayor, posiblemente proveniente del ácido sulfúrico que lo compone. Para el ácido de Caro en una concentración del 2% la interferencia es de 0.26 ppm de oro, al aumentar la concentración al 5 y 10% la interferencia incrementa a 0.60 y 1.26 ppm de oro, respectivamente; este valor posteriormente fue restado a los resultados obtenidos de la oxidación del mineral de calaverita, para obtener la concentración real de oro en solución.

Figura 5 Cuantificación de la interferencia del ácido de Caro que provoca una sobre estimación del oro en solución (25 ˚C; 1 atm).
Al realizar los ajustes para conocer la concentración real de oro en solución, la recuperación de este metal disminuyó; sin embargo, se obtuvieron altas disoluciones de oro, como se observa en la Figura 6. La disolución de oro en la prueba con el ácido de Caro al 2% fue de 0.15 ppm en 3 horas, con una concentración del 5% la disolución de oro fue de 0.24 ppm en el mismo tiempo y al aumentar la concentración del ácido de Caro al 10% la disolución del metal alcanzó recuperaciones cercanas a 0.74 ppm de oro.

Figura 6 Disolución de oro contenido en un mineral refractario de calaverita empleando H2SO5 (25˚C; 1 atm).
Una vez completada la oxidación, el mineral fue sometido a un proceso de cianuración para averiguar si existe mayor recuperación del elemento de interés.
Cianuración de calaverita
Los resultados de las cianuraciones realizadas al mineral con presencia de calaverita se presentan en la Figura 7; con el mineral de calaverita que no fue sometido al proceso de oxidación con ácido de Caro se alcanzó una recuperación de 0.04 ppm de oro durante 5 horas de cianuración estándar. La disolución de oro para el caso del mineral oxidado con ácido de Caro al 2% fue de 0.04 ppm. Para el caso de la oxidación con ácido de Caro al 5% la disolución máxima fue de 0.08 ppm.

Figura 7 Disolución de oro con cianuro de sodio del mineral refractario de calaverita (25˚C; 1 atm).
Al emplearse el ácido de Caro al 10% se obtuvieron recuperaciones máximas de 0.066 ppm de oro; estos resultados claramente indican que no hubo aumento significativo de la disolución de oro entre el mineral que se sometió a la oxidación con ácido de Caro y el que solamente fue sometido a cianuración estándar.
Disolución total de oro
A partir de los resultados obtenidos, se propone que la disolución de oro mediante la adición de ácido de Caro se lleva a cabo a través de una lixiviación ácida directa (2).
Los resultados mostraron que hubo un aumento significativo en la recuperación de oro al pasar de 0.041 ppm empleando cianuración estándar, mientras que al emplear ácido de Caro se obtuvieron disoluciones de 0.74 ppm de oro, representando un aumento considerable en la disolución de oro, el cual se reportaba como no recuperable dentro de una cianuración estándar.
La recuperación total al sumar la cianuración estándar y la disolución con el ácido de Caro al 10% asciende a 0.81 ppm de oro (Figura .8). Al aplicarse el ácido de Caro como un agente lixiviante fue posible recuperar el oro que había sido considerado como no recuperable al encontrarse asociado al teluro.
Conclusiones
De acuerdo con los resultados obtenidos, la disolución del oro en el mineral refractario de calaverita se produce dentro de la etapa de oxidación con el ácido de Caro, lo cual podría ocurrir como se describe en la ecuación (2):
Esto significa que el ácido de Caro funciona como un agente lixiviante alterno al cianuro para minerales de telururo de oro, lo cual abre una nueva alternativa para procesar este tipo de minerales.











 nueva página del texto (beta)
nueva página del texto (beta)






