INTRODUCCIÓN
Desde un punto de vista fisiológico, el sueño es un proceso complejo (Corsi-Cabrera, 2018). Intrincadas redes de neuronas (McGinty y Szymusiak, 2017) generan potenciales eléctricos, representados en una gráfica de voltaje sobre el tiempo, medidos desde el cuero cabelludo mediante sensores llamados electrodos (Paniagua e Iznaola, 2015). Es posible colocar 19 electrodos sobre el cuero cabelludo de acuerdo con un sistema internacional llamado “10-20”, según la proporción de cada cabeza respecto a puntos estándar fácilmente localizables (Ferré y Sagalés, 2015) (Figura 1).
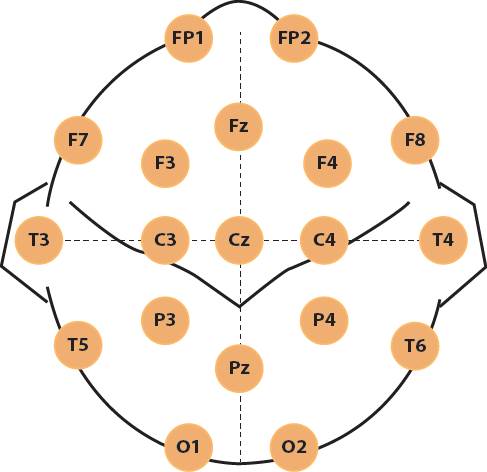
Figura 1 Ubicación de los 19 electrodos sobre el cuero cabelludo. Se amplifica la actividad eléctrica cerebral y se consigue una señal de voltaje en función del tiempo o electroencefalograma (EEG). La “z” proviene del inglés “zero”o cero correspondiente a la línea media. Los electrodos con números nones se colocan al lado izquierdo y los pares al lado derecho. “F” es frontal; “Fp” es frontopolar; “C” es central; “T” es temporal; “P” es parietal; “O” es occipital. La figura fue extraída de Perona y Diez (1973).
Además del registro de la actividad eléctrica cerebral o electroencefalograma (EEG), la técnica no invasiva de la polisomnografía (PSG) -o registro de múltiples componentes durante el sueño- comprende la medición de la actividad eléctrica ocular o electrooculograma (EOG) (Ferré y Lainez, 2015), para lo cual se colocan al menos dos electrodos cerca de los cantos de los ojos; también de la actividad muscular o electromiograma (EMG), situando dos electrodos sobre los músculos del mentón (Ferré y Lainez, 2015). La señal obtenida durante el sueño, a partir del EEG, EOG y EMG, cambia su morfología de acuerdo con las áreas cerebrales registradas: frontales, centrales, parietales u occipitales y de sus referencias (o electrodos adicionales auxiliares).
El sueño se clasifica en dos: el sueño de movimientos oculares rápidos (sueño MOR) (Siegel, 2017) y, el de no MOR (sueño NMOR). El sueño NMOR se divide a su vez en etapas 1, 2 y 3 (Ferré y Lainez, 2015). Cuando se está despierto o en el estado de vigilia con ojos cerrados se puede observar un registro en donde predomina un EEG con oscilaciones denominadas “ritmo alfa” y un tono muscular alto (Figura 2). En cambio, cuando el sueño propiamente comienza, es decir, en un registro de la etapa 1 del sueño NMOR, se observan frecuencias mezcladas, hay disminución del ritmo alfa y el tono muscular es menor que en vigilia (Figura 3) (AASM, 2007; Ferré y Lainez, 2015).
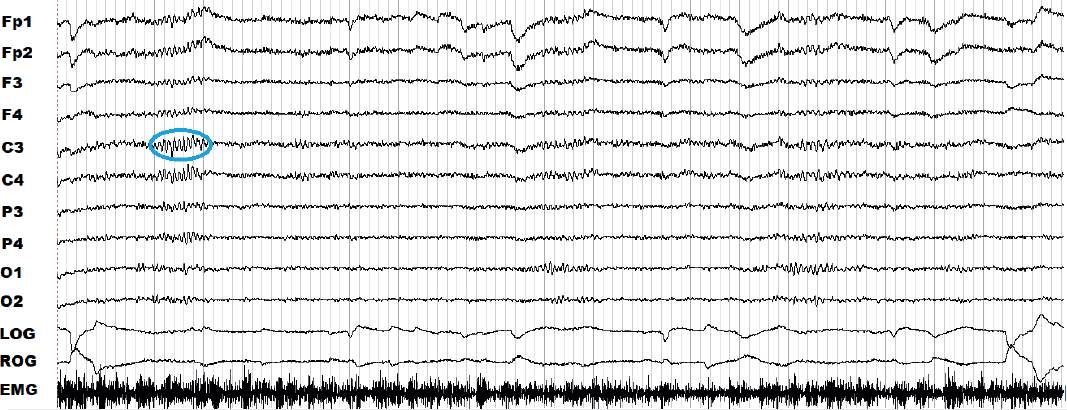
Figura 2 Registro de la polisomnografía durante 30 s de la vigilia con ojos cerrados de una paciente del grupo control. Los canales frontopolares (Fp), frontales (F), centrales (C), parietales (P) y occipitales (O) se denotan en la columna de la izquierda; las regiones cerebrales se asocian a números: las derivaciones del lado derecho de la cabeza se representan con números pares y las del lado izquierdo de la cabeza, con los nones. Los electrooculogramas (EOG) derecho e izquierdo son LOG y ROG, por sus siglas en inglés; el canal de la electromiografía (EMG) comprende el trazo grueso. En azul se observa el ritmo alfa característico de este estado.
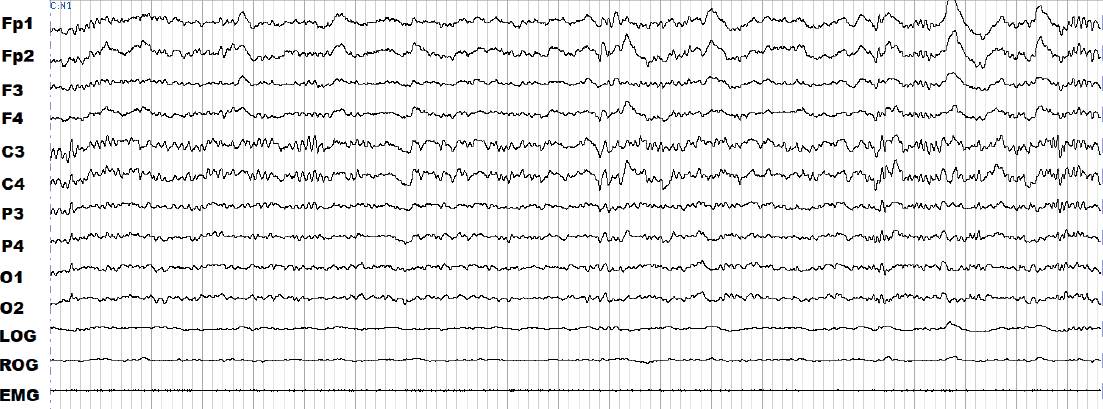
Figura 3 Registro de la polisomnografía durante 30 s de la etapa 1 del sueño que no es de movimientos oculares rápidos (NMOR) de una paciente del grupo control. Los canales frontopolares (Fp), frontales (F), centrales (C), parietales (P) y occipitales (O) se denotan en la columna de la izquierda, siendo asociadas las regiones cerebrales a números: las derivaciones del lado derecho de la cabeza se representan con números pares y las del lado izquierdo de la cabeza, con los nones. Los electrooculogramas (EOG) derecho e izquierdo se muestran en los canales de LOG y ROG, por sus siglas en inglés; el canal de la electromiografía (EMG) comprende el último trazo.
En la Figura 4 se presenta el registro de un paciente control en la etapa 2 de sueño NMOR, cuyos grafo-elementos principales son los husos de sueño y los complejos K. Los husos de sueño son ondas oscilatorias sinusales de 7 Hz a 14 Hz con una duración de 1 s a 2 s y los complejos K son ondas bifásicas seguidas o no de un huso de sueño (Nuñez y Rodrigo, 2015). Ambos grafo-elementos representan a un fenómeno que podría resumirse como un estado cerebral de marcapasos en un organismo con “puertas cerradas” por un bloqueo de los mecanismos del despertar y la presencia de circuitos neuronales con tendencia inhibitoria (McGinty y Szymusiak, 2017). En ocasiones es posible observar el surgimiento de ambos fenómenos ante estímulos del medio, sin embargo, por lo general su presencia implica una falla en la transmisión de información entre los circuitos neuronales (Corsi-Cabrera, 2018). La etapa 3 contiene ondas lentas (Figura 5) (McGinty y Szymusiak, 2017) y la amplia sincronía de la actividad neuronal favorece una transmisión de la información pobre y fragmentada (Corsi-Cabrera, 2018).
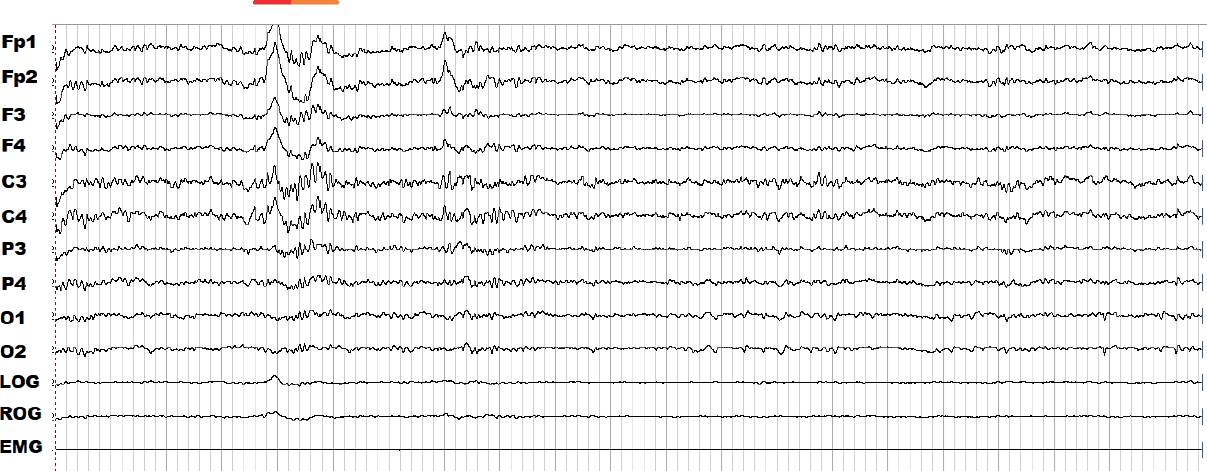
Figura 4 Registro de la polisomnografía de la etapa 2 de sueño de no movimientos oculares rápidos (NMOR) de una paciente del grupo control. Los complejos K y los husos de sueño se indican debajo de la línea roja y naranja, respectivamente; el trazado del electromiograma es menos pronunciado que en vigilia.
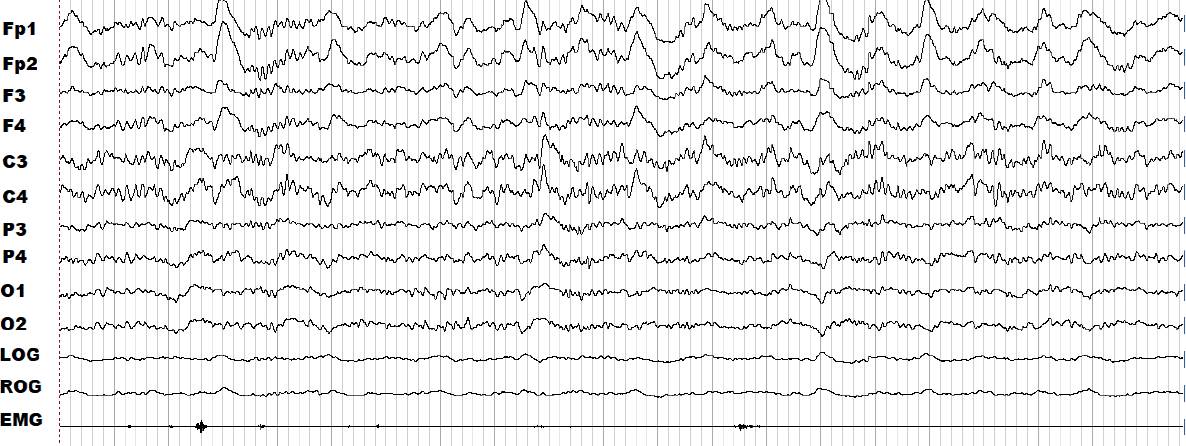
Figura 5 Registro de la polisomnografía de la etapa 3 de sueño de no movimientos oculares rápidos (NMOR) de una paciente del grupo control. Las ondas lentas son evidentes y el trazado del electromiograma es menos pronunciado que en la vigilia.
Tanto para el sueño NMOR como para el MOR hay dos posibles indicadores de la fragmentación: los movimientos periódicos de las piernas (MPP) y los arousals o alertamientos. Los MPP se observan en vigilia, el sueño NMOR y MOR, incluso cuando hay movimientos oculares rápidos. En esta última etapa de sueño MOR (Figura 6) se detectan proporcionalmente menos MPP que durante el sueño NMOR (Figura 7), debido a su atonía muscular característica (Rosales-Lagarde y col., 2009; Calvo y García-Borreguero, 2015). Los MPP y los alertamientos son fenómenos relacionados con las activaciones simpáticas del sistema nervioso y la frontera entre su caracterización como fenómenos normales o anormales continúa en debate (Ferri y Fulda, 2017; Parrino y Terzano, 2017). La frecuencia y las manifestaciones subjetivas de una mala calidad de sueño y/o la sensación de malestar en las piernas, son especialmente características del síndrome de piernas inquietas (SPI) (Ashbrook y During, 2017). El SPI implica el movimiento de las piernas involuntario con parestesias y dolor (Ashbrook y During, 2017).
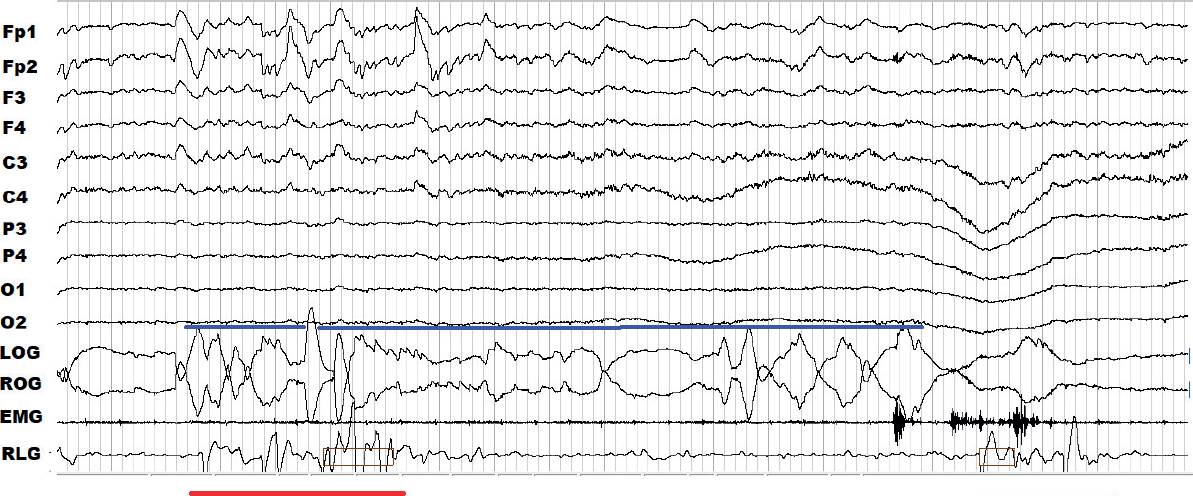
Figura 6 Registro de la polisomnografía durante 30 s de la etapa de movimientos oculares rápidos (MOR) de una paciente con deterioro cognitivo leve. Se detectaron varios MOR (azul) en el canal correspondiente al electrooculograma. Los movimientos periódicos de las piernas (MPP) (rojo) coinciden con los MOR y los MPP se presentan en el canal correspondiente a RLG (right leg, por sus siglas en inglés).
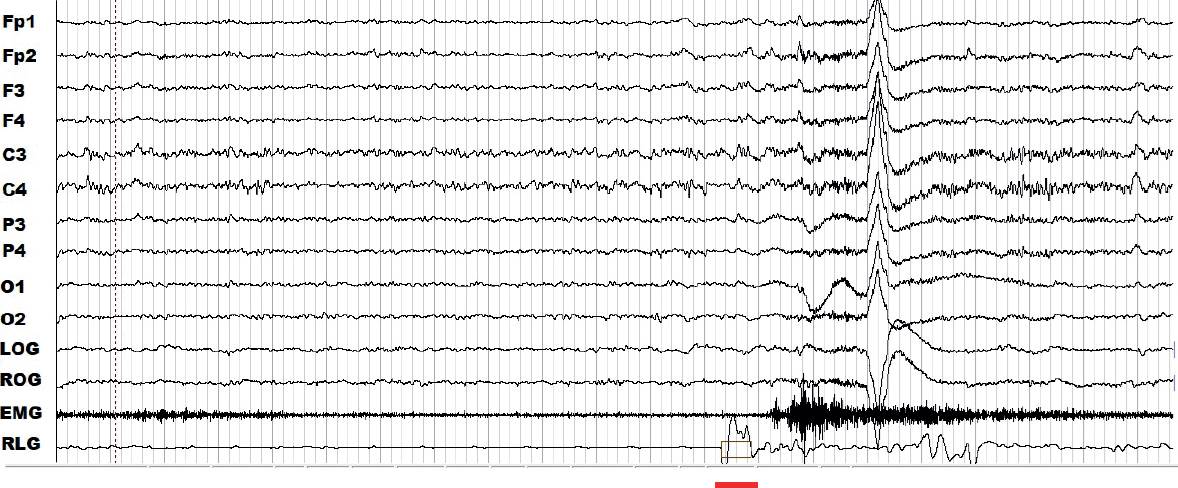
Figura 7 Registro de la polisomnografía durante 30 s de la etapa 2 de sueño de no movimientos oculares rápidos (NMOR) de una paciente del grupo con deterioro cognitivo leve cuando hay un alertamiento y un movimiento periódico de la pierna (MPP). El MPP se presenta en el canal correspondiente a RLG (right leg, por sus siglas en inglés, en rojo).
Los MPP representan contracciones periódicas de los músculos tibiales anteriores y de otros músculos cercanos (Calvo y García-Borreguero, 2015), ligados a incrementos de la presión sanguínea (Pennestri y col., 2007; Ferri y col., 2015; Sieminski y col., 2017a; 2017b). Su significado clínico depende de la frecuencia y puede variar según los estándares de puntuación que sean utilizados (Ferri y Fulda, 2017). Los criterios existentes incluyen un grupo de 5, o más recientemente, 15 MPP consecutivos en 1 h, con al menos 4 movimientos de las piernas consecutivos con duración de al menos 0.5 s a 5 s, y un intervalo de los movimientos entre 4 s a 90 s (Ferri y Fulda, 2017). Los MPP pueden ocurrir frecuentemente en sujetos sin quejas subjetivas de sueño (Boehm y col., 2009; Claman y col., 2013; Frauscher y col., 2014).
Los alertamientos son otros fenómenos ligados a la fragmentación de sueño, y son considerados fenómenos espontáneos y benignos, dependientes de la madurez y de la edad (Parrino y Terzano, 2017). Los alertamientos también se han relacionado con un estado de alerta fisiológica con influencias perjudiciales para la salud, porque un índice abundante se asocia con varios desórdenes del sueño, como insomnio y somnolencia excesiva diurna, de acuerdo con información de la Asociación Americana de Medicina del Sueño (AASM, por sus siglas en inglés: American Association of Sleep Medicine) (AASM, 2007; Claman y col., 2013).
El deterioro cognitivo leve (DCL) es un padecimiento asociado a la pérdida de la memoria o de la capacidad cognitiva (lenguaje, percepción visual o espacial), que se manifiesta de forma temprana sin afectar la capacidad del individuo de realizar sus actividades diarias de manera independiente (Parada-Muñoz y col., 2022). Se considera una etapa intermedia entre la normalidad y la demencia que es posible detectar de manera prematura, ya que antes de la alteración en las funciones psicológicas, ocurren cambios en la fisiología cerebral. La demencia es un síndrome que implica la pérdida parcial o combinada de funciones cognitivas junto con una imposibilidad de ser independiente, por lo que es vital detectarla tempranamente antes de su aparición (López-Álvarez y col., 2015). Las muertes totales debidas a demencia fueron en un 65 % de mujeres, de acuerdo con la Organización Mundial de la Salud (OMS, 2023). En México, el número estimado de personas que tendrán demencia alcanzará los 3.5 millones para el 2050 (Gutiérrez-Robledo y col., 2017).
El conocimiento del vínculo entre los MPP y los alertamientos es escaso en personas con DCL sin problemas graves en el sueño y sin una sintomatología del SPI (Rosales-Lagarde y col., 2019), tampoco se ha estudiado ampliamente su asociación con el riesgo de desarrollar demencia. Es por ello la importancia de detectar a tiempo el DCL en los adultos mayores y la aplicación oportuna de baterías neuropsicológicas (López-Álvarez y col., 2015).
El objetivo de este trabajo fue determinar la prevalencia de los alertamientos y de los movimientos periódicos de piernas durante el sueño en un grupo control y un grupo con deterioro cognitivo leve, así como conocer si hay diferencias entre los grupos en ambos índices y establecer si existe una correlación entre ambos fenómenos.
MATERIALES Y MÉTODOS
Esta investigación consistió en un estudio piloto ligado al programa de Cátedras-Consejo Nacional de Ciencia y Tecnología (CONACYT) en la Universidad Autónoma del Estado de Hidalgo (UAEH) en México. Se trató de un estudio transversal, no aleatorizado y exploratorio.
Invitación a participar
Se abrieron varias convocatorias dirigidas a los adultos mayores, quienes acudieron por voluntad propia. Se invitó a los adultos mayores del Centro Gerontológico Integral de Punta Azul, en el Estado de Hidalgo, México. Adicionalmente se realizaron invitaciones en el transcurso de la impartición de los talleres de alfabetización digital y otras más fueron dirigidas a los alumnos de la UAEH para convocar a sus abuelos.
Fase 1
Esta fase pretendía evaluar al adulto mayor interesado en conocer su estado de salud mental. Era de acceso abierto y los criterios de exclusión fueron los déficits pronunciados no corregidos de la audición y la visión. Los 115 adultos mayores fueron entrevistados y se obtuvo su edad, sexo y años de educación. Se administraron varias escalas en sus versiones en español (Ugalde, 2010). Entre las escalas se encontraban el test de Katz de las actividades de la vida diaria (ADL, por sus siglas en inglés: Activities of Daily Living), y la Evaluación Mini del Estado Mental (MMSE, por sus siglas en inglés: Mini-Mental State Examination), usadas comúnmente para diagnosticar demencia y DCL. El MMSE en su versión “Consenso Mexicano para el Síndrome de Deterioro Intelectual” es una prueba de cribado con 30 preguntas (Ugalde, 2010), que permite diagnosticar DCL en pacientes con escolaridad de 8 a 12 años si solo alcanzan 21 a 22 puntos en sus respuestas. Se determinó la posible presencia de depresión de acuerdo con la Escala Geriátrica de Depresión (GDS, por sus siglas en inglés: Geriatric Depression Scale), y de ansiedad de acuerdo al Test Corto de Cribado de Ansiedad (SAST, por sus siglas en inglés: Short Anxiety Screening Test), porque estas variables tienen mayor prevalencia en adultos mayores con DCL (Zlatar y col., 2018) y pacientes con SPI (Fulda y col., 2010), en concurrencia con un tiempo de sueño disminuido (Montplaisir y col., 2011). También se administró el Neuropsi (Ostrosky y col., 1999) para detectar DCL. El Neuropsi es una batería neuropsicológica que además incluye en su protocolo un cuestionario sobre el estado de salud (enfermedades, antecedentes de riesgo neurológico: traumatismos craneoencefálicos con pérdida de conocimiento, entre otros) y se investigó sobre los medicamentos que ingerían. Como antecedentes neurológicos de riesgo, se consideraron, entre otros, a los problemas académicos en la infancia y en la adultez de acuerdo con Harmony y col. (1990) (Tabla 1).
Tabla 1 Fármacos y condición médica de los participantes de cada grupo.
| Grupo de estudio/ paciente | Fármacos | Condición médica y antecedentes neurológicos de riesgo |
|---|---|---|
| Control | ||
| 1. JA | Telmisartán; risedronato; calcitrol; telmisartán; cinitrapida. | Hipertensión arterial; disminución de agudeza visual; osteoporosis; un traumatismo craneoencefálico. |
| 2. MJ | Levotiroxina; caltrate (carbonato de calcio). | Hipotiroidismo; extirpación de una parte de la glándula tiroides; osteoporosis. |
| 3. MG | --- | --- |
| Deterioro cognitivo leve | ||
| 4. AE | --- | Problemas académicos en la infancia. |
| 5. CL | Losartán; digoxina; insulina. | Cistitis; hipertensión arterial: insuficiencia cardiaca; diabetes. |
| 6. JG | --- | Vista cansada desde hace 6 años. |
| 7. RL | Insulina; medicamento para la hipertensión arterial. | Hipertensión arterial; diabetes; insuficiencia renal. |
| 8. PC | Finasterida; losartán, pravastatina; complejo B; omeprazol; aspirina. | Hipertrofia benigna de próstata; hipertensión arterial; disminución de agudeza visual en un ojo; hipercolesterolemia; dos traumatismos craneoencefálicos; quejas subjetivas de memoria. |
| 9. FG | Enalapril; celebrex; glucosamina; hidroxocobalamina. | Parálisis facial; hipotiroidismo; traumatismo; radicardia; desgaste de cadera; cataratas; embolia hace 5 años; ronca hace 10 años; “salta en la cama”; problemas académicos en la infancia y en la adultez. |
--- No medicados o no enfermedad.
Fase 2
De los 115 participantes de la fase 1, se acercaron a las investigadoras 21 adultos mayores que tuvieron interés en conocer más sobre su salud y/o fueron exhortados por la coordinadora del Centro Gerontológico Integral y/o por las propias investigadoras.
La fase 2 se centró en el estudio psicológico y psicofisiológico del sueño y de la vigilia. La vigilia fue investigada de diferentes formas: en reposo con ojos cerrados (Rodríguez-Torres y col., 2020; 2023); durante tareas emocionales (Rosales-Lagarde y col., 2017) y tareas ejecutivas (Rosales-Lagarde y col., 2021).
La investigadora principal y una estudiante de maestría preguntaron a los adultos mayores interesados si su sueño era bueno, regular o malo, de acuerdo con un cuestionario señalado más adelante. Debido a que se sabe que los medicamentos para tratar el cáncer influyen en el sueño, se excluyó a una adulta mayor en tratamiento de cáncer; otros 2 adultos mayores no llegaron el día convenido al registro de la PSG. De esta forma, el registro psicofisiológico del estado de vigilia con ojos cerrados y durante la ejecución de tareas se realizó a 18 adultos mayores, de los cuales 4 prefirieron ser registrados únicamente durante el estado de vigilia, por lo tanto, el estudio psicológico y psicofisiológico del sueño se llevó a cabo en 14 de ellos. De esos 14, en el momento de la colocación de los electrodos, en 5 adultos mayores la hora indicada de su sueño era inminente. Es conocido que la colocación de electrodos es un proceso artesanal cuya inversión en horas deviene en sueño por parte de los adultos mayores, por lo que no fueron puestos los electrodos de las piernas en 5 de ellos. Por lo tanto, a 9 personas (3 mujeres controles y 3 mujeres con DCL; y 3 hombres con DCL) (edad de los dos grupos: 69.1 ± 5; años de educación: 8 ± 2) se les colocaron los electrodos para el registro de MPP. Debido al reducido tamaño de la muestra, no se realizó un análisis por separado de las variables de interés entre hombres y mujeres.
Los 9 adultos mayores cumplieron con los requisitos de inclusión: no tener demencia, depresión (ninguno de los 9 adultos mayores sobrepasó el puntaje indicativo de depresión de la GDS que sería mayor o igual a 11 puntos) o ansiedad (22 a 23 puntos en el límite o mayor de 24 puntos); adicionalmente, que consideraran sus hábitos de sueño como “buenos” o “regulares”, en el primer cuestionario de sueño aplicado; que no ingirieran medicamentos que alteraran su sueño y que realizaran con independencia sus actividades de la vida diaria. En la Tabla 1, se muestran los fármacos ingeridos por grupo y la condición médica de cada participante, de los cuales, 3 adultos mayores reportaron no estar bajo ninguna medicación (grupo de DCL: 2/6; grupo control: 1/3), mientras que 1 de ellos mencionó que tampoco presentaba ninguna enfermedad (grupo control: 1/3).
Deterioro cognitivo leve
La batería Neuropsi, con 130 reactivos, fue desarrollada en México e incluye normas para individuos con educación y analfabetos. Se considera más sensible en la detección del DCL que el MMSE (Ostrosky y col., 1999; Serrano y col., 2013). Mide 6 dominios neuropsicológicos con 27 subtests que suman un total de 130 puntos. Los 27 subtests evalúan las funciones neuropsicológicas de: orientación (3 subtests); atención y concentración (3 subtests); memoria en dos modalidades: codificación (2 subtests) y memoria de evocación (4 subtests); lenguaje (5 subtests); lectura y escritura (3 subtests) y funciones ejecutivas (7 subtests) (Tabla 2) (Ostrosky y col., 1999). Una vez calificados los subtests, se puede conocer cuáles son las puntuaciones normalizadas al colocar aquellas naturales en los perfiles específicos en cuanto a la edad y años de educación particular. Usualmente se consideran pacientes con DCL aquellos que presentan al menos 1.5 desviaciones estándar por debajo de la media (Tabla 2), en una prueba cognitiva estandarizada (Petersen, 2004). Sin embargo, en este estudio se utilizó como criterio para diagnosticar DCL, el presentar 3 desviaciones estándar por debajo de la media en alguno de los subtests. Esto vuelve más exigente el criterio y permite evitar considerar con DCL a pacientes que pudiesen no tenerlo. Se utilizó la clasificación de Petersen (2016) de DCL, que distingue entre los subtipos amnésico (DCL-a) y no-amnésico (DCL-na), en dominios únicos o múltiples (DCL-dm) (Petersen, 2004; 2016). Los sujetos que obtuvieron 3 desviaciones estándar por debajo de la media en alguno de los subtests de memoria (memoria en su modalidad de codificación o de evocación) fueron considerados como amnésicos y en los otros subtests (orientación, atención y concentración, lenguaje, lectura y escritura y funciones ejecutivas) no amnésicos. Si poseían 3 desviaciones estándar por debajo de la media tanto en subtests de memoria y de alguna otra función considerada “no amnésica” se les clasificó con DCL “mixto” (Tabla 2).
Tabla 2 Perfil del Neuropsi de una adulta mayor del grupo con deterioro cognitivo leve (edad de 71 años y escolaridad de 9 años*).
| Categoría | Normal | Moderado | Severo | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2.5 | 2 | 1.5 | 1 | 0.5 | O | -0.5 | -1 | -1.5 | -2 | -2.5 | -3 | -3.5 | ||||
| Perfil de funciones cognoscitivas | Orientación | Tiempo | 3 | 2 | 0-1 | |||||||||||
| Lugar | 2 | 0-1 | ||||||||||||||
| Persona | 1 | 0 | ||||||||||||||
| Atención y concentración | Dígitos | 6 | 5 | 4 | 3 | 2 | 0 | |||||||||
| Detección visual | 16 | 15 | 14 | 11- 13 | 10 | 7 9 | 4-6 | 0-3 | ||||||||
| 20-3 | 5 | 4 | 0-3 | |||||||||||||
| Memoria | Codificación | Palabras | 6 | 5 | 3 | 0-2 | ||||||||||
| Figura semicompleja | 11.5- 12 | 10- 11 | 9.5 | 9 | 8- 8.5 | 7- 7.5 | 6- 6.5 | 5- 5.5 | 0-4.5 | |||||||
| Evocación | Espontánea | 6 | 5 | 3-4 | 2 | 1 | 0 | |||||||||
| Por categorías | 6 | 5 | 4 | 3 | 2 | 1 | 0 | |||||||||
| Reconocimiento | 6 | 5 | 4 | 3 | 2 | 0-1 | ||||||||||
| Figura semicompleja | 12 | 10.5- 11.5 | 9.5 10 | 6.5 9 | 5.5 6 | 4.5 5 | 3 4 | 1 2.5 | 0 | |||||||
| Lenguaje | Denominación | 8 | 7 | 6 | 4-5 | 0-3 | ||||||||||
| Repetición | 4 | 0-3 | ||||||||||||||
| Comprensión | 6 | 5 | 4 | 3 | 0-2 | |||||||||||
| Fluidez verbal semántica | 27 | 25 26 | 22-24 | 20- 21 | 15- 19 | 13 14 | 12 | 8 11 | 4 7 | 0-3 | ||||||
| Fluidez verbal fonológica | 17- 18 | 15- 16 | 13-14 | 9-12 | 7 8 | 5- 6 | 3 4 | 1 2 | 0 | |||||||
| Lectura y Escritura | Lectura | 3 | 2 | 1 | 0 | |||||||||||
| Dictado | 1 | 0 | ||||||||||||||
| Copiado | 1 | 0 | ||||||||||||||
| Funciones ejecutivas | Conceptuales | Semejanzas | 6 | 5 | 4 | 3 | 2 | 0-1 | ||||||||
| Cálculo | 3 | 2 | 1 | 0 | ||||||||||||
| Secuenciación | 1 | 0 | ||||||||||||||
| Motoras | Mano derecha | 2 | 1 | 0 | ||||||||||||
| Mano izquierda | 2 | 1 | 0 | |||||||||||||
| Movimientos alternos | 2 | 1 | 0 | |||||||||||||
| Reacciones opuestas | 2 | 1 | 0 | |||||||||||||
| 2.5 | 2 | 1.5 | 1 | 0.5 | 0 | -0.5 | -1 | -1.5 | -2 | -2.5 | -3 | -3.5 | ||||
Normal = 2.5 a -1 desviación estándar (DE); Moderado = -1.5 a -2.5 DE. Severo ≥ -3 DE. *Se muestran los valores de las puntuaciones naturales posibles en cada subtest cuya normalización se establece en el perfil según un rango de edad y escolaridad determinada, de acuerdo a Ostrosky y col. (1999). Se resaltan los datos de la paciente, quien obtuvo en 4 subtest puntajes con 3 desviaciones estándar por debajo de la media.
El subtest de secuenciación, perteneciente al rubro de funciones ejecutivas, consiste en una lámina con las siguientes figuras en una línea continua (O + OO ++ OOO…). Se trata de que el participante siga la secuencia al menos hasta los cinco círculos (O + OO ++ OOO +++ OOOO ++++ OOOOO +++++). La puntuación normal depende de la edad y educación particular, es decir, se escoje el perfil adecuado a esas variables. Si la edad del participante está entre 66 a 85 años, su nivel de escolaridad es de 5 a 9 años, y la respuesta que dio es incorrecta, el puntaje a otorgarle corresponde a hallarse a 1.5 desviación estándar por debajo de la media. Por otra parte, si la edad está entre 51 a 65 años y la escolaridad entre 5 a 9 o entre 10 a 24 años, la contestación correcta implica estar en la normalidad; en cambio, responder de forma incorrecta supone estar 3 desviaciones estándar por debajo de la media (Ostrosky y col., 1999).
Cuestionarios de calidad de sueño
Se administraron 2 cuestionarios para medir el sueño y el llenado de un diario de sueño durante dos semanas antes del registro. Aunque estos 3 instrumentos no tienen propiedades psicométricas, su uso representa una herramienta útil para establecer la percepción de la calidad del sueño por parte de los participantes.
El diario de sueño sólo lo llenaron apropiadamente dos sujetos controles y un participante con DCL, por lo que no se reportan los resultados de dicho instrumento.
El primer cuestionario se aplicó previo a la PSG a los 14 participantes y consistió en preguntas abiertas sobre cuántas horas duerme habitualmente y a qué hora se levanta y se acuesta habitualmente; y otras 2 preguntas de opción múltiple sobre cuánto tiempo se tarda en dormir (opciones: menos de 10 min; entre 11 min y 15 min; entre 16 min y 20 min; entre 21 min y 25 min; ente 26 min y 44 min y más de 45 min; y si su sueño es considerado bueno, regular o malo. El segundo cuestionario se aplicó solo a los 9 participantes en los que se pudo concluir el estudio de la PSG, inmediatamente en la mañana al terminar la prueba. Contenía 8 preguntas, 6 de ellas de tipo escala Likert de 0 a 10: 1. “mi sueño fue”: muy malo/muy bueno); 2. “mi sueño fue refrescante”: muy poco/muy refrescante; 3. “mi sueño fue”: muy ligero/muy profundo; 4. “Disposición de ánimo después de levantarse”: terrible/excelente; 5. “Tiempo para levantarse”: inmediatamente/mucho tiempo; 6. “Mi cama fue”: muy incómoda/cómoda. 7. Si fue muy incómoda, se debía especificar por qué; y 8. Si se quisiera dormir más horas, cuántas horas añadiría (Tabla 3).
Tabla 3 Medias y desviaciones estándar del cuestionario de calidad de sueño aplicado inmediatamente después del registro de la polisomnografía en el laboratorio.
| Pregunta | Grupo control (n = 3) | Grupo con deterioro cognitivo leve (n = 6) |
|---|---|---|
| 1. “Mi sueño fue”: muy malo/muy bueno | 8.27 ± 1 | 9.57 ± 1 |
| 2. “Mi sueño fue refrescante”: muy poco/muy refrescante | 9.33 ± 1 | 9.68 ± 0.6 |
| 3. “Mi sueño fue”: muy ligero/muy profundo | 8.87 ± 1 | 8.02 ± 4 |
| 4. “Disposición de ánimo después de levantarse”: terrible/excelente | 9.23 ± 1 | 9.63 ± 0.7 |
| 5. “Tiempo para levantarse”: inmediatamente/mucho tiempo | 2.87 ± 4 | 6.43 ± 9 |
| 6. “Mi cama fue”: muy incómoda/cómoda | 10 ± 0 | 9.72 ± 0.7 |
| 7. Si fue muy incómoda, se debía especificar por qué, pero todos dijeron que no fue incómoda | -- | -- |
| 8. Si se quisiera dormir más horas, cuántas horas añadiría | 1 participante expresó que dormiría 1 h | 2 mujeres añadirían 2 h cada una, y 1 más dijo que 3 h |
Del primer cuestionario de preguntas abiertas, se obtuvieron las frecuencias de las horas de sueño y se promediaron por cada grupo; se calculó la proporción de los participantes en cuanto a sus latencias para dormir y a su calidad subjetiva del sueño. Del segundo cuestionario, se obtuvieron los puntajes a cada pregunta y se calcularon los promedios por cada grupo.
Estudios psicofisiológicos
Los registros se efectuaron en el Instituto de Ciencias de la Salud (ICSa) de la UAEH, ubicado en el municipio de San Agustín Tlaxiaca, en el estado de Hidalgo, México. Se solicitó a los sujetos lavaran su cabeza con jabón neutro y no tomar cafeína o bebidas alcohólicas al menos 2 h previas al estudio. Se les pidió la no suspensión de sus medicamentos y fueron admitidos a las 4 p.m. De acuerdo con el Sistema Internacional 10/20, los 19 electrodos fueron colocados para medir el EEG: FP1, FP2, F3, F4, F7, F8, C3, C4, P3, P4, T3, T4, T5, T6, O1, O2, FZ, CZ, PZ (Figura 1), y cada uno fue referenciado a los lóbulos de las orejas cortocircuitados. En la parte frontal y central de la cabeza (no mostrado en la Figura 1) se ubicó el electrodo FPZ, que tiene como función servir como tierra para eliminar el ruido de los aparatos con respecto a los potenciales biológicos de interés. El EMG fue registrado con 2 electrodos localizados en el mentón y éstos fueron referenciados bipolarmente. Para medir los EOG, fueron colocados 2 electrodos, 1 a la izquierda y 1 a la derecha del canto del ojo; cada uno tenía la misma referencia que el EEG. Una vez ubicados los electrodos, los participantes realizaron varias tareas (Rosales-Lagarde y Martínez-Alcalá, 2021) en un orden contrabalanceado, es decir, el orden de las tareas varió de sujeto a sujeto para eliminar efectos del orden.
Polisomnografía (PSG)
Todos los sujetos se acostaron en su horario habitual de sueño, y se les comentó que durmieran ad libitum. Cualquier queja o sugerencia la debían expresar, incluyendo la necesidad de ir al baño.
El aparato MEDICID-5 (Neuronic) amplificó las señales de todos los electrodos. Se utilizaron los siguientes filtros: para el EEG, de 0.1 Hz a 70 Hz; de 10 Hz a 70 Hz para el EMG; de 0.3 Hz a 15 Hz para el EOG; y de 0.5 Hz a 30 Hz para los electrodos de la pierna en particular. La impedancia se mantuvo por debajo de 10 kΩ.
Los datos fueron digitalizados con una frecuencia de muestreo de 512 Hz, usando un convertidor de 12-bits, y fueron almacenados en una computadora con un disco duro por el software MEDICID-5, marca Neuronic de México.
Las etapas de sueño se clasificaron, de acuerdo con los lineamientos de la AASM (2007). Los alertamientos y los MPP se detectaron automáticamente usando el software del equipo Neuronic, siguiendo las instrucciones del Manual para el análisis de la PSG. De forma subsecuente, se revisaron visualmente los MPP y los alertamientos.
El porcentaje de sueño de cada etapa se calculó con respecto al tiempo total de sueño (TTS). El porcentaje de vigilia se calculó sobre el tiempo de registro total.
Los índices de alertamientos y de MPP fueron calculados al dividir el tiempo total en la etapa de sueño, sobre el número de eventos en él, para arrojar un índice de eventos/h de sueño para cada etapa y cada grupo.
Movimientos periódicos de las piernas
Se colocaron 2 electrodos bipolares para medir los MPP en los músculos tibiales de una pierna.
Consideraciones éticas
El Comité de Ética de la Coordinación de Investigación del ICSa de la UAEH aprobó el proyecto. A cada participante se le explicó el objetivo del estudio y firmó dos cartas de consentimiento informado siguiendo los lineamientos de la Declaración de Helsinki: una sobre la fase 1 y otra para la fase 2. Se les indicó que podían abandonar la evaluación en cualquier momento que lo desearan y ninguno abandonó el estudio de la PSG.
Análisis estadístico
Para los datos sociodemográficos, las escalas, los subtests, los cuestionarios y las variables polisomnográficas, se obtuvieron las frecuencias y/o proporciones, y en su caso promedios respectivos a cada grupo. Se calcularon pruebas estadísticas de U de Mann-Whitney encontradas en softwares especializados para comparar los puntajes entre los grupos. Se calcularon pruebas de Wilcoxon entre los alertamientos y los MPP de cada grupo. Se obtuvieron correlaciones de Spearman entre los índices para el grupo con DCL; para los controles esto no fue posible debido a que eran tres datos, menos de los cuatro requeridos para dicho análisis.
Para hacer los cálculos se utilizaron varios softwares: el Paquete estadístico para ciencias sociales (SPSS, por sus siglas en inglés: Statistical Package for the Social Sciences) versión 23, Excel de Microsoft y el programa estadístico “Estadis-1” del Dr. Daniel Zarabozo de la Facultad de Psicología de la Universidad Nacional Autónoma de México, de acceso gratuito.
RESULTADOS Y DISCUSIÓN
Características sociodemográficas
La edad promedio y el nivel de estudio (correspondiente a educación secundaria) no fue diferente significativamente (P > 0.05) entre ambos grupos de estudio (Tabla 4). Esto es importante porque ambos parámetros tienen incidencia sobre el SPI, el cual suele aumentar con la edad y en personas con menores niveles de escolaridad (Didriksen y col., 2017).
Tabla 4 Características sociodemográficas, clínicas y polisomnográficas de los adultos mayoresdivididos de acuerdo a su ejecución en la batería del Neuropsi.
| Parámetro evaluado | Control (n = 3) | Deterioro cognitivo leve (n = 6) | PruebaU | P | ||
|---|---|---|---|---|---|---|
| Media | DE | Media | DE | |||
| Edad | 70.3 | 8.6 | 68.5 | 3.8 | 11 | 0.69 |
| Educación (años) | 7.66 | 2.3 | 8.5 | 2 | 6.5 | 0.58 |
| MMSE (Evaluación Mini del Estado Mental, en español) | 28.6 | 1.1 | 26.6 | 3.1 | 12 | 0.49 |
| Neuropsi | 109.7 | 6.6 | 92.08 | 10 | 17 | 0.04 |
| TTS (min) | 398.6 | 52 | 354.2 | 103 | 6 | 0.54 |
| N1/TTS | 6.61 | 3.0 | 8.33 | 4 | 7 | 0.71 |
| N2/TTS | 57.11 | 6 | 60.26 | 7 | 7 | 0.71 |
| N3/TTS | 18.09 | 3.0 | 17.83 | 9 | 7 | 0.71 |
| MOR/TTS | 18.08 | 7 | 12.71 | 3 | 4 | 0.26 |
| VDIS | 57.5 | 27 | 49.38 | 69 | 10 | 0.90 |
| Latencia al sueño (min) | 14.97 | 9.8 | 10.37 | 11 | 13 | 0.38 |
| Latencia a MOR (min) | 86.5 | 33 | 82.2 | 46.3 | 9 | 1 |
| Eficiencia de sueño | 80.45 | 6.0 | 84.05 | 11.08 | 4 | 0.26 |
| MPP (movimientos periódicos de piernas) | 241 | 180 | 277.50 | 143 | 6 | 0.54 |
| MPP/h | 29.06 | 21 | 44.88 | 26 | 6 | 0.54 |
| Alertamientos | 109 | 88 | 127 | 60 | 6 | 0.54 |
| Alertamientos/h | 16.69 | 13 | 23.14 | 12 | 7 | 0.71 |
| N1 alertamientos/h | 21.28 | 22 | 22.98 | 16 | 8 | 0.90 |
| N2 alertamientos/h | 21.39 | 19 | 29.5 | 16 | 6 | 0.54 |
| N3 alertamientos/h | 3.92 | 2.0 | 13.19 | 9 | 2 | 0.09 |
| MOR alertamientos/h | 12.28 | 4 | 9.82 | 6 | 6 | 0.54 |
TTS, Tiempo total de sueño; N1, Etapa 1; N2, Etapa 2; N3, Etapa 3; MOR, sueño de movimientos oculares rápidos; VDIS, Vigilia después del inicio de sueño.
Mini Evaluación del Estado Mental (MMSE)
Los resultados de esta evaluación no arrojaron diferencias significativas (P > 0.05) entre ambos grupos (grupo control: 28.6 ± 1.1; grupo con DCL: 26.6 ± 3.1). El puntaje más bajo fue de 21, correspondiente a un diagnóstico de DCL, de acuerdo con el MMSE realizado en la fase 1, el cual se presentó en una participante que adicionalmente manifestó el mayor número de antecedentes neurológicos de riesgo del grupo, pero con la capacidad manifiesta para realizar de forma independiente sus actividades en la vida cotidiana.
Batería Neuropsi
En este estudio se observó a 6 adultos mayores con 3 desviaciones estándar por debajo de la media en alguno de los subtest del Neuropsi, por lo que se consideraron con diagnóstico afirmativo de DCL. Existieron diferencias significativas (P < 0.05) entre las medias de los puntajes globales y de las funciones ejecutivas de ambos grupos (Tabla 5), lo cual está de acuerdo con otros estudios en los que se detectaron fallas en los adultos mayores con DCL a nivel frontal (Rosales-Lagarde y Martínez-Alcalá, 2021), ya que las regiones frontales están especializadas en iniciar, mantener, supervisar y finalizar acciones particulares (Bembibre y Arnedo, 2013).
Tabla 5 Promedios y desviaciones estándar, así como valores de las comparaciones de acuerdo con la U de Mann-Whitney de los puntajes de las funciones neuropsicológicas según la batería del Neuropsi.
| Parámetro evaluado | Control (n = 3) | Deterioro cognitivo leve (n = 6) | Prueba U | P | ||
|---|---|---|---|---|---|---|
| Media | DE | Media | DE | |||
| Puntaje global | 109.7 | 6.6 | 92.08 | 10 | 17 | 0.04 |
| Orientación | 6.0 | 0 | 5.66 | 0.5 | 6 | 0.37 |
| Atención y concentración | 22.33 | 2 | 18.33 | 4 | 3.5 | 0.18 |
| Memoria | 38.3 | 2 | 30.1 | 5 | 2.5 | 0.16 |
| Lenguaje | 23 | 1 | 21 | 2 | 3.5 | 0.26 |
| Lectura/escritura | 4.3 | 1 | 4.6 | 0.5 | 8 | 0.87 |
| Funciones ejecutivas | 15.6 | 0.5 | 11.6 | 2 | 0.5 | 0.03 |
De los 6 participantes con DCL, el 33.3 % presentaron DCL-a, 50 % DCL-na y 16.6 % DCL-dm (Tabla 6). En la prueba de secuenciación, se obtuvo de todos los participantes una respuesta por debajo del valor estándar considerado normal, lo que sugiere la necesidad de llevar a cabo más estudios sobre este tema, puesto que la falta de entendimiento de la implicación que poseen esos puntos suspensivos en la prueba podría deberse a una falla menor en el índice de comportamiento lector. Al respecto, es necesario considerar que el presente estudio se realizó en Hidalgo, el cual es un estado con mayor índice de pobreza que la Ciudad de México, de acuerdo al Consejo Nacional de Evaluación de la Política de Desarrollo Social (CONEVAL, 2020). En la Ciudad de México se obtuvieron las normas del Neuropsi (Ostrosky y col., 1999). Usualmente a mayor pobreza suele haber menor nivel de alfabetización y mayores índices de DCL (Rosales-Lagarde y col., 2020).
Tabla 6 Principales características sociodemográficas y polisomnográficas de los sujetos de estudio.
| Pacientes del grupo control | Pacientes con DCL | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | DCL-a | DCL-na | DCL-dm | ||||
| 1 | 2 | 1 | 2 | 3 | 1 | ||||
| Nivel educativo | 9 | 9 | 5 | 11 | 9 | 9 | 8 | 5 | 9 |
| Edad | 61 | 72 | 78 | 65 | 63 | 71 | 73 | 68 | 71 |
| Sexo | F | F | F | M | F | M | M | F | F |
| MMSE (Evaluación Mini del Estado Mental, en español) | 28 | 30 | 28 | 25 | 29 | 28 | 29 | 28 | 21 |
| Neuropsi | 114 | 113 | 102 | 87 | 85 | 111 | 96 | 85 | 83.5 |
| MPP (movimientos periódicos de las piernas) | 299 | 385 | 39 | 220 | 119 | 338 | 205 | 533 | 250 |
| MPP/h | 35.80 | 46.05 | 5.32 | 21.93 | 16.92 | 54.87 | 27.04 | 70.87 | 77.63 |
| Alertamientos | 46 | 211 | 71 | 139 | 51 | 131 | 98 | 233 | 110 |
| Alertamientos/h | 6.13 | 31.57 | 12.35 | 22.15 | 7.82 | 23.70 | 13.01 | 33.39 | 41.50 |
El criterio actual sobre DCL, en su modalidad de no demencia, es que el participante presente puntuación por debajo de la media en al menos dos pruebas (Barroso y col., 2013; Montoro y col., 2013). En el presente estudio, la mayoría de la muestra obtuvo ese puntaje bajo en la prueba de secuenciación y en otro subtest.
Los resultados obtenidos por las pruebas neuropsicológicas permitieron establecer que los participantes presentaron DCL incipiente. Aunque no se realizó un estudio longitudinal para comparar sus puntajes, en la demencia tipo Alzheimer y en la frontotemporal hay afectación en la vida independiente (Barroso y col., 2013; Montoro y col., 2013). En cambio, en el presente estudio, no la hubo. Además, sólo uno de los participantes manifestó afectación subjetiva de la memoria.
Calidad del sueño reportada antes y después de la noche en el laboratorio
En ambos grupos se presentaron pocas quejas de calidad de sueño, y reportaron dormir 7 h u 8 h, con excepción de la mujer señalada con DCL en la prueba de MMSE, que refirió dormir 5 h y que “daba saltos en la cama” (fue incluida en el grupo con DCL, evaluado mediante Neuropsi). Adicionalmente, una participante del grupo control mencionó que una vez a la semana no podía dormir y otra, del mismo grupo, que se acostaba y no podía dormir o se dormía y se despertaba temprano debido a preocupaciones, con una frecuencia de una vez al mes.
Sobre la latencia al sueño, en el grupo control, 2 adultas mayores reportaron tardarse menos de 10 min en esta fase y 1 más entre 21 min a 25 min.
Del grupo con DCL (n = 6), 2 hombres reportaron tener una latencia corta de sueño de menos de 10 min; 2 mujeres entre 11 min a 15 min; 1 hombre de 16 min a 20 min y la latencia para la participante con más antecedentes neurológicos fue de 1 h. Del grupo control 1 adulta mencionó dormir bien y 2 de forma regular. En el grupo con DCL, una dormía de forma regular (la mujer con más antecedentes neurológicos) y los demás dijeron dormir bien.
El cuestionario aplicado para evaluar la calidad del sueño, actividad que realizaron en el laboratorio, inmediatamente después del monitoreo de su actividad polisomnográfica, indicó que en ambos grupos, se presentó un sueño de muy buena calidad (Tabla 3).
A la participante con mayores antecedentes neurológicos se le notificó que tenía una gran cantidad de MPP y se le preguntó si tenía sensaciones dolorosas. Ella manifestó nuevamente que “saltaba en la cama” pero no mencionó que tuviera dolores o sensaciones anómalas en las piernas y añadió que roncaba desde hacía 10 años.
Polisomnografía
En la Tabla 4 pueden observarse las características sociodemográficas y polisomnográficas de los participantes y el grupo en el que fueron clasificados control o los diferentes tipos de DCL. Se observa que no hubo diferencias significativas (P > 0.05) entre los índices totales de alertamientos, ni de MPP entre los dos grupos y tampoco manifestaron en los cuestionarios quejas subjetivas para diagnosticar el SPI. En el reporte de Leng y col. (2016), en una muestra considerable de 2 636 adultos mayores hombres, aquellos quienes presentaron problemas en una prueba neuropsicológica y tuvieron 30 MPP o más, eventualmente tendieron a desarrollar DCL. En el presente estudio algunos de los participantes presentaron valores más elevados a los reportados en dicha investigación: una de las participantes control tuvo 31.57 MPP/h y dos adultas mayores del grupo con DCL, 33.39 MPP/h y 41.50 MPP/h (Tabla 6). Un seguimiento longitudial permitiría una comparación con el estudio de Leng y col. (2016) para conocer quiénes sí desarrollaron eventualmente el DCL o la demencia.
Aunque una línea de investigación se ha centrado en las funciones cognitivas alteradas entre los pacientes con el SPI (Fulda y col., 2010; Galbiati y col., 2015; Cha y col., 2017; Zhang y col., 2018), hasta donde se tiene conocimiento, hay un único estudio sobre el DCL y los MPP (Leng y col., 2016) y no hace referencia al SPI ni a los alertamientos. En cambio, otras investigaciones se han focalizado en la actividad del sueño de MOR y el funcionamiento neuropsicológico en los pacientes con DCL (Chen y col., 2011; Brayet y col., 2015; Rosales-Lagarde y col., 2018; 2019).
La asociación entre los índices de alertamientos y de MPP del grupo con DCL fue altamente significativa (coeficiente de correlación de Spearman = 0.94, P = 0.05). A pesar de ser una muestra pequeña, en el grupo con DCL se pudo observar una cantidad mayor de MPP en comparación con los alertamientos (Figura 8), ya que existieron diferencias estadísticamente significativas entre el índice total de alertamientos/h y los MPP/h, de acuerdo a la prueba de Wilcoxon (Z = - 2.20, P < 0.02).
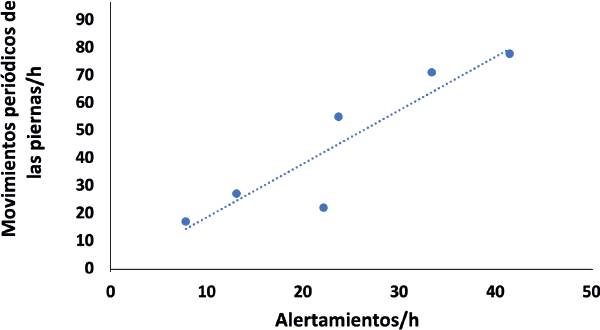
Figura 8 Correlación positiva significativa entre los índices por hora de alertamientos y de los de movimientos periódicos de las piernas en el grupo con deterioro cognitivo leve (DCL) durante el registro de la polisomnografía nocturna. Se trata de la correlación de Spearman = 0.94, P < 0.05.
La aparición y asociación positiva de altos índices de alertamientos y de MPP, en especial de estos últimos, podrían conducir a una fragmentación de sueño aún mayor. En el grupo con DCL, el mayor índice de MPP y de alertamientos de algunos participantes (Tabla 6) probablemente indica una falla en los mecanismos catecolaminérgicos y colinérgicos del sueño (Corsi-Cabrera, 2018).
En la paciente con más antecedentes neurológicos, las ejecuciones en el MMSE y el Neuropsi se encuentran vulneradas y existe un índice mayor de MPP y de alertamientos/h.
Se observó a un participante del grupo de DCL con puntajes globales altos en el MMSE e incluso en el Neuropsi, con índices elevados de MPP y alertamientos/h (Tabla 4), pero con quejas subjetivas de memoria y un subtest con un puntaje con 3 desviaciones por debajo de la media. En este sentido, es conveniente evaluar con baterías neuropsicológicas completas y normalizadas como el Neuropsi en contraste con las de cribado como el MMSE.
Los medicamentos ingeridos por los adultos mayores no eran psicofármacos o neurofármacos prescritos para dormir (Tabla 1) y no están reportados con capacidad de influir significativamente en su sueño y tampoco se sabe que tengan el efecto adverso de modificarlo. Es decir, se trató de adultos mayores con control médico de sus padecimientos.
El hallazgo sobre los altos índices de alertamientos y de MPP en una de las adultas mayores del grupo control puede ser sugerente de un riesgo mayor de desarrollar DCL, en comparación con otras de las participantes controles. Es la adulta mayor que sí tiene más de los 30 MPP/h, mencionada previamente.
La edad es una de las variables altamente influyente y predictoras del DCL, por lo que las pacientes controles y en especial aquellas con antecedentes neurológicos, tienen un riesgo alto de desarrollar DCL en etapas posteriores al estudio (Gutiérrez-Robledo y col., 2017).
El síndrome obstructivo de apnea puede incrementar el índice de alertamientos en el sueño MOR entre los grupos, pero no fue el caso porque los pacientes no lo declararon ni manifestaron (Durán y col., 2015). Sin embargo es importante señalar que no se registraron los eventos respiratorios de apneas/ hipoapneas que presentaron los participantes durante el estudio en el laboratorio.
Los MPP se encuentran presentes en hasta el 80 % de los casos de SPI. Sin embargo, un porcentaje mucho menor de pacientes con una evidencia PSG de MPP (22.5 %) tienen un SPI comórbido con otros trastornos del sueño y diversas afecciones médicas (cardiacas, hepáticas, renales, diabetes, migraña) y varios trastornos neurológicos y psiquiátricos importantes (Drakatos y col., 2021).
El índice de alertamientos/h de sueño es de 14.9 a 18.27 en personas con 50 a 64 años de edad y de 15.3 a 22.3 para aquellas con 65 a 79 años (Boselli y col., 1998; Jaimchariyatan y col., 2015; Boulos y col., 2019). En el presente estudio 1 mujer del grupo control sobrepasó el límite superior de 22.3 alertamientos/h, en tanto que, 2 participantes del grupo con DCL lo sobrepasaron por 10 y 20 puntos.
Los altos índices de alertamientos, asociados con elevados índices de MPP, pueden conducir a una severa fragmentación de sueño de quienes lo sufren, con serias afectaciones a su salud. Se ha reportado que la tasa de MPP: alertamientos suele ser de 3:1 (Drakatos y col. 2021), pero en el presente estudio la relación promedio encontrada fue cercana a 2.2: 1 (Tabla 4). Esta disminución en el valor de la tasa encontrada podría estar relacionada con pocas fallas subjetivas en el sueño, menores eventos cardiacos asociados a los MPP y a que la muestra estuvo constituida en especial por mujeres (Koo y col., 2011). Es necesario reproducir el estudio en una muestra mayor y determinar la secuencia, duración exacta e intervalos de los fenómenos descritos (Pollmächer y Schulz, 1993; Boehm y col., 2009).
CONCLUSIONES
Los resultados preliminares obtenidos señalan la estrecha relación que tienen los movimientos periódicos de piernas (MPP) con los alertamientos, aunado a un índice mayor de MPP con respecto a los alertamientos en el grupo con deterioro cognitivo leve (DCL). Es necesario continuar evaluando si ambos fenómenos podrían servir como marcadores tempranos de la fragmentación de sueño asociada al DCL y a la demencia.











 nueva página del texto (beta)
nueva página del texto (beta)



