INTRODUCCIÓN
Las frutas y hortalizas frescas son productos perecederos, susceptibles a sufrir deterioro físico, fisiológico y bioquímico. Su calidad disminuye durante el manejo poscosecha, lo que afecta la comercialización (Nayak y col., 2019). El deterioro se debe principalmente a daños provocados por insectos, hongos o bacterias. Sin embargo, las pudriciones bacterianas y fúngicas son las que causan la mayor pérdida (Dukare y col., 2018; Singh y col., 2022), ya que alteran la fisiología del fruto, debido en parte, a un incremento de la producción de etileno y de la respiración.
En papaya (Carica papaya L.), al igual que en otros frutos tropicales de importancia comercial, la descomposición por antracnosis, debida al hongo Colletotrichum gloeosporioides, es la causa más importante de grandes pérdidas económicas (Ayón-Reyna y col., 2017). El género Carica agrupa 21 especies (Badillo y Leal, 2019), entre las que destaca C. papaya por su importancia comercial (Cunha y col., 2018). Los frutos se caracterizan por ser climatéricos, con altas tasas de respiración y producción de etileno. Su exocarpio es delgado y frágil, por lo tanto, el fruto es perecedero y susceptible al ataque de hongos, con una vida de anaquel corta (1 a 3 semanas), según su manejo (pre y poscosecha) y las condiciones climáticas del lugar de producción (Vela-Gutiérrez y col., 2016).
Para evitar el daño causado por hongos en productos hortofrutícolas, existen estrategias de control, entre las que destaca la aplicación de fungicidas químicos. Sin embargo, su uso se ha restringido debido a los efectos adversos ocasionados en humanos y en el ambiente (Alam y col., 2017). Además de que, la utilización indiscriminada de dichos agroquímicos ha propiciado la generación de fitopatógenos resistentes (Rodríguez-Delgado y col., 2019). Ante esta problemática, se ha iniciado el estudio de fungicidas naturales (extractos vegetales) (Alam y col., 2017).
Sharma y Tripathi (2006) consideran que, dentro de los extractos vegetales, los aceites esenciales obtenidos de cítricos son una alternativa en la industria de alimentos, por su actividad antifúngica, ser de origen natural y amigables con el ambiente. Se ha reportado la incorporación de aceites esenciales a una matriz de recubrimientos biodegradables para el control de microorganismos y aumento de la vida de anaquel de productos hortofrutícolas (Ramos y col., 2010). Una película biodegradable, aplicada por inmersión, sobre un alimento fresco puede permitirle mayor vida de anaquel y conservar su calidad, al regular la migración de humedad, oxígeno y CO2 sin afectar a los compuestos antioxidantes, aroma y sabor; además de en ocasiones servir también como empaque (Fernández y col., 2015). Los materiales para la elaboración de recubrimientos biodegradables son numerosos, entre ellos destacan los polímeros de origen natural obtenidos mediante el aprovechamiento de productos subutilizados, tales como el quitosano, derivado de la quitina, la cual se obtiene de forma comercial principalmente del caparazón de crustáceos (Philibert y col., 2016). El quitosano es un producto natural no tóxico y biodegradable. Su uso en la conservación de frutas y hortalizas durante el almacenamiento poscosecha, reduce el desarrollo de pudriciones por Botrytis cinerea, Penicillium expansum, Penicillium digitatum, Aspergillus niger, Rhizopus stolonifer, entre otros (Yuan y col., 2016; Bauer y col., 2022).
El objetivo de esta investigación fue elaborar un recubrimiento biodegradable a base de quitosano adicionado con aceite esencial de cítricos para evaluar su efecto en las propiedades físico químicas, fisiológicas e inhibición del crecimiento de Colletotrichum gloeosporioides en frutos de papaya (Carica papaya L.) en poscosecha.
MATERIALES Y MÉTODOS
Extracción de aceite esencial
Se recolectaron frutos de tres especies de cítricos: naranja (Citrus sinensis), mandarina (Citrus reticulata), y toronja (Citrus paradisi), sin daños físicos o presencia de enfermedades, en el municipio de Tuxpan, Veracruz, México. La extracción del aceite esencial del exocarpio de cada especie se realizó por hidrodestilación en una trampa Clevenger por 4 h. Las trazas de humedad en los aceites obtenidos se retiraron mediante la adición de Na2SO4 anhidro, y se almacenaron en refrigeración a 4 °C ± 2 °C. Se calculó el rendimiento (%) de aceite esencial por especie.
Aislamiento de C. gloeosporioides
El hongo se aisló de frutos de papaya (C. papaya var. Maradol) con lesiones características visuales de antracnosis (círculos concéntricos y mancha oscuras), de acuerdo con lo descrito por Acosta y col. (2001). Los frutos se adquirieron en un mercado local del municipio de Texcoco, Estado de México. Se obtuvieron fragmentos (5 mm x 5 mm) de la superficie infestada de los frutos de papaya. Cada fragmento se sembró en medio de cultivo Papa Dextrosa Agar (PDA, BD Bioxon®), con un periodo de incubación por 3 d, a una temperatura de 28 °C ± 2 °C (Acosta y col., 2001). Se tomó una muestra pequeña del hongo y se observó al microscopio (Olympus CX3I, Tokyo, Japón), comparando la forma de micelios y de conidios con los reportados en la literatura (Barnett y col., 1998). Una vez identificado el hongo se procedió a purificar la cepa. Se tomó una muestra del hongo en desarrollo para obtener un cultivo monoconidial, según la técnica de dilución descrita por Acosta y col. (2001), con la finalidad de obtener un inóculo monospórico puro (IP) proveniente de una sola espora. Cabe mencionar que no se realizó la caracterización molecular del hongo.
Bioensayo in vitro de los aceites esenciales
Se utilizó el método de Kirby-Bauer modificado (Bauer y col., 1966). Se colocaron 4 círculos de papel filtro esterilizados (6 mm de diámetros) equidistantes, impregnados con 15 μL de aceite esencial por especie. Se sembró una alícuota de 100 μL de la suspensión de conidios (3.77 x 108 UFC/mL) de la cepa fitopatógena en un medio de cultivo Papa Dextrosa Agar (PDA, BD Bioxon®), según el método descrito por Acosta y col. (2001). Se utilizó agua destilada esterilizada como control negativo y un fungicida químico Amistar® (azoxistrobin: Metil (E)-2-2-6-(2-cianofenoxi) pirimidin-4-iloxifenil-3-metoxiacrilato) como control positivo.
Se realizaron cuatro repeticiones por cada tratamiento, en total se obtuvieron 5 tratamientos, 3 aceites esenciales, un control negativo y un control positivo. Los tratamientos se incubaron a 28 °C ± 2 °C. A los 7 d de incubación se midieron los halos de inhibición de crecimiento del hongo (mm) con un pie de rey (Calibrador Vernier® Mitutoyo 530, Kanagawa Japón). Se promediaron 2 diámetros perpendiculares de cada uno de los discos. Se determinó el porcentaje de inhibición (% I) de los aceites esenciales, mediante la fórmula:
Determinación del grado de desacetilación del quitosano
Se determinó por el método potenciométrico de titulación (Yuan y col., 2016). Se pesaron 0.25 g de quitosano, se le adicionaron 10 mL de ácido clorhídrico (HCl) 0.3 M y se agitó hasta disolver. La muestra se tituló utilizando hidróxido de sodio (NaOH) 0.1 N, y se midió el cambio de pH por cada mL de NaOH añadido, hasta un volumen igual a 50 mL. Se realizó una gráfica de pH vs mL de NaOH y se calculó la diferencia entre los puntos de inflexión de la gráfica. El porcentaje de desacetilación se determinó mediante la ecuación, que expresa la cantidad de grupos aminos (NH2) formados:
Donde:
y: punto de inflexión mayor en la gráfica de la primera derivada.
x: punto de inflexión menor en la gráfica de la primera derivada.
f: normalidad de la solución de NaOH. w: peso en gramos de la muestra.
16.1: factor cuyo valor está relacionado con el peso equivalente.
Preparación del recubrimiento biodegradable
Las características del quitosano utilizado fueron: peso molecular 127 x 10 g/mol, tamaño de partícula 0.4 mm < 50 %, masa 1 mm; solubilidad > 99.9 %; fuente, caparazón de jaiba (Callinectes sp). El recubrimiento se preparó de acuerdo con el método propuesto por Hernández-Ochoa y col. (2011) modificado, mediante la adición de ácido acético glacial 1.0 % (v/v) (JT Baker®), glicerol 0.5 % (v/v) y quitosano 1.0 % (p/v) (proporcionado por el Centro de Investigación y Desarrollo, Sonora, México) a 60 °C en agitación constante por 24 h. A la mezcla fría (35 °C) se le añadió el aceite esencial con mayor efecto antifúngico, en 3 concentraciones: 0.5 %, 1.0 % y 1.5 %, disuelto con Tween® 80 a 0.1 % (v/v). La mezcla se mantuvo en agitación constante por 7 h.
Inoculación del fruto de papaya y aplicación del recubrimiento
Los frutos de papaya (C. papaya var. Maradol) de tamaño uniforme (1 000 g a 1 200 g), sin daños físicos y libre de enfermedades, se obtuvieron de un cultivo de un huerto familiar ubicado en el municipio de San Pedro Pochutla, Oaxaca, México. Los frutos en estado de Maduración 2 (escala de maduración establecida por Santamaría y col. (2009a) se desinfectaron sumergiéndolos en hipoclorito de sodio (1.0 % v/v) por 5 min, se enjuagaron con agua destilada esterilizada y se secaron a temperatura ambiente. Se seleccionaron 5 áreas de la epidermis de cada fruto aleatoriamente, para aplicar una punción de aproximadamente 2 mm de profundidad, donde se inocularon 20 μL de la suspensión de esporas de C. gloeosporioides (1 x 108 conidios mL). Después de 2 h, a la epidermis se aplicó el recubrimiento biodegradable mediante una brocha (Camelus® 2”, BYP BCA20, Monterrey, México) y se dejaron secar por 30 min a temperatura ambiente. Se realizaron 4 tratamientos (recubrimiento conteniendo aceite esencial a 0.5 %, 1.0 % y 1.5 % y un tratamiento sin recubrimiento (testigo) con 6 repeticiones cada uno, dispuestos en un diseño completamente al azar. Los frutos se mantuvieron a 24 °C ± 2 °C por 10 d.
Características fisicoquímicas y parámetros de color
La pérdida de peso (%) del fruto y el pH de la pulpa se determinaron de acuerdo con la metodología de la Asociación de Químicos Analíticos Oficial (AOAC, por sus siglas en inglés: Association of Official Analytical Chemist) (AOAC, 1990). El contenido de sólidos solubles totales (SST) se estableció con un refractómetro manual (Atago N1) a 20 °C ± 2 °C. El resultado se reportó como porcentaje (%) de sólidos solubles.
El color del fruto se determinó mediante las mediciones de Luminosidad (L), ángulo de tono (Hue) y pureza de color o índice de cromaticidad (Chroma) en tres áreas de la epidermis. Las lecturas de L, a* y b* se obtuvieron con un colorímetro HunterLab (MiniScan XE Plus45/0-L, Reston, Virginia, EUA) para identificar las diferencias de color en forma numérica. Se realizó el cálculo de los parámetros Hue y Chroma con las siguientes ecuaciones:
Las mediciones se realizaron cada 2 d en cada fruto almacenado a 24 °C ± 2 °C por 10 d.
Firmeza del fruto
La firmeza se determinó por el método de punción mediante un texturómetro universal TA.XT2i (Stable Micro Systems UK, Surrey, RU) de base automática, con una punta cónica de 6 mm de diámetros, celda de 5 kg, velocidad de compresión de 0.5 mm/s y distancia de compresión de 10 mm. La firmeza se midió en la parte ecuatorial central de la papaya y se registró la fuerza de oposición del tejido a la penetración del punzón, en cinco regiones del fruto sin exocarpio. Los resultados se reportaron en newtons (N).
Evaluación de la tasa de respiración
Se seleccionaron tres frutos por tratamiento. Los frutos se colocaron en el interior de un frasco de vidrio por 1 h cada 24 h. Con una jeringa se extrajeron 5 mL de gas del espacio de cabeza del frasco, se guardaron en frascos BD Vacutainer® de 5 mL en congelación a - 4 ºC hasta su análisis (Santamaría y col., 2009a). Se inyectó 1 mL de cada muestra en un cromatógrafo de gases (Varian® Star 3 400, Palo Alto, California, Estados Unidos), equipado con una columna Hayesep Q 100/120 (1.8 m longitud x 3.2 mm diámetros) y detectores en serie de conductividad térmica (TCD, por sus siglas en inglés: Thermal Conductiviy Detector) para la cuantificación del contenido de CO2, y de ionización de flama (FID, por sus siglas en inglés: Flame Ionization Detector) para la determinación del contenido de etileno. Se utilizó helio como gas acarreador (flujo de 25 mL/min). La temperatura se mantuvo a 70 ºC en ambos detectores. Los resultados se calcularon a partir de curvas de calibración con estándares de concentración conocida de CO2 y etileno. Los resultados se expresaron en mL de CO2 kg /h y μL de etileno kg/h.
Severidad de daño en el fruto y efectividad de los recubrimientos
Para calcular el porcentaje de severidad de daño en los frutos de papaya se utilizó la fórmula:
Donde:
P = media ponderada de severidad.
n = número de lesiones por cada clase de la escala, esto con respecto a las características de la enfermedad, de acuerdo con grado 5 de daño con base a la escala establecida por Santamaría y col. (2011).
v = valor numérico de cada clase.
CM = categoría mayor.
N = número total de lesiones evaluadas.
Para calcular la efectividad biológica de los recubrimientos (%) se utilizó la fórmula de Abbott (1925):
Donde:
ET = efectividad del tratamiento.
IT = porcentaje de infección en el testigo.
It = porcentaje de infección en cada tratamiento.
Análisis estadístico
Los datos obtenidos para cada variable se sometieron a un análisis de varianza (ANOVA) sin restricciones, correspondiendo a un diseño completamente al azar. La comparación de medias se hizo de acuerdo con Tukey (P < 0.05), mediante el Sistema de Análisis Estadístico (SAS, por sus siglas en inglés: Statistical Analysis System) versión 9.1.3.
RESULTADOS Y DISCUSIÓN
Rendimiento de la extracción de los aceites esenciales
El exocarpio de Citrus reticulata (mandarina) proporcionó el mayor rendimiento de aceite esencial (0.15 %), seguido de C. sinensis (0.07 %) y C. paradisi (0.03 %). Lota y col. (2001) reportaron rendimientos de aceite esencial en 15 variedades de C. reticulata que fueron de 0.05 % a 0.6 % por kg de cáscara, lo cual concuerda con lo obtenido en la presente investigación. Por otro lado, Rojas-Fernández y col. (2014) mencionaron que la diferencia en los rendimientos de aceite esencial en cítricos se debe principalmente a la variabilidad genética entre especies y al método de extracción. Sin embargo, la composición por especie está también determinada por diferentes factores edafoclimáticos (luz, agua, temperatura, suelo), estacionalidad (temporada de producción y cosecha del fruto) y estado de madurez, que influyen en los procesos fisiológicos y bioquímicos o en las rutas metabólicas donde se sintetizan, produciendo modificaciones estructurales y concentraciones en los componentes del aceite esencial (Boaro y col., 2019).
Bioensayo in vitro de los aceites esenciales
El aceite de mandarina (C. reticulata) presentó un porcentaje de inhibición de crecimiento del hongo significativamente mayor (P < 0.05) que el de los otros cítricos evaluados y cercano al control positivo (Tabla 1). La diferencia observada de la actividad antifúngica de los aceites esenciales podría explicarse por una diferencia en el perfil o concentración de los metabolitos presentes en cada especie (Rabari y col., 2017). Dutra y col. (2016) reportaron 45 componentes en el aceite esencial de Citrus spp y al limoneno como el monoterpeno de mayor abundancia, y en menor proporción α- y β-pineno, linanol y terpineno. Estos autores identificaron a limoneno (94 %) y mirceno (1.6 % a 2.1 %) como los principales componentes del aceite esencial de C. sinensis, C. reticulata y C. paradisi.
Tabla 1 Halo de inhibición y porcentaje de inhibición in vitro de los aceites esenciales del exocarpio del fruto de tres especies de cítricos.
| Tratamiento | Halo de inhibición (mm) | Inhibición (%) |
|---|---|---|
| Citrus sinensis (naranja) | 19.4c | 23.7 |
| Citrus reticulata (mandarina) | 22.8b | 32.4 |
| Citrus paradisi (toronja) | 15.3d | 14.7 |
| Control positivo (fungicida químico) | 25.8a | 41.4 |
| Control negativo (agua destilada) | 0.0e | 0.0 |
| DHS | 2.8 | - |
Medias con letras diferentes en una columna difieren significativamente (Tukey, P < 0.05). DHS = Diferencia honesta significativa.
Los aceites esenciales de los cítricos evaluados mostraron notables propiedades antimicrobianas (Tabla 1). Aunque su mecanismo de acción aún no es totalmente conocido (Burt, 2004; Bosquez-Molina y col., 2010). Wang y col. (2019) mencionaron que el carácter hidrofóbico de los aceites esenciales se debe a la presencia de los terpenoides volátiles de bajo peso molecular que, de manera sinérgica, pueden interactuar con los fosfolípidos de la membrana celular y de las mitocondrias, aumentando así su permeabilidad, pérdida de la integridad de membrana y la disipación del gradiente de iones, como el Ca+2. En conjunto, todos estos efectos provocan la liberación de otros constituyentes intracelulares que interfieren en muchos procesos biológicos (Sharifi-Rad y col., 2017), induciendo en consecuencia la muerte celular. También se ha reportado que la penetración de los aceites esenciales puede afectar la función de las proteínas y enzimas incrustadas en la membrana (Rabari y col., 2017).
Grado de desacetilación del quitosano
Hernández y col. (2009) indicaron que el valor óptimo de desacetilación para el quitosano debe ser mayor a 50 %, aunque el quitosano comercial presenta un porcentaje de desacetilación superior a 60 %. Esto concuerda con el resultado obtenido de la muestra de quitosano analizado en este estudio que fue de 57.1 %. Al respecto, Araya y Meneses (2010) mencionaron que la variación del grado de desacetilación se debe a la presencia de grupos amino libres en quitosanos de diferentes crustáceos. Por otro lado, Calero y col. (2013), argumentaron que el grado de desacetilación del quitosano, comprendido entre 60 % y 98 %, es un parámetro determinante en la solubilidad o insolubilidad en medios acuosos, ya que se encuentra cargado positivamente en medios ácidos, siendo los grupos amino responsables de dicha densidad de carga (positiva) lo que favorece su solubilidad. Y el carácter hidrofílico e hidrofóbico del quitosano está asociado a las características estructurales que convierten al polímero en excelente estabilizador de emulsiones, además reduce la tensión superficial, actúa como espesante y pude formar películas con mejores propiedades viscoelásticas (Calero y col., 2013).
Características fisicoquímicas del fruto con recubrimiento
Los frutos con recubrimiento mostraron menor pérdida de peso durante los 10 d de almacenamiento, en comparación con los frutos sin recubrimiento (Tabla 2). A mayor concentración del aceite esencial hubo menor pérdida de peso, aunque solo el tratamiento con 1.5 % de aceite esencial redujo significativamente la pérdida de peso (P < 0.05) hasta un valor de 2.90 %. Este efecto podría deberse a que el incremento del contenido de aceite esencial confiere un aumento de la hidrofobicidad del recubrimiento, lo cual disminuye la transpiración y esta a su vez la pérdida de agua, ya que los recubrimientos actúan como una barrera de protección que evita el intercambio de gases con el ambiente, incluyendo al vapor de agua del fruto, lo que provoca una pérdida de peso más lenta (Télles-Pichardo y col., 2013).
Tabla 2 Efecto del recubrimiento en las características fisicoquímicas de la pulpa de papaya durante el almacenamiento (24 ºC ± 2 ºC).
| Días de almacenamiento | Tratamiento | Aceite esencial (%) | pH | Pérdida de peso (%) | SST (%) |
|---|---|---|---|---|---|
| 0 | T0 | 0.0 | 5.01a | 0.0 | 7.10a |
| T1 | 0.5 | 5.15a | 0.0 | 7.71b | |
| T2 | 1.0 | 4.92a | 0.0 | 7.80a b | |
| T3 | 1.5 | 5.10a | 0.0 | 7.81a b | |
| DHS | - | - | 0.34 | - | 0.20 |
| 10 | T0 | 0.0 | 6.29a | 4.50b | 11.46b |
| T1 | 0.5 | 5.90a | 3.70a b | 10.46a b | |
| T2 | 1.0 | 6.17a | 3.50a b | 11.03a b | |
| T3 | 1.5 | 6.50a | 2.90a | 9.61a | |
| DHS | - | - | 0.969 | 1.094 | 1.746 |
T0 = sin recubrimiento; T1 = aceite esencial (0.5 %); T2 = aceite esencial (1.0 %); T3 = aceite esencial (1.5 %). DHS = Diferencia Honesta significativa. SST = sólidos solubles totales.
a, bMedias con letras diferentes en una columna difieren significativamente (Tukey, P < 0.05).
En el presente trabajo se observó menor pérdida de peso que lo reportado por Télles-Pichardo y col. (2013), quienes evaluaron recubrimientos de cera de candelilla con polifenoles, aplicados en frutos de papaya almacenados a temperatura ambiente, y la pérdida de peso que encontraron fue aproximadamente de 5 % a partir del día 6. En tanto que, Miranda y col. (2014) obtuvieron pérdidas de peso de 9.54 % en el día 9, al aplicar recubrimientos a base de almidón de yuca al mismo fruto en condiciones similares de almacenamiento.
El recubrimiento de los frutos no afectó el valor de pH durante su almacenamiento (10 d a temperatura ambiente) (Tabla 2). Martínez-Tenorio y López-Malo (2011) encontraron un pH alcalino en frutos de papaya con recubrimiento y aceites esenciales a los 5 d y 7 d, en comparación con los que no tuvieron recubrimiento. Asimismo, Miranda y col. (2014) reportaron el aumento del pH a partir del día 9. Esto fue atribuido a una reducción del contenido de ácidos orgánicos presentes en el fruto, causado por la desaceleración de la actividad metabólica. El origen de este fenómeno lo atribuyeron a que las películas provacaron menor difusión del oxígeno, lo que pudo ocasionar el decremento de la oxidación metabólica.
El recubrimiento biodegradable con 1.5 % de aceite esencial redujo significativamente (P < 0.05) el contenido de sólidos solubles totales en el fruto tratado, con respecto al testigo, a los 10 d de almacenamiento (Tabla 2). Esta disminución podría deberse a la poca permeabilidad de la pared celular por la hidrofobicidad y mayor concentración del aceite, lo que evitó su ablandamiento y rompimiento de polisacáridos y mayor firmeza de los frutos del T3 (Dos-Passos-Braga y col., 2019). Aunque los cambios de azúcares en los frutos de papaya poscosecha aún no se encuentran completamente establecidos como posibles indicadores de calidad, es importante señalar que, el contenido de SST (10° a 11.5° Brix) permite evaluar el estado de madurez de consumo de la papaya var. Maradol (Santamaría y col., 2009a).
Parámetros de color
En frutos y hortalizas el color es parte de la calidad, por lo mismo, puede ser factor de preferencia, aceptación o rechazo por el consumidor y determinante del fracaso o éxito en la comercialización. En este trabajo, el valor de Hue, en la superficie de los frutos sin recubrimiento (testigo), presentó una mayor disminución (aproximadamente 50°) durante el almacenamiento, en comparación con los frutos con recubrimiento (aproximadamente 27º) (Figura 1A y Figura 2). Esta diferencia explica el cambio del color de la epidermis de verde a anaranjado en los frutos sin recubrimiento y de verde a verde-amarillo en los frutos tratados (Figura 2). La manifestación del color naranja durante la maduración de los frutos está relacionada con los cambios en el contenido de pigmentos, principalmente por la degradación de clorofilas, como consecuencia de procesos oxidativos y por la síntesis de otros pigmentos anaranjados y amarillos (carotenoides) (Shakya y Lal, 2018).

Figura 1 Variación en los indicadores de color: A) valores de hue; B) valores de chroma; C) valores de L en papaya durante el almacenamiento.
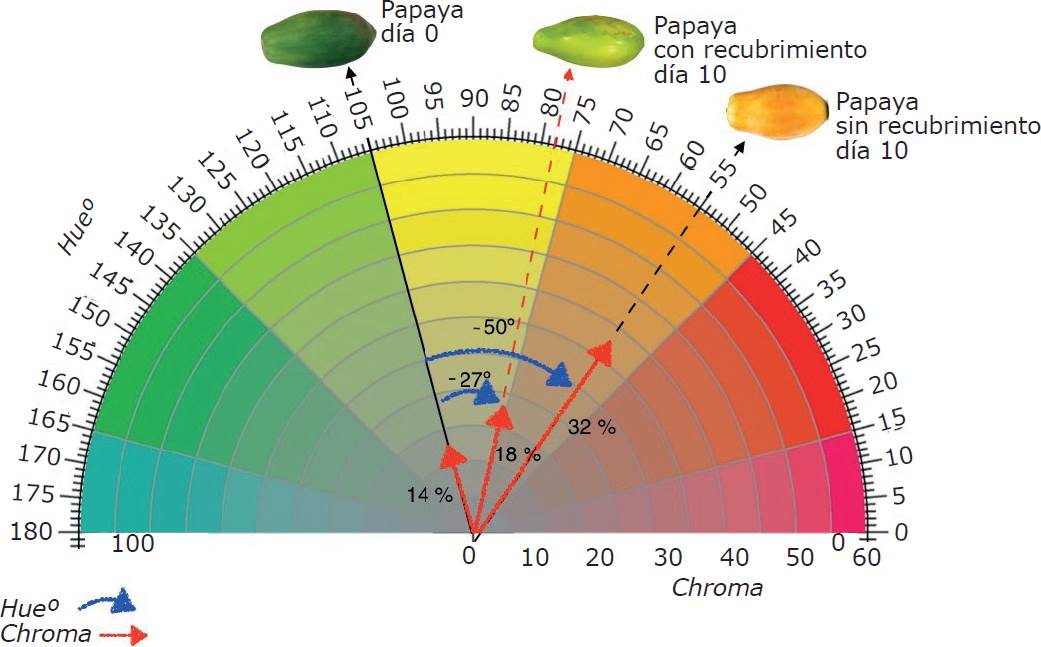
Figura 2 Variación en los indicadores de color (hue y chroma) en papaya con y sin recubrimiento a los 0 d y 10 d de almacenamiento.
La saturación de color (chroma) en la epidermis fue significativamente menor en los frutos con recubrimiento (Figuras 1B y Figura 2), que en los frutos sin recubrimiento después de los 6 d de almacenamiento. Valores mayores de chroma indican mayor intensidad de color y significan que el color es más definido. Es importante destacar que, aunque los frutos con recubrimiento mostraron valores bajos de chroma, esto no implica que perderán su atractivo para el consumidor, ya que, en esta etapa, el retraso en la instalación del color naranja intenso característico del fruto, se asocia con una instalación tardía de la maduración, es decir, una mayor vida de anaquel. El contenido de aceite esencial en el recubrimiento no afectó los valores de chroma de la epidermis de los frutos, ya que no se encontró diferencia significativa entre los tratamientos T1, T2 y T3.
Los valores de luminosidad (L) se incrementaron en los 4 tratamientos (T0, T1, T2 y T3) durante el almacenamiento (Figura 1C), pero fue mayor en la fruta sin tratamiento, seguido de la que contenía 1.5 % de aceite esencial (T3). Se observó un incremento en el cambio de color alrededor del día 6 en los frutos sin recubrimiento, que podría estar asociado con un inicio del proceso de maduración. El incremento de luminosidad también fue reportado por Santamaría y col. (2009b) al estudiar la madurez de consumo de papaya maradol después de la cosecha en condiciones de almacenamiento.
Firmeza
Se observó una tendencia decreciente en el valor de firmeza en fruta control (T0) en comparación con los tratamientos con recubrimiento (T1, T2 y T3) durante el almacenamiento. Este efecto está asociado a la maduración de los frutos, que induce su a blandamiento (Barragán-Iglesias y col., 2018), debido al proceso de desorganización de los tejidos; lo que provoca menor resistencia a la deformación. A los 10 d de almacenamiento se observaron diferencias significativas entre los frutos con y sin recubrimiento (Figura 3). Osuna-García y col. (2005) mencionaron que, a mayor retención del valor de firmeza, los frutos presentan mayor vida de anaquel, lo que contribuye, por un lado, a alcanzar mercados más distantes y por el otro a disminuir pérdidas. La firmeza inicial (148 ± 2 N) de los frutos, en todos los tratamientos, resultó similar (144 ± 5 N) a lo reportado por Sañudo y col. (2008). La firmeza de la pulpa de papaya var. Maradol entre 4.7 N y 6.9 N es indicador de madurez de consumo (Santamaría y col., 2009b). Utilizando la escala propuesta por Santamaría y col. (2009b), fue posible establecer que, los frutos tratados con las películas alcanzaron a los 10 d una madurez grado 4, menor a la del fruto control (grado 6), lo que indica una prolongación de la vida de anaquel.
Respiración
Los frutos sin recubrimiento presentaron un pico máximo (45.6 mg de CO2 kg/h) de producción de CO2 a los 6 d de almacenamiento (Figura 4A). Este patrón de respiración corresponde, como se esperaba, a un fruto climatérico, caracterizado por un patrón oscilatorio en la producción de CO2 y un aumento en la producción de etileno (Sañudo y col., 2008; Velasco-Ulloa y col., 2012).

Figura 4 Respiración en papaya durante el almacenamiento: A) producción de CO2 ; B) producción de etileno.
La producción de CO2 fue menor en los frutos con recubrimiento, con diferencias significativas en su tendencia oscilatoria (Figura 4A). El fruto con el T1 presentó un pico máximo en el día 6 y a partir de ahí se mantuvo con la mayor tasa de producción de CO2. Los frutos con T2 reportaron dos picos elevados los días 2 y 6, y su valor máximo el día 10. En tanto que los frutos con T3 presentaron un pico máximo el día 2 y después de alcanzar su mínimo el día 6 incrementaron su producción de CO2 hasta alcanzar el máximo el día 10. Este comportamiento sugiere que, aunque no perdieron su característica climatérica, los tratamientos disminuyeron sus tasas de respiración, con producción máxima de 27.9 mg de CO2 kg/h, retrasando la maduración, lo cual concuerda con los datos observados en los cambios de color, firmeza y SST.
Las concentraciones de CO2 fueron similares a las reportadas por Mercado-Ruiz y col. (2014), quienes utilizaron una composición diferente de recubrimiento (cera comestible) aplicado a frutos de papaya almacenados a temperatura ambiente por 12 d. Concluyeron que la producción de CO2 dependió principalmente de la variedad y de los componentes del recubrimiento. En el presente estudio, la aplicación del recubrimiento de quitosano y aceite esencial de cítrico permitió controlar la tasa de producción de CO2 (Figura 4A). No obstante, la aplicación de recubrimientos no siempre permite mejorar la vida de anaquel de un producto. Pontigo-Suárez y col. (2015) encontraron que la tasa respiratoria se elevó (165.4 mg de CO2 kg/h) y con ello la velocidad de maduración, en los frutos con recubrimiento a base de carboximetilcelulosa y aceite esencial de orégano, debido posiblemente al estrés que se provocó en los frutos durante la aplicación del recubrimiento.
La presencia de compuestos activos, añadidos a los recubrimientos, permiten retardar la senescencia del fruto. Esto se atribuye principalmente a la naturaleza hidrofóbica que se confiere al recubrimiento de la barrera física formada; a la modificación de la permeabilidad de la película, lo que permite regular la concentración de O2 y CO2 que recibe y libera el fruto; la reducción del número de poros por el cual el vapor de agua y otros gases se intercambian; y a la presencia de compuestos con actividad antioxidante y antifúngica (Télles-Pichardo y col., 2013).
Los recubrimientos en frutos actúan como una barrera semipermeable, modificando el intercambio gaseoso del interior de la fruta con el medio exterior, el recubrimiento provocó una disminución en la tasa respiratoria y transpiración, por lo tanto, una prolongación de la vida poscosecha de producto (Rahimi y col., 2019).
La producción de etileno se muestra en la Figura 4B. Los tratamientos control (T0) y T1 presentaron un comportamiento muy parecido, con un pico de producción de etileno (4.7 μL/kg/h y 5.3 μL/kg/h, respectivamente) a los 4 d, que no fue diferente significativamente (P < 0.05). En tanto que, los T2 y T3 presentaron un pico de etileno en el día 2 con disminución gradual al día 4 y 6, respectivamente, para volver a incrementar y alcanzar su máximo nivel. Este comportamiento coincidió con el de la oscilación de la tasa respiratoria que mostraron ambos frutos (Figura 4A). La variación de la producción de etileno en los frutos fue similar a lo reportado por Sañudo y col. (2008); y Santamaría y col. (2009a), con un patrón respiratorio observado para frutas climatéricas, con oscilaciones constantes durante el periodo de almacenamiento (Sañudo y col., 2008; Velasco-Ulloa y col., 2012).
Efectividad de los recubrimientos en el control C. gloeosporioides
La aplicación de los recubrimientos biodegradables en los frutos inoculados con C. gloeosporioides mostraron una reducción significativa de los síntomas de la enfermedad con respecto al testigo (mayor al 80 %) (Tabla 3). Las diferentes concentraciones del aceite esencial no mostraron diferencia significativa (P < 0.05) sobre los porcentajes de severidad y efectividad en la inhibición de C. gloeosporioides, por lo que, el efecto de los tratamientos posiblemente esté asociado más a la capacidad inhibitoria del quitosano, que de los aceites. El efecto inhibidor de este polímero depende de su concentración, el grado de polimerización de la cadena de glucosamina, el grado de desacetilación (en este estudio de 18.2 ± 2.9), el porcentaje de acetilación (57.1 %) e incluso, el tiempo de exposición sobre la célula fúngica (Hernández-Lauzardo y col., 2005). Es importante considerar que los hongos presentan diferente sensibilidad al quitosano y esto puede ser debido a la composición de fosfolípidos de membrana y particularmente a la naturaleza de sus cargas (Palma-Guerrero y col., 2008; Ramos y col., 2010). La interacción del quitosano con los grupos de cabeza de fosfolípidos cargados o las proteínas que componen la pared celular permite su capacidad para entrar e interactuar con el ADN y con ello, alterar su conformación e inhibir la síntesis de ARN y de proteína (El-Ghaouth y col., 1992; Hernández-Lauzardo y col., 2005). El uso del quitosano para el control de las enfermedades poscosecha promete ser una nueva alternativa de conservación de los productos hortícolas durante el almacenamiento sin riesgos ecológicos; sin embargo, es necesario continuar profundizando en los diferentes aspectos básicos que contribuyen a explicar el efecto de la aplicación de este biopolímero en las frutas y hortalizas. Dos-Passos-Braga y col. (2019) reportaron una disminución de 49 % a 100 %, en los síntomas de antracnosis en papaya, a 25 °C ± 0.5 °C durante 10 d, con un recubrimiento a base de quitosano (5 mg/mL) y aceite esencial de Mentha piperita L (1.25 μL/mL). En este estudio la disminución de síntomas de antracnosis varió de 80.7 % a 84 %, almacenados a una temperatura de 24 °C ± 0.2 °C durante 10 d (Tabla 3).
Tabla 3 Síntomas en frutos, porcentajes de severidad y de efectividad de los recubrimientos en frutos de papaya inoculados con C. gloeosporioides.
| Tratamiento | Síntomas en frutos | Severidad (%) | Efectividad (%) |
|---|---|---|---|
| T0 | Mancha circular, hundida, acuosa, color gris-negro | 97.1a | 0.0a |
| T1 | Mancha irregular, superficial, seca, color gris | 16.8b | 80.7b |
| T2 | Mancha irregular, superficial, seca, color gris | 18.8b | 84.0b |
| T3 | Mancha irregular, superficial, seca, color gris | 17.1b | 82.4b |
| DHS | - | 13.1 | 14.9 |
TO = sin recubrimiento; T1 = aceite esencial a 0.5 %; T2 = aceite esencial a 1.0 % y T3 = aceite esencial a 1.5 %.
a,bMedias con letras diferentes en una columna difieren significativamente (Tukey, P < 0.05).
Los porcentajes de control del hongo para los frutos con recubrimiento fueron de 60 %. Los resultados fueron similares a lo reportado por Bosquez-Molina y col. (2010), quienes lograron reducir 60 % la antracnosis en papayas con recubrimiento adicionado con aceite esencial de limón mexicano a 0.1 %. Los mismos autores observaron que la concentración de aceite esencial utilizado en la formulación del recubrimiento no fue un factor determinante en la reducción del desarrollo del hongo.
Integridad del recubrimiento
En todos los tratamientos con recubrimiento se observó un desprendimiento del mismo a los 10 d de almacenamiento (Figura 5). Varios factores pudieron ocasionar el desprendimiento, como la pérdida de peso del fruto, la naturaleza química de los componentes del recubrimiento y/o la concentración del aceite esencial en la formulación del recubrimiento. Pontigo-Suárez y col. (2015) observaron a los 7 d, el desprendimiento de los recubrimientos aplicados en papaya a base de carboximetilcelulosa y aceite esencial de clavo y canela, matriz diferente a la evaluada en la presente investigación. Por lo tanto, se requieren más estudios para mejorar las condiciones de aplicación de este tipo de recubrimientos en frutas y hortalizas, así como, evaluar las propiedades fisicoquímicas, mecánicas y térmicas que pudieran condicionar la calidad del fruto en relación con su vida de anaquel y preferencias de los consumidores.
CONCLUSIONES
El aceite esencial de Citrus reticulata registró mejor rendimiento y mayor actividad antifúngica in vitro contra Colletotrichum gloeosporioides en comparación con los aceites de C. sinensis y C. paradisi. Los frutos con recubrimiento presentaron mayor vida de anaquel respecto al control, el cual alcanzó su madurez en los 10 d que duró el estudio. El uso de recubrimientos biodegradables, combinando quitosano con aceite esencial de C. reticulata, aplicados en frutos de papaya en etapa poscosecha, demostró ser eficaz, por lo que podría ser una alternativa para darles mayor vida de anaquel por su capacidad de controlar la antracnosis, disminuir la pérdida de peso y firmeza, y retrasar el cambio de color de verde a anaranjado de la epidermis del fruto sin afectar la producción de sólidos solubles totales.











 nueva página del texto (beta)
nueva página del texto (beta)





