Introducción
En el mundo existen alrededor de 9 800 especies de aves, en su mayoría insectívoras (Ibarra y Cruzado, 2017;Nyffeler y col., 2018). Sin embargo, los ecosistemas están siendo alterados por acciones antropogénicas, reduciendo hábitats originales, lo que ha interrumpido procesos ecológicos, ocasionando la extinción de varias especies de aves (Da-Ponte y col., 2017; Guzmán-Manrique y Flórez-García, 2019;Xu y col., 2019).
México reporta cerca de 1 150 especies de aves, principalmente insectívoras (Ramírez-Albores, 2006; Morales-Martínez y col., 2018; Adame y col., 2019), ocupa el 11.° lugar de diversidad a nivel mundial y el 4.° lugar de endemismo (212 especies endémicas) (Navarro y col., 2014; Fuentes-Moreno y col., 2020). Sin embargo, debido a una alta presión provocada por el desarrollo industrial y agropecuario, varios ecosistemas se han visto alterados, causando la disminución y pérdida de diversidad, revelando 388 especies bajo alguna categoría de riesgo (Ramos y col., 2016; Ortiz-Pulido, 2018; López-Segoviano y col., 2019).
Los sistemas agroforestales (SAF) han resultado una forma sostenible de dar respuesta al problema de alteración de ecosistemas (Yashmita-Ulman y Kumar, 2018; García-Núñez y col., 2020;Perez y col., 2021). Entre las diversas funciones que ofrecen dichos sistemas de origen antropogénico está el generar un equilibrio entre la producción agropecuaria y la conservación de la biodiversidad a partir de la conexión ecológica (corredor biológico) de remanentes naturales fragmentados (Vilchez y col., 2017;Haggar y col., 2019;Marconi y Armengot, 2020).
Dado el arreglo espacial (vertical y horizontal) que presentan los SAF, se generan pequeños hábitats, regulando factores como el clima, la humedad y la temperatura, entre otros. Representan un papel importante como refugio para la vida silvestre, en el que probablemente las aves (particularmente insectívoras) pueden desempeñar un papel sustancial en el equilibrio de este ambiente, regulando poblaciones de insectos perjudiciales (García y col., 2015;Nell y col., 2018).
Cabe destacar que, dado el comportamiento ecológico de las aves, se presenta una gran relación en cuanto a las características de estructura y composición florística al momento de seleccionar su hábitat (Alonso y col., 2018;Perez y col., 2021). Se ha demostrado que estos dos elementos intervienen directamente en la riqueza de especies insectívoras y diferentes gremios tróficos para determinada zona (Cubley y col., 2020; Salas y Mancera-Rodríguez, 2020) debido a la disponibilidad de espacio, alimento, sitios de percha, áreas de nidación, predación, parasitismo de nidos y protección contra adversidades climáticas (Tomasevic y Marzluff, 2020). Con base en ello y dada la composición estructural que representan los diferentes tipos de SAF (tradicional, rústico, policultivo comercial, monocultivo sombreado y monocultivo sin sombra) (Villavicencio-Enríquez, 2012), posiblemente se logre albergar un gran número de aves insectívoras que podrían coadyuvar en los procesos ecológicos que se desenvuelven en este medio natural, tal como el control biológico de plagas (García-Flores y col., 2017;Sow y col., 2020).
En el municipio de Huatusco, Veracruz, México se encuentra ubicado un sistema de producción tradicional de café, inmerso en un Bosque Mesófilo de Montaña (BMM). Este sistema se constituye por diferentes tipos de vegetación (herbácea, arbustiva y arbórea), en un arreglo espacial que dispone de nichos en donde se podría albergar un gran número de aves, particularmente insectívoras. No obstante, a pesar de la importancia que representa dicho SAF en función de la conservación de especies, hasta el momento no se tienen investigaciones sobre la diversidad y uso de hábitat de estos organismos.
El objetivo del presente trabajo fue estimar y comparar la diversidad y uso de hábitat de aves insectívoras en sistemas agroforestales enclavados en un bosque mesófilo de montaña en Huatusco, Veracruz, México.
Materiales y métodos
El área evaluada se localiza en el municipio de Huatusco, Veracruz, México (19º 09’ N y 96º 57’ W. 1 933 msnm). Se determinaron 16 puntos de monitoreo distribuidos en tres hábitats: café-tradicional (CT; 6 puntos), potrero (PT; 6 puntos) y bosque mesófilo de montaña (BMM; 4 puntos), en una superficie total de 32.42 ha (Figura 1). En cada entorno se aplicó un muestreo sistemático a conveniencia con distancias lineales de 150 m entre cada punto. El seguimiento de aves se efectuó mensualmente, de agosto de 2018 a enero de 2019, empleando recuento en puntos con radio fijo de 25 m y búsqueda intensiva, en un horario de las 7 horas a las 16 horas del día. Este seguimiento se llevó acabo en los primeros 6 d de cada mes (Ponce y col., 2012;Alonso y col., 2018; Espejo y Morales, 2019). Conjuntamente, se emplearon Líneas de Canfield, aplicando ciertas modificaciones para conocer las variables del hábitat (Bueno y col., 2015). Se determinó índice de abundancia relativa (IAR). La riqueza de especies insectívoras se estimó mediante el índice de Jacknife1, la diversidad con Shannon-Wiener y la similitud con el índice de Jaccard; estos índices fueron empleados teniendo en cuenta el tipo de datos colectados (estocásticos), considerando lo descrito por Moreno (2001), quien propone a estos índices de mayor precisión y con menor sesgo (Molina y col., 2012; Pérez y col., 2015; Sandoval, 2019); los índices se obtuvieron a partir delsoftwareEstimates versión 9.1.0 (Colwell, 2013). Para determinar el estatus de conservación nacional e internacional se consultaron las bases de datos de La Convención sobre el Comercio Internacional de Especies Amenazadas de Fauna y Flora Silvestres (CITES, por sus siglas en inglés: The Convention on International Trade in Endangered Species of Wild Fauna and Flora), la Unión Internacional para la Conservación de la Naturaleza (IUCN, por sus siglas en inglés: International Union for the Conservation of Nature) y la NOM-O59-SEMARNAT-2010 (SEMARNAT,2010).
Para observar posibles diferencias estadísticamente significativas por cada índice (considerando los datos de cada monitoreo aplicado) e inferir si los datos obtenidos son los que potencialmente se encuentran en el área, se aplicaron análisis de Kruskal-Wallis yX2(Galicia y col., 2019), los cuales se obtuvieron mediante el Sistema de Analisis Estadistico (SAS, por sus siglas en inglés: Statistical Analisys System) (SAS, 2009) JMP IN versión 8.0.2. Para visualizar gráficamente la similitud entre la riqueza y la abundancia de especies detectadas por cada monitoreo realizado se efectuaron análisis de conglomerados (clúster), aplicando el método de Ward y la distancia euclídea como elementos de similitud y unión. Así mismo, con el fin de conocer qué componentes del hábitat y vegetación mostraban correlación con las aves enlistadas, se llevaron a cabo análisis de componentes principales; para ambos casos se utilizó el software estadístico XLSTAT versión 2018.7.5. (XLSTAT, 2018; Figueroa y col., 2019).
Resultados y discusión
Los muestreos permitieron identificar 52 especies de aves, 50 de ellas insectívoras (Cathartes aura y Coragyps atratusno formaron parte de este gremio trófico), considerando a todas a aquellas especies que integran, al menos temporalmente, un porcentaje de insectos en su dieta (Lopes y col., 2016;Nyffeler y col., 2018;Olsen y col., 2018; Sherry y col., 2020), 10 órdenes y 19 familias (Figura 2). Estos hallazgos concuerdan con investigaciones aplicadas en diferentes SAF, que encontraron el mismo número de especies, señalando a los SAF como un elemento que coadyuva a la conservación de dicho grupo taxonómico (Santos y col., 2013).
De las 50 especies insectívoras, 21 fueron observadas exclusivamente en el hábitat de café tradicional (CT), 11 solo en el entorno potrero (PT) y 5 en el bosque mesófilo de montaña (BMM). Del total de especies, 15 fueron migratorias, 35 residentes y 4 transitorias, siendo el hábitat de PT quien permite el arribo de un mayor número de especies migratorias, seguida del CT, con una especie menos (Tabla 1).
Tabla 1 Lista de especies registradas por cada condición evaluada.
| Especie | ID | CT | PT | BMM | Residencia | NOM-059 |
|---|---|---|---|---|---|---|
| Accipiter striatus | AccStr | 0 | 1 | 0 | MI | Pr |
| Amazilia cyanocephala | AmaCya | 2 | 0 | 0 | R | |
| Atlapetes albinucha | AtlAlb | 1 | 0 | 0 | R | E |
| Arremon brunneinucha | ArrBru | 0 | 0 | 1 | R | |
| Basileuterus lachrymosus | BasLac | 0 | 1 | 0 | R | |
| Bubulcos ibis | BubIbi | 0 | 2 | 0 | MI | |
| Cardellina canadensis | CarCan | 1 | 0 | 1 | T | |
| Cardellina pusilla | CarPus | 7 | 1 | 0 | MI | |
| Haemorhous mexicanus | HaeMex | 0 | 3 | 0 | R | |
| Cathartes aura* | CatAur | 0 | 1 | 0 | R | |
| Chlorospingus flavopectus | ChlFla | 3 | 0 | 1 | R | |
| Patagioenas nigrirostris | PatNig | 1 | 0 | 0 | R | Pr |
| Columbina passerina | ColPas | 1 | 0 | 0 | R | |
| Contopus pertinax | ConPer | 1 | 1 | 0 | R | |
| Contopus sordidulus | ConSor | 0 | 2 | 0 | MV, T | |
| Contopus sp. | ConSp | 0 | 1 | 0 | T | |
| Coragyps atratus* | CorAtr | 0 | 2 | 0 | R | |
| Cyanocorax morio | CyaMor | 5 | 1 | 0 | R | |
| Dives dives | DivDiv | 1 | 2 | 0 | R | |
| Empidonax sp. | EmpSp. | 3 | 2 | 1 | MI | |
| Eugenes fulgens | EugFul | 3 | 0 | 0 | R | |
| Euphonia hirundinacea | EupHir | 6 | 0 | 0 | R | |
| Glyphorhynchus spirurus | GlySpi | 0 | 0 | 2 | R | A |
| Leipidocolaptes souleyetti | LeiSou | 2 | 0 | 0 | R | |
| Leptotila verreauxi | LepVer | 1 | 0 | 0 | R | |
| Megarynchus pitangua | MegPit | 0 | 4 | 1 | R | |
| Melanerpes aurifrons | MelAur | 7 | 2 | 0 | R | |
| Melanerpes formicivorus | MelFor | 2 | 1 | 1 | R | |
| Melospiza lincolnii | MelLin | 0 | 2 | 0 | MI | |
| Mitrephanes phaeocercus | MitPha | 1 | 0 | 0 | R | |
| Mniotilta varia | MniVar | 3 | 1 | 0 | MI | |
| Molothrus aeneus | MolAen | 1 | 1 | 0 | MV | |
| Molothrus ater | MolAte | 1 | 0 | 0 | MI | |
| Myioborus miniatus | MyiMin | 1 | 0 | 0 | R | |
| Ortalis vetula | OrtVet | 2 | 0 | 0 | R | |
| Pheucticus chrysopeplus | PheChr | 1 | 0 | 0 | R | |
| Pheucticus ludovicianus | PheLud | 0 | 0 | 1 | MI, T | |
| Pionus senilis | PioSen | 2 | 0 | 0 | R | A |
| Psarocolius montezuma | PsaMon | 3 | 0 | 0 | R | Pr |
| Quiscalus mexicanus | QuiMex | 0 | 2 | 0 | R | |
| Ramphocelus sanguinolentus | RamSan | 1 | 0 | 0 | R | |
| Scaphidura oryzivora | ScaOry | 0 | 2 | 0 | R | |
| Setophaga occidentalis | SetOcc | 2 | 0 | 0 | MI | |
| Setophaga townsendi | SetTow | 1 | 0 | 0 | MI | |
| Sphyrapicus nuchalis | SphNuc | 2 | 2 | 0 | MI | |
| Sphyrapicus varius | SphVar | 1 | 0 | 0 | MI | |
| Spinus atriceps | SpiAtr | 0 | 0 | 1 | R | A |
| Spinus notatus | SpiNot | 1 | 0 | 0 | R | |
| Stelgidopteryx ruficolis | SteRuf | 0 | 1 | 0 | MI | |
| Thraupis abbas | ThrAbb | 1 | 0 | 0 | R | |
| Trogon collaris | TroCol | 0 | 0 | 1 | R | Pr |
| Volatinia jacarina | VolJac | 0 | 2 | 0 | R |
Residencia: Mi = migratoria de invierno, MV = migratoria de verano, R = residente, T = transitoria. NOM-059: Pr = protección especial, A = amenazada, E = endémica; *= No son especies insectívoras (se incluyeron como evidencia de su avistamiento para la discusión de futuros trabajos).
Los resultados permiten evidenciar que la estructura y composición florística de los potreros son elementos importantes que facilitan la llegada de especies migratorias, ofreciendo nichos ecológicos y espacios de utilización, tal como lo señalanWilcox y Murphy (1985);Tarbox y col. (2018);Chará y col. (2019); Morales y col. (2021), quienes además describen a estos sistemas bioproductivos como efecto de borde y/o corredor biológico, en donde se dispone de alimento, refugio y sitios de descanso que coadyuvan a la conservación de dicho grupo taxonómico; como lo describen la teoría de islas y de metapoblaciones (MacArthur y Wilson, 1967;Hanski, 1999; Sánchez y col., 2018;Huang y col., 2020). Estas teorías sugieren que la pérdida y fragmentación del hábitat, producto de diversos eventos intrínsecos y extrínsecos al sistema, podrían originar metapoblaciones faunísticas aisladas en los remanentes de vegetación natural, mismas que tendrían pocas probabilidades de viabilidad en el mediano y largo plazo, lo cual podría sugerir que el establecimiento de SAF y potreros como los explorados en la presente investigación podrían disponer condiciones que permitan establecer una conexión entre tales remanentes (parches), facilitando el flujo de germoplasma entre metapoblaciones, actuando como corredores biológicos locales, facilitando la llegada de especies migratorias e incluso permitiendo la coexistencia simpátrica de algunas especies de aves en la utilización de nichos específicos.
De acuerdo con la Norma Oficial Mexicana (SEMARNAT, 2010), se observó la presencia de 4 especies bajo protección especial: [Accipiter striatus (PT), Patagioenas nigrirostris (CT), Psarocolius Montezuma (CT) y Trogon collaris (BMM)]; una endémica: [Atlapetes albinucha (CT)], y tres amenazadas: [Glyphorhynchus spirurus (BMM), Pionus senilis (CT) y Spinus atriceps (BMM)]. Lo anterior, producto de la complejidad en la estructura y composición de los elementos que integran los hábitats analizados, considerando que a mayor tiempo de establecimiento, los SAF desarrollan características similares a espacios conservados, permitiendo el arribo de especies especialistas, quienes encuentran sitios de oportunidad en el interior de estos medios de producción, adoptando los recursos disponibles como parte de su nicho ecológico (Ramírez-Albores, 2010; Botero y De-la-Ossa, 2011; Cipriano-Anastasio y col., 2017;Naoki y col., 2017).
Los valores promedio observados de la riqueza de especies insectívoras fueron: CT: 9.67, PT: 6, BMM: 1.83 y CT-PT-BMM: 16.33. Por su parte, los resultados esperados mediante el estimador Jacknife1muestra medias de 33.02, 24.20, 9.98 y 52.22 especies, respectivamente. Por lo que, hasta ahora, con los valores de riqueza obtenidos, se conoce un promedio del 29.27 % (CT), 24.80 % (PT), 18.37 % (BMM) y 31.28 % (CT-PT-BMM), de la avifauna insectívora teóricamente presente en estos hábitats (Tabla 2).
Tabla 2 Valores de riqueza observados y esperados mediante el índice de Jacknife1.
| Riqueza de especies de CT | |||
| Muestreo | Observado | Esperado (Jacknife1) | Porcentaje de riqueza conocida por muestreo |
| 1 | 6 | 9.2 | 65.22% |
| 2 | 9 | 22.54 | 39.93 % |
| 3 | 9 | 32 | 28.13 % |
| 4 | 13 | 39.8 | 32.66 % |
| 5 | 6 | 44.94 | 13.35 % |
| 6 | 15 | 49.66 | 30.21 % |
| Promedio general observado y esperado de CT | |||
| 9.67 | 33.02 | 29.27 % | |
| Riqueza de especies de PT | |||
| Muestreo | Observado | Esperado (Jacknife1) | Porcentaje de riqueza conocida por muestreo |
| 1 | 10 | 6.88 | 145.35 % |
| 2 | 0 | 17.06 | 0.00 % |
| 3 | 9 | 23.98 | 37.53 % |
| 4 | 3 | 29.47 | 10.18 % |
| 5 | 12 | 32.95 | 36.42 % |
| 6 | 2 | 34.83 | 5.74 % |
| Promedio general observado y esperado de PT | |||
| 6 | 24.20 | 24.80 % | |
| Riqueza de especies de BMM | |||
| Muestreo | Observado | Esperado (Jacknife1) | Porcentaje de riqueza conocida por muestreo |
| 1 | 2 | 1.83 | 109.29 % |
| 2 | 1 | 5.19 | 19.27 % |
| 3 | 1 | 8.66 | 11.55 % |
| 4 | 3 | 11.94 | 25.13 % |
| 5 | 1 | 14.76 | 6.78 % |
| 6 | 3 | 17.5 | 17.14 % |
| Promedio general observado y esperado de BMM | |||
| 1.83 | 9.98 | 18.37 % | |
| Riqueza de especies de CT-PT-BMM | |||
| Muestreo | Observado | Esperado (Jacknife1) | Porcentaje de riqueza conocida por muestreo |
| 1 | 16 | 16.69 | 95.87 % |
| 2 | 10 | 38.71 | 25.83 % |
| 3 | 16 | 52.4 | 30.53 % |
| 4 | 19 | 62.77 | 30.27 % |
| 5 | 18 | 69.1 | 26.05 % |
| 6 | 19 | 73.66 | 25.79 % |
| Promedio general observado y esperado de CT-PT-BMM | |||
| 16.33 | 52.22 | 31.28 % | |
Los resultados de Kruskal-Wallis para la riqueza y abundancia no describen diferencias significativas. Por el contrario, la diversidad y las variables en el uso de hábitat muestran diferencias entre condiciones. Se exhibe que para las tres condiciones la riqueza y abundancia presentan patrones similares, no así para la diversidad y las variables que determinan el uso del hábitat (Tabla 3).
Tabla 3 Resultados de Kruskal-Wallis para la riqueza, abundancia, diversidad y uso de hábitat.
| Ji cuadrado | Grados de libertad | Prob > Ji cuadrado |
|---|---|---|
| Riqueza | ||
| CT-PT-BMM | ||
| 5.801 2 | 2 | 0.055 |
| Abundancia | ||
| CT | ||
| 6.866 8 | 5 | 0.230 7 |
| PT | ||
| 7.952 2 | 5 | 0.158 9 |
| BMM | ||
| 2.089 4 | 5 | 0.836 6 |
| CT-PT-BMM | ||
| 2.737 3 | 5 | 0.740 4 |
| Diversidad | ||
| CT-PT-BMM | ||
| 7.052 6 | 2 | 0.029 4* |
| Uso de hábitat | ||
| CT | ||
| 64.185 2 | 4 | < 0.000 1* |
| PT | ||
| 17.520 3 | 5 | 0.003 6* |
| BMM | ||
| 14.458 3 | 5 | 0.012 9* |
| CT-PT-BMM | ||
| 45.463 6 | 4 | <0.0001* |
Los resultados de X2muestran que la riqueza de especies encontrada no es la que potencialmente se presenta en estos hábitats. Por su parte, la abundancia y diversidad es la que se distribuye en las áreas analizadas (Tabla 4).
Tabla 4 Resultados de X2 para riqueza, abundancia y diversidad de especies registradas.
| N | Grados de libertad | Chi-cuadrada | Valor P |
|---|---|---|---|
| Riqueza | |||
| CT | |||
| 59 | 5 | 9.712 71 | 0.084 |
| PT | |||
| 47 | 5 | 32.889 4 | 0 |
| BMM | |||
| 24 | 5 | 6.960 42 | 0.224 |
| CT-PT-BMM | |||
| 112 | 5 | 31.584 4 | 0 |
| Abundancia | |||
| CT | |||
| 4 | 5 | 52.932 | 0.554 1 |
| PT | |||
| 50 | 0 | 49.497 | 0.493 5 |
| BMM | |||
| 0 | 5 | 20.127 | 0.740 1 |
| CT-PT-BMM | |||
| 18 | 0 | 56.365 | 0.609 3 |
| Diversidad | |||
| CT-PT-BMM | |||
| 8 | 4 | 36 | 0.375 1 |
Los resultados del IAR reportaron valores bajos con mayor abundancia para las siguientes especies: en CT:Melanerpes aurifrons (MelAur) y Cardellina pusilla (CarPus), en PT:Megarynchus pitangua (MegPit) y Haemorhous mexicanus (HaeMex), en BMM: Glyphorynchus spirurus (GlySpi), y en CT-PT-BMM: Melanerpes aurifrons y Cardellina pusilla (Figura 3).
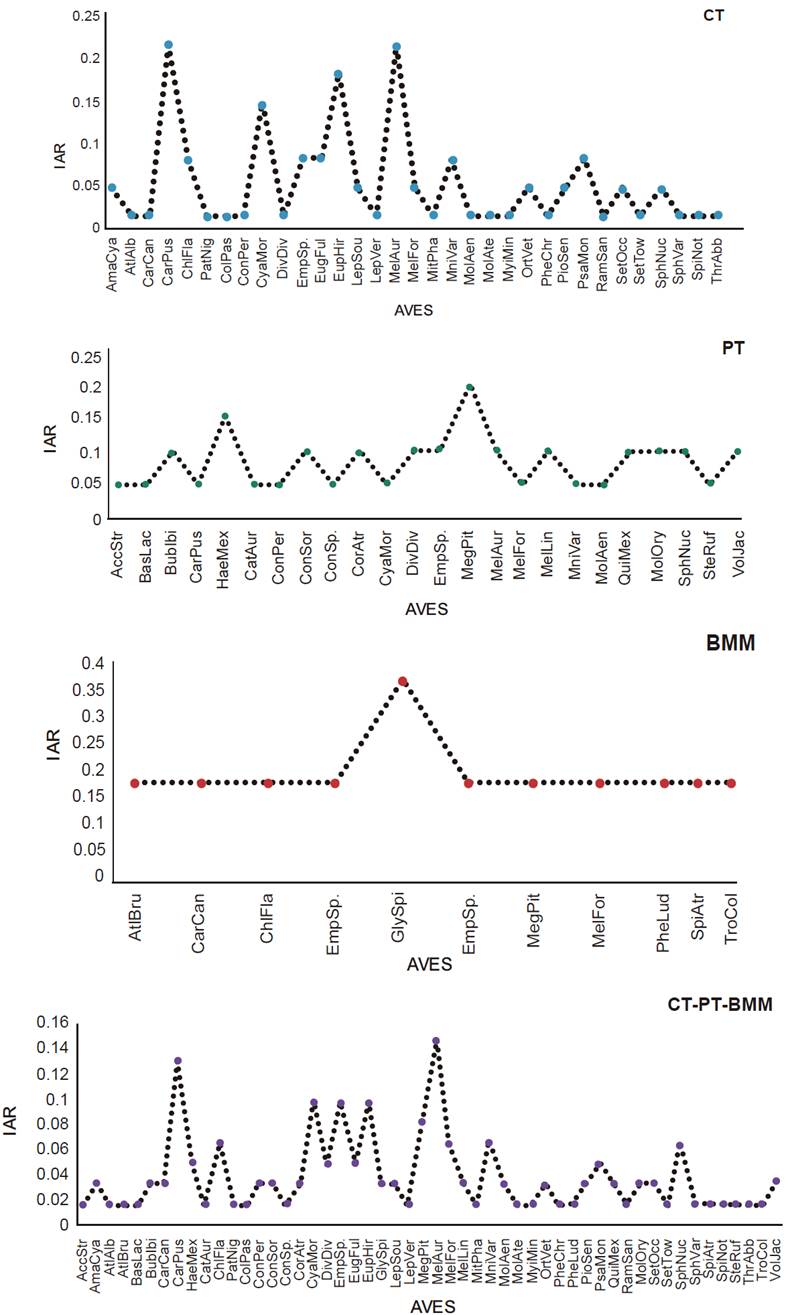
Figura 3 Índice de abundancia relativa de las especies de aves registradas en las condiciones bajo estudio.
Los valores porcentuales obtenidos mediante el índice de Jaccard para la similitud de riqueza arrojaron los siguientes resultados: CT: 19 %, PT: 16 %, BMM: 10 % y CT-PT-BMM: 23 %, exponiendo gran disimilitud en la riqueza, reafirmando el efecto que presentaron el hábitat, la composición y estructura florística como factores determinantes de la riqueza y diversidad en cada uno de los hábitats (Figura 4) (Perez y col., 2021).
Shannon-Wiener obtuvo valores mínimos y máximos de: H´= 2.15; 1.99; 0.48; 2.79 y H´= 3.3; 3.1; 2.27; 3.78, respectivamente. Con valores promedio de: H´= 2.91; 2.65; 1.59; 3.44, respectivamente (Figura 5). Tales resultados arrojaron una diversidad alta en los hábitats observados; soportando lo propuesto por Connell (1978) en su hipótesis del disturbio intermedio, en la que postula que sitios con mediano grado de perturbación, al igual que los SAF analizados, favorecen el incremento en la riqueza y diversidad, particularmente de especies generalistas y algunas especialistas, quienes se ven influenciadas por factores como la competencia, segregación del hábitat, dispersión o recolonización de nuevos espacios. De igual forma,Sommer y col. (2018) reportaron que especies flexibles sujetas a cierto disturbio suelen retornar a hábitats fotosintéticamente activos, tal como se presenta en los SAF estudiados, que ofrecieron nichos de oportunidad para estos organismos, sugiriendo estos medios de producción como modelo sostenible que coadyuva a la conservación de este grupo taxonómico.
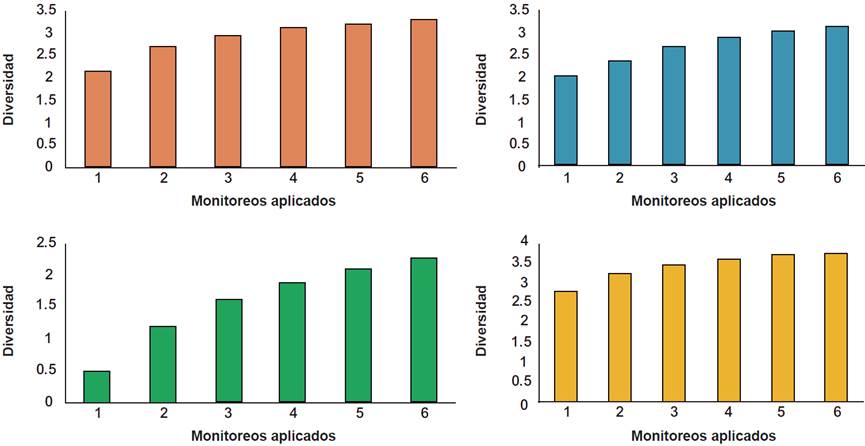
Figura 5 Diversidad de riqueza Shannon-Wiener de las aves registradas en las condiciones bajo estudio.
El análisis de conglomerados evidenció la conformación de diversos clústeres, Riqueza: CT=1, PT = 3, BMM = 3 y CT-PT-BMM = 3 (Figura 6,Tabla 5), y para Abundancia: CT = 2, PT= 2, BMM = 3 y CT-PT-BMM = 3 (Figura 7, Tabla 6), mostrando diferentes porcentajes de similitud en el registro de ambos parámetros (riqueza y abundancia). Estos indicios fueron producto del periodo de muestreo, en donde se contemplaron especies residentes, migratorias y transitorias, que determinaron la variabilidad y similitud de dichos índices. Un factor que pudo influenciar en dichos resultados se encuentra ligado al tiempo, por tanto, prolongar el periodo de muestreo permitirá visualizar gráficamente las fluctuaciones estacionales como elemento determinante en el valor de dichos índices para los hábitats evaluados (Tobar y col., 2021).
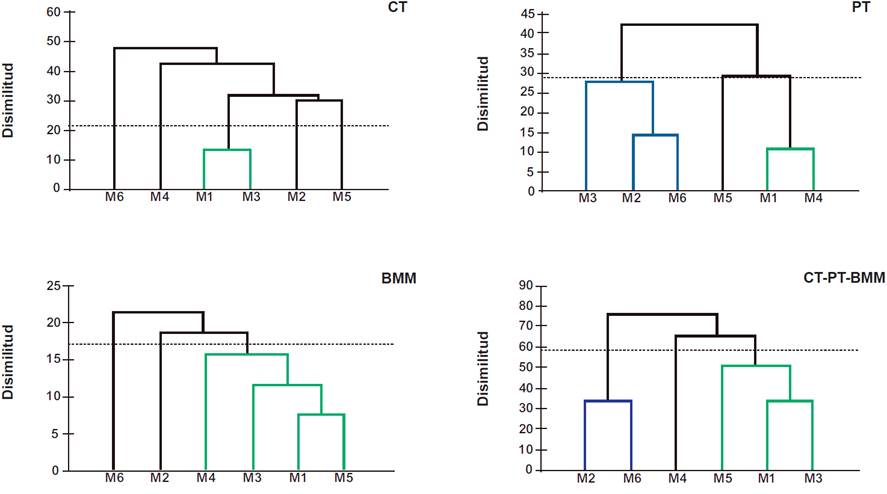
Figura 6 Análisis clúster de la riqueza de especies registrada en el monitoreo de las aves. Nota: la línea horizontal (línea euclídea) define el número de clústeres de cada condición evaluada; los colores muestran la agrupación de los monitoreos con mayor similitud en riqueza de especies registradas.
Tabla 5 Resultados absolutos y porcentuales de los clústeres conformados con la riqueza de especies registrada por cada monitoreo.
| Descomposición de la varianza | Absoluto | Porcentaje |
|---|---|---|
| CT | ||
| Intraclase | 2.5 | 37.31 % |
| Interclases | 4.2 | 62.69 % |
| PT | ||
| Intraclase | 3.889 | 68.23 % |
| Interclases | 1.811 | 31.77 % |
| BMM | ||
| Intraclase | 2.667 | 80 % |
| Interclases | 0.667 | 20 % |
| CT-PT-BMM | ||
| Intraclase | 8.778 | 74.81 % |
| Interclases | 2.956 | 25.19 % |
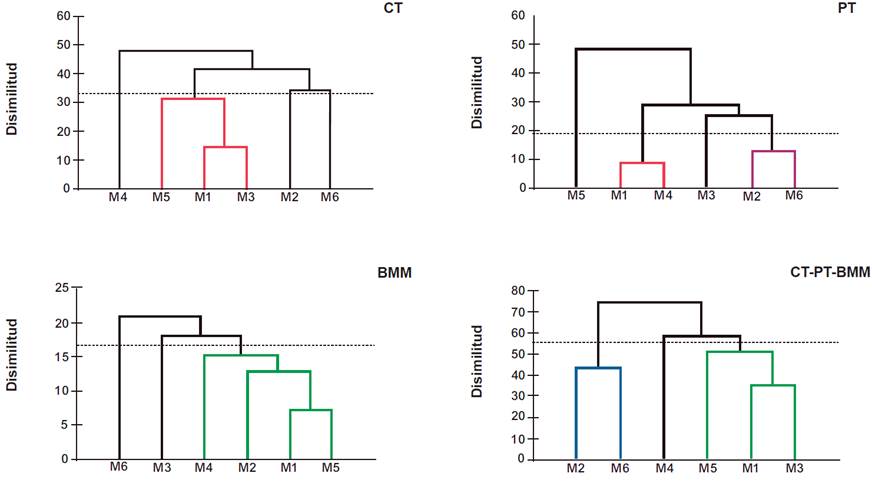
Figura 7 Análisis clúster de la abundancia de aves registrada en los diferentes monitoreos. Nota: la línea horizontal (línea euclídea) define el número de clústeres de cada condición evaluada; los colores muestran la agrupación de los monitoreos con mayor similitud en la abundancia de especies registradas.
Tabla 6 Resultados absolutos y porcentuales de los clústeres conformados con la abundancia de especies registrada por cada monitoreo.
| Descomposición de la varianza | Absoluto | Porcentaje |
|---|---|---|
| CT | ||
| Intraclase | 111 | 56.66 % |
| Interclases | 84.9 | 43.34 % |
| PT | ||
| Intraclase | 104.5 | 70.86 % |
| Interclases | 42.967 | 29.14 % |
| BMM | ||
| Intraclase | 20.583 | 80.4 % |
| Interclases | 5.017 | 19.6 % |
| CT-PT-BMM | ||
| Intraclase | 259.611 | 73.54 % |
| Interclases | 93.422 | 26.46 % |
El ACP reportó una proporción de varianza acumulada en sus tres primeros ejes (componentes); de CT: 62.96 % (Tabla 7); PT: 52.65 % (Tabla 8); BMM: 71.17 % (Tabla 9); y CT-PT-BMM: 58.50 % (Tabla 10). En las tablas mencionadas y en la Figura 8, se explica la variabilidad presente entre las variables que conforman y determinan la incidencia y uso del hábitat y vegetación de las aves en los hábitats analizados. Se encontró mayor correlación del hábitat y vegetación empleado para la alimentación en el estrato herbáceo y arbóreo, en alturas de 5 m y 10 m, utilizando el estrato aéreo para vuelo. Dichos hallazgos han sido detectados anteriormente, señalando que estos hábitats también son empleados para la construcción de nidos, percha, refugio y desplazamiento (Sánchez y col., 2011; Velásquez y col., 2012; Ordóñez-Delgado y col., 2017; Alonso y col., 2018; Figueroa y col., 2019;Perez y col., 2021); no obstante, el presente trabajo es el primero en reportar especies bajo protección especial alimentándose en el estrato arbóreo de los SAF referidos; evidenciando cómo la estructura horizontal y vertical del hábitat en dichos medios de producción ha desarrollado cierta influencia en el arribo de especies migratorias y bajo cierto estatus de conservación, proporcionando recursos que permiten la coexistencia de estas especies. Lo último coincide con lo reportado por Sánchez (2017)y Medrano-Guzmán y col. (2020), quienes además hallaron especies migratorias haciendo uso del dosel para alimentación y como sitio de descanso. De igual manera, la relevancia del dosel es soportada por Sáenz y col. (2006) y Narango y col. (2019), quienes mencionaron que esta regula, para algunas especies, su dinámica y estructura poblacional, tal como se observó en ciertos individuos de Pionus senilis, los cuales se detectaron en el dosel perchando y algunos reproduciéndose. Se propone la implementación de buenas prácticas de manejo agroforestal que permitan la diversificación de estratos y sustratos como elementos del hábitat que coadyuven a la conservación de especies; de igual forma, cuidar el Bosque Mesófilo de Montaña y no permitir su degradación, para garantizar la coexistencia de especies con hábitos especialistas.
Tabla 7 Componentes principales del hábitat y vegetación y su correlación con las aves registradas en CT.
| Variables | Componentes | ||
|---|---|---|---|
| Componente 1 | Componente 2 | Componente 3 | |
| CT | |||
| Aéreo | 0.202 585 2 | 0.363 235 4 | 0.419 883 9 |
| Alimentación | 0.180 576 5 | - 0.497 467 | 0.087 153 9 |
| Alto más de 10 m | 0.257 339 2 | 0.181 619 8 | - 0.467 449 |
| Arbórea | 0.486 749 8 | - 0.100 438 | -0.232 25 |
| Arbustiva | - 0.011 094 | - 0.343 509 | 0.202 155 9 |
| Bajo 0 cm a 70 cm | - 0.071 597 | - 0.316 176 | 0.119 822 7 |
| Canto | 0.222 857 8 | 0.062 344 9 | 0.209 423 5 |
| Cortejo | 0.402 363 | 0.150 409 7 | 0.204 207 4 |
| Herbácea | - 0.114 158 | 0.024 001 4 | 0.125 524 8 |
| Medio de 1 m a 5 m | 0.395 957 2 | - 0.351 361 | 0.140 593 4 |
| Percha | 0.329 454 2 | - 0.207 835 | 0.049 239 5 |
| Vocalización | 0.294 952 5 | 0.184 041 1 | - 0.434 303 |
| Vuelo | 0.202 585 2 | 0.363 235 4 | 0.419 883 9 |
| Importancia de los componentes | |||
| Desviación estándar | 1.831 280 9 | 1.617 446 3 | 1.488 394 2 |
| Proporción de variación | 0.257 968 4 | 0.201 241 | 0.170 409 |
| Proporción acumulativa | 0.257 968 4 | 0.459 209 4 | 0.629 618 4 |
Tabla 8 Componentes principales del hábitat y vegetación y su correlación con las aves registradas en PT.
| Variables | Componentes | ||
|---|---|---|---|
| Componente 1 | Componente 2 | Componente 3 | |
| PT | |||
| Aéreo | 0.257 571 49 | 0.217 810 73 | 0.243 502 18 |
| Alimentación | 0.288 806 44 | - 0.198 023 19 | - 0.260 444 75 |
| Alto más de 10 m | - 0.419 883 26 | - 0.223 017 23 | 0.331 834 82 |
| Arbórea | - 0.392 764 98 | - 0.340 340 38 | - 0.141 404 31 |
| Arbustiva | - 0.169 305 1 | 0.033 084 09 | - 0.410 569 78 |
| Bajo 0 cm a 70 cm | 0.360 437 34 | - 0.452 598 29 | - 0.160 617 39 |
| Canto | 0.080 965 83 | - 0.291 433 96 | - 0.163 987 64 |
| Herbácea | 0.404 474 74 | - 0.423 332 52 | 0.192 502 73 |
| Medio de 1 m a 5 m | - 0.080 431 45 | - 0.126 546 09 | - 0.644 954 32 |
| Percha | - 0.412 920 97 | - 0.200 723 54 | 0.108 733 74 |
| Reproducción | 0.056 956 11 | 0.121 180 49 | - 0.115 648 49 |
| Vocalización | - 0.087 953 8 | - 0.160 144 63 | - 0.094 616 75 |
| Vuelo | 0.054 718 3 | 0.425 509 37 | 0.185 296 91 |
| Importancia de los componentes | |||
| Desviación estándar | 1.769 496 5 | 1.404 123 2 | 1.320 264 7 |
| Proporción de variación | 0.240 855 2 | 0.151 658 6 | 0.134 084 5 |
| Proporción acumulativa | 0.240 855 2 | 0.392 513 8 | 0.526 598 4 |
Tabla 9 Componentes principales del hábitat y vegetación y su correlación con las aves registradas en BMM.
| Variables | Componentes | ||
|---|---|---|---|
| Componente 1 | Componente 2 | Componente 3 | |
| BMM | |||
| Aéreo | 0.415 964 03 | 0.064 755 09 | 0.087 131 77 |
| Alimentación | 0.389 822 26 | - 0.184 866 86 | 0.090 477 74 |
| Alto más de 10 m | - 0.239 110 49 | 0.098 092 52 | 0.338 697 96 |
| Arbórea | - 0.179 697 15 | - 0.191 220 38 | 0.474 716 34 |
| Arbustiva | 0.139 194 17 | - 0.437 389 9 | 0.049 713 09 |
| Bajo 0 cm a 70 cm | - 0.153 920 86 | 0.190 030 35 | - 0.176 878 89 |
| Canto | - 0.078 050 49 | 0.163 255 43 | - 0.568 933 4 |
| Herbácea | 0.271 632 59 | 0.439 720 68 | - 0.148 491 73 |
| Medio de 1 m a 5 m | 0.393 120 58 | - 0.107 484 13 | 0.095 447 28 |
| Nidación | 0.289 749 91 | 0.416 404 13 | 0.111 860 12 |
| Percha | - 0.028 178 45 | 0.403 861 92 | 0.456 717 67 |
| Vocalización | 0.224 245 32 | - 0.340 253 84 | - 0.163 864 35 |
| Vuelo | 0.415 964 03 | 0.064 755 09 | 0.087 131 77 |
| Importancia de los componentes | |||
| Desviación estándar | 2.185 460 2 | 1.613 321 2 | 1.368 893 |
| Proporción de variación | 0.367 402 8 | 0.200 215 8 | 0.144 143 7 |
| Proporción acumulativa | 0.367 402 8 | 0.567 618 6 | 0.711 762 3 |
Tabla 10 Componentes principales del hábitat y vegetación y su correlación con las aves registradas en CT-PT-BMM.
| Variables | Componentes | ||
|---|---|---|---|
| Componente 1 | Componente 2 | Componente 3 | |
| CT-PT-BMM | |||
| Aéreo | 0.261 366 27 | 0.385 697 53 | 0.027 399 92 |
| Alimentación | 0.428 388 38 | 0.050 836 94 | 0.106 584 35 |
| Alto más de 10 m | 0.066 089 97 | -0.410 205 49 | - 0.153 780 55 |
| Arbórea | 0.353 223 47 | -0.415 665 35 | - 0.199 143 84 |
| Arbustiva | 0.281 431 01 | 0.163 963 83 | 0.286 675 08 |
| Bajo 0 cm a 70 cm | - 0.023 375 83 | 0.161 473 46 | - 0.549 221 94 |
| Canto | 0.096 232 73 | - 0.066 791 73 | - 0.220 687 31 |
| Cortejo | 0.296 753 86 | 0.254 769 06 | -0.310 201 0 |
| Herbácea | - 0.031 010 03 | 0.315 227 46 | - 0.562 982 43 |
| Medio de 1 m a 5 m | 0.498 908 91 | - 0.080 948 83 | 0.044 196 01 |
| Percha | 0.261 758 75 | - 0.229 444 59 | 0.011 340 3 |
| Vocalización | 0.161 040 77 | - 0.338 713 16 | - 0.239 517 63 |
| Vuelo | 0.312 473 08 | 0.334 646 19 | 0.139 382 94 |
| Importancia de los componentes | |||
| Desviación estándar | 1.754 715 6 | 1.683 935 3 | 1.300 542 1 |
| Proporción de variación | 0.236 848 2 | 0.218 126 0 | 0.130 108 4 |
| Proporción acumulativa | 0.236 848 2 | 0.454 974 2 | 0.585 082 7 |
Conclusiones
La estructura y composición florística y del hábitat son elementos determinantes en la riqueza y diversidad de aves insectívoras. Por ello, se puntualiza la importancia que presentan los sistemas agroforestales examinados en el aprovisionamiento de nichos de utilización para alimentación, nidación y reproducción, que coadyuvan a la conservación de especies amenazadas, bajo protección especial y migratoria. Se propone para futuras investigaciones contemplar el efecto estacional como un factor determinante en los valores de riqueza y diversidad para los hábitats en esta región particular de México.











 nueva página del texto (beta)
nueva página del texto (beta)







