Introducción
En los últimos 30 años se han aprobado diversos medicamentos biotecnológicos (MB) para diferentes padecimientos, tales como diabetes, artritis o cáncer, por mencionar algunos (Schellekens, 2009; Bhawani y col., 2018). Con más de 8 500 productos en desarrollo, esta industria fue valuada en $ 174.7 billones de dólares en 2019, y para 2020 se proyectaba un crecimiento de $ 248.7 billones de dólares (Agyei y col., 2017; Jiang y col., 2017; Informa, 2019).
En su mayoría, los MB se caracterizan por baja biodisponibilidad oral (menor al 2 %), tiempo de vida media corto en fluidos biológicos (aproximadamente de 30 min) y una escasa absorción gastrointestinal. Estas características limitan la vía de administración y la confinan a la intravenosa, subcutánea e intramuscular (Bruno y col., 2013; Pawar y col., 2014; Pachioni-Vasconcelos y col., 2016).
Para mantener las concentraciones terapéuticas, los MB deben ser administrados varias veces al día, esquema que compromete el éxito terapéutico a largo plazo (Pawar y col., 2014; Pachioni-Vasconcelos y col., 2016). Para hacer frente a este problema, el uso de microacarreadores ha favorecido los sistemas de administración de fármacos, células y proteínas, disminuyendo los efectos colaterales asociados a los tratamientos y garantizando el éxito farmacológico (Pawar y col., 2014; Shah y Schwendeman, 2014). Los sistemas micrométricos están representados por polímeros, lípidos, metales y materiales inorgánicos (Tabla 1), los cuales pueden estar en el rango micro y nanométrico (Bilati y col., 2005; Bruno y col., 2013; Wang y col., 2013).
Table 1 Advantages and disadvantages of polymeric systems.
Fuente: modificado a partir de Bracho-Sanchez y col. (2016).
Cada sistema tiene peculiaridades únicas, sin embargo, los sistemas micrométricos ofrecen las siguientes ventajas: (i) protección al biofármaco de una rápida degradación y aclaramiento después de su administración, así como de efectos ambientales de pH, luz, temperatura y humedad; (ii) el efecto terapéutico pue-de prolongarse, a diferencia de la forma tradicional de administración y (iii) el perfil de liberación puede controlarse, dependiendo del diseño de la microesfera o microcápsula Figura 1 (Wang y col., 2013; Pachioni-Vasconcelos y col., 2016; Hu y col., 2017).
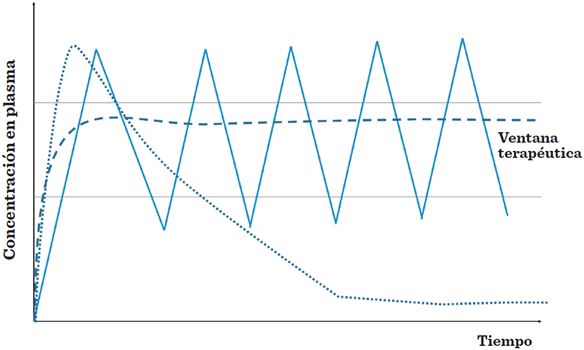
Fuente: modificado a partir de Wang y col. (2013).
Figura 1 Representación esquemática de la liberación de biofármaco en fluidos biológicos de forma tradicional (línea sólida), en comparación con la liberación de biofármaco en dosis repetidas (línea punteada) y a partir de un sistema en microesferas (línea segmentada).
El objetivo de este trabajo fue destacar las principales características que deben ser evaluadas en el desarrollo de microacarreadores, enfatizando la seguridad de los medicamentos biotecnológicos, tras el proceso de microencapsulación, para el desarrollo de nuevas formas de administración.
Métodos de preparación de microcápsulas y microesferas a partir de biopolímeros
Las micropartículas tienen un diámetro medio de 1 mm a 1 000 mm y pueden dividirse en microcápsulas o microesferas. El término “microcápsula” hace referencia a un cuerpo esférico que recubre al principio activo, mientras que el término “microesfera” se refiere a una matriz homogénea, donde la sustancia activa está inmersa en el cuerpo de la esfera. Los métodos de obtención de microesferas y microcápsulas se categorizan en tres tipos (Tabla 2): métodos químicos, fisicoquímicos y físico-mecánicos (Coelho y col., 2010; Jyothi y col., 2010; Singh y col., 2010; Wong y col., 2018). El material empleado debe ser biocompatible, de baja toxicidad y biodegradable en fluidos biológicos (Bracho-Sanchez y col., 2016). En este sentido, los polímeros hidrofílicos, como el alginato o quitosano, ofrecen una ventaja determinante al ser inmunotolerables y solubles en agua (McClements, 2018).
Table 2 Methods for obtaining microcapsules and microspheres obtention.
| Método | Polímero empleado |
Material encapsulado |
Factores de proceso |
Tamaño (μm) |
Aplicación | Referencias |
|---|---|---|---|---|---|---|
| Métodos químicos | ||||||
| Emulsión | Polietilenglicol Eextrinas Quitosano Alginato Liposomas |
Súper óxido dismutasa bovina Albúmina Sérica bovina Metformina Insulina Cúrcuma |
Interfase agua-aceite Agitación Reacción de entrecruzamiento |
0.5 a 1 000 | Liberación de fármacos |
Morita y col.
(2000); Yuan y col. (2009); Perry y McClements (2020); Zheng y McClements (2020) |
| Policondensación interfacial | - | Albúmina sérica bovina Pigmentos |
Interfase de la emulsión | 0.5 a 1 000 | Industria alimenticia Industria farmacéutica |
Ozkan y col. (2019) |
| Métodos fisicoquímicos | ||||||
| Coacervación | Goma tragacanto Gelatina Goma arábica |
Beta-caroteno | Aglomeración | 5 a 1 000 | Liberación de fármacos | Ozkan y col. (2019) |
| Evaporación con solvente | Ácido poli(láctico-co-glicólico) | Glucosa oxidasa | Aglomeración | 0.5 a 1 000 | Liberación de fármacos |
Li y col. (2000);
Ozkan y col. (2019) |
| Precipitación | Goma gelana | Proteínas | Características químicas de los materiales | 5 a 1 000 | Liberación de fármacos | Coelho y col. (2019) |
| Métodos físico-mecánicos | ||||||
| Secado por aspersión |
Alginato Quitosano Inulina Maltodextrina |
Insulina Jugo de arándano |
Temperatura | 1 a 500 | Industria alimenticia Industria farmacéutica |
Yuan y col.
(2009); Bowey y col. (2013) |
| Liofilización | Celulosa Maltodextrinas Quitosano |
Albúmina sérica bovina Té verde Toxoide tetánico |
Sonicación | 20 a 500 | Industria farmacéutica Industria alimenticia |
Sánchez y col.
(1999); Costantino y col. (2000) |
| Encapsulación electrostática | Alginato Pectina |
Extracto de cocoa | Capacitancia | 20 a 500 | Industria alimenticia | Ozkan y col. (2019) |
Caracterización integral de microcápsulas y microesferas
La caracterización integral de microesferas y micropartículas se resume en la Tabla 3 y está basada en la determinación de lo siguiente: i) propiedades del material, ii) tamaño de partícula, morfología, forma o estructura del cristal, iii) propiedades de superficie, como carga, funcionalidad, iv) eficiencia de la microencapsulación, v) cinética de liberación, vi) estabilidad del MB (Gill y col., 2010).
Table 3 Main techniques for characterization of microspheres and microcapsules.
| Parámetro | Método | Aplicación | Referencia | |
|---|---|---|---|---|
| Material (matriz) | NMR | Resonancia magnética nuclear | Microesferas | Chen y Zeng (2017) |
| FTIR | Espectroscopía de infrarrojo con transformada de Fourier | Microesferas | Chen y Zeng (2017) | |
| IR | Infrarrojo | Microesferas | Ribeiro y col. (2005) | |
| Forma y tamaño de partícula | TEM | Microscopia electrónica de trasmisión | Albúmina Interferón Lisozima Nanopartículas |
Zhou y col.
(2008); Nigen y col. (2010); Bronze-Uhle y col. (2017) |
| SEM | Microscopia electrónica de barrido | Hormona de crecimiento Interferón Eritropoyetina |
Zhou y col.
(2008); Jagtap y col. (2012); Kang y col. (2014); Ghasemi y col. (2019) |
|
| AFEM | Microscopia de fuerza atómica | Lisozima | Nigen y col. (2010) | |
| Tamaño | DLS | Radio hidrodinámico | Insulina Filgrastim |
Bowey y col.
(2013); Kiafar y col. (2016) |
| SPR | Análisis de superficie de plasmones | Albúmina sérica humana | Bhakta y col. (2015) | |
| Porosidad | MIP | Potenciometría de intrusión con mercurio o helio | Lisozima | Reinhold y Schwendeman (2013) |
| Propiedades térmicas | DSC | Calorimetría diferencial de barrido | Albúmina sérica bovina Eritropoyetina |
Kang y Singh
(2003); Jagtap y col. (2012) |
| TGA | Análisis termogravimétrico | Eritropoyetina |
Abdelhakim y col.
(2019); Nguyen y col. (2020) |
|
| Eficacia de la encapsulación/ Cinética de liberación |
HPLC | Cromatografía de líquidos | Filgrastim Insulina |
Kiafar y col.
(2016); Agrawal y col. (2017) |
La forma de las partículas puede ser observada a partir de diversas microscopias, cuyo alcance depende de las necesidades y limitaciones propias de la metodología. Las microscopias más empleadas son microscopia electrónica de barrido (SEM, por sus siglas en inglés: Scanning Electron Microscopy), microscopia electrónica de transmisión (TEM, por sus siglas en inglés: Transmission Electron Microscopy), microscopia de fuerza atómica (AFEM, por sus siglas en inglés: Atomic Force Electroluminescence Microscopy), entre otras (Rokstad y col., 2014; Chogale y col., 2016). El radio hidrodinámico determina la vía por la cual podrá ser administrada la formulación, por lo que la técnica de dispersión dinámica de luz (DLS, por sus siglas en inglés: Dynamic Light Scattering) es comúnmente usada para este fin; la principal desventaja de este método es la interferencia que implican moléculas de grandes dimensiones, las cuales pueden sedimentar o formar agregados, comprometiendo la fiabilidad de los resultados (Andhariya y Burgess, 2016).
Las propiedades físicas de las microcápsulas y microesferas dependen de las propiedades térmicas de una sustancia y se analizan por calorimetría diferencial de barrido (DSC, por sus siglas en inglés: Differential Scanning Calorimetry) o termogravimetría (TGA, por sus siglas en inglés: Thermogravimetric Analysis), lo que permite determinar la temperatura y el flujo de calor asociado a las transiciones térmicas, como la temperatura de fusión o transición vítrea, así como pérdida de masa (Schick, 2009; Gill y col., 2010).
Las propiedades de superficie determinan el grado de biotolerabilidad de estas moléculas en el organismo receptor. Las metodologías empleadas son la espectroscopia fotoelectrónica de rayos X (XPS, por sus siglas en inglés: X-Ray Photoelectron Spectrometry), espectrometría de masas de iones secundarios de tiempo de vuelo (ToF-SIMS, por sus siglas en inglés: Time-of-Flight Secondary Ion Mass Spectrometry) y espectroscopía de infrarrojo con transformada de Fourier acoplado a reflectancia total atenuada (ATR-FTIR, por sus siglas en inglés: Attenuated Total Reflection-Fourier Transform Infra-Red Spectroscopy).
La eficacia de atrapamiento puede evaluarse como i) la capacidad de encapsulación (CE), expresada en la relación de principio activo entre cantidad total de otros componentes de las micropartículas, o ii) la eficiencia de encapsulación (EE), que se define en términos de porcentaje o fracción del principio activo presente en el sistema y la cantidad del principio activo inicial (Paul y col., 2012; Kim y col., 2014). La eficacia de microencapsulación puede verse afectada por la concentración y peso molecular del biopolímero, el método de preparación, la solubilidad del fármaco y del polímero, las interacciones fármaco-polímero y la tasa de evaporación del solvente (Jyothi y col., 2010; Bale y col., 2016).
Evaluar la cinética de liberación de los microacarreadores determina la cantidad de medicamento disponible y el tiempo que tarda en hacerlo (Kim y col., 2014; Zhao y col., 2016). Los modelos de cinéticas se ajustan a: i) difusión, donde el mecanismo obedece a la velocidad con la que el líquido traspasa la membrana de polímero y la velocidad con la que el MB migra de la microesfera (Singh y col., 2010); ii) disolución, que depende del grado de solubilidad del polímero y del biofármaco en fluidos biológicos (Bittner y col., 1998; Singh y col., 2010), iii) erosión, proceso complejo que implica la hinchazón, difusión y disolución del sistema (Mohammed y col., 2017).
La caracterización integral de estos sistemas permite brindar seguridad y certeza a las formulaciones desarrolladas, al asegurar la biocompatibilidad con los tejidos. La biocompatibilidad es la habilidad que tiene el material de no inducir, directa o indirectamente, respuestas inflamatorias (Rokstad y col., 2014). Diversos estudios relacionan las propiedades fisicoquímicas, como peso del polímero, tamaño, forma, carga del sistema y vías de degradación, con el desarrollo de respuestas inmunes (Andorko y col., 2017). Por ejemplo, el tamaño de partícula es capaz de influenciar la distribución biológica y limita la vía de administración. Micropartículas diseñadas para liberación oral, con un diámetro medio de 11 mm, pueden localizarse en el intestino (placas de Peyer), mientras que las micropartículas de 5 mm son trasladadas del intestino de rata al bazo por el sistema linfático (Benne y col., 2016; Savage y col., 2019; Alqahtani y col., 2020). La forma de la partícula influye en esta internalización, ya que el proceso depende de la interacción del sistema con células fagocíticas (células dendríticas); partículas esféricas favorecen este proceso, mientras que formas cilíndricas pueden decrecer la eficacia de la vía de transporte, partículas con otras formas favorecen la presentación de antígenos (Savage y col., 2019). Durante el metabolismo, las partículas son degradadas y esto favorece la liberación del principio activo, sin embargo, los productos de degradación pueden tener propiedades químicas diferentes al material inicial, por lo que pueden interaccionar de manera distinta con células del sistema inmune y los tejidos; estas interacciones no siempre son benéficas; los productos de degradación de materiales, como los poliésteres, pueden ser empleados como adyuvantes en la fabricación de vacunas (Andorko y col., 2017). El desarrollo de efectos no deseados se puede evaluar mediante ensayos in vitro, que precisan la interacción entre las micropartículas o nanopartículas con diferentes sistemas celulares. Los ensayos in vitro detallan posibles modificaciones en el crecimiento, reproducción y morfología celular (Li y col., 2015). En la Tabla 4 se exponen algunas de las principales pruebas in vitro para evaluar la citotoxicidad o viabilidad celular por parte de los materiales empleados para la fabricación de sistemas en escala nano o micrométrica.
Table 4 Main in vitro trials to evaluate biocompatibility and cytotoxicity.
| Método | Ensayo | Material | Bibliografía |
|---|---|---|---|
| Apoptosis | Anexina V | Alginato | Sáenz-del-Burgo-Martínez y col. (2018) |
| Hemolisis/necrosis | Ensayo LDH Ensayo MTT |
Dextrano |
Ribeiro y col.
(2013) ; Khalkhali y col. (2015); |
| Peroxidación de lípidos (Especies reactivas de oxígeno) |
TBA | Nanocápsulas | Charão y col. (2019) |
| Citocompatibilidad | Viabilidad celular TBA Viabilidad celular (LDH) |
Alginato Nanopartículas |
Berger y col.
(2017); Calasans-Maia y col. (2019) |
MTT = bromuro de 3-(4, 5- dimetiltiazol-2-ilo)-2, 5-difeniltetrazol; TBA = ácido tiobarbitúrico; LDH = lactato deshidrogenasa.
Caracterización integral de estabilidad de biofármacos como proteínas terapéuticas
Los medicamentos biotecnológicos dependen de su estructura para ejercer actividad biológica (eficacia), por lo que el sistema y método de microencapsulación deben asegurar la integridad del MB (Paul y col., 2012). La pérdida de esta estructura (calidad) podría llevar a la formación de productos de degradación que potencialmente minimizan el efecto terapéutico y modifican las propiedades farmacocinéticas y fármacodinámicas de los MB, lo que conllevaría la presencia de diferentes efectos adversos y respuestas inmunes no deseadas (seguridad) (Butreddy y col., 2020; Schuster y col., 2020).
La integridad de una proteína farmacéutica puede ser estudiada en términos de estabilidad física y química. La degradación química incluye procesos de desamidación, isomerización, hidrólisis y oxidación, mientras que la degradación física es evidenciada por la formación de agregados que llevará invariablemente a un decaimiento en la actividad biológica (Kim y col., 2014).
La estabilidad se determina en parámetros críticos de calidad (Tabla 5), los cuales dependen de los atributos relacionados con la estructura y función biológica del MB. Los principales parámetros son, i) pureza del producto, ii) presencia de agregados de alto peso molecular, iii) la estructura de orden superior; iv) análisis de isoformas, v) ensayos de actividad biológica (Kim y col., 2014).
Table 5 Main techniques for proteins characterization.
| Parámetro | Atributo | Método de control y/o caracterización |
|---|---|---|
| Estructura primaria | Peso de la cadena ligera y pesada Masa intacta Secuencia de aminoácidos |
LC-ESI-MS LC-ESI-MS Mapeo peptídico Secuenciación |
| Estructura de orden superior | Estructura secundaria y terciaria | Dicroísmo circular Intercambio de hidrógeno/deuterio Cristalografía |
| Otras modificaciones | Oxidación Deamidación |
RP-HPLC Mapeo peptídico Cromatografía de intercambio aniónico Cromatografía de intercambio iónico MP |
| Heterogeneidad de tamaño | Agregación Fragmentación |
Cromatografía de exclusión por tamaño Ultracentrifugación Microscopía Electroforesis capilar SDS-PAGE RP-HPLC |
| Actividad biológica | Unión blanco terapéutico a receptor Bioactividad |
Trasposomas ELISA Ensayos en modelos animales |
LC-ESI-MS = cromatografía de líquidos acoplado a espectrometría de masas de ionización por electrospray; SDS-PAGE = electroforesis en una sola dimensión; RP-HPLC = cromatografía de líquidos de alta resolución en fase reversa .
Fuente: modificado a partir de Sekhon y Saluja (2011).
La determinación de agregados, partículas o fragmentos es un atributo crítico de calidad, el cual se relaciona directamente con la eficacia y seguridad de las proteínas terapéuticas (Wagh y col., 2018). La cromatografía de exclusión por tamaño (SEC-HPLC, por sus siglas en inglés: Size Exclusion Chromatography) y la electroforesis capilar (CE, por sus siglas en inglés: Capillary Electrophoresis) son las técnicas empleadas para analizar las variantes de peso (Kirchhoff y col., 2017; Wagh y col., 2018).
Las variantes de carga pueden ser seguidas mediante cromatografía aniónica (IEX, por sus siglas en inglés: Ionic Exchange Chromatography) o Electroforesis Capilar (EC); las diferencias en este parámetro afectan directamente los perfiles farmacocinéticos y farmacodinámicos (Zhao y col., 2016; Kirchhoff y col., 2017). La estructura de orden superior (secundaria y terciaria) puede ser determinada por cristalografía, dicroísmo circular (DC) o calorimetría diferencial de barrido (DCS).
Por otra parte, los modelos in vitro permiten describir el comportamiento del biofármaco liberado, mientras que los modelos in vivo detallan su biodisponibilidad en fluidos biológicos (Andhariya y Burgess, 2016), en tanto que los modelos animales deben asegurar: i) la evaluación a largo plazo en las formulaciones y ii) la medición de anticuerpos neutralizantes (Andhariya y Burgess, 2016).
La pérdida de estabilidad involucra respuestas celulares complejas, que dan como resultado la formación de citocinas pro-inflamatorias, reacciones de hipersensibilidad (reacciones alérgicas y anafilaxia) hasta la formación de anticuerpos neutralizantes (anticuerpos que inhiben la actividad biológica deseada del MB), además de la presencia de síntomas como dolor, anemia y fiebre, que darán como resultado modificaciones en las propiedades farmacocinéticas del MB (mayor aclaramiento renal y menor eficacia terapéutica) (Schellekens, 2002; Laptoš y Omersel, 2018).
Aplicaciones
Algunos microacarreadores empleados para la liberación de medicamentos biotecnológicos se resumen en la Tabla 6.
Table 6 Examples of microformulations.
| Familia de biofármacos | Proteína encapsulada | Matriz | Bibliografía |
|---|---|---|---|
| Enzimas | Heparina Lisozima Glucógeno fosforilasa Fasudil Alteplasa |
Dextranos PSA Microesferas porosas de Ca2CO3 |
Li y col.
(2000); Nguyen y O’Rear (2017); Correa-Paz y col. (2019); Han y col. (2020); Mietzner y col. (2020) |
| Hormonas | Insulina Somatropina Albúmina Filgrastim Eritropoyetina Interferón Factor de crecimiento de fibroblastos Factor de coagulación |
Alginato PLA PLGA Ácido hialurónico Parafina Liposomas PLGA PLA PLGA Gelatina Alginato |
Bittner y col.
(1998); Katti y Krishnamurt (1999); Diwan y Park (2003); Hahn y col. (2004); Yang y col. (2010); Bowey y col. (2013); Kiafar y col. (2016); Kim y Kim (2016); Gravastrand y col. (2017); Lan y col. (2017); Zhang y col. (2018); Wang y col. (2019) |
| Anticuerpos | Anti TNF-α Antimesotelina Anti p46 Trastuzumab |
PLGA Silicio poroso Metacrilato |
Macura y
col. (2013); Marquette y col. (2014); Horák y col. (2017); Nifontova y col. (2019) |
La insulina recombinante es el tratamiento de elección para combatir la diabetes mellitus, padecimiento que afecta a más de 439 millones de adultos en el mundo. En el trabajo publicado por Bowey y col. (2013) se caracterizaron las micropartículas de alginato e insulina obtenidas por la técnica de secado por aspersión. El resultado fueron micropartículas con un diámetro medio de 2.1 ± 0.3 mm, de forma esférica y una eficiencia de carga del 38.2 ± 9.5 %. Se determinó por microscopia confocal la presencia de una distribución matricial de insulina en las micropartículas. El bioensayo in vitro, para la determinación de la potencia biológica, consistió en medir la fosforilación intracelular de la proteína quinasa B (PKB, por su siglas en inglés: Protein Kinase B) en la línea celular L6 de mioblasto (rata), donde la insulina liberada de las partículas presentó un 88 ± 15 % de actividad, demostrando que el secado por aspersión no impacta de forma significativa la estructura de la proteína.
Mientras que en el trabajo de Zhang y col. (2018) se diseñaron microesferas de finas capas de polivinil-sulfato y ácido poliláctico cargadas con insulina. El tamaño de las microesferas fue de 5.25 ± 0.15 mm, con una eficiencia de carga del 33.7 ± 0.19 % y una liberación de 111.33 ± 1.15 mg/g de insulina. El ensayo de eficacia preclínica in vivo consistió en probar el control glicémico de la formulación, en un modelo animal de diabetes tipo II, mediante la inducción del estado hiperglicémico en ratas hembra Sprague Dawley con la administración intraperitoneal de estreotozotocina (55 mg/kg). Se formaron seis grupos experimentales (n = 10) que recibieron tratamiento como se describe a continuación: grupo control (solución salina vía oral), grupo control negativo (200 U/kg insulina vía oral), grupo control positivo (5 U/kg insulina subcutánea) y tres grupos experimentales (100 U/kg, 200 U/kg y 300 U/kg, todos vía oral). Se logró demostrar que los tratamientos ejercieron un control glucémico dependiente de la dosis, lo cual sugiere un método prometedor para la obtención de microesferas cargadas con MB (Zhang y col., 2018). Estos trabajos evidencian que la insulina presente en ambos sistemas se encuentra activa, a pesar de haberse obtenido por metodologías diferentes.
La osteoclasis mandíbular, asociada a medicamentos como los bisfosfonatos, genera problemas en pacientes medicados que requieren extracciones dentales, con la finalidad de disminuir los efectos colaterales de este tratamiento. Erten-Taysi y col. (2019) demostraron la exitosa fabricación de microesferas de quitosano cargadas con hormona paratiroidea humana por el método de gelación. Las microesferas cargadas tienen un tamaño promedio de 0.61 mm, con un valor de potencial z de (+) 18.5 mV. Se compararon varias formulaciones, pero las partículas con la proporción 3:1 de quitosano y hormona evidenciaron la eficacia de encapsulación más alta, con un 72.9 ± 4.84 % de hormona, porcentaje que decreció dramáticamente al modificar la relación. El estudio in vivo consistió en la observación del proceso necrótico. Después de la extracción de tres molares superiores en ratas hembra Sprague-Dawley de 6 semanas, las cuales fueron aleatorizadas en 4 grupos (n = 12), como se describe a continuación: grupo control (la curación de los animales se permite sin la administración de tratamientos), grupo control negativo (se colocan 30 mL de formulación con microcápsulas vacías en la región subperiostal) y 2 grupos experimentales. El grupo experimental 1 recibió hormona paratiroidea contenida en un hidrogel (0.05 mg/mL por 3 d), mientras que el grupo experimental 2 fue tratado con una sola administración de microesferas (0.233 mg/L de hidrogel). En los días 10 y 21 después de la extracción dental, 6 animales de cada grupo fueron sacrificados para el análisis histomorfométrico. En ambos casos se observó un proceso necrótico, inferior en aquellos animales que recibieron una sola dosis de microesferas, a diferencia de aquellos que recibieron dosis repetidas de hormona paratiroidea (Erten-Taysi y col., 2019).
La hormona de crecimiento representa una alternativa de tratamiento para infantes con trastornos del crecimiento, falla renal o síndrome de Turner. Los problemas asociados a las limitaciones de la proteína la confinan a la administración intramuscular (IM), dando como resultado inflamación en el sitio de administración y un pobre apego al tratamiento. En el trabajo presentado por Kang y col. (2014) se desarrollaron microesferas de dextranos con PLGA cargadas con hormona de crecimiento por el método de doble emulsion. La caracterización de estas microesferas evidenció partículas con un diámetro medio de 40 mm a 100 mm. Mientras que la caracterización de la integridad de la proteína se realizó mediante cromatografía de exclusión por tamaño, para evaluar la presencia de fragmentos, y microscopia de dicroísmo circular, para determinar la estructura de orden superior. La formulación de dextrano con PLGA y somatropina no desnaturalizó de forma significativa al MB, al no decaer la presencia del monómero que conforma la proteína. La estructura de orden superior se determinó por comparación de la microscopia DC de una solución de proteína fresca y proteína contenida en el sistema de micropartículas. Los resultados no sugieren diferencia significativa en este parámetro, por lo que se asume que la proteína tendrá efecto biológico.
El ensayo de liberación in vivo consistió en la determinación de los niveles de hormona de crecimiento en plasma, en ratas hembra Sprague Dawley que fueron aleatorizadas en 3 grupos (n = 5) que se detallan a continuación: grupo control (recibe hormona de crecimiento, 5 mg/kg vía subcutánea), grupo experimental 1 (microesferas de dextrano con PLGA, 5 mg/kg vía subcutánea) y grupo experimental 2 (microesferas sin la presencia de dextranos, 5 mg/kg vía subcutánea). Los días 1, 2, 3, 4, 5, 6, 7, 8, 10, 12, 15 y 28 se tomó una muestra de sangre para la cuantificación de hormona de crecimiento, mediante un kit de ELISA (por sus siglas en inglés: Enzyme-Linked Immunosorbent Assay). Las curvas de concentración de hormona de crecimiento sérica versus el tiempo permitieron visualizar un aumento de concentración media después de la dosis. Los resultados evidenciaron una mayor concentración de hormona de crecimiento en suero y un perfil de liberación lento, hasta por 40 d en las microesferas de dextrano con PLGA, en comparación con las microesferas sin la presencia de dextrano, lo que sugiere un sistema altamente efectivo para la liberación controlada de hormona de crecimiento.
El modelo in vivo de eficacia consistió en evaluar la ganancia de peso en ratas macho Sprague Dawley hipofisectomizados de 6 semanas y tratados con un agente inmunosupresor (tacrolimus 50 g vía sc). Los animales de estudio fueron aleatorizados en 4 grupos (n = 5) para recibir tratamiento, de esta manera: grupo control negativo (solución salina), grupo control positivo (solución de hormona de crecimiento, 6 mg/kg por 30 d) y dos grupos experimentales: grupo experimental 1 (6 mg/kg de microesferas sin dextranos vía subcutánea) y grupo experimental 2 (6 mg/kg de microesferas con dextranos vía subcutánea). La ganancia de peso se determinó cada 24 h por 40 d. Los resultados obtenidos con el modelo de eficacia abordado fueron consistentes con el modelo in vitro; el modelo in vivo confirmó un aumento de peso, superior del día 6 hasta el día 40 en aquellos animales tratados con microesferas de dextrano y PLGA, en comparación con el grupo control. Los resultados demostraron el desarrollo de una formulación de liberación controlada estable y con evidencia de actividad biológica (eficacia) de la hormona de crecimiento.
La microencapsulación o formación de microesferas de proteínas farmacéuticas, empleando biopolímeros para modificar la vía de administración, el régimen de dosificación o controlar la liberación de medicamentos biotecnológicos, se han estudiado arduamente, con la finalidad de caracterizar los procesos de fabricación de manera integral para asegurar que los MB no pierdan su estructura y por ende presenten menor actividad biológica y mayor inmunogenicidad, por lo que este trabajo describe las principales técnicas de caracterización de microesferas y proteínas farmacéuticas, para asegurar la viabilidad de estos sistemas de encapsulación.
Conclusiones
El éxito de los microacarreadores como sistemas de liberación de medicamentos biotecnológicos está basado en la integridad de las proteínas farmacéuticas, a través del proceso de microencapsulación. Las nuevas estrategias para el desarrollo de microacarreadores se sustentan en la exploración y explotación de biopolímeros altamente biotolerables, de baja inmunogenicidad y fácil degradación en fluidos biológicos, así como en la optimización de los parámetros en cada método, para obtener sistemas con altos porcentajes de carga y de rendimiento, evitando la desnaturalización de las proteínas farmacéuticas. Las vías de degradación de biopolímeros y la falta de estabilidad de las proteínas podrían conducir al fracaso terapéutico y al desarrollo de reacciones inmunes no deseadas, como procesos inflamatorios y la aparición de anticuerpos neutralizantes. La caracterización integral de los microacarreadores debe ser gradual y enfocada en la seguridad tanto del biopolímero empleado como de las proteínas ensayadas.











 text new page (beta)
text new page (beta)





